鸡血藤总黄酮乙酸乙酯部位对大肠杆菌脂多糖(LPS)刺激RAW264.7免疫细胞氧化应激的调节作用
2017-06-30陈海兰蒙西南赵尉丹付远妨韦雅
陈海兰++蒙西南++赵尉丹+付远妨+韦雅妮++胡庭俊


摘要:通过观察鸡血藤总黄酮乙酸乙酯部位(FEA)预处理和后处理对大肠杆菌脂多糖(LPS)刺激RAW264.7细胞所致氧化应激的影响,探讨其抗应激活性。试验将细胞分为空白对照组、LPS刺激组、LPS+阳性药物组(维生素C)、LPS+不同浓度FEA组(25、50、100、200 μg/mL)。试验1的细胞先用药物预处理12 h,再用LPS进行刺激;试验2则先用LPS刺激2 h后,再用药物进行处理。分别采用Griess法和荧光探针法检测NO分泌和活性氧(ROS)水平。结果发现,FEA预处理和后处理均能显著抑制LPS刺激引起的NO和ROS水平的升高(P<0.05),且后处理效果更明显。因此,FEA具有良好的抗氧化应激活性,且作为治疗药物比作为预防药物效果更佳。
关键词:鸡血藤总黄酮;乙酸乙酯部位;脂多糖;氧化应激;免疫细胞
中图分类号: R285.5文献标志码: A文章编号:1002-1302(2017)08-0154-03
近年来,我国规模化养殖迅猛发展,在给畜牧养殖业带来革命性变化的同时,畜禽应激综合征的问题也开始显现。饲养管理、环境变化、饲料营养、免疫治疗和运输等均会使动物产生应激,引起氧化损伤[1]。大量研究表明,氧化应激可导致动物采食量下降、生长发育和抗病力降低、死亡率增高,并显著降低畜产品品质[1]。因此,如何预防或降低规模化养殖中畜禽的应激反应具有重要意义。
鸡血藤为豆科植物密花豆(Spatholobus suberectus Dunn)的干燥藤茎,分布于广西、云南、广东、贵州、福建等地区,主产于广西,以广西产者为道地药材[2]。黄酮类化合物是鸡血藤的主要活性成分,主要包括异黄酮类、异黄烷类、二氢黄酮类、花青素类、查尔酮类等[3-4]。鸡血藤总黄酮可依次采用石油醚、三氯甲烷、乙酸乙酯、乙醚等有机溶剂进行萃取分离,研究发现乙酸乙酯萃取物中黄酮化合物的含量最高[5]。鸡血藤具有活血补血、调经止痛、抗炎、抗氧化、免疫调节、抗病毒、抗肿瘤等多种药理活性[6-9]。现代药理学研究发现,鸡血藤总黄酮具有很强的自由基清除作用,可有效抑制Fenton体系诱导的大鼠心、肝、肾丙二醛(MDA)生成,抑制H2O2诱发的大鼠红细胞氧化溶血,通过清除·OH、O2-及H2O2发挥抗氧化作用。鸡血藤黄酮的强抗氧能力,使它在消除氧化应激、增强机体免疫力、提高抗病能力方面有很大的应用潜能。然而,目前国内外对鸡血藤黄酮抗氧化能力的研究多集中在鸡血藤的提取物上,并以体外清除自由基能力检测为主,而对鸡血藤进一步纯化产物及在细胞水平上的研究还比较少。
本试验采用乙醇提取法从广西产鸡血藤中得到鸡血藤总黄酮,通过有机溶剂萃取法对其进行初步分离,经浓缩干燥后得到鸡血藤总黄酮乙酸乙酯部位(FEA),然后对FEA的细胞毒性及其预处理、后处理对大肠杆菌脂多糖(LPS)刺激RAW264.7细胞所致氧化应激的影响,探讨其细胞安全性及抗应激活性,为鸡血藤的进一步开发利用提供参考。
1材料与方法
1.1试验材料
1.1.1试验细胞小鼠单核巨噬细胞系RAW264.7细胞,购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.1.2药品与试剂鸡血藤饮片,购自南宁市中尧路中药材市场,产地为广西崇左市,经广西大学动物科学技术学院药理实验室鉴定为鸡血藤正品。药材饮片经粉碎成中细粉后(过4号筛),采用乙醇提取法,以50%乙醇溶液为溶剂,在 1 g ∶30 mL 料液比和80 ℃条件下提取3 h。提取液经过滤、浓缩、初步纯化后,依次用石油醚、三氯甲烷、乙酸乙酯和正丁醇进行萃取,并对乙酸乙酯萃取液通过旋转蒸发去除有机溶剂得到棕黄色粉末,即为鸡血藤黄酮乙酸乙酯部位(FEA)。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、维生素C(VC)、2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)、大肠杆菌脂多糖(LPS)、亚硝酸钠(NaNO2)、萘乙烯二胺和对氨基苯磺酸,均购自美国Sigma公司,胎牛血清(FBS)、DMEM培养液、青链霉素(PS),均购自Gibco公司。
1.2试验内容与方法
1.2.1FEA的细胞毒性研究将对数生长期的RAW264.7细胞以1×105个/mL的浓度接种于96孔板中,100 μL/孔。37 ℃、5% CO2培养箱培养过夜后,弃去上清液,每孔加入 90 μL 新鮮培养液和10 μL不同浓度的FEA溶液,使其终浓度为50、100、200、400、800 μg/mL。同时设对照组,加入 90 μL 新鲜培养液和10 μL磷酸缓冲盐溶液(PBS)。每个处理设4个重复。继续培养72 h后,弃去含药培养液,每孔加入90 μL新鲜培养液和10 mL MTT储存液(5 mg/mL),37 ℃孵育4 h后,每孔加入100 μL MTT结晶溶解液[10%十二烷基硫酸钠(SDS),10 mmol/L HCl],37 ℃孵育过夜,使紫色结晶充分溶解,用多功能酶标仪检测D595 nm,并根据以下公式计算细胞相对活性:
细胞相对活性=D试验-D空白1D对照-D空白×100%。
1.2.2FEA预处理对LPS刺激免疫细胞氧化应激的作用取对数生长期的RAW264.7细胞,以1×105 个/mL的浓度接种于96孔板中,100 μL/孔,并分为对照组、LPS组、VC100组、FEA25组、FEA50组、FEA100组和FEA200组,每个处理组设4个重复。37 ℃、5% CO2培养箱培养过夜后,弃去上清液,对照组每孔加入90 μL新鲜培养液和10 μL PBS,VC100组每孔加入90 μL新鲜培养液和10 μL 1 000 μg/mL VC溶液,FEA25~FEA200组每孔分别加入100 μL终浓度为25、50、100、200 μg/mL 的FEA溶液。药物处理12 h后,弃去上清液,除对照组外,每孔加入终浓度为1 μg/mL LPS溶液。刺激2 h后,弃去含LPS培养液,换新鲜培养液(100 μL/孔)继续培养4 h后,检测上清液中NO浓度及细胞中活性氧(reactive oxygen, 简称ROS)水平。
1.2.3FEA后处理对LPS刺激免疫细胞氧化应激的作用取对数生长期的RAW264.7细胞,以1×105 个/mL的浓度接种于96孔板中,100 μL/孔,分组方式同“1.2.2”节。37 ℃、5% CO2培养箱培养过夜后,弃去上清液,除对照组外,每孔加入终浓度为1 μg/mL的LPS溶液。刺激2 h后,弃去上清液,对照组每孔加入90 μL新鲜培养液和10 μL PBS,VC100组每孔加入90 μL新鲜培养液和10 μL 1 000 μg/mL VC溶液,FEA25~FEA200组每孔分别加入100 μL终浓度为25、50、100、200 μg/mL的FEA溶液。继续培养8 h后,检测上清液中NO浓度及细胞中ROS水平。
1.2.4NO浓度的检测称取6.9 mg NaNO2加入100 mL超纯水中溶解,配成1 mmol/L的储存液。用NaNO2储存液配制浓度为100、80、60、40、20、0 μmol/L的标准稀释液,各取 100 μL,加入100 μL Griess试剂(等体积混合的0.1%萘乙烯二胺和1%对氨基苯磺酸),振荡,室温避光反应10 min,于多功能酶标仪上检测D550 nm,并以NaNO2浓度为横坐标、吸光度为纵坐标制作标准曲线。
取100 μL细胞上清液,加入100 μL Griess试剂测定D550 nm作对照,并根据NaNO2标准曲线计算NO浓度。
1.2.5ROS水平的检测弃去培养液,用PBS洗涤细胞3次,每孔加入50 μL 10 μmol/L的DCFH-DA荧光探针,37 ℃、5% CO2孵育30 min,每10 min轻轻摇匀1次。孵育结束后,弃上清液,用PBS洗涤3次,于多功能酶标仪激发波长488、525 nm处检测荧光强度。
1.3数据分析
试验数据采用SPSS 21.0进行分析,采用单因素方差分析(One-Way ANOVA)方法,进行LSD组间比较,结果以“平均值±标准差”的形式表示。
2结果与分析
2.1细胞毒性作用研究
用不同浓度的FEA处理RAW264.7细胞后,利用MTT法检测细胞活性以分析FEA的细胞毒性作用。由圖1可见,当FEA浓度≤200 μg/mL 时,细胞存活率均接近对照组;随着FEA浓度的增大,细胞活性逐渐下降,当FEA浓度 ≥400 μg/mL 时,细胞活性显著或极显著低于对照组。因此,FEA的安全浓度范围为0~200 μg/mL,在此范围内对RAW264.7细胞的生长无不良影响。
2.2FEA预处理对LPS刺激免疫细胞氧化应激的作用
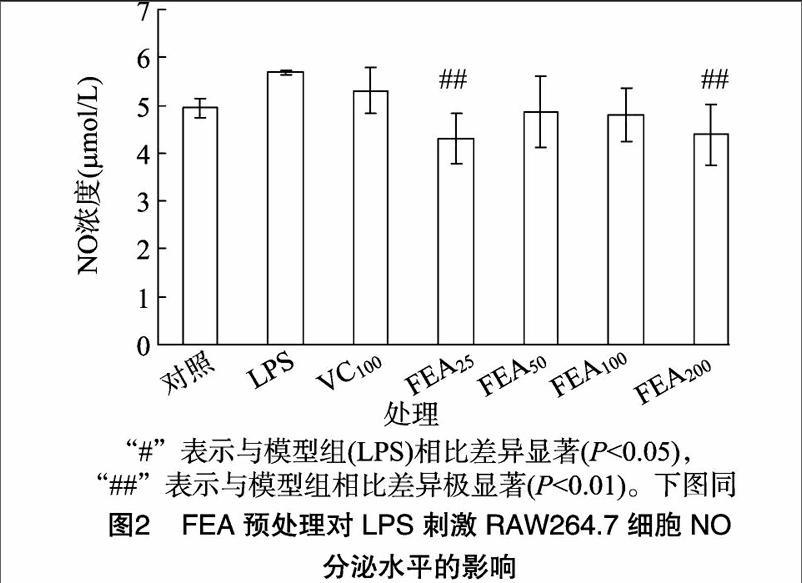
为了探讨FEA对氧化应激的预防作用,RAW264.7细胞先用系列浓度的FEA处理12 h,然后用LPS刺激诱导氧化应激的产生,再对NO分泌水平和ROS水平进行分析。由图2可知,LPS刺激4 h后,NO分泌水平有所升高,但是与对照组相比差异不显著;与模型组(LPS)比较,FEA预处理可以降低NO分泌水平,且在25、200 μg/mL时,差异极显著(P<001)。从图3可以看出,LPS刺激后,RAW264.7细胞内的ROS水平显著升高(P<0.05),而FEA预处理则可以显著降低ROS水平,在FEA浓度为100 μg/mL时差异极显著(P<0.01)。这些结果表明,FEA预处理对于预防LPS诱导的氧化应激具有一定的保护作用。
2.3FEA对LPS刺激免疫细胞氧化应激的作用
进一步研究FEA对LPS诱导RAW264.7细胞氧化应激
的治疗作用。与预防试验不同的是,本试验先用LPS刺激RAW264.7细胞建立氧化应激模型,然后用不同浓度的FEA处理细胞,通过检测NO、ROS水平的变化,分析其抗氧化应激作用。由图4、图5可知,LPS刺激RAW264.7细胞后,NO、ROS水平均极显著升高(P<0.01),表明免疫细胞氧化应激模型已成功建立。相比于模型组,经VC或25~200 μg/mL的FEA处理后,NO水平均极显著下降(P<0.01),且较高浓度的FEA(50~200 μg/mL)可同时显著(P<0.05)或极显著(P<0.01)下调ROS水平。因此,FEA后处理对于LPS诱导产生的氧化应激具有良好的抑制作用,效果与对照药物VC相当。
3讨论与结论
氧化应激是指机体遭受各种有害刺激时,机体内的活泼分子如活性氧自由基(reactive oxygen free radicals)产生并堆积,超过了动物机体对过氧化物的清除能力,致使机体的氧化系统和抗氧化系统失衡[10]。活性氧是含有氧分子的自由基,包括超氧阴离子( O-2· )、过氧化氢(H2O2)、次氯酸离子(OCl-)和一氧化氮(NO)。ROS含有的不成对电子使其具有很强的反应活性,极易攻击DNA、脂质、蛋白质等生物分子,造成机体组织的氧化损伤,加速机体的衰老,引发炎症,导致各种慢性疾病的发生[11-12]。当机体受到刺激时,细胞内成分转移至细胞膜的内表面,形成具有NADPH氧化酶活性的完全活性酶复合物,进而催化ROS的生成[13]。脂多糖是介导系统性炎症反应综合征的主要启动因子,它可激活单核细胞和巨噬细胞,引起NO和炎性细胞因子的合成与释放,进而导致机体一系列炎症反应的发生和发展[14-15]。
本试验中,首先通过MTT法研究了FEA的细胞毒性作用,发现其细胞毒性较低,在≤200 μg/mL范围内对RAW264.7细胞的生长无明显不良影响。然后,通过预防试验和治疗试验探讨了FEA的抗氧化应激活性。研究发现,LPS刺激RAW264.7细胞后,NO、ROS水平明显上升,提示氧化应激的发生。FEA预处理和后处理,基本能不同程度抑制LPS刺激引起的NO和ROS产生,表明FEA能够改善RAW264.7细胞氧化应激损伤,与黄酮类化合物较强的自由基清除能力和抗氧化能力相关,并与黄酮类化合物可通过抑制炎症因子(NO、TNF-α等)的释放降低细胞氧化损伤的报道[16-17]相一致。另外,相比于药物预处理(预防试验),先造成氧化应激再用药物处理(治疗试验),FEA的作用更加明显。治疗试验中,NO、ROS水平均显著或极显著低于LPS刺激组(P<0.05或P<0.01),表明在抗应激反应中,FEA更适宜作为治疗药物使用。
综上所述,本试验先通过MTT法检测了FEA的细胞毒性,然后通过分析FEA预处理或后处理对LPS刺激RAW264.7细胞NO、ROS分泌水平的影响,探讨了其抗氧化应激作用。试验观察到FEA在0~200 μg/mL浓度内对RAW264.7细胞的生长无明显不良影响,能显著或极显著抑制LPS诱导的氧化应激反应,且后处理比预处理细胞对LPS诱导应激反应的抑制作用更明显,表明FEA更适合作为治疗药物用于抵抗氧化应激反应。
参考文献:
[1]徐建雄. 关注氧化应激提高动物健康水平[J]. 饲料与畜牧,2012(8):1.
[2]王强,徐国钧. 道地药材图典:中南卷[M]. 福州:福建科学技术出版社,2003:102-103.
[3]符影,程悦,陈建萍,等. 鸡血藤化学成分及药理作用研究进展[J]. 中草药,2011,42(6):1229-1234.
[4]刘湘,汪秋安. 天然产物化学[M]. 北京:化学工业出版社,2005:65-75.
[5]张夏辉. 鸡血藤中黄酮类化合物提取及抗氧化性的研究[D]. 柳州:广西科技大学,2013.
[6]邓家刚,梁宁,周程艳. 鸡血藤药效及作用机理研究进展[J]. 广西中医药,2006,29(6):311-313.
[7]Li R W,David L G,Myers S P,et al. Anti-inflammatory activity of Chinese medicinal vine plants[J]. Journal of Ethnopharmacology,2003,85(1):61-67.
[8]胡庭俊,何彩美,钟晶. 鸡血藤不同极性段提取物制备及体外抑菌作用初步研究[J]. 动物医学進展,2010,31(9):33-36.
[9]张爱文,何彩美,钟晶,等. 鸡血藤提取物的制备及药理毒理研究[J]. 中兽医医药杂志,2011,30(3):20-22.
[10]Sohal R S,Allen R G. Oxidative stress as a causal factor in differentiation and aging:a unifying hypothesis[J]. Experimental Gerontology,1990,25(6):499-522.
[11]Aruoma O I,Grootveld M,Bahorun T. Free radicals in biology and medicine:from inflammation to biotechnology[J]. Biofactors,2006,27(1/2/3/4):1-3.
[12]Niki E. Free radicals in biology and medicine:good,unexpected,and uninvited friends[J]. Free Radical Biology & Medicine,2010,49(49):S2.
[13]Dawson J,Walters M. Uric acid and xanthine oxidase:future therapeutic targets in the prevention of cardiovascular disease?[J]. British Journal of Clinical Pharmacology,2006,62(6):633-644.
[14]王红梅,吕耀中,刘莉娜,等. 不同组方加味藿香正气软胶囊对脂多糖诱导小鼠原代骨髓巨噬细胞炎症相关因子表达的影响[J]. 世界科学技术:中医药现代化,2016,18(3):476-481.
[15]Leyva N,Nair V,Bang W Y,et al. Protective role of terpenes and polyphenols from three species of Oregano (Lippia graveolens,Lippia palmeri and Hedeoma patens) on the suppression of lipopolysaccharide-induced inflammation in RAW 264.7 macrophage cells[J]. Journal of Ethnopharmacology,2016,187:302-312.
[16]汪娟,蒋维,王毅. 降香中黄酮类化合物对脂多糖诱导的RAW264.7细胞抗炎作用研究[J]. 细胞与分子免疫学杂志,2013,29(7):681-684.
[17]杨耀智,汤有志,陈建新. 取代基对黄酮类化合物抑制脂多糖诱导巨噬细胞释放一氧化氮活性的影响[J]. 中国畜牧兽医,2012,39(5):107-110.郭晓军,郭威,周贤,等. 产有机酸芽孢杆菌对玉米秸秆青贮品质及有氧稳定性的影响[J]. 江苏农业科学,2017,45(8):163-165.
