ABT1处理对降香黄檀硬枝扦插生根及其关联酶活性的影响
2017-06-30王宏信李向林王楠冷凝
王宏信+李向林++王楠++冷凝
摘要:为揭示降香黄檀(Dalbergia odorifera T.Chen)硬枝扦插苗的生根机制,取降香黄檀4年生母树上当年生硬枝制穗,比较50、100、200 mg/L ABT1生根剂处理的插穗,观测降香黄檀硬枝扦插苗的生根特性,研究扦插生根过程中过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、吲哚乙酸氧化酶(IAAO)等生根关联酶的活性变化。结果表明,降香黄檀属于愈伤组织生根类型,用100 mg/L的ABT1处理插穗,明显提高生根率和生根质量。在降香黄檀硬枝扦插生根过程中,相关联氧化酶活性均成规律性变化,其中PPO、SOD、IAAO的活性在扦插后逐渐升高,在根系形成期达到高峰,然后逐渐下降。而POD的活性在扦插后逐渐升高,在根系形成期达到高峰,然后逐渐下降,接着又逐渐升高,在根系伸长期达到另一个峰值,最后又逐渐下降,呈现双峰趋势。
关键词:ABT1生根剂;降香黄檀;硬枝扦插苗;关联酶;生根特性
中图分类号: S792.280.5文献标志码: A文章编号:1002-1302(2017)08-0138-04
降香黄檀(Dalbergia odorifera T.Chen)别称黄花梨,蝶形花科(Papilionaceae)黄檀属(Dalbergia)乔木,是海南省特有的珍稀濒危树种,国家二级保护植物[1],木质结构细致、质地重、极耐腐、花纹美丽、芳香气味长留,是制造高档家具和精美工艺品的材料。降香黄檀具有极高的药用和经济价值,且耐干旱瘠薄,适应性强,是值得推广种植的珍贵树种[2]。降香黄檀一般采用播种、扦插的方式繁殖,但播种繁殖较慢,技术不成熟、不稳定,实生苗总量较少且优劣混杂,极大地限制了优质降香黄檀人工林规模化发展。因此,探索降香黄檀的无性繁殖技术尤为重要。目前研究多局限于多种因素影响下的降香黄檀扦插繁育技术体系,如前人研究的扦插基质、插条类型、激素类型、激素浓度、浸泡时间5个因素对降香黄檀插条生长指标的影响[3],而对生根机制的研究鲜见报道。本研究探讨不同浓度的ABT1处理对降香黄檀硬枝扦插苗生根的影响,分析扦插生根过程中过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、吲哚乙酸氧化酶(IAAO)等生根关联酶活性变化,旨在为确定建立高效的降香黄檀扦插体系,加快降香黄檀树种推广提供科学的理论依据。
1试验地概况
在三亚学院园林教学试验苗圃进行试验。该地位于海南省三亚市吉阳区,地处109°53′92″E,18°32′72″N,海拔200 m。年平均气温25.4 ℃,7月平均最高气温28.3 ℃,1月平均最低气温20.7 ℃,紫外线强,光照充足,全年日照时间约 2 563 h。干、湿季节分明,7—11月为雨季,降水量占全年的85%。
2材料与方法
2.1扦插试验
于2016年4月初在三亚学院苗圃内进行扦插试验,插条取自三亚学院崖台山黄花梨种植园内,2012年栽植的降香黄檀母树基部当年萌芽条中生长健壮、無病虫害的木质化硬枝。摘去下部叶片,保留2~3张上部叶片和顶芽,剪成长度为 8~10 cm的插穗,下切口平剪,用石蜡涂抹上切口,剪好的插穗每20根为1捆,用1 000倍多菌灵溶液浸泡20 min晾干后备用。扦插前用浓度为50、100、200 mg/L的ABT1溶液浸泡2 h,对照用蒸馏水浸泡2 h。扦插基质为珍珠岩、蛭石、细河沙的混合基质(体积比为5 ∶3 ∶2)。扦插后保持遮光率50%左右,相对湿度控制在70%~80%,温度控制在20~30 ℃,按照需要进行喷雾处理,常规管理。完全随机区组设计,每个处理80根插穗,3次重复。扦插深度为穗长的2/3,密度为50根/m2,保持基质湿润,每周消毒1次(多菌灵和甲基硫菌灵交替使用)。新叶完全展开后每隔15 d喷1次0.2%尿素溶液。
2.2测定指标
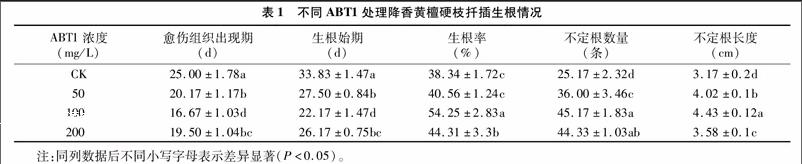
2.2.1生长形态指标扦插10 d后观察插穗愈伤组织形成情况和出现不定根的情况。以后每隔2~3 d观察1次,至切口愈合。统计和测定的指标有:愈伤组织出现期(d)、生根始期(d)、生根率(%)、不定根条数(条)、不定根长度(cm)。
2.2.2关联酶指标扦插后每隔4 d采样1次,每区随机取5株插穗,采样后洗净吸干水分,先观察生根情况,然后取插穗基部3 cm表皮部分别测定POD、PPO、SOD、IAAO的活性,3次重复。
2.3测定方法
PPO活性采用焦儿茶酚比色法方法[4]测定;POD活性采用愈创木酚法[5]测定;SOD活性采用氯化硝基氮蓝四唑法[5]测定;IAAO活性用比色方法[6]测定。PPO以1 g鲜样品 1 min 的D410 nm光密度变化0.01个单位所需要的酶液量作为1个活力单位(U),POD以1 min内D470 nm变化0.01为1个过氧化物酶活性单位(U),SOD以抑制NBT光氧化还原50%的酶量为1个酶活性单位(U),IAAO以1 g鲜样品在1 h内分解破坏IAA的mg数表示1个酶活性单位(U)。
2.4数据处理
采用Excel 2007软件整理分析数据并绘制指标变化图;采用SPSS 18.0软件进行方差分析和Duncans多重对比。
3结果与分析
3.1ABT1浓度对硬枝插穗生根特性的影响
降香黄檀硬枝扦插生根形态学观测结果表明:经ABT1处理后插穗扦插10~20 d(对照组为20~30 d)后,观察到切口及以上3~5 cm区段部位的插穗膨胀并伴有更多的突起;20~30 d(对照组为30~40 d)时有一些插穗切口愈伤组织处已伸出明显的不定根尖端,陆续形成根系,不定根明显伸长。
由表1可知,与对照相比,外源生长素ABT1的所有处理均能明显缩短降香黄檀硬枝插穗愈伤组织出现及不定根发生时间,各处理的愈伤组织分别出现在插后16~20 d,不定根出现在22~28 d,而对照则分别在扦插后25、33 d才出现愈伤组织及不定根。且用ABT1处理的降香黄檀硬枝插穗在不定根数量、不定根长度2个方面均显著高于对照,各处理的生根率分别高出对照5.79%、41.50%、15.57%。就生根质量而言,100 mg/L ABT1处理的不定根长度分别显著高出其他3组处理1.26、0.41、0.85 cm,而生根条数分别多出其他3组处理20.00、9.17、0.84条。总体来看,ABT1处理能提高降香黄檀硬枝插穗的生根率与生根质量,其中100 mg/L ABT1处理的插穗生根率最高,且生根质量最佳。
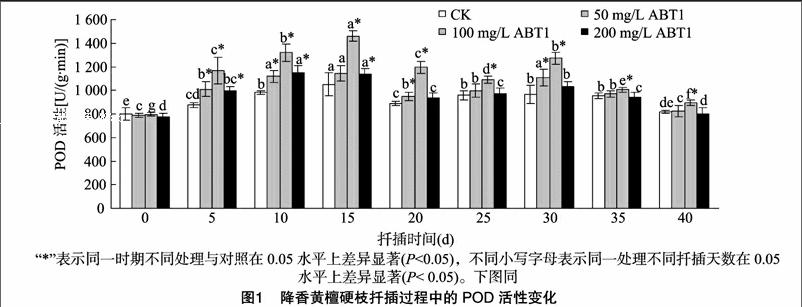
3.2.1POD的活性变化POD是活性较高的酶,可参与植物体内的各种生理过程以及木质素的形成,与不定根的诱导和伸长生长密切相关,能氧化IAA,消除体内过多的内源IAA,与一些高等植物的发育进程有密切关系。POD的活性与离体植物生根有密切关系,是植物生根标志性物质之一[7],在不定根诱导期和表达期,POD活性升高是有生根能力的标志[8]。从图1可以看出,对照插穗及3个不同浓度ABT1溶液处理的插穗在扦插后0~15 d,POD活性均不同程度上升,且在15 d的时候达到最高,之后开始下降,而在30 d时再次升高,之后再次下降。扦插天数为5~40 d,100 mg/L ABT1處理与对照中的插穗POD活性差异均显著(P<005),这说明100 mg/L ABT1可以提高插穗的POD活性,而在扦插过程中,其他2个处理插穗的POD活性与对照相比具有一定的变化。POD活跃状态对降香黄檀插穗的生根是有利的。所有处理的POD的活性都是先上升后下降,再上升然后再下降的趋势,其中在扦插天数40 d时,对照、50、100、200 mg/L ABT1处理插穗中的POD含量比扦插15 d峰值时分别下降16.22%、27.97%、38.63%、29.55%。
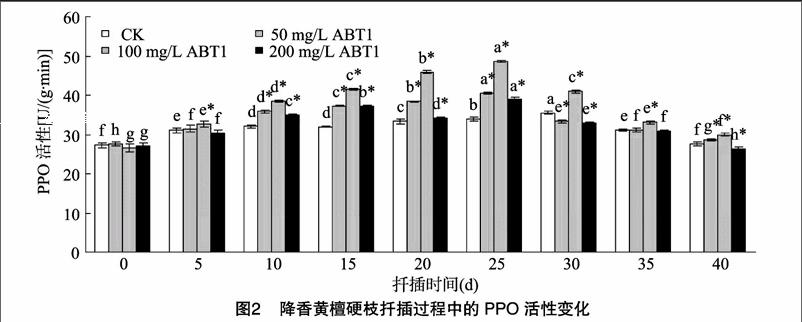
3.2.2PPO的活性变化PPO是一种含铜的酶,能够催化吲哚乙酸(IAA)与酚类物质缩合形成IAA-酚酸复合物,可以促进不定根形成的生根辅助因子,对植物生根具有重要作用,同时也与植物光合作用、抵抗病虫害等有关[9-10]。从图2可以看出,对照处理的插穗PPO活性在0~30 d内都是逐渐提高的,在30 d时达到峰值,之后逐渐降低;而50、100 mg/L ABT1处理的插穗PPO活性在0~25 d内均是逐渐提高的,在25 d时到达峰值,之后逐渐降低;200 mg/L ABT1处理的插穗PPO活性在0~15 d内均是逐渐提高的,在20 d时出现降低,而在25 d达到峰值,之后逐渐降低。扦插天数在5~40 d,100 mg/L ABT1处理插穗的PPO活性均显著高于对照处理(P<0.05)。
3.2.3SOD的活性变化SOD是生物体内天然的超氧阴离子自由基的有效清除剂,是植物氧化代谢的关键酶,能催化体内O2-转化为H2O2,从而减轻自由基对植物的毒害作用,能有效地抑制自由基对生物体的伤害,使植物在一定程度上忍耐或抵抗逆境胁迫[10]。SOD活性影响着植物的发育过程,与植物生根密切相关。从图3可以看出,各处理的降香黄檀硬枝插穗在扦插过程中韧皮部的SOD活性均成先上升后下降趋势。在扦插初期的0~25 d内,50、100、200 mg/L ABT1处理的插穗SOD活性逐步升高,在25 d时达到峰值,而对照处理的SOD活性则是在30 d达到峰值,之后随不定根的长出,SOD活性均逐渐降低。除扦插天数 10 d 的200 mg/L ABT1处理外,其他各阶段各处理插穗的SOD活性均与对照差异显著(P<0.05)。
3.2.4IAAO的活性变化IAA重要的生理功能就是促进不定根的形成,它的含量变化影响不定根的发生。IAAO可以氧化IAA,因此IAAO活性的大小与根的发生也有重要联系[11]。由图4可以看出,在降香黄檀硬枝扦插的过程中,所有处理的IAAO活性均为先升高后降低的趋势。不同的是,50、100、200 mg/L ABT1处理的插穗IAAO活性在扦插25 d时候达到最高,而对照处理则是在扦插30 d时达到最高。除扦插 5 d 的50 mg/L ABT1处理外,其他各阶段各处理插穗的IAAO活性均与对照差异显著(P<0.05)。
4结论与讨论
选择应用植物促根剂,是提高林木扦插成活率的关键技术之一[12]。降香黄檀属于韧皮部生根类型,试验中分别采用50、100、200 mg/L ABT1对插穗进行处理,结果表明,适宜浓度的ABT1可以显著缩短降香黄檀硬枝扦插的生根周期,提高生根率和不定根的质量。在该试验条件下,降香黄檀的硬枝插穗最适宜的ABT1浓度为100 mg/L,该处理比对照生根率提高41.50%,不定根出现时间缩短11.66 d,根长增加126 cm,生根条数增加20.00条。这与前人的研究结果一致,较高浓度的促根剂反而会影响到插穗的生根时间及其生根质量[13-15]。
过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)和吲哚乙酸氧化酶(IAAO)等活性酶均与降香黄檀硬枝插穗生根过程有非常密切的关系,直接影响植物的生根特性。不同的ABT1处理明显改变了降香黄檀硬枝插穗内的过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)和吲哚乙酸氧化酶(IAAO)等氧化酶的活性,且在生根过程中成规律性变化。其中多酚氧化酶(PPO)、超氧化物歧化酶(SOD)和吲哚乙酸氧化酶(IAAO)的活性在扦插后逐渐升高,在根系形成期达到高峰,然后逐渐下降。多酚氧化酶(PPO)活性变化呈现先上升后下降的趋势,这说明在降香黄檀硬枝扦插生根过程中,愈伤组织的形成、分化以及不定根诱导形成时,需要高活性的多酚氧化酶(PPO),而在不定根伸长阶段则需要低活性的多酚氧化酶(PPO)。还有研究也表明,PPO活性与植物的抗性密切相关[16-17],当植物受到外界不良刺激,PPO活性就会升高,而在扦插后期,PPO活性开始下降,这可能是由于不定根伸长、细胞数量增多,PPO参与了细胞壁及木质素的合成所致[18]。降香黄檀插穗在离开母体之后就处于逆境条件下生长,这会促进氧自由基或超氧负离子的生成,增加了细胞膜透性,而超氧化物歧化酶(SOD)对细胞膜脂过氧化具有保护作用,所以在扦插后到根系形成期这一阶段活性逐渐升高,并达到最大值。吲哚乙酸氧化酶(IAAO)活性先升高后降低,这是因为愈伤组织形成后,低活性的IAAO能够减少IAA的消耗,增加插穗内部IAA的质量分数,而高浓度的IAA能促进插穗不定根的形成与生长。这一变化趋势与前人对其他物种的的研究不太一致,据推测这是插穗内激素种类和相对比例、生根抑制剂的存在与否、插穗内营养物质含量等多种因素综合作用的结果,但这种推测还有待进一步深入研究。过氧化物酶(POD)活性在扦插后逐渐升高,在根系形成期达到高峰,然后逐渐下降,再逐渐升高,在根系生长期达到另一个高峰,然后随着根系的伸长,又逐渐下降,呈现“升高—下降—升高—下降”的双峰趋势,这和前人的研究结果[19-22]一致。
ABT1对过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)和吲哚乙酸氧化酶(IAAO)等产生的酶活性变化,从而促进细胞的脱分化,产生愈伤组织。本研究从生根过程中相关氧化酶变化方面揭示了降香黄檀硬枝扦插生根的生理响应机制,但由于影响植物扦插生根的因素较多,只有对插穗内营养物质含量、内源激素水平等与生根相关指标的变化规律进行研究后,才能更确切地阐明降香黄檀硬枝扦插生根的机制。
参考文献:
[1] 王卫斌. 中国的红木树种及其可持续发展对策研究[J]. 福建林业科技,2003,30(4):108-111.
[2]吳国欣,王凌晖,俞建妹,等. 降香黄檀幼苗年生长节律研究[J]. 浙江林业科技,2010,30(3):56-60.
[3]施福军,俞建妹,王凌晖. 降香黄檀扦插繁殖技术研究[J]. 广东农业科学,2011,38(1):50-52.
[4]郝再彬,苍晶,徐仲. 植物生理实验[M]. 黑龙江:哈尔滨工业大学出版社,2004:87-88.
[5]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,1999:35-37.
[6]张志良,瞿伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社,2004:188-189.
[7]Gaspar T,Kevers C,Hausman J F,et al. Practical uses of peroxidase activity as a predictive marker of rooting performance of micropropagated shoots[J]. Agronomie,1992,12(10):757-765.
[8]Nordstrom A C,Eliasson L. Levels of endogenous indole-3-acetic acid and indole-3-acetylaspartic acid during adventitious root formation in pea cuttings[J]. Physiologia Plantarum,1991,82(4):599-605.
[9]Haissig B E. Influences of auxins and auxin synergists on adventitious root primordium initiation and development[J]. New Zealand Journal of Forestry Science,1974,4(2):311-323.
[10]Al Barazi Z,Schwabe W W. The possible involvement of polyphenoloxidase and the austin-oxidase system in root formation and development in cuttings of Pistacia vera[J]. Journal of Horticultural Science,1984,59(3):453-461.
[11]Van Camp W,Inzé D,van Montagu M. The regulation and function of tobacco superoxide dismutases[J]. Free Radical Biology and Medicine,1997,23(3):515-520.
[12]原牡丹,侯智霞,翟明普,等. IAA分解代谢相关酶(IAAO、POD)的研究进展[J]. 中国农学通报,2008,24(8):88-92.
[13]潘瑞炽,李玲. 植物生长发育的调控[M]. 广州:广东高等教育出版社,1995:45-48.
[14]陈辉,刘玉宝,陈福甫. 激素处理南方红豆杉扦插生根的研究[J]. 经济林研究,1999,17(2):8-10.
[15]傅瑞树,黄琦,孙晓冬,等. 南方红豆杉扦插繁殖技术研究——Ⅵ.促根剂对扦插穗条生根的影响[J]. 中国生态农业学报,2005,13(3):178-180.
[16]陈彧,杨众养,方发之,等. 海南特类材树种扦插育苗技术研究[J]. 热带林业,2014,42(1):4-6.
[17]李保聚,李凤云. 黄瓜不同抗性品种感染黑星病菌后过氧化物酶和多酚氧化酶的变化[J]. 中国农业科学,1998,31(1):86-88.
[18]谢文华,谢大森. 棱角丝瓜不同品种对霜霉病抗性的相关研究[J]. 华南农业大学学报,1999,20(2):28-31.
[19]代丽,宮长荣,史霖,等. 植物多酚氧化酶研究综述[J]. 植物生理科学,2007,23(6):312-316.
[20]宋金耀,何文林,李松波,等. 毛白杨嵌合体扦插生根相关理化特性分析[J]. 林业科学,2001,37(5):64-67.
[21]Pacheco P,Calderón X,Vega A. Flavonoids as regula-tors and markers of root formation by shoots of Euca-lyptus globulus raised in vitro[J].Plant Perox Newslett,1995(5):9-12.
[22]扈红军,曹帮华,尹伟伦,等. 不同处理对欧榛硬枝扦插生根的影响及生根过程中相关氧化酶活性的变化[J]. 林业科学,2007,43(12):70-75.
