反应温度对台湾乳白蚁内外源纤维素酶活力的差异影响
2017-06-30曾文慧钟俊鸿李秋健刘炳荣
曾文慧++钟俊鸿++李秋健++刘炳荣
摘要:台湾乳白蚁(Coptotermes formosanus Shiraki)不仅是我国重要的经济害虫,也是研究低等白蚁木质纤维素二元降解系统的模式生物。将台湾乳白蚁消化道解剖分成唾液腺/前肠+中肠(内源)与后肠(外源)2个部分,以台湾乳白蚁生理临界温度区间(15~42 ℃)为反应温度,测定内切葡聚糖酶(endo-1,4-β-D-glucanohydrolasease,简称EG)、纤维二糖水解酶(cellobiohydrases,简称CBH)、β-葡萄糖苷酶 (β-glucosidase,简称BG)以及滤纸酶(filter paper,简称FPA)的活力,旨在探讨反应温度对台湾乳白蚁内源与外源纤维素酶活力的影响差异。结果表明,整头白蚁的FPA与EG酶活力随反应温度变化趋势一致。整头白蚁BG酶在22~42 ℃下反應活力无显著差异。反应温度对外源纤维素酶活力的影响大于对内源纤维素酶活力的影响。后肠EG、BG、CBH及FPA最佳反应温度均为32 ℃,而相应内源纤维素酶最佳反应温度均高于37 ℃。
关键词:台湾乳白蚁;纤维素酶;双纤维素水解系统;反应温度
中图分类号: S433.89文献标志码: A文章编号:1002-1302(2017)08-0091-04
台湾乳白蚁(Coptotermes formosanus Shiraki)属于低等白蚁,高效的木质纤维素降解系统不仅使它成为世界范围内危害极大的重要经济害虫,也成为研究生物质能转化的模式生物[1-2]。台湾乳白蚁的木质纤维素降解系统由2部分组成:前肠/唾液腺及中肠组成的内源性消化系统;后肠微生物共生体组成的外源性消化系统[3-4]。一方面,低等白蚁后肠生物密度极大的共生鞭毛虫在降解纤维素的过程中起着不可替代的主导作用。同时,大量原核微生物(细菌与古细菌)或生活在鞭毛虫的细胞表面(ectosymbionts),或生活在鞭毛虫的细胞内部(endosymbionts)与鞭毛虫形成了第二重的共生关系[5-6]。另一方面,低等白蚁自身也能分泌整套由纤维素酶、半纤维素酶组成的木质纤维素降解酶系[7-8]。其中,纤维素酶主要包括内切葡聚糖酶(endo-1,4-β-D-glucanase,EC. 3.2.1.4,简称EG)、纤维二糖水解酶(β-1,4-cellobiohydrolase,EC. 3.2.1.91,简称CBH)以及β-葡萄糖苷酶 (β-glucosidase,EC. 3.2.1.21,简称BG)[9-10]。
研究表明,温度是低等白蚁取食、生存、后肠原生动物活性及消化效率[11-13]的重要影响因素。但目前为止,关于温度对低等白蚁纤维素降解双系统差异影响鲜有研究。台湾乳白蚁的生理温度临界范围(critical thermal range)为14.0~46.3 ℃[14]。本研究在台湾乳白蚁生理临界温度范围内,选取15、22、28、32、37、42 ℃作为纤维素酶反应温度,分析反应温度对内源、外源3种纤维素酶,以及滤纸酶(filter paperase,简称FPA)活力的差异影响,为今后更深入地阐明环境与低等白蚁宿主-共生微生物纤维素水解系统相互作用机制以及新型白蚁防治方法提供理论数据。
1材料与方法
1.1试验材料
试验白蚁:供试白蚁工蚁取自本实验室饲养的3个独立台湾乳白蚁巢。供试工蚁在28 ℃,相对湿度(80±5)%条件下,以蛭石保湿饥饿48 h均一化白蚁肠道,以备酶活力测定。
主要试剂包括:羧甲基纤维素钠(sodium salt of caboxy methyl cellulose,简称CMC-Na,天津福晨化学试剂厂)、葡萄糖(glucose,广州化学试剂厂)、滤纸(双圈定性滤纸)、 D-水杨苷(D-salicin,上海晶纯试剂有限公司)、对硝基苯-8-D-纤维二糖苷(p-NPC,美国Sigma公司)、对硝基苯酚(p-NP,美国Genview公司)、牛血清蛋白组分Ⅴ(albumin from bovine serum,简称BSA,美国Genview公司)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,简称DNS,美国Genview公司)、考马斯亮蓝G-250(coomassie brilliant blue G-250,美国Genview公司)。
1.2试验方法
1.2.1纤维素酶粗酶液制取选取乳白蚁工蚁约80头置于0.9%(质量浓度)灭菌生理盐水中反复漂洗之后,用滤纸吸干表面水分,放入已灭菌的干净培养皿中。在实体解剖镜下将白蚁肠道解剖,分成前肠/唾液腺+中肠(内源纤维素酶活力检测段)和后肠(外源纤维素酶活力检测段)2部分,与5头未解剖的乳白蚁共分成3组,分别用1 mL醋酸钠缓冲液(0.1 mol/L,pH值=5.6)离心管再转移至玻璃组织匀浆器,冰浴研磨;研磨完毕后,将匀浆液吸至离心管定容至1 mL,12 000 r/min、4 ℃冷冻离心(美国Sigma公司,3K15) 15 min,取上清,再次12 000 r/min、4 ℃冷冻离心5 min,取上清即为粗酶液,于 -20 ℃ 保存待用。
1.2.2纤维素酶活力测定(1)滤纸酶(FPA)、内切葡聚糖酶(EG)及β-葡萄糖苷酶(BG)活力的测定参照Miller的方法[15],均采用还原糖法。在1.5 mL的离心管中,分别加入120 μL 1% CMC-Na、D-Salicin及5 mm×5 mm灭菌滤纸1片,预热5 min,然后加入12 μL酶液,37 ℃准确反应 60 min,立即加入120 μL DNS 溶液终止反应,沸水浴 5 min,冰浴冷却,使用多功能酶标仪(victor 3 multi-label microplate reader,美国珀金埃尔默仪器有限公司)在540 nm处测定吸光度,以葡萄糖为标准物计算产物还原糖含量[16]。EG、BG、FPA酶活力定义为1 mg蛋白质在37 ℃、pH值=56反应条件下分解底物,1 min可以产生还原糖的量,表示为U/mg。每个酶切反应重复3次。(2)纤维二糖水解酶(CBH)活力测定:在 1.5 mL 离心管中加入120 μL 1 mmol pNPC底物,预热5 min,然后加入酶液12 μL,37 ℃ 准确反应 60 min,加入120 μL Na2CO3 (0.6 mol/L)溶液终止反应,使用酶标仪测定D405 nm,从p-NP标准曲线求得p-NP含量,计算酶活力单位。CBH酶活力定义为1 mg蛋白质在37 ℃、pH值=5.6反应条件下分解p-NPC,1 min可以产生p-NP的量,表示为U/mmol。每个酶切反应测定3次。
1.2.3蛋白质浓度的测定采用考马斯亮蓝法。将粗酶液稀释1倍,取50 μL稀释粗酶液,加入250 μL考马斯亮蓝 G-250显色试剂,多功酶标仪测定D595 nm,用牛血清蛋白组分Ⅴ制作标准曲线求蛋白质含量,每个样本测定3次。
1.2.4统计学方法采用SPSS 17.0软件分析数据。整头白蚁、唾液腺/前肠+中肠及后肠3组样品在不同反应温度下的酶活力差异均采用单因素方差分析(One Way ANOVA,α=0.05)与t检验(LSD,α=0.05)。3巢白蚁共进行3次梯度反应温度测定,所有误差线为均值的标准误差(standard error of mean,简称SEM)。
2结果与分析
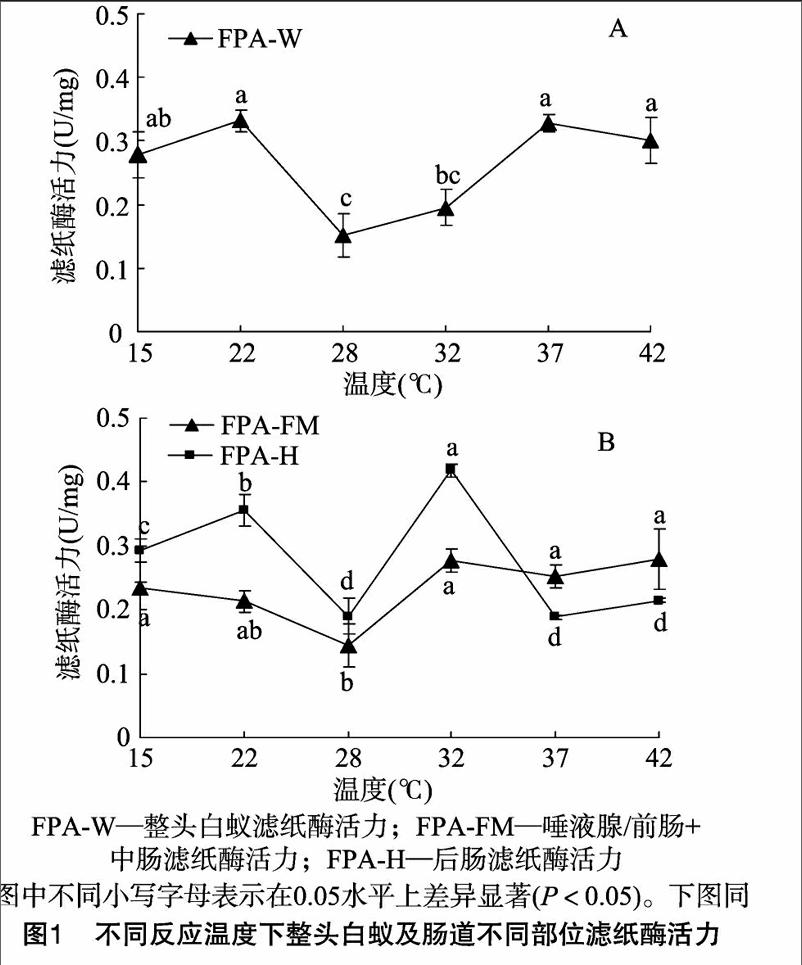
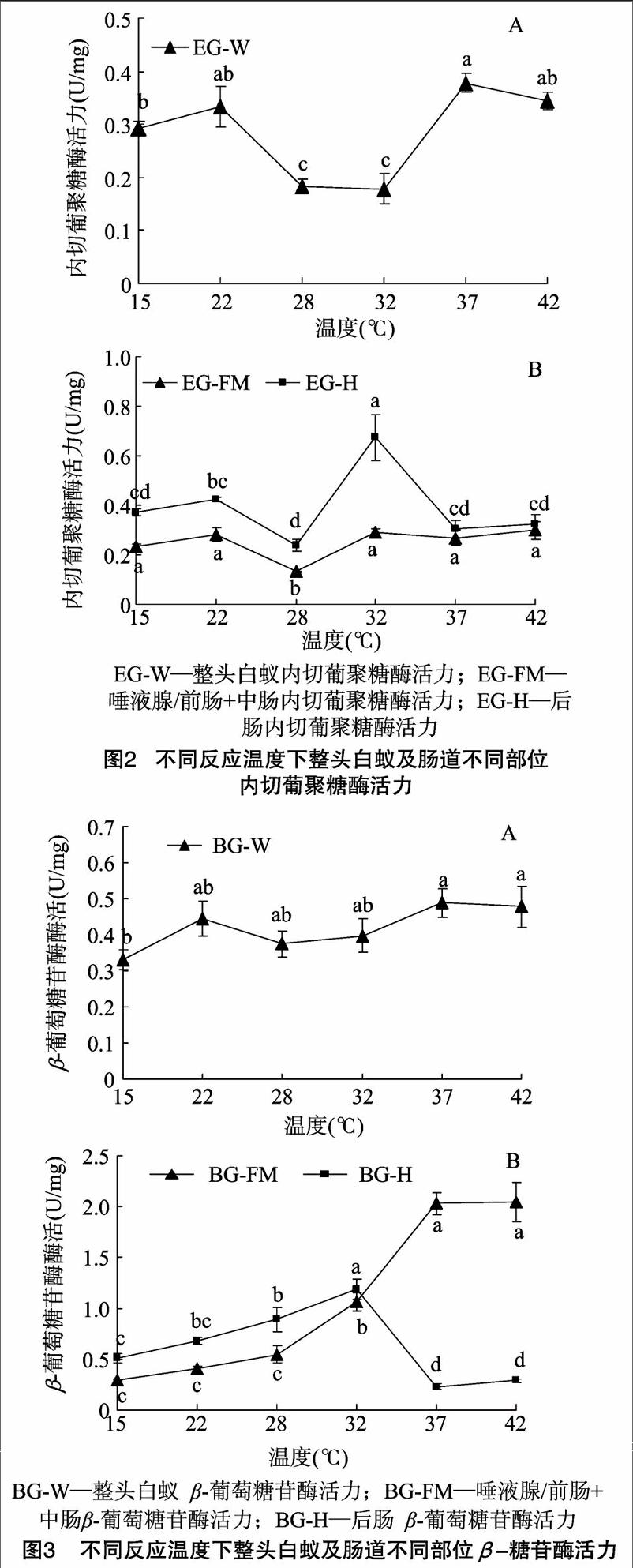
前肠/唾液腺+中腸部分用于检测白蚁内源性纤维素酶活性变化,4种酶标准缩写为FPA/EG/BG/CBH-FM;后肠部分用于检测白蚁共生微生物来源纤维素酶活性变化,4种酶标准缩写为FPA/EG/BG/CBH-H;整头白蚁4种酶指标缩写为FPA/EG/BG/CBH-W。
2.1反应温度对内源与外源纤维素酶降解滤纸能力的差异影响
FPA-W活力在反应温度为22 ℃达到最大值,且在15、22、37、42 ℃下反应测得各FPA酶活力之间无显著差异。FPA-W在28、32 ℃下反应活性相对较小(图1-A)。后肠对滤纸的降解能力受反应温度影响较内源性纤维素酶大(FPA-FM 组内F=3.536,P<0.05;FPA-H组内F=2875,P<0.05)。FPA-H最佳反应温度为32 ℃,显著大于其他反应温度下FPA-H活力。FPA-FM对滤纸的最佳降解温度为42 ℃。在15~32 ℃时,FPA- H活力大于FPA-FM活力,而在 37~42 ℃时,FPA- FM活力大于FPA-H活力(图1-B)。
2.2反应温度对内源与外源内切葡聚糖酶活力的影响
EG- W的最佳反应温度为37 ℃,且在22、37、42 ℃下反应测得各EG-W酶活力之间无显著差异。在28、32 ℃下,EG-W反应活性相对较小(图2-A)。后肠微生物群落对滤纸酶的降解能力受反应温度影响较内源性纤维素酶大(EG-FM 组内F=7.111,P<0.05;EG-H组内F=11.107,P<0.05)。EG-H 最佳反应温度为32 ℃,显著大于其他温度下EG-H活力。在15、22、32、37、42 ℃下,EG-FM反应活性两两之间无显著差异(图2-B)。
2.3反应温度对内源与外源β-葡萄糖苷酶活力的影响
BG-W活力受反应温度影响小,组内无显著差异(BG-W 组内F=2.040,P=0.145)(图3-A)。BG -FM与BG-H酶活力在15~32 ℃下反应, 随温度升高而增加,而反应温
度升高至37~42 ℃,BG-FM活力显著增加,BG-H活力则显著降低(图3-B)。
2.4反应温度对内源与外源纤维二糖水解酶的影响
CBH-W最佳反应温度为37 ℃,且在37、42 ℃时,CBH-W的酶活力之间无显著差异(图4-A)。CBH-FM在15~32 ℃内,反应活力变化整体趋势随温度升高而增加。在22~32 ℃之内,CBH-H活性随反应温度升高逐渐增加,且在32 ℃时,CBH-H活力达到最高值,反应温度再升高活力显著下降(图4-B)。
3结论与讨论
低等白蚁对木质纤维素的高效降解通常认为是内源与外源(后肠共生微生物)降解系统的增效协同作用[3]。温度是影响低等白蚁取食消化等生理功能的重要物理因子[11-13]。本试验选取台湾乳白蚁生理临界温度范围内的15、22、28、32、37、42 ℃作为纤维素酶反应温度,分析研究了反应温度对乳白蚁工蚁内源与外源3种纤维素酶及滤纸酶活力的差异影响。
整头白蚁的FPA、EG、BG、CBH活力随反应温度的变化为内源及外源纤维素酶活力随反应温度变化的综合作用。其中,FPA-W与EG-W的活力随反应温度变化的趋势相似,BG-W活力则受反应温度影响小,组内无明显差异。滤纸全酶活是衡量纤维素酶降解天然纤维素能力的指标。EG首先作用于非结晶态纤维素和水溶性纤维素衍生物,随机水解糖苷键,分解成葡萄糖、纤维二糖、纤维三糖和其他寡聚糖。BG再将纤维二糖和水溶性糊精水解成葡萄糖。因而,只需要EG与BG等2种酶的参与即能将一部分纤维素水解成葡萄糖[14]。结果表明,白蚁对天然纤维素的降解可能极大地被EG活力所影响。
本试验结果表明,外源(后肠)共生微生物纤维素酶对温度的敏感性大于内源性(唾液腺/前肠+中肠)纤维素酶。而且,内源性纤维素酶的最佳反应温度高于外源共生微生物纤维素酶的最佳反应温度。其中,FPA-H、EG-H、BG-H 及CBH-H的最佳反应温度均为32 ℃,且活力均在37 ℃后显著下降。然而,FPA-FM与EG-FM在反应温度升至42 ℃时,活性未出现明显影响。在15~42 ℃范围内,BG-FM 与CBH-FM活力整体随反应温度上升而增加,且CBH-FM活力在42 ℃有显著增加。由此可见,32 ℃是内源与外源酶发挥作用的重要分歧温度。研究表明,台湾乳白蚁的生理活性温度范围为14.0~46.3 ℃[17],最佳取食温度范围为30~35 ℃[18-20]。因此,后肠纤维素酶最佳反应温度处于最佳取食温度范围内,而内源纤维素酶的最佳反应温度则高于该温度范围。一方面,低等白蚁后肠消化系统被认为对木质纤维素的降解起主导性作用,例如:北美散白蚁(Reticulitermes flavipes Kollar)的内源与外源纤维素水解系统分别提供33%与66%的葡萄糖[10],由此推测,台湾乳白蚁后肠纤维素酶最佳反应温度是与乳白蚁最佳取食温度相互对应的,即在最适取食温度下台湾乳白蚁降解木质纤维素也主要依靠后肠共生微生物消化系统。另一方面,纤维素在经过白蚁唾液腺和中肠上皮细胞分泌的各种消化酶的分解后,大部分较易消化的木质纤维素在到达中肠末尾时已被降解吸收[21],表明内源纤维素酶系统的独立性。因此,在40 ℃生理极限高温环境下,台湾乳白蚁的内源性纤维素降解系统对白蚁的生存起到了非常重要的作用。
白蟻对周围环境的适应能力与肠道微生物的组成以及肠道微生物的消化能力有着密不可分的联系[22]。阐明温度与低等白蚁木质纤维素消化系统之间的相互作用机制还需要进一步研究。
参考文献:
[1]Vargo E L,Husseneder C,Grace J K. Colony and population genetic structure of the formosan subterranean termite,Coptotermes formosanus,in Japan[J]. Molecular Ecology,2003,12(10):2599-2608.
[2]Shinzato N,Muramatsu M,Matsui T,et al. Molecular phylogenetic diversity of the bacterial community in the gut of the termite Coptotermes formosanus[J]. Bioscience,Biotechnology,and Biochemistry,2005,69(6):1145-1155.
[3]Nakashima K,Watanabe H,Saitoh H,et al. Dual cellulose-digesting system of the wood-feeding termite,Coptotermes formosanus Shiraki[J]. Insect Biochemistry and Molecular Biology,2002,32(7):777-784.
[4]Xie L,Zhang L,Zhong Y,et al. Profiling the metatranscriptome of the protistan community in Coptotermes formosanus with emphasis on the lignocellulolytic system[J]. Genomics,2012,99(4):246-255.
[5]Ohkuma M,Ohtoko K,Iida T,et al. Phylogenetic identification of hypermastigotes,pseudotrichonympha,spirotrichonympha,holomastigotoides,and parabasalian symbionts in the hindgut of termites[J]. Journal of Eukaryotic Microbiology,2000,47(3):249-259.
[6]Zhou X,Smith J A,Oi F M,et al. Correlation of cellulase gene expression and cellulolytic activity throughout the gut of the termite Reticulitermes flavipes[J]. Gene,2007,395(1/2):29-39.
[7]Tartar A,Wheeler M M, Zhou X,et al. Parallel metatranscriptome analyses of host and symbiont gene expression in the gut of the termite Reticulitermes flavipes[J]. Biotechnol for Biofuels,2009,2(1):25.
[8]Scharf M E,Karl Z J,Sethi A,et al. Multiple levels of synergistic collaboration in termite lignocellulose digestion[J]. PLoS One,2011,6(7):e21709.
[9]Arakawa G,Watanabe H,Yamasaki H,et al. Purification and molecular cloning of xylanases from the wood-feeding termite,Coptotermes formosanus Shiraki[J]. Bioscience,Biotechnology,and Biochemistry,2009,73(3):710-718.
[10]Willis J D,Oppert C,Jurat-Fuentes J L. Methods for discovery and characterization of cellulolytic enzymes from insects[J]. Insect Science,2010,17(3):184-198.
[11]Gautam B K,Henderson G. Relative humidity preference and survival of starved formosan subterranean termites (Isoptera:Rhinotermitidae) at various temperature and relative humidity conditions[J]. Environmental Entomology,2011,40(5):1232-1238.
[12]Belitz L A,Waller D A. Effect of temperature and termite starvation on phagocytosis by protozoan symbionts of the eastern subterranean termite Reticulitermes flavipes Kollar[J]. Microbial Ecology,1998,36(2):175-180.
[13]Fuller C A,Postava-Davignon M. Termites like it hot and humid:the ability of arboreal tropical termites to mediate their nest environment against ambient conditions[J]. Ecological Entomology,2014,39(2):253-262.
[14]Sponsler R C,Appel A G. Temperature tolerances of the formosan and eastern subterranean termites (Isoptera:Rhinotermitidae)[J]. Journal of Thermal Biology,1991,16(1):41-44.
[15]Miller G L. Use oidinitrosalicylic acid reagent tor determination oi reducing sugar[J]. Analytical Chemistry,1959,31(3):426-428.
[16]Eveleigh D E,Mandels M,Andreotti R,et al. Measurement of saccharifying cellulase[J]. Biotechnol for Biofuels,2009,2(1):21.
[17]相輝,周志华. 白蚁及共生微生物木质纤维素水解酶的种类[J]. 昆虫知识,2009,46(1):32-40.
[18]Smythe R V,Williams L H. Feeding and survival of two subterranean termite species at constant temperatures[J]. Annals of the Entomological Society of America,1972,65(1):226-229.
[19]Yamano K. An experimental study on the feeding consumption of the formosan subterranean termite Coptotermes formosanus Shiraki (in Japanese)[J]. Shiroari,1979,37:9-15.
[20]Nakayama T,Yoshimura T,Imamura Y. The optimum temperature-humidity combination for the feeding activities of Japanese subterranean termites[J]. Journal of Wood Science,2004,50(6):530-534.
[21]Brune A. Symbiotic associations between termites and prokaryotes[M]. Springer New York,2006.
[22]Boucias D G,Cai Y,Sun Y,et al. The hindgut lumen prokaryotic microbiota of the termite Reticulitermes flavipes and its responses to dietary lignocellulose composition.[J]. Molecular Ecology,2013,22(7):1836-1853.
