拟南芥铵转运蛋白AtAMT1.3的电生理功能
2017-06-30郝东利杨顺瑛黄亚楠苏彦华
郝东利++杨顺瑛++黄亚楠++苏彦华
摘要:在生理条件下,植物铵的吸收主要由定位于细胞膜上的铵转运蛋白(ammonium transporter,AMT)介导完成,研究模式植物拟南芥AMT的功能特性及调控机制对于解析植物的铵吸收过程具有重要意义。本研究克隆了拟南芥AtAMT1.3并将其在蛙卵异源系统中表达,电生理结果表明,AtAMT1.3 是一个典型的对铵有高度选择性、高亲和的铵吸收系统[Km =(25.5 ± 3.2) μmmol/L]。同时,AtAMT1.3也能介导铵的同系物甲基铵的吸收[Km =(3.3±0.2) mmmol/L],对铵和甲基铵的吸收具有浓度依赖性和电压依赖性。 AtAMT1.3的铵转运能力不受pH值调控,它的转运底物是NH4+,运输机制是NH4+单向运输。
关键词:拟南芥;铵转运蛋白AtAMT1.3;介导;电生理;功能特征;铵吸收系统;运输机制
中图分类号: S184;Q946.1文献标志码: A文章编号:1002-1302(2017)08-0036-05
铵态氮是植物能够直接吸收的重要无机氮素形态。模式植物拟南芥是一种喜铵植物,在相同浓度供应下,铵态氮的吸收速率高达硝态氮的20倍[1],植物对铵的吸收主要是由铵转运蛋白(AMT)介导的[2-4]。拟南芥基因组中一共有6个AMT,即AtAMT1.1、AtAMT1.2、AtAMT1.3、AtAMT1.4、AtAMT1.5、AtAMT2[5]。除了AtAMT1.4 专一地在花粉和花粉管中表达外[6],其他5个AMT在根部均有表达[5,7]。拟南芥突变体试验证明,3个AtAMT1(AtAMT1.1、AtAMT1.2、AtAMT1.3)贡献了约90%的铵吸收,其中AtAMT1.1和AtAMT1.3各贡献了约30%[3,5],AtAMT1.2贡献率略小(18%~26%)[5]。AtAMTS 通过时空定位以及对铵亲和力的差异来满足拟南芥生长合适的氮素需要[5]。简单来说,AtAMT1.1、AtAMT1.3 和AtAMT1.5主要定位于表皮细胞,其对铵的亲和力很强,三者负责将铵从土壤溶液中吸收到根内并通过共质体途径运输;而AtAMT1.2主要定位于内皮层,且对铵的亲和力相对较低,通过质外体途径运输的铵受阻于凯氏带,此时AtAMT1.2将其运进细胞,进入共质体途径,最终完成同化或木质部的输送。由于植物体的复杂,将单个铵转运蛋白在异源系统中表达更有利于研究其转运、调控机制。酵母和蛙卵是2种常用的表达系统,酵母铵吸收缺失突变体31019b 不能在 <5 mmol/L NH4+作为唯一氮源的培养基上生长[8-9],转入任意一个AtAMT1 均能使其恢复生长,再次证实了它们直接吸铵的功能[5-6,10-11]。蛙卵系统除了能够验证其吸铵功能外,还有一个重要的作用就是可以用来解析其转运机理。虽然植物AMT1之间同源性很高,但是其转运机理却大不相同[12],目前对于AtAMT1.3的蛙卵电生理功能特征研究尚缺少。本试验克隆了AtAMT1.3并将其在蛙卵系统中进行表达,通过电生理技术研究其离子选择性,对铵及其同系物甲基铵的亲和性、pH值响应,初步阐明了AtAMT1.3的运输机制及功能特征。
1材料與方法
1.1材料
拟南芥(Arabidopsis)、大肠杆菌 DH5α和蛙卵表达载体 pCI 由笔者所在实验室保存,非洲爪蟾由笔者所在实验室饲养;PCR扩增高保真酶PrimeSTAR购自TaKaRa 公司;T4连接酶、限制性内切酶 EcoRⅠ和XbaⅠ购自 NEB公司;引物由上海英骏生物技术有限公司合成;胶原酶A 购自 Roche 公司;电生理用试剂购自Ameresco 公司;双电极电压钳设备购自Axon公司。放大器型号为pClamp 900A,数模转换型号为Digidata 1440,质粒注射仪器型号为 Nanoliter 2000。
1.2AtAMT1.3开放阅读框的扩增及表达载体的构建
取冻存的拟南芥样品约100 mg,液氮研磨,根据说明书提取RNA。利用反转录试剂合成cDNA第1链,AtAMT1.3序列登录号为At3g24300.1。以cDNA为模板,进行PCR扩增。引物序列:P1,5′-GTCGAATTCATGTCAGGAGCAATAACATGC-3′;P2,5′-GTCTCTAGATTAAACGCGAGGAGGAGTAGC-3′。PCR扩增程序:95 ℃预变性5 min;95 ℃ 1 min,53 ℃ 1 min,72 ℃ 1.67 min,24个循环;72 ℃延伸10 min。割胶回收,将产物“3′-”端加A尾后连到 PMD19-T vector,转入大肠杆菌DH5α,阳性克隆送往华大基因科技有限公司测序。用限制性内切酶EcoRⅠ和XbaⅠ将测序正确地克隆切下来,通过T4连接酶连入蛙卵表达载体pCI。
1.3注射蛙卵及电生理检测
首先,将蛙卵从非洲爪蟾中取出,用 1 mg/mL 胶原酶A 消解1.5~2.0 h,然后挑选健康的单个蛙卵保存于ND96溶液中,其中ND96溶液成分包括96 mmol/L NaCl、2 mmol/L KCl、1.8 mmol/L CaCl2、1 mmol/L MgCl2、5 mmol/L HEPES(用NaOH调pH值至7.4)。将59.8 nL的质粒pCI-OsAMT1.3注射进入健康的蛙卵,同等体积的无菌水注射进入蛙卵,作为对照。将蛙卵置于ND96溶液(2.5 mmol/L丙酮酸钠)中,19 ℃ 培养3 d,检测。蛙卵钳置于-70 mV中,利用连续ramp记录。膜电位施加程序的电压为-140~20 mV,与之前的报道一样,注射水的蛙卵对1 mmol/L NH4+ 或 10 mmol/L MeA+ 不敏感[12]。电生理用基本溶液成分包括100 mmol/L NaCl、2 mmol/L CaCl2、2 mmol/L MgCl2、4 mmol/L Tris (用MES调pH值至7.4),NH4Cl或者MeACl 根据图表的指示添加。在做离子选择性试验时,基本溶液中的 NaCl 换成相同浓度的CholineCl。
2结果与分析
2.1AtAMT1.3-pCI载体的构建
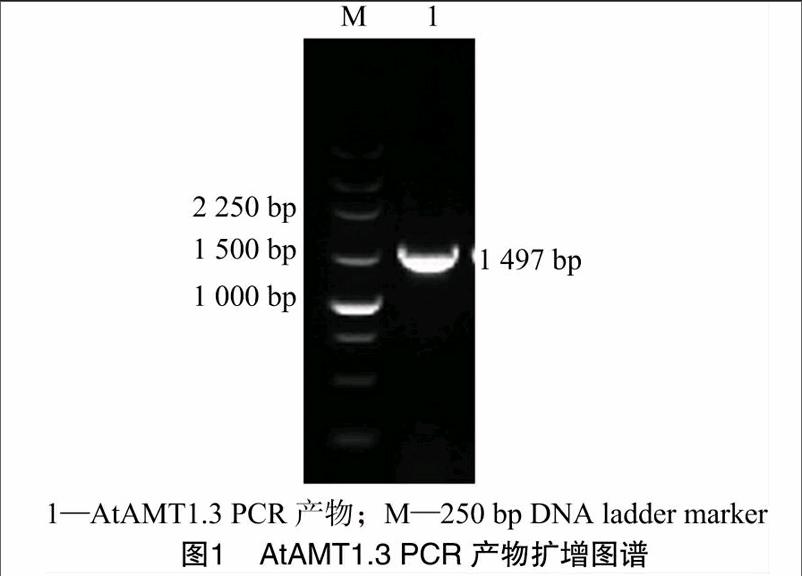
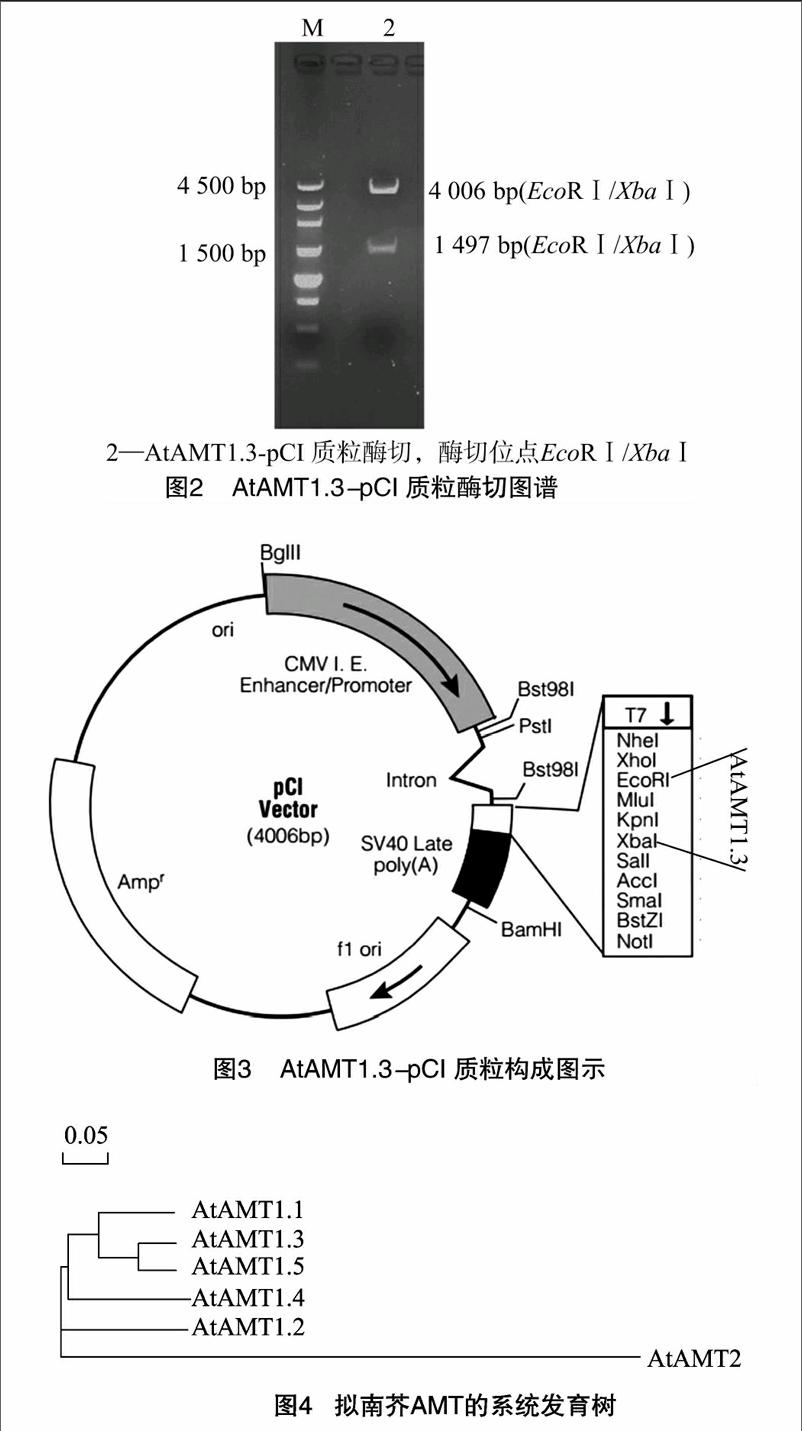
以拟南芥cDNA为模板,以 P1、P2为引物进行PCR扩增,获得长度为1 497 bp 目的片段(图1),割胶回收,连入 PMD19-T vector 载体,经转化、筛选、测序得到正确的AtAMT1.3-PMD19-T,用EcoRⅠ和XbaⅠ双酶切 AtAMT1.3-PMD19-T和 pCI,割胶回收AtAMT1.3片段和pCI大片段,通过T4 连接酶连接目的片段和大载体片段,转化后筛选获得阳性质粒AtAMT1.3-pCI,酶切验证正确后浓度浓缩至>1 μg/μL,备用 (图2),AtAMT1.3-pCI 质粒构成见图3。
2.2AtAMT1.3 的氨基酸序列分析
氨基酸序列分析表明,AtAMT1.3 在进化上与AtAMT1.5亲缘关系最近,AtAMT1.1次之 (图4)。它们都属于 AMT-1亚家族,其中AtAMT1.3 与 AtAMT1.2之间的亲缘关系在该亚家族内部最远(图4)。基于 AtAMT1.1 和 AtAMT1.2 已较
为明了的功能特征[11,13-15]进行预测,结果显示,AtAMT1.3在功能特征方面的表现与 AtAMT1.1相近,而与 AtAMT1.2 差异较大。
2.3AtAMT1.3的离子选择性
在-70 mV 下添加 1 mmol/L碱性阳离子Li+、Na+、K+、Rb+、Cs+入电生理基本溶液,对AtAMT1.3介导的电流没有明显影响,而用 1 mmol/L NH4+ 灌流能产生大幅内向的电流(图5-a),说明 AtAMT1.3是一个高度选择性的铵吸收系统。这种高度铵的选择性在整个电压区间内(-140 ~20 mV)皆是如此(图5-b),说明 AtAMT1.3 对铵吸收的高度选择性是不依赖于膜电位的。
2.4AtAMT1.3的铵浓度响应
在-70 mV 下,AtAMT1.3 介导的内向铵电流随着铵浓度的增加而增加,在<400 μmol/L 的铵浓度下,电流急剧增大;而在1 000 μmol/L 下,接近饱和,说明AtAMT1.3介导的铵吸收具有浓度依赖性(图6-a);AtAMT1.3介导的内向铵电流睡着膜电位的增加而增加,说明AtAMT1.3的铵吸收具
有电压依赖性(图6-b)。通过米氏方程拟合得到AtAMT1.3 介导的铵吸收在 1 mmol/L左右达到饱和(图6-c)。在 -140 mV 下,Km值(达到1/2最大吸收速率时的铵浓度)为(18.1±2.8) μmol/L;在-130 mV下,Km值为(21.4±3.01) μmol/L;在-120 mV下,Km值为(25.5±3.2) μmol/L;在-110 mV下,Km值为(28.2±3.5) μmol/L;在-100 mV下,Km值为(35.0±3.5) μmol/L;在-90 mV下,Km值为(44.6±4.0) μmol/L;在-80 mV下,Km值为(57.8±5.2) μmol/L,由此可见Km值具有电压依赖性,即膜电位越正,Km值越大,说明铵是以离子的形态進入细胞膜的(图6-d)。假设在膜内有1个NH4+的结合位点,则这个位点应位于整个膜电场52%的位置。
2.5AtAMT1.3的甲基铵浓度响应
甲基铵是铵的同系物,广泛应用于AMT的功能研究。在-70 mV 下,AtAMT1.3 介导的内向甲基铵电流也具有浓度依赖性,即随着甲基铵浓度的增加而增加,在铵浓度<7.5 mmol/L 下,电流急剧增大;而在胺浓度为10 mmol/L 下,电流接近饱和(图7-a)。AtAMT1.3介导的内向甲基铵具有电压依赖性,即膜电位越负,电流越大(图7-b)。通过米氏方程拟合得到甲基铵亲和力常数Km值在毫摩尔级:在 -140 mV 下,Km =(2.5±0.1) mmol/L;在-130 mV下,Km =(2.9±0.1) mmol/L;在-120 mV下,Km=(3.3±0.2) mmol/L;在-110 mV下,Km=(3.8±0.2) mmol/L;在-100 mV下,Km=(4.4±0.2) mmol/L;在-90 mV下,Km=(5.1±0.3) mmol/L;在-80 mV下,Km=(5.7±0.4) mmol/L。Km值具有电压依赖性,即膜电位越正,Km值越大(图7-c),说明甲基铵是以离子的形态进入细胞膜的。假设在膜内有1个MeA+的结合位点的话,则这个位点应位于整个膜电场34%的位置。
2.6AtAMT1.3的pH值响应
在-70 mV 下,AtAMT1.3介导的铵电流不受外界pH值调控,即酸性条件和接近中性的pH值对铵电流基本没有影响(图8-a)。在不同膜电位下,AtAMT1.3介导的铵电流皆不受pH值调控(图8-b、图8-c)。
3结论与讨论
在同一氮素水平供应下,拟南芥对铵的吸收速率是硝的20倍[1],说明铵态氮对其生长极其重要,植物的铵吸收是由AMT介导完成的[2-4]。AtAMT1.3虽然贡献于根部的铵吸收,但是其功能特征如对铵吸收专一与否、对膜电位的响应、不同电压下的亲和力、运输机理等还不清楚。本研究结果表明,AtAMT1.3 是一个典型的高度选择性的、高亲和铵吸收系统 (图5、图6),其 Km 值为25 μmol/L,与AtAMT1.1 的Km 值很接近[13],但与AtAMT1.2差距很大[11]。AtAMT1.3与AtAMT1.1亲缘性近,而与AtAMT1.2远(图4),再根据结构决定功能的原理可知,这种Km 值的差异反映了AtAMT1.3与AtAMT1.1的相似性。 AtAMT1.3不仅能通透NH4+,也能通透NH4+的同系物MeA+,但其对MeA+的通透性要低,亲和力降低了约100倍(图7),这与大多数报道的AMT-1亚家族的铵转运类似[11,16-17]。AMT既能通透NH4+、又能通透MeA+的种特性有利于对AMT功能特征的研究,如在酵母表达系统中,通过14C标记的MeA来研究AMT的吸收以及亲和特征[18-19]。
盡管AMTs在结构上同源性很高,但其转运底物和转运机理却大不相同[12],甚至对相同的AMT提出不同的转运机制。Khademi等通过解析大肠杆菌EcAmtB晶体结构提出该蛋白结合的是NH4+,但是最终运输的是NH3[20]。因为记录得到了离子态的NH4+内流,这个NH3运输的观点受到挑战[21]。对于植物AMT,研究者们根据一系列的试验证据提出了4种运输机制:如番茄LeAMT1.1、水稻OsAMT1.1的运输机制是NH4+单向运输[16-17];拟南芥AtAMT1.2、小麦TaAMT1.1的运输机制是NH3/H+共运[22-23];菜用大豆的PvAMT1.1运输机制是 NH4+/H+同向运输[24];拟南芥AtAMT2的运输机制是NH3运输[25]。本研究解析出AtAMT1.3的运输机制是NH4+单向运输,原因如下:(1)酵母功能互补证明了AtAMT1.3 具有吸铵功能[5],电生理记录得到了NH4+产生的电流(图3),说明进入蛙卵的铵形态是离子态的(因分子进入不会产生电流),排除了NH3运输的机制。(2)AtAMT1.3介导的铵内流不受pH值调控(图8),排除了NH4+/H+同向运输和NH3/H+共运2种可能,因为如果是这2种机制的话,外界pH值改变(pH 值由5.4 转变到 74)使得溶液中H+的浓度减小100倍,即其中的一个底物量急剧减少,势必会对其运输产生巨大的影响。事实上,AtAMT1.3介导的铵内流不受外界pH影响(图8),那么AtAMT1.3的铵运输机理只可能是NH4+单向运输。(3)吸收动力学拟合得到AtAMT1.3的希尔吸收等于1,说明只有1种底物(图6)。通过拟合Km值对电压的依赖性,得到这个底物的结合位点位于整个膜电场52%的位置;进一步说明AtAMT1.3的运输机制是 NH4+单向运输。AtAMT1.3运输机制与AtAMT1.1相同,而与AtAMT1.2不同;在同源性上前两者之间也比AtAMT1.3与AtAMT1.2之间近 (图4)。由此推测,决定AtAMT1.3与AtAMT1.2 运输机制不同的很可能是与AtAMT1.1相同、而与AtAMT1.2差异较大的氨基酸区域,这个猜想需要进一步的试验证实。
拟南芥中AtAMT1.3缺失突变体引起的侧根分化差异表型,只能由AtAMT1.3 补回,而不能由AtAMT1.1补回[26]。AtAMT1.3在基本功能特征上与AtAMT1.1很相似,如对铵的高度选择性和很高的亲和力,NH4+作为转运底物,不受pH值调控 (图5至图7)。功能如此相似,表型却不能被相似的AtAMT1.1恢复,进一步说明AtAMT1.3 在植物体内除了养分吸收外还扮演其他的角色,如影响侧根分化。
总体来说,本试验通过研究拟南芥的AtAMT1.3电生理功能特征,证明该蛋白是典型的高度选择性的高亲和铵吸收系统,其对铵的亲和力在微摩尔级,而对甲基铵的亲和力至少低了10倍。AtAMT1.3介导的铵内流不受外界pH值调控,其运输机制是NH4+单向运输。
参考文献:
[1]Gazzarrini S,Lejay L,Gojon A,et al. Three functional transporters for constitutive,diurnally regulated,and starvation-induced uptake of ammonium into arabidopsis roots[J]. The Plant Cell,1999,11(5):937-947.
[2] von Wirén N,Merrick M. Regulation and function of ammonium carriers in bacteria,fungi,and plants[J]. Top Current Genetics,2004,9:1-26.
[3]Loque D,Yuan L X,Kojima S,et al. Additive contribution of AMT1.1 and AMT1.3 to high-affinity ammonium uptake across the plasma membrane of nitrogen-deficient Arabidopsis roots[J]. Plant Journal,2006,48(4):522-534.
[4]Ludewlg U,Neuhduser B,Dynowski M. Molecular mechanisms of ammonium transport and accumulation in plants[J]. FEBS Letters,2007,581(12):2301-2308.
[5]Yuan L X,Loque D,Kojima S,et al. The organization of high-affinity ammonium uptake in Arabidopsis roots depends on the spatial arrangement and biochemical properties of AMT1-type transporters[J]. The Plant Cell,2007,19(8):2636-2652.
[6]Yuan L X,Graff L,Loque D,et al. AtAMT1.4,a pollen-specific high-affinity ammonium transporter of the plasma membrane in Arabidopsis[J]. Plant and Cell Physiology,2009,50(1):13-25.
[7]Birnbaum K,Shasha D E,Wang J Y,et al. A gene expression map of the Arabidopsis root[J]. Science,2003,302(5652):1956-1960.
[8] Marini A M,Soussi-Boudekou S,Vissers S,et al. A family of ammonium transporters in saccharomyces cerevisiae[J]. Molecular and Cellular Biology,1997,17(8):4282-4293.
[9]楊顺瑛,丛郁,郝东利,等. 利用异源酵母功能互补法研究水稻铵转运体OsAMT1.1功能及调控机制[J]. 江苏农业科学,2015,43(1):27-31.
[10]Loque D,Lalonde S,Looger L L,et al. A cytosolic trans-activation domain essential for ammonium uptake[J]. Nature,2007,446(7132):195-198.
[11]Neuhaeuser B,Dynowski M,Mayer M,et al. Regulation of NH4+ transport by essential cross talk between AMT monomers through the carboxyl tails[J]. Plant Physiology,2007,143(4):1651-1659.
[12]Mayer M,Dynowski M,Ludewig U. Ammonium ion transport by the AMT/Rh homologue LeAMT1.1[J]. Biochemical Journal,2006,396(3):431-437.
[13]Loque D,Mora S I,Andrade S L,et al. Pore mutations in ammonium transporter AMT1 with increased electrogenic ammonium transport activity[J]. Journal of Biological Chemistry,2009,284(37):24988-24995.
[14]Mayer M,Ludewig U. Role of AMT1.1 in NH4+ acquisition in Arabidopsis thaliana[J]. Plant Biology,2006,8(4):522-528.
[15]Wood C C,Poree F,Dreyer I,et al. Mechanisms of ammonium transport,accumulation,and retention in ooyctes and yeast cells expressing Arabidopsis AtAMT1.1[J]. FEBS Letters,2006,580(16):3931-3936.
[16]Ludewig U,von Wiren N,Frommer W B. Uniport of NH4+ by the root hair plasma membrane ammonium transporter LeAMT1.1[J]. Journal of Biological Chemistry,2002,277(16):13548-13555.
[17]Yang S Y,Hao D L,Cong Y,et al. The rice OsAMT1.1 is a proton-independent feedback regulated ammonium transporter[J]. Plant Cell Reports,2015,34(2):321-330.
[18]Dapuzzo E,Rogato A,Simon-Rosin U,et al. Characterization of three functional high-affinity ammonium transporters in Lotus japonicus with differential transcriptional regulation spatial expression[J]. Plant Physiology,2004,134(4):1763-1774.
[19]Shelden M C,Dong B,de Bruxelles G L,et al. Arabidopsis ammonium transporters,AtAMT1.1 and AtAMT1.2,have different biochemical properties and functional roles[J]. Plant and Soil,2001,231(1):151-160.
[20]Khademi S,Oconnell J,Remis J,et al. Mechanism of ammonia transport by Amt/MEP/Rh:structure of AmtB at 1.3.5 A[J]. Science,2004,305(5690):1587-1594.
[21]Wacker T,Garcia-Celma J J,Lewe P,et al. Direct observation of electrogenic NH4+ transport in ammonium transport (Amt) proteins[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(27):9995-10000.
[22]Neuhaeuser B,Ludewig U. Uncoupling of Ionic currents from substrate transport in the plant ammonium transporter AtAMT1.2[J]. Journal of Biological Chemistry,2014,289(17):11650-11655.
[23]Sogaard R,Alsterfjord M,Macaulay N,et al. Ammonium ion transport by the AMT/Rh homolog TaAMT1.1 is stimulated by acidic pH[J]. Pflugers Archiv(European Journal of Physiology),2009,458(4):733-743.
[24]Ortiz-Ramirez C,Mora S I,Trejo J,et al. PvAMT1;1,a highly selective ammonium transporter that functions as H+/NH4+ symporter[J]. Journal of Biological Chemistry,2011,286(36):31113-31122.
[25]Neuhaeuser B,Dynowski M,Ludewig U. Channel-like NH3 flux by ammonium transporter AtAMT2[J]. FEBS Letters,2009,583(17):2833-2838.
[26]Lima J E,Kojima S,Takahashi H,et al. Ammonium triggers lateral root branching in Arabidopsis in an ammonium transporter 1,3-dependent manner[J]. The Plant Cell,2010,22(11):3621-3633.
