拟南芥ERA—1蛋白的原核表达及多克隆抗体制备
2017-06-30付世英刘夏燕
付世英++刘夏燕

摘要:将拟南芥ERA-1基因除信号肽外的剩余编码序列克隆到原核表达载体pET28a上,转化到大肠杆菌BL21 (DE3)中表达,发现表达的目的蛋白位于包涵体中,大量表达目的蛋白并用镍柱亲和层析法进行纯化,获得足量的重组蛋白后将其作为抗原免疫家兔,获得抗血清。用重组蛋白亲和纯化抗血清中的ERA-1多克隆抗体。利用野生型拟南芥、ERA-1敲除突变系和ERA-1过表达系的叶片总蛋白进行免疫印迹试验,检测ERA-1多克隆抗体的特异性,发现纯化后的ERA-1多克隆抗体(1 ∶1 000体积比稀释)能特异地检测到拟南芥中的ERA-1蛋白。本试验成功制备了ERA-1蛋白的多克隆抗体,可以用于今后对ERA-1基因功能的研究。
关键词:拟南芥ERA-1;原核表达;蛋白纯化;抗血清;多克隆抗体制备
中图分类号: Q946.1文献标志码: A文章编号:1002-1302(2017)08-0033-03
ERA(Eecherichia coli ras-like protein,简称ERA)基因最早在大肠杆菌中发现,因其蛋白序列与真核生物的大鼠肉瘤(Ras)蛋白相似度高,所以命名为ERA[1]。但随后的研究表明,ERA与Ras蛋白序列相似性主要集中于N端的GTP酶结构域,而其C端与包括Ras在内的其他小GTP酶不具有同源性,因而把它列为一类新的小GTP酶。对大肠杆菌ERA功能的研究表明,该基因是大肠杆菌生存繁殖所必需的[2]。大肠杆菌ERA表达量降低突变体表现为细胞分裂异常、细胞增长呈丝状、拟核数目增多,表明ERA在染色体分离后,胞质分裂前发挥重要作用[3-4]。另有研究表明,ERA的C端能与核糖体16S RNA结合,对核糖体小亚基的组装成熟起重要作用[5-6]。细菌的ERA蛋白序列具有高度保守性,不同种类细菌的ERA蛋白可以互补大肠杆菌ERA的功能[7-8]。
真核生物的ERA基因起源于原核生物,真核生物的ERA蛋白序列與原核生物具有高度相似性,大多分布于线粒体或叶绿体中[9]。人类ERA同源蛋白ERAL1定位于线粒体[10],能与线粒体12S rRNA结合,参与核糖体小亚基的组装[11]。ERAL1功能缺陷细胞从G1期进入到S期受阻,进而引发细胞凋亡[12]。拟南芥ERA家族有2个成员ERA-1及ERA-2,亚细胞定位研究表明ERA-1定位于叶绿体,而ERA-2定位于线粒体[13]。目前植物中ERA的功能尚未见报道,为了方便研究ERA-1在拟南芥叶绿体中的功能,将拟南芥ERA-1基因在大肠杆菌中表达,获得重组ERA-1蛋白经过纯化后免疫家兔制备多克隆抗体。ERA-1多克隆抗体的成功制备,为后续研究ERA-1的生物学功能提供了条件。
1材料与方法
1.1材料
野生型拟南芥、era-1-1纯合突变体、ERA-1过表达株系(ERA-1OE-1、ERA-1OE-13、ERA-1OE-4、ERA-1OE-5)均为Columbia-0生态型背景,由笔者所在实验室保存。
试验中使用的限制性内切酶、T4连接酶等各种酶类均购自TaKaRa。琼脂糖凝胶回收试剂盒、质粒小提试剂盒等购自天根生化科技(北京)有限公司。His标签蛋白纯化柱填料Ni琼脂糖凝胶6 Fast Flow购自GE Healthcare Life Science。完全弗氏佐剂、不完全弗氏佐剂为Sigma公司产品;HRP标记的羊抗兔抗体G&R购自北京康为世纪生物科技有限公司;蛋白免疫印迹化学发光试剂盒购自Bio-Rad。其他试剂均为进口或国产分析纯试剂。
pBluescript-ERA-1为包含ERA-1基因编码区全长序列的重组质粒,该质粒及原核表达载体pET28a、大肠杆菌Top10感受态细胞和BL21(DE3)菌株均由笔者所在实验室保存。
1.2方法
1.2.1原核表达载体的构建以质粒pBluescript-ERA-1为模板,设计引物F1、R1,PCR扩增ERA-1除去叶绿体定位信号肽序列的剩余编码区序列。回收的PCR产物经BamHⅠ酶切后连入pET28a表达载体,转化大肠杆菌Top10。挑选阳性克隆提质粒,用BamHⅠ酶切鉴定是否有目的片段插入,再用HindⅢ酶切鉴定插入方向。将酶切鉴定正确的重组质粒送去测序,测序验证正确的重组质粒命名为pET28a-ERA-1。所用扩增引物序列为:F1,5′-CATGGATCCAAATCACATCTCCAGGCGCAC-3′;R1,5′-CATGGATCCCTACATAGCTCGGATCTGTCC-3′(下划线部分为BamHⅠ酶切位点)。
1.2.2重组蛋白的原核表达分析将重组质粒pET28a-ERA-1转化至BL21(DE3)宿主菌,挑取阳性单克隆,接种于含50 μg/mL卡那霉素的LB培养液中过夜培养,次日按体积比1 ∶100接种至25 mL含50 μg/mL卡那霉素的LB培养液中,200 r/min、37 ℃摇床培养至D600 nm达到0.5~1.0,取1 mL诱导前菌液,离心,弃上清,沉淀重悬于500 μL裂解液[50 mmol/L NaH2PO4(pH值8.0)、300 mmol/L NaCl]中,留作诱导前对照。然后加入异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl β-D-1-Thiogalactopyranoside,简称IPTG,终浓度1 mmol/L),继续37 ℃摇培4 h,摇培结束后取出 1 mL 菌液,处理同诱导前的1 mL菌液。将剩余的诱导后的菌液离心,沉淀重悬于11.5 mL裂解缓冲液中,冰浴,超声波破碎,结束后离心,收集上清,将沉淀部分溶解在11.5 mL裂解缓冲液中。分别取5 μL诱导前菌体总蛋白、诱导后菌体总蛋白、诱导破菌后上清蛋白、诱导破菌后沉淀蛋白样品液进行10% SDS-PAGE电泳,分析重组蛋白的表达形式。
1.2.3重组蛋白的大量表达和亲和纯化挑取含重组质粒pET28a-ERA-1的阳性克隆,按照“1.2.2”节中的方法摇培、诱导,获得1 L表达重组蛋白的菌液;破菌,离心,将获得的沉淀用含有8 mol/L尿素的裂解缓冲液溶解,离心,收集上清液。上清液经0.22 μm滤膜过滤后与1 mL Ni琼脂糖凝胶6 Fast Flow填料孵育30 min,然后转入层析柱中;用 20 mmol/L 咪唑洗脱液洗涤杂蛋白,然后依次用2 mL 咪唑液(100、200、400 mmol/L)洗脱重组蛋白,每个浓度的咪唑洗脱液分2管收集(1支管1 mL)。将不同浓度咪唑液洗脱的蛋白及025 mg/mL牛血清蛋白(BSA)进行SDS-PAGE电泳,以检测重组蛋白的纯度和浓度。
1.2.4抗血清的制备及验证将纯化后的ERA-1重组蛋白测定浓度,作为抗原免疫家兔。首免按200 μg/只,加入等体积弗氏完全佐剂涡旋混匀后,背部多点皮下注射[14]。之后每2周进行1次加强免疫,蛋白用量按100 μg/只,佐剂使用弗氏不完全佐剂。3次加强免疫之后,心脏采血并收集血清。
将纯化后的重组蛋白进行梯度稀释,然后分别取100、10、1 ng进行SDS-PAGE电泳。蛋白样品经半干法转移到硝酸纤维素膜上,封闭液(5%脱脂牛奶/TBST)室温封闭1 h后,加入经封闭液稀释的抗血清(1 ∶5 000)室温孵育1 h;用TBST[20 mmol/L Tris-HCl(pH值7.5)、150 mmol/L NaCl、0.1% Tween 20]洗涤3次;用HRP标记的羊抗兔IgG(1 ∶10 000 稀释)室温孵育1 h后,再用TBST洗涤3次;ECL显色处理,化学发光仪成像[15]。
1.2.5多克隆抗体的纯化将1 mg纯化后的重组蛋白进行10% SDS-PAGE电泳,转膜,番红染色。然后将重组蛋白条带从NC膜上切下,用100 mmol/L甘氨酸/HCl(pH值2.5)洗膜 5 min,然后用TBS[20 mmol/L Tris(pH值7.4)、500 mmol/L NaCl,005% Tween 20]洗2次,每次2 min。5%脱脂牛奶室溫封闭1 h后,取5 mL抗血清加入到5 mL TBS中,与膜在摇床上4 ℃过夜孵育。保留上清,将膜先用TBS洗涤2次,再用PBS[20 mmol/L磷酸钠(pH值7.2),150 mmol/L NaCl]洗涤2次。洗脱抗体时加入1 mL甘氨酸,孵育10 min,然后将洗脱液移入新管中并加入100 μL Tris(pH值8.0)使pH值调到7.0。
1.2.6植物叶片总蛋白中ERA-1的检测将拟南芥种子点种于泥炭营养土上,4 ℃放置2 d诱导种子萌发,然后在 22 ℃ 持续光照下培养。
当植物生长到2周大时,每株植物取2张真叶于1.5 mL离心管中,记录管中叶片的质量,液氮中研磨。根据管中叶片的质量,加入对应体积的蛋白抽提液[0.125 mg/L Tris(pH值6.8)、20%葡萄糖、4% SDS、1% β-巯基乙醇],使得蛋白抽提液终浓度为0.1 mg/μL,充分研磨成匀浆;最后将样品于 65 ℃ 加热2 h,离心,取上清。将上清及10 ng重组蛋白进行10% SDS-PAGE电泳,用“1.2.5”节中纯化得到的多克隆抗体(1 ∶1000稀释)进行蛋白免疫印迹检测。
2结果与分析
2.1重组质粒pET28a-ERA-1的构建
阳性质粒酶切鉴定结果如图1所示,用BamH Ⅰ酶切鉴定,获得的质粒骨架及插入片段大小符合预期(1.16、5.3 kb);用Hind Ⅲ鉴定是否为正向插入(插入片段和pET28a质粒上各有1个Hind Ⅲ酶切位点,若正向插入两者距离约为1.08 kb),酶切结果符合正向插入。将酶切鉴定正确的质粒送去测序,所测得的序列与预期完全一致。
2.2目的蛋白在大肠杆菌中的表达分析
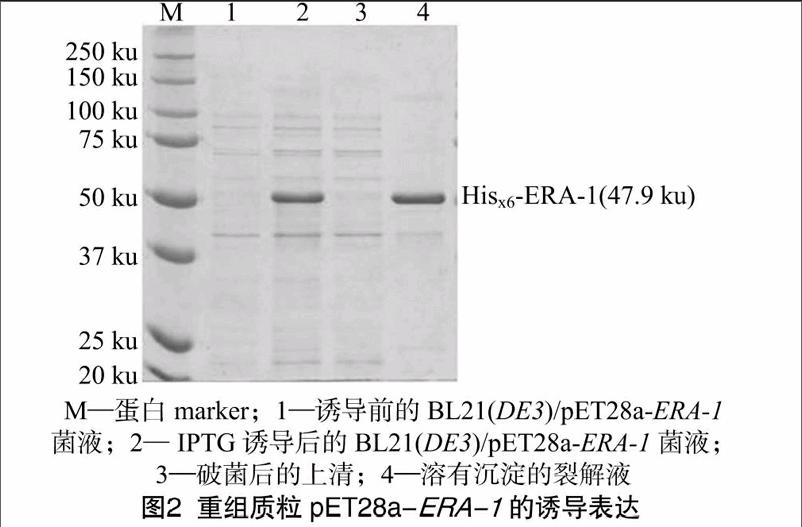
将构建好的重组质粒pET28a-ERA-1转化大肠杆菌BL21(DE3)菌株,挑取单菌落接种于LB培养基上,培养至对数生长期时加IPTG诱导,收集诱导前及诱导后的菌体经10% SDS-PAGE检测。结果如图2中1、2泳道所示,与诱导前相比,诱导后的菌液在50 ku附近多出明显的蛋白条带,符合预期,说明目的蛋白已成功表达。在进行大量表达和纯化之前,须对目的蛋白的可溶性进行分析,因此将诱导后的大肠杆菌细胞经超声破碎,分离上清液和沉淀,并将沉淀溶于裂解液中,进行SDS-PAGE电泳,结果如图2中3、4泳道所示,所表达的重组蛋白质几乎全部在沉淀中,以包涵体的形式存在。
2.3Hisx6-ERA-1蛋白的大量表达与亲和纯化
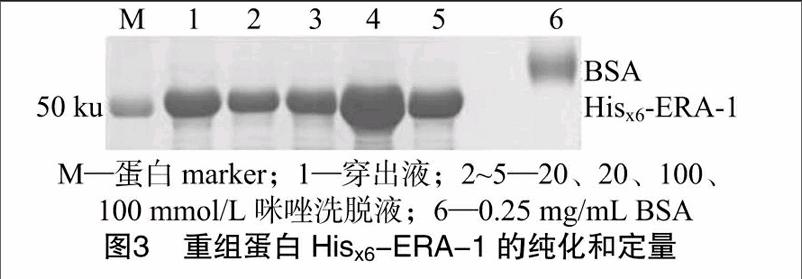
在获知重组蛋白主要以不溶性的包涵体形式存在后,开始大量诱导表达重组蛋白,并将获得的包涵体溶解于含 8 mol/L 尿素的裂解液中,通过镍琼脂糖亲和柱分离,再用不同浓度的咪唑液洗脱。SDS-PAGE结果如图3所示,第1支管100 mmol/L咪唑洗脱液(泳道4)中的目的蛋白浓度最高,用0.25 mg/mL BSA对该管洗脱液中的蛋白浓度进行粗定量,结合软件分析其蛋白浓度大于1 mg/mL,可用于后续免疫家兔试验。
2.4抗血清的制备与检测
利用纯化得到的Hisx6-ERA-1重组蛋白免疫家兔,将获得的抗血清作免疫印迹试验,分析其结合抗原有效性。结果表明,Hisx6-ERA-1抗血清1 ∶5 000稀释后,能够清晰地检测到10 ng的Hisx6-ERA-1重组蛋白(图4)。
2.5免疫印迹法检测植物叶片总蛋白中的ERA-1
用ChloroP预测表明,具有427个氨基酸残基的ERA-1蛋白的前39个氨基酸残基为叶绿体定位信号肽,切去前39个信号肽的成熟野生型ERA-1蛋白的分子量约为 42.88 ku,而pET28a-ERA-1载体表达的加上Hisx6标签的重组ERA-1蛋白大小约为47.9 ku。提取WT、era-1-1纯合突变体及ERA-1过表达株系ERA-1OE-1、ERA-1OE-13、ERA-1OE-4、ERA-1OE-5的叶片总蛋白,并用10 ng的Hisx6-ERA-1重组蛋白抗原作为阳性对照,与经重组蛋白Hisx6-ERA-1亲和纯化过的多克隆抗体(1 ∶1 000稀释)进行免疫印迹试验。结果如图5所示,野生型、过表达株系在预期分子量大小(42.88 ku)位置附近出现了2条带,而era-1-1纯合突变体没有对应条带。野生型、过表达株系都出现2条特异性条带,说明ERA-1在植物体内可能有2种不同的存在形式。本试验所制备的多克隆抗体能清晰地检测到植物叶片总蛋白中的ERA-1,并在负对照era-1-1突变体中无特异性带的产生,可满足后续试验的需求。
3结论与讨论
ERA基因在原核生物及真核生物中广泛存在,并具有很高的保守性。对大肠杆菌及人的ERA的研究都表明,ERA在核糖体小亚基的成熟过程中起重要作用,参与细胞周期调控,然而ERA蛋白在植物中的功能却鲜有报道。本试验通过原核表达重组蛋白,抗体制备和抗体的亲和纯化成功获得了拟南芥ERA-1蛋白的多克隆抗体,为后续深入研究植物 ERA-1的生物学功能提供了条件。
参考文献:
[1]Ahnn J,March P,Takiff H,et al. A GTP-binding protein of Escherichia coli has homology to yeast RAS proteins[J]. Proceedings of the National Academy of Sciences of the United States of America,1986,83(23):8849-8853.
[2]Chen X,Chen S,Powell B,et al. Purification,characterization and crystallization of ERA,an essential GTPase from Escherichia coli[J]. FEBS Letters,1999,445(2/3):425-430.
[3]Britton R,Powell B,Dasgupta S,et al. Cell cycle arrest in Era GTPase mutants:a potential growth rate-regulated checkpoint in Escherichia coli[J]. Molecular Microbiology,1998,27(4):739-750.
[4]Britton R,Powell B,Court D,et al. Characterization of mutations affecting the Escherichia coli essential GTPase era that suppress two temperature-sensitive dnaG alleles[J]. Journal of Bacteriology,1997,179(14):4575-4582.
[5]Sayed A,Matsuyama S,Inouye M. Era,an essential Escherichia coli small G-protein,binds to the 30S ribosomal subunit[J]. Biochemical and Biophysical Research Communications,1999,264(1):51-54.
[6]Tu C,Zhou X,Tarasov S,et al. The era GTPase recognizes the GAUCACCUCC sequence and binds helix 45 near the 3' end of 16S rRNA[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(25):10156-10161.
[7]Zuber M,Hoover T,Dertzbaugh M,et al. A francisella tularensis DNA clone complements escherichia coli defective for the production of era,an essential ras-like GTP-binding protein[J]. Gene,1997,189(1):31-34.
[8]Pillutla R,Sharer J,Gulati P,et al. Cross-species complementation of the indispensable Escherichia coli era gene highlights amino acid regions essential for activity[J]. Journal of Bacteriology,1995,177(8):2194-2196.
[9]Suwastika I N,Denawa M,Hata A,et al. Energy from the Sun[M]. Netherlands:Springer Netherlands,2008:1137-1140.
[10]Dennerlein S,Rozanska A,Wydro M,et al. Human ERAL1 is a mitochondrial RNA chaperone involved in the assembly of the 28S small mitochondrial ribosomal subunit[J]. The Biochemical Journal,2010,430(3):551-558.
[11]Uchiumi T,Ohgaki K,Yagi M,et al. ERAL1 is associated with mitochondrial ribosome and elimination of ERAL1 leads to mitochondrial dysfunction and growth retardation[J]. Nucleic Acids Research,2010,38(16):5554-5568.
[12]Akiyama T,Gohda J,Shibata S,et al. Mammalian homologue of E. coli Ras-like GTPase (ERA) is a possible apoptosis regulator with RNA binding activity[J]. Genes to Cells:Devoted to Molecular & Cellular Mechanisms,2001,6(11):987-1001.
[13]Suwastika I,Denawa M,Yomogihara S,et al. Evidence for lateral gene transfer (LGT) in the evolution of eubacteria-derived small GTPases in plant organelles[J]. Frontiers in Plant Science,2014,5:678.
[14]李芳,羅军,许会芬,等. 西农萨能羊MAT基因的原核表达及多克隆抗体制备[J]. 西北农林科技大学学报(自然科学版),2014,42(12):1-6,12.
[15]Yu F,Park S,Liu X,et al. Suppressor of variegation4,a new var2 suppressor locus,encodes a pioneer protein that is required for chloroplast biogenesis[J]. Molecular Plant,2011,4(2):229-240.
