绵羊Toll样受体7基因多态性分析
2017-06-30梁田杨霞张勋肖媛媛陈新凯
梁田++杨霞++张勋++肖媛媛++陈新凯++宋佳玮++盛金良

摘要:对新疆萨福克羊Toll样受体7基因单核苷酸进行多态性分析,探索绵羊TLR7基因多态性与抗病力的关系,为家畜抗病育种提供候选分子标记。采集新疆地区种羊场萨福克羊血液600份,提取DNA,设计扩增引物进行聚合酶链式反应-单链构象多态性(PCR-SSCP)检测,对突变位点进行测序分析。结果表明,12对扩增引物中,第2、5、6、7对引物扩增产物具有多态性。其中第2对和第7对引物扩增产物存在错义突变,第5对和第6对引物扩增产物存在同义突变。经SSCP分析,第2对引物扩增产物表现为3种带型,第7对引物有2种带型.经序列比对分析存在A343G、A350G、A1244G的错义突变,氨基酸改变分别是Lys突变为Gln,Asp突变为Ser,Glu突变为Arg,且突变都发生在胞外区亮氨酸重复区内。其中第2对引物的带型AB是位点A343G和A350G同时发生突变。位点A343G的突变频率最高为45.0%,A350G突变频率12.0%,而A1244G突变频率为5.8%。检测的突变可能改变TLR7基因的功能,进而影响其对病源的免疫应答。为进一步的疾病相关的研究奠定基础,以调查这些研究结果在家畜育种方面的用处。
关键词:Toll样受体7;多态性;萨福克羊;基因型
中图分类号: S826.2文献标志码: A文章编号:1002-1302(2017)08-0026-04
先天性免疫系统是生物进化过程中1种比较古老而保守的防御体系,是抵御病原微生物感染和有害物质侵害的第一道防线,而广泛模式识别受体(pattern recognition receptors,PRR)[1]是先天性免疫系统执行识别潜在的病原微生物和非致病性共生菌群,并清除病原微生物的重要受体。PRR包括NK细胞活化受体、清道夫受体、甘露糖受体和Toll样受体(Toll like receptors,TLRs)。这些受体中,TLRs是最为重要的受体,能够识别不同病原微生物所携带的特异性结构成分,即病原相关分子模式(patho-gen-associated molecular patterns,PAMPs)。在家畜中,已经检测到10种功能性TLR基因[2]。TLR3、TLR7、TLR8、TLR9能够识别细胞内的病原体表达的配体。其中TLR7属于Ⅰ型跨膜蛋白受体,具有与其他TLR家族成员共同的结构特征,其分子结构由胞外区、跨膜区和胞内区组成。其存在于多种细胞中,包括浆细胞样树突状细胞(pDC)、巨噬细胞、T细胞、B细胞等免疫细胞,嗜酸性粒细胞、中性粒细胞和内皮细胞中也有一定水平的表达[3-5]。另外,在扁桃体、脾、胎盘、骨髓、肺和淋巴结等组织中也有表达[6]。1996年,Hofmann 等证实克隆果蝇Toll样受体能识别并抑制真菌繁殖[7]。随后,人们发现Toll样受体在天然免疫系统和获得性免疫中起着重要的作用。TLRs信号转导途径主要包括依赖MyD88的信号通路和非依赖MyD88的信号通路。TLR7能够通过依赖MyD88的信号通路激活免疫细胞,并诱导免疫细胞表达高水平的干扰素、肿瘤坏死因子-α、IL-12 等细胞因子,介导抗病毒免疫。TLR7胞外区负责识别和接受相应信号,随后TIR位点招募富含Toll/白介素1受体接头蛋白分子,启动下游信号分子,最终杀伤感染的病原体[8-9]。通过TLR7的作用,机体能激发天然免疫与获得性免疫,有效地防御来自外部环境的病原体感染,维持机体内环境的稳定。
基因多态性与机体对疾病的遗传易感性相关。Toll 样受体在识别病原微生物启动免疫应答中起重要作用。越来越多数据表明,TLRs单核苷酸多态性与炎性应答损伤及感染性疾病的遗传易感性相关,如TLR4 基因Asp299Gly和Thr399Ile SNPs与多种感染性疾病正相关,在动脉粥样硬化及其相关疾病中则起保护作用[10]。研究表明,当动物面对体外环境(空气灰尘较多)和体内环境(细菌入侵)的变化,会作出适应性反应,由于TLR 配体可能会受到 Toll 样受体基因单核苷酸多态性的影响,导致对细菌感染或炎症性疾病易感性的改变[11]。目前,绵羊TLRs的多态性研究较少,其与疾病关系还不十分清楚。本研究通过PCR-SSCP分析及其基因突变频率分析,研究绵羊Toll样受体7胞外区基因的多态性,为今后绵羊育种的标记辅助选择提供确切的遗传学证据。
1材料与方法
1.1主要试剂与仪器
丙烯酰胺、双丙烯酰胺、TEMED、2×Taq PCR MasterMix,均购自上海生工生物工程有限公司;DNA提取试剂盒购自北京天根生物工程有限公司;DNA凝膠回收试剂盒购自上海捷瑞生物工程有限公司。其他常规试剂来自于石河子大学动物科技学院病理实验室。
DYC系列电泳仪、水平电泳槽、垂直电泳槽,均购自北京市六一仪器厂;脱色摇床,购自江苏省会坛市医疗仪器厂;PCR仪、凝胶成像系统为美国生产。
1.2试验动物与样品采集
分别在新疆维吾尔自治区昌吉市和玛纳斯县某种羊场分别随机采集200、400份萨福克羊血液样本,用颈静脉采血法,每只羊采5 mL血液,用肝素钠采血管带回实验室,4 ℃保存备用。
1.3DNA的提取
采血管中的羊血用试剂盒进行DNA提取,-20°保存备用。
1.4引物的设计与合成
采用文献报道的12对引物[12],送上海生工生物工程有限公司合成,扩增片段200~400 bp。
1.5PCR扩增
PCR扩增体系25 μL:上游引物和下游引物各1 μL,模板DNA 2 μL,1×LightScannerMaster 12 μL,超纯水9 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性35 s,退火30 s(退火温度见表1),72 ℃延伸30 s,33个循环;72 ℃延伸 10 min;4 ℃ 保存。PCR产物用1.5%的琼脂糖凝胶电泳检测。
1.6PCR-SSCP分析
1.6.1制备8%非变性聚丙烯酰胺凝胶首先将玻璃板洗净、擦干,玻璃板的两边放上塑料胶条,用夹子固定在架子上,1.5%琼脂糖封底,防止漏胶。配置8%非变性聚丙烯酰胺凝胶:加入丙稀酰胺和甲叉双丙稀酰胺体积比为29 ∶1 的30%丙烯酰胺贮备液16 mL,5×TBE 12 mL,ddH2O 32 mL,10%过硫酸铵500 μL,N,N′—二甲基乙二胺(TEMED) 30 μL,混合后将配好的8%凝胶液缓慢倒入两玻璃板之间,插上梳子,室内聚合2 h后,拔掉梳子,用针管冲洗点样孔,向电泳槽中加入1×TBE电泳缓冲液。
1.6.2SSCP电泳取3 μL PCR产物,8 μL变性剂(98%甲酰胺,10 mmol/L EDTA,0.025%溴酚蓝和0.025%二甲苯青),经98 ℃变性10 min,然后置于冰上10 min,每孔加样 10 μL,在8%非变性聚丙烯酰胺凝胶电泳12~16 h,银染显带,并拍照分析。
1.7PCR产物测序
SSCP分析后,选取不同基因型个体,将其进行PCR扩增胶回收,将纯化回收的目的片段吸取5 μL于小EP管中,分别加入0.5 μL的T4 DNA Ligase、0.5 μL的 PGEM-T Easy、4 μL 的Buffer,吹打混匀,室温放置1 h,之后4 ℃孵育过夜。将连接产物转化到感受态细胞中,筛选阳性克隆后送上海生工生物工程有限公司测序。
1.8数据统计分析
用DNAMAN (V 5.2.10)将测得的序列与GenBank已登录的绵羊的TLR7基因序列分别进行比对。使用卡方分析SPSS 13.0软件进行差异显著性检验,对群体多态性分布及基因频率进行统计分析。
2结果与分析
2.1TLR7基因胞外区多态性
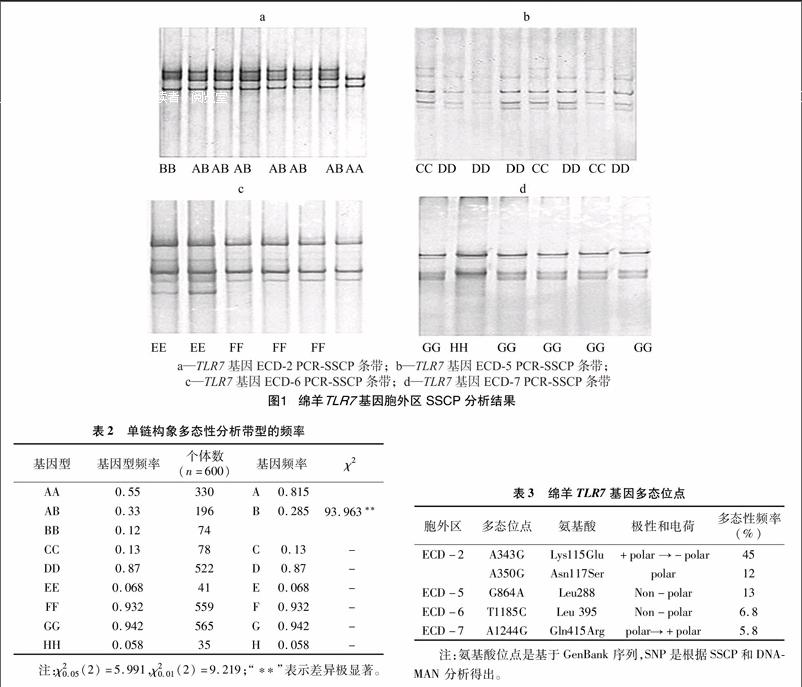
本研究对TLR7基因胞外区扩增产物进行SSCP分析,结果发现,第2对引物扩增的胞外区产物有3种带型(图1-a),第5、6、7对分别具有2种不同带型(图1-b、图1-c、图1-d)。从表2中可以看出,AA、AB、BB、CC、DD、EE、FF、GG、HH基因型频率分别是0.55、0.33、0.12、0.13、0.87、0068、0.932、0.942、0.058。对第2对引物带型进行χ2 适合性检验,发现χ2值差异极显著,该基因位点在绵羊群体中哈迪-温伯格平衡处于非平衡状态(表2)。
2.2TLR7基因胞外区的点突变
经测序发现,绵羊TLR7胞外区共有5个点突变,包括3个错义突变和2个同义突变。在343位核苷酸的改变导致了Lys115Glu,350 位核苷酸的改变导致了Asn117Ser,1244位核苷酸的改变导致了Gln415Arg。115位氨基酸的改变使电荷由正变负(表3),415位氨基酸的改变使其带上正电荷,这3个突变都发生在胞外区的亮氨酸重复区外的区域。
2.3TLR7基因多态性频率分析
根据PCR-SSCP的结果,600只萨福克羊的TLR7存在多态性,其分布情况见表2。其中343位核苷酸突变频率最高,达45%;其次350位核苷酸突变频率是12%,864位核苷酸突变频率是13%,突变频率最少的是1 244位核苷酸突变,突变频率是5.8%(表3)。
3讨论
本研究发现TLR7基因胞外区有5个点突变,包括3个错义突变和2个同义突变,证明了TLR7基因高度保守。其中突变带型AB的频率是33%,是突变带型中频率最高的,然后是突变带型CC(13%)、BB(12%),其他的突变带型频率都小于10%。在AB 和BB条带中都存在343位核苷酸的突变,突变频率为45%,经检测分析该基因位点不处于Hardy-Wernberg平衡状态,可能由于人工饲养,受育种选择的影响。
绵羊的TLR7由1 046个氨基酸残基组成,TLR7 的胞外区由LRR区和LRR区外的基序组成,LRR区在胞外区的内部,而LRR区外的基序形成胞外区凸表面[13]。这种凸表面可能影响病原相关分子模式(PAMP)与TLR 的结合[14]。本研究发现的115和415位的氨基酸突变都是在绵羊TLR7 的LRR区外的基序上,也导致了氨基酸极性和带电荷量的改变,这种替换极可能会影响TLR7 的结构或功能,从而改变对疾病的易感性。由于同义突变可能通过影响mRNA稳定、翻译和蛋白质的折叠[15-16]影响TLR7 的功能,本研究也分析了同义突变,有研究表明TLR7能够识别单链RNA病毒,包括水泡口腔咽喉病毒和流感病毒[17]。TLR7单核苷酸多态性与丙型肝炎病毒感染引起的炎癥反应密切相关。研究显示,TLR7的遗传变异影响丙型肝炎病毒感染后的免疫反应[18]。同样的,羊的梅迪维斯纳病毒易感性差异可能与TLR7多态性有关。TLR7也能被自身的RNA活化,引起自身免疫性疾病[19] 。在狼疮小鼠模型中Toll样受体7与此病的风险性直接相关[20-21]。研究表明,TLR7的激动剂能增强T细胞免疫和固有免疫,诱导TLR7表达肿瘤凋亡来抗肿瘤[22]。大量研究表明肿瘤细胞表面表达多种 Toll样受体与肿瘤细胞的生长转移有关。在这一领域未来的研究需要检测TLR7基因多态性与绵羊群病毒感染易感性的关系。
综上所述,TLR7识别病毒单链RNA介导抗病毒免疫应答,在自身免疫性疾病和一些肿瘤的发生中也有一定的作用,这些均提示TLR7在治疗病毒感染性疾病、自身免疫性疾病和肿瘤疾病的重要作用。本研究探讨绵羊TLR7胞外结构域的区域的遗传变异,这些研究结果可以用来进一步探察遗传易感性羊感染疾病与TLR7基因变异的关系。通过基因图谱分析估计疾病的危险因素,也可用于育种计划中增加羊群的天然抵抗力。
参考文献:
[1]Janeway Jr C A,Medzhitov R. Innate immune recognition[J]. Annual review of immunology,2002,20(1):197-216.
[2]Chang J,Russell G,Jann O,et al. Molecular cloning and characterization of Toll-like receptors 1-10 in sheep[J]. Veterinary Immunology and Immunopathology,2009,127(1/2):94-105.
[3]Chuang T,Ulevitch R. Cloning and characterization of a sub-family of human toll-like receptors:hTLR7,hTLR8 and hTLR9[J]. European Cytokine Network,2000,11(3):372-378.
[4]Martin M,Wesche H. Summary and comparison of the signaling mechanisms of the Toll/interleukin-1 receptor family[J]. Biochimica et Biophysica Acta,2002,1592(3):265-280.
[5]何小兵,房永祥,賈怀杰,等. Toll样受体7介导的抗病毒天然免疫反应研究进展[J]. 中国兽医科学,2010,40(6):645-649.
[6]Takeda K,Kaisho T,Akira S. Toll-like receptors[J]. Annual Review of Immunology,2003,21(1):335-376.
[7]Lemaitre B,Nicolas E,Michaut L,et al. The dorsoventral regulatory gene cassette sptzle/Toll/cactus controls the potent antifungal response in Drosophila adults[J]. Cell,1996,86(6):973-983.
[8]曾爽,何小兵;陈国华.Toll样受体介导的信号转导通路及其调控分子的研究进展[J]. 中国兽医科学,2011,41(4):433-440.
[9]马思慧,杨欢,吴天成,等. Toll样受体信号传导通路的研究进展[J]. 中国畜牧兽医,2014,41(8):160-164.
[10]Kolek M,Carlquist J,Muhlestein J,et al. Toll-like receptor 4 gene Asp299Gly polymorphism is associated with reductions in vascular inflammation,angiographic coronary artery disease,and clinical diabetes[J]. American Heart Journal,2004,148(6):1034-1040.
[11]Schrder N,Schumann R. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infectious disease[J]. The Lancet Infectious Diseases,2005,5(3):156-164.
[12]Mikula I,Bhide M,Pastorekova S,et al. Characterization of ovine TLR7 and TLR8 protein coding regions,detection of mutations and Maedi Visna virus infection[J]. Veterinary Immunology and Immunopathology,2010,138(1/2):51-59.
[13]Bell J K,Mullen G E,Leifer C A,et al. Leucine-rich repeats and pathogen recognition in Toll-like receptors[J]. Trends in Immunology,2003,24(10):528-533.
[14]Mller-Larsen S,Nyegaard M,Haagerup A,et al. Association analysis identifies TLR7 and TLR8 as novel risk genes in asthma and related disorders[J]. Thorax,2008,63(12):1064-1069.
[15]Duan J,Wainwright M S,Comeron J M,et al. Synonymous mutations in the human dopamine receptor D2 (DRD2) affect mRNA stability and synthesis of the receptor[J]. Human Molecular Genetics,2003,12(3):205-216.
[16]Kimchi-Sarfaty C,Oh J M,Kim I W,et al. A “silent” polymorphism in the MDR1 gene changes substrate specificity[J]. Science,2007,315(5811):525-528.
[17]Lund J,Alexopoulou L,Sato A,et al. Recognition of single-stranded RNA viruses by Toll-like receptor 7[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(15):5598-5603.
[18]Yue M,Gao C,Wang J,et al. Toll-like receptor 7 variations are associated with the susceptibility to HCV infection among Chinese females[J]. Infection,Genetics and Evolution,2014,27:264-270.
[19]Krieg A. The toll of too much TLR7[J]. Immunity,2007,27(5):695-697.
[20]Berland R,Fernandez L,Kari E,et al. Toll-like receptor 7-dependent loss of B cell tolerance in pathogenic autoantibody knockin mice[J]. Immunity,2006,25(3):429-440.
[21]Deng Y,Shen N. Effects of Toll-like receptor 7 in anti-infection and autoimmune disease[J]. Journal of Medical Molecular Biology,2008.
[22]Kanzler H,Barrat F,Hessel E,et al. Therapeutic targeting of innate immunity with Toll-like receptor agonists and antagonists[J]. Nature Medicine,2007,13(5):552-559.
