新疆油鸡禽流感病毒Xj14分离株PA基因的克隆与序列分析
2017-06-30武军元黄忠武康强姚礼文
武军元++黄忠武++康强++姚礼文

摘要:为了从分子水平上掌握新疆油鸡H9N2亚型禽流感病毒PA基因的遗传进化情况,采用RT-PCR技术对新疆油鸡分离株Xj14的PA基因进行克隆、测序及分子进化分析,将PA基因的核苷酸序列和对应的氨基酸序列与 GenBank 中已经公布的参考序列进行同源性比较。结果表明,新疆油鸡分离株的PA基因由2 151个碱基组成,编码716个氨基酸,与AIV A/Duck/HongKong/Y439/97的PA基因处于同一分支,其核苷酸和氨基酸水平的同源性依次为899%和96.9%,在系统进化上属于欧亚分支中的Y439谱系。
关键词:禽流感病毒;油鸡;PA基因;克隆;序列分析
中图分类号: S852.65+7文献标志码: A文章编号:1002-1302(2017)08-0020-03
禽流感(avian influenza,AI)是由A型流感病毒(avian influenza virus,AIV)引起的病毒性传染病。自Homme等1966年从威斯康辛州患有温和呼吸道疾病的火鸡中分离到第1株H9N2亚型禽流感病毒之后,该亚型病毒在世界范围内呈广泛流行的趋势[1-4]。我国1994年首次从广东省的发病鸡群中分离到H9N2亚型禽流感病毒[5-6],1998年首先报道H9N2亚型AIV可以感染人[7],1999年我国香港地区发生了人感染H9N2的病例[8]。进一步的研究结果表明,1997年我国香港地区感染人的H5N1病毒的内部蛋白基因片段来源于H9N2亚型AIV[9];2013年发生于我国上海等地的重配病毒H7N9中6个内部基因均来自H9N2亚型AIV[10];刘金华等近期发表在PNAS上的研究结果揭示,单一基因型H9N2流感病毒在我国鸡群中的优势流行为H7N9流感病毒的重排提供了充分条件[11]。A型流感病毒基因组由8个单股负链RNA片段组成,它们编码11个已知的病毒蛋白质,RNA聚合酶是由流感病毒基因组3个最大的片段PB1、PB2和PA编码的异源三聚体复合物。其中,PB1是病毒RNA聚合酶的催化亚基,负责病毒RNA的复制以及转录、PB2以一种称为“Snatch”的方式参与宿主mRNA帽状结构的切割而完成病毒mRNA的转录[12]。近年来的研究结果表明,PA亚基不但参与病毒复制过程,而且参与病毒RNA轉录、决定内切核酸酶和蛋白酶的活性,以及参与病毒粒子组装等多种生命活动过程,基于筛选慢性肝炎和艾滋病药物的启示[13],PA蛋白因可以抑制病毒的复制转录、有效发挥抗病毒作用而成为新型抗流感药物研发的潜在靶点。
由此可见,加强对不同物种H9N2亚型AIV的检测,密切关注其重配情况,进一步对其生物学特性以及分子流行病学进行研究,对于预测和防控流感大流行的发生具有不可忽视的作用。本研究对从新疆油鸡当中分离到的1株H9N2亚型禽流感病毒进行PA基因克隆测序,并进行分子进化分析,以了解新疆油鸡H9N2亚型AIV PA基因遗传进化的情况。
1材料与方法
1.1材料
1.1.1病毒H9N2亚型禽流感病毒新疆油鸡分离株A/Chicken/XinjiangBaicheng/1/2014(H9N2)(简称Xj14)于新疆生产建设兵团塔里木畜牧科技重点实验室分离保存。
1.1.2主要试剂及仪器设备High Pure Viral RNA Kit(Cat. No. 11858882001)购自Roche公司;PrimeScriptTM Ⅱ First-strand cDNA Synthesis Kit(Cat. No.6210A)购自宝生物工程(大连)有限公司;HiPure Gel Pure DNA Kits购自Magen公司;pGEM-T Easy Vector购自Promega公司;Trans 2K DNA Markers、TransTaq-T DNA Polymerase购自北京全式金生物技术有限公司;TIANprep Mini Plasmid Kit购自天根生化科技有限公司。梯度PCR仪、全自动凝胶成像分析系统、高速离心机为德国Eppendorf公司。
1.2方法
1.2.1引物设计参照已知的AIV序列设计了1条反转录通用引物Uni 12,用于AIV各片段的反转录扩增,序列为Uni 12:5′-AGCAAAAGCAGG-3′。
参考NCBI公布的H9N2亚型AIV的PA基因序列,利用Primer premier 5.0软件设计一对基因特异性引物,引物由上海生工生物工程技术服务有限公司合成,序列为Bm-PA-1:5′-TATTCGTCTCAGGGAGCAAAAGCAGGTAC-3′;Bm-PA-2:5′-ATATCGTCTCGTATTAGTAGAAACAAGGTACTT-3′。
1.2.2病毒RNA提取及PA基因RT-PCR扩增取 200 μL 尿囊液,按照Roche公司的High Pure Viral RNA Kit(Cat. No. 11858882001)说明书提取病毒RNA,用流感病毒反转录通用引物Uni-12,按照PrimeScriptTM Ⅱ First-strand cDNA Synthesis Kit(Cat. No.6210A)说明书反转录合成 cDNA。用所设计的PA基因特异性引物进行PCR扩增,采用 50 μL 的反应体系,组成如下:10×PCR缓冲液5 μL,10 mmol dNTPs 4 μL,Taq DNA聚合酶(5 U)0.5 μL,上下游引物各 1 μL(10 μmol),cDNA模板1 μL,无RNA酶的水37.5 μL。反应条件:95 ℃ 5 min;95 ℃ 40 s,53 ℃ 40 s,72 ℃ 2.5 min,35个循环;72 ℃ 10 min。PCR反应结束后,取5 μL反应产物在1.2%琼脂糖凝胶上电泳,在紫外灯下观察结果。
1.2.3PA基因克隆与序列测定参照HiPure Gel Pure DNA Kits说明书将RT-PCR产物纯化回收,回收产物克隆到pGEM-T Easy Vector上,将连接产物转化到DH5α感受态细胞中,选择PCR鉴定为阳性的重组质粒送北京擎科武汉测序部进行序列测定。
1.2.4PA基因生物学分析应用序列分析软件DNAStar对测序结果进行拼接处理,将所得序列与GenBank中公布的H9N2亚型流感病毒典型代表株(表1)的PA基因序列进行同源性比较,用MEGA6软件的neighbour-joining方法构建进化树,分析其遗传进化关系。
2结果与分析
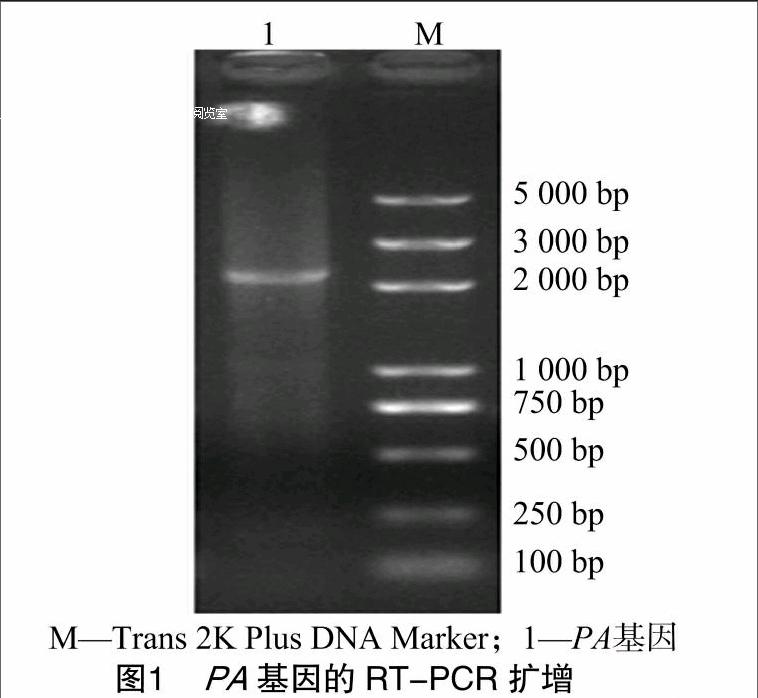
2.1PA基因的RT-PCR扩增
利用设计的针对PA基因的特异性引物Bm-PA-1/Bm-
2.2PA基因的核苷酸及氨基酸序列同源性分析
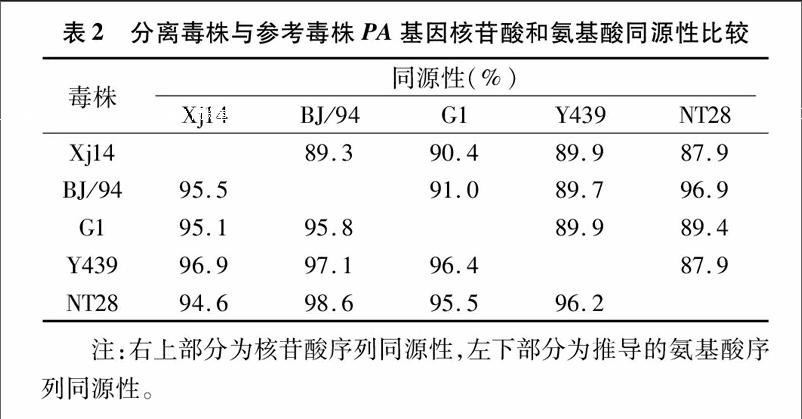
测序结果表明,本研究扩增的PA基因开放阅读框由 2 151 个碱基组成,编码716个氨基酸,将扩增的核酸序列提交NCBI数据库获得GenBank登录号KX575647。将本研究分离毒株与GenBank公布的其他毒株进行核苷酸和氨基酸序列同源性比较,结果发现,本研究分离毒株的核苷酸和氨基酸序列均与A/Duck/HongKong/Y439/97具有较高的同源性,其核苷酸和氨基酸水平的同源性依次为89.9%和96.9%(表2)。
2.3PA基因的系统进化分析
将本研究分离毒株与国内流行毒株的PA基因进行多序列比对并绘制PA基因的系统发育进化树(图2),分析结果表明,新疆油鸡分离毒株Xj14的PA基因与2013年世界卫生组织推荐的疫苗株A/HongKong/33982/2009亲缘关系最近,与国内参考毒株A/Duck/HongKong/Y439/97同处于一个分支。
3讨论
禽流感病毒是目前危害世界及我国养禽业的烈性病毒之一。禽流感病毒的血清亚型众多,遗传变异程度极其频繁,目前,H5和H7亚型禽流感病毒对养殖业造成的直接危害较
大,因此,该亚型是基层生产防控的重点。H9N2禽流感是中国大陆主要的流行亚型,感染鸡群具有发病率高、免疫抑制和产蛋下降的特点,而且一旦感染很难清除,对养殖业以及公共衛生造成了极大的危害。近期,Pu等研究发现,单一基因型H9N2流感病毒在我国鸡群中的优势流行为H7N9流感病毒的重排提供了充分条件[11],由此可见,H9N2流感病毒可以通过基因重组或重配产生新的对哺乳动物甚至人类高致病力的病毒株。
禽流感病毒依据HA和NA基因的分子进化特征可以分为北美和欧亚两大谱系,欧亚谱系又进一步分为A/CK/BJ/94、G1/97和Y439/97 3个亚分支[14],AIV的HA、NA、NP、M、PB1、PB2和PA进化情况相似。笔者所在实验室前期的研究结果显示,新疆油鸡分离株Xj14的HA和NA基因均属于国内稳定存在的BJ/94亚分支,且从分子水平上证实Xj14为低致病力的毒株,只是HA在关键位点出现Q234L的突变,NA基因在3个红细胞吸附区域发生多处突变,HA、NA基因的糖基化位点均有所增加,这种受体结合位点的改变和潜在糖基化位点的增加可能使之在进化过程中获得跨种传播的能力[15]。本研究发现,新疆油鸡分离毒株Xj14的PA基因与2013年世界卫生组织推荐的疫苗株A/HongKong/33982/2009亲缘关系最近,与欧亚谱系国内参考毒株A/Duck/HongKong/Y439/97处于一个分支。因此,新疆油鸡分离株Xj14很有可能是欧亚谱系不同亚分支重排的新毒株,其中,疫苗株A/HongKong/33982/2009参与病毒的重排组成。
综上所述,应当加强边疆新疆地区H9N2亚型AIV监控的力度,为流感大数据的建立提供理论依据。
参考文献:
[1]Homme P J,Easterday B C.Avian influenza virus infections.Ⅳ. Response of pheasants,ducks,and geese to influenza A-turkey-Wisconsin-1966 virus[J]. Avian Dis,1970,14(2):285-290.
[2]Alexander D J.A review of avian influenza in different bird species[J]. Vet Microbiol,2000,74(1/2):3-13.
[3]Brown I H,Banks J,Manvell R J,et al.Recent epidemiology and ecology of influenza A viruses in avian species in Europe and the Middle East[J]. Dev Biol,2006,124:45-50.
[4]Lee Y J,Shin J Y,Song M S,et al.Continuing evolution of H9 influenza viruses in Korean poultry[J]. Virology,2007,359(2):313-323.
[5]Wang J Y,Ren J J,Liu W H,et al.Complete genome sequence of a new H9N2 avian influenza virus isolated in China[J]. Genome Announc,2013,1(3):e00261.
[6]陈伯伦,张泽纪,陈伟斌. 禽流感研究Ⅰ. 鸡A型禽流感病毒的分离与血清学初步鉴定[J]. 中国兽医杂志,1994,20(10):3-5.
[7]Guo Y J,Li J G,Cheng X W.Discovery of man infected by avian influenza A (H9N2) virus [J]. Chin J Exp Clin Virol,1999,13(2):105-108.
[8]Peiris M,Yuen K Y,Leung C W,et al.Human infection with influenza H9N2[J]. The Lancet,1999,354(9182):916-917.
[9]Liu J H,Okazaki K,Ozaki H,et al.H9N2 influenza viruses prevalent in poultry in China are phylogenetically distinct from A/quail/Hong Kong/G1/97 presumed to be the donor of the internal protein genes of the H5N1 Hong Kong/97 virus[J]. Avian Pathology,2003,32(5):551-560.
[10]Gao R,Cao B,Hu Y,et al.Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engal J Med,2013,368(20):1888-1897.
[11]Pu J,Wang S G,Yin Y B,et al.Evolution of the H9N2 influenza genotype that facilitated the genesis of the novel H7N9 virus[J]. Proc Natl Acad Sci USA,2015,112(2):548-553.
[12]Li M L,Rao P,Krug R M.The active sites of the influenza capdependent endonuclease are one different polymerase subunits[J]. EMBO J,2001,20(8):2078-2086.
[13]Xing S H,Li X B.Research progress of anti-virus activity and action mechanism of febrifuge and detoxifying herbs[J]. Chin Pharmacol Bull,2014,30(4):464-468.
[14]Bi J M,Deng G C,Dong J,et al.Phylogenetic and molecular characterization of H9N2 influenza isolates from chickens in Northern China from 2007—2009[J]. PLoS One,2010,5(9):e13063.
[15]武軍元,康强. 新疆油鸡H9N2亚型禽流感病毒分离株HA和NA基因的克隆及进化生物信息分析[J]. 中国兽医学报,2016,36(4):623-629.
