多年生植物芽休眠研究进展
2017-06-30王武孙龙陶建敏
王武++孙龙++陶建敏
摘要:在多年生植物“生长—休眠—生长”的周期变化过程中,芽休眠是一个动态变化的过程,受到植物基因的综合调控,可避开外界不利条件,并在环境合适时恢复生长,是一种有益的生物学特性。近年来,许多研究人员从光照、水分、激素代谢、能量代谢等对芽休眠的形成和解除进行研究,但具体调控机制尚不明确,仍被称为“生命的隐蔽现象”。在对国内外有关芽休眠及其调控机制研究进行综述的基础上,从内源物质、分子调控、生物钟等阐述多年生植物芽休眠诱导及解除过程,以期为芽休眠研究提供新的思路。
关键词:芽;休眠;生物鐘;内部因子;分子调控;研究进展;多年生植物
中图分类号: Q945.35文献标志码: A文章编号:1002-1302(2017)08-0006-05
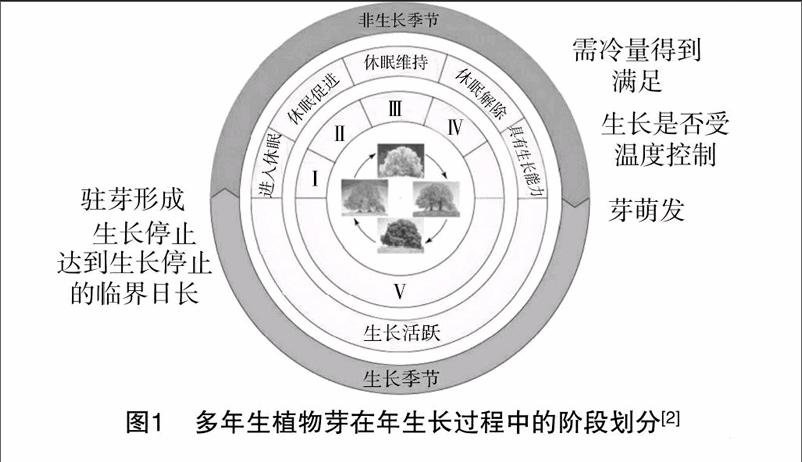
多年生植物在连年生长过程中,会受到因季节性气候变化和外界环境因子导致的不良环境条件影响,如冬天低温霜冻、夏天高温灼伤、季节性干旱或洪水等,这些不良条件严重影响植物的正常发育和生殖生长。为适应不同的气候条件,植物在长期演化过程中,能够通过一系列物质、能量代谢调节自身生理活动而进入休眠状态,以应对或避开短期或长期的不利环境条件。Lang将休眠分为3类:生态休眠(ecodormancy),由外界环境条件引起的暂时性生长停止;类休眠(paradormancy),指植物其他结构导致的生长抑制;自然休眠/内休眠(endodormancy),由休眠结构本身引起的生长抑制[1]。早期研究者认为,休眠是指含有分生组织的植物结构可见生长的暂时停止[2],而分生组织结构生长量一般极小,且不易观察。因此,Rohde等在综合前人研究的基础上,结合植物季节性生长周期,将芽休眠过程分为5个阶段:第1阶段,具有休眠能力,由于光照、温度的原因导致芽不能正常生长,芽进入浅休眠,当外界环境适合时又会恢复生长;第2阶段,休眠能力的提升,由于低温导致需冷量的积累,能够使休眠加深,一旦温度超过一定阈值,休眠又会再次变浅;第3阶段,休眠真正的建立,植物真正进入深度休眠;第4阶段,具有解除休眠的能力,芽打破休眠的需冷量基本足够,用外源破眠剂如单氰胺处理能有效打破休眠;第5阶段,具备生长的能力,芽只要温度、光照等条件满足即可萌发(图1)[2]。在这5个阶段中,植物体内发生许多物质和能量代谢,外界一系列环境因子如温度、光照等参与并影响芽的休眠。
休眠芽内部发生的变化主要涉及水分代谢,钙离子信号转导,激素、糖类、多胺、抗氧化酶变化等,而温度、光照对休眠的调控被视为生物钟调控过程。芽休眠转换过程是一系列基因及分子参与调控的过程,调控因子包括CO(constans)、FT(flowering locus T)、DAM(dormancy associated mads-box)等,它们共同作用并影响芽的休眠进程。
1生物钟对休眠的调控
生物钟别称生理钟,是指生物体在连年进化过程中,为适应由地球自转引起的昼夜更替和环境变化而形成的一种内在分子机制,当外界环境发生变化时,生物体可通过生物钟对外界的变化作出预测,从而调节自身生命活动来应对这种变化[3]。在多年生植物生长过程中,要经历季节、温度及光周期变化,而生物钟是有机体适应这些变化的一个至关重要的因子。生物钟调控节律具有温度补偿现象,能够被周围环境条件所诱导[4],而植物要适应光周期、温度及季节性变化的一个重要生物学途径就是休眠。近年来,有研究表明,生物钟充当环境变化和植物休眠生理活动之间的信号调节着植物芽的休眠过程[5]。Horvath等研究乳浆大戟各个休眠阶段的转录组表达水平时发现,ELF4、GIGANTEA、FLVAING-BINDING等许多生物钟基因在内休眠和生态休眠期间均上调表达[6]。Johansson等研究生物钟系统对植物芽需冷量和休眠的重要性时指出,CCA1、LHY、TOC1等一系列生物钟基因在多年生植物休眠及其解除过程中有着重要作用[7]。
生物钟系统可划分为输入系统、振荡器、输出系统,输入系统主要包括红光受体PHYs和蓝光受体CRYs,通过感受环境信号来控制振荡器节律,输出系统通过感受振荡器信号变化来调控植物激素合成、周期性生长、开花时间、胁迫反应等过程,振荡器由早晨循环、核心循环、夜晚循环3个循环回路组成,核心循环由CCA1、LHY这2个转录因子组成,早晨循环主要由PRR9、PRR7组成,夜晚循环由TOC1、GIGANTEA(GI)、EARLY FLOWERING3(ELF3)、ELF4、PHYTOCLOCk 1(PCL1)/LUX ARRHYTHMO(LUX)等多个基因组成[8]。TOC1、PRR9、PRR7、PRR5、PRR3、PRR1均属于PRR基因家族,黎明时分,CCA1、LHY的表达量相对最大,促进了PRR9基因的表达,随后每隔2~3 h,PRR7、PRR5、PRR3基因依次表达,直至傍晚时分基因PRR1、TOC1开始表达;ELF3、ELF4、PCL1/LUX组成夜晚循环复合物(EC),通过LUX结合PRR9基因的启动子直接抑制PRR9的表达;TOC1基因的表达受到核心循环CCA1、LHY这2个转录因子的抑制,从而结束夜晚循环进入早晨循环模式[9]。多年生植物对季节及环境周期性变化的适应性得益于生物钟系统,植物通过生物钟系统去获得发现季节到来的能力,感受日长和温度的变化,以此来调节TOC1/PRR/LHY等一系列基因及CHE等蛋白的表达,通过反馈环来调节与休眠相关的激素、蛋白、糖类合成,找到适合进入休眠及解除休眠的恰当时间[10],然后,通过进入休眠及解除休眠的特定时间来适应季节和环境变化,而低温积累、合适日长和一定温度是植物休眠诱导和解除所必需的[11]。
2内部因子对休眠的调控
2.1钙离子
钙是植物信号转导级联反应系统中最主要的第二信使,参与调控包括环境刺激响应、花芽分化等多种生长发育过程[12-13],对调控植物芽休眠具有重要作用。Jian等对杨树、桑树的研究表明,随日照时间的长短变化,休眠不同阶段Ca2+的亚细胞定位发生改变[14]。研究单氰胺解除芽休眠时发现,单氰胺通过抑制抗氧化酶活性来诱导氧化应激反应[15],而氧化应激反应能够活化Ca2+通道,诱导提高Ca2+浓度,进而影响钙调素(CaM)、钙离子结合蛋白(CBP)、钙离子依赖的蛋白激酶(CDPK)等下游受体,CaM和其他CBP基因均上调表达,CDPK活性及相关基因的转录水平、编码蛋白质含量随之提高[16-17],而CDPK磷酸化相应底物,调控基因表达、酶活性、水和离子转运等过程,进而调控芽的休眠。
2.2水分
多年生植物芽的休眠与水分扩散能力及其存在状态有关,休眠的诱导和解除进程中伴随着束缚水和自由水之间的相互转换,通过调节水分存在状态来影响需冷量积累而影响休眠进程。Faust等研究发现,苹果芽中束缚水的含量与休眠状态高度耦合,自由水含量在低温解除休眠的过程中逐渐提高[18]。Erez等对桃树、葡萄芽的研究结果表明,休眠过程中束缚水的含量会逐渐增加,即使在长时间低温条件下依然保持较高的含量;长期高温能显著促进束缚水向自由水转变,自由水含量的增加意味着生长的开始而不是休眠的结束[19]。Morris等研究发现,休眠过程中,脱水素蛋白(dehydrin)高度表达,在低温、脱水胁迫时被诱导合成,并与ABA结合,在缺水条件下保护生物大分子[20]。Frewen等对葡萄萌芽过程研究发现,脱水素蛋白含量总体呈下降趋势,但在芽即将萌发前有2个小高峰[21]。Yakovlev等研究发现,脱水素表达量在芽萌发前显著下降,其表达量的高低受需冷量的影响,调控着芽萌发时间的早晚[22]。同时,水孔蛋白(AQP)是一种内在膜蛋白,能够控制水分在细胞中的进出,调节水分转运和平衡,并与脱水素共同作用来调节休眠芽内的水分含量,诱导和解除芽的休眠。
2.3激素
植物体内有多种内源激素,激素含量及其动态平衡与植物芽的季节性休眠诱导与解除关系密切[11,23-24]。脱落酸被认为是感受外界环境因子变化,并传导外界信号导致休眠的物质。Nagar对茶树芽的季节性休眠研究发现,茶树芽进入休眠阶段,脱落酸主要以游离态形式存在,且含量很高;休眠解除,含量开始下降[25]。Powell对苹果的研究表明,脱落酸会延迟苹果芽的萌芽,休眠季节脱落酸含量出现下降[26]。Or等研究表明,葡萄休眠最深时,芽中的ABA含量相对最高;ABA含量变化与休眠进程并不完全一致[27]。Peng等研究发现,冬芽休眠的解除一方面与脱落酸含量下降有关,另一方面还与赤霉素的合成有关[28]。高东升等研究表明,GA破除油桃休眠的效果因树种和施用GA时期而异,自然休眠前期,GA处理会使对短日照迟钝的油桃低温需求量增加,加深其休眠,芽萌发受到抑制;自然休眠即将解除期使用GA,能有效打破油桃芽的休眠,促进其萌发[29]。有学者认为,芽休眠并不是由ABA或GA某单一激素所诱导,而是由这2种激素共同作用[30]。王海波基于对油桃休眠芽的研究结果提出,芽内ABA含量并不是决定芽休眠与诱导的唯一因素,而是由GA和ABA的比值决定的,只有达到一定阈值才能诱导油桃芽进入休眠[31]。马海燕对星比诺、赤霞珠葡萄研究表明,(IAA+GA3)/ABA的值在芽休眠前期相对较高,并随休眠加深而逐渐下降,休眠最深时达到最低,此后,随休眠解除该比值逐渐上升,萌芽时达到最大值[32]。除ABA、GA外,乙烯、細胞分裂素等内源激素也共同调控着芽休眠诱导、维持与萌发[33-34]。
2.4糖类
糖作为一种常见的能源物质和植物体重要的组成成分,既能为生命活动提供能量,又能够维持植物体细胞质的稳定,并可作为一种信号物质参与生物体的发育活动[35]。目前,许多学者对植物芽休眠期碳水化合物的变化规律进行了深入研究。Yang等研究指出,植物生长发育后期碳水化合物在体内积累,次年春天萌芽时发挥作用[36];Elle等研究表明,休眠解除阶段,休眠芽内部分淀粉水解为可溶性糖,其中以降解酶作用下得到的蔗糖相对最多[37];Ben等研究表明,葡萄自然休眠前期淀粉含量迅速下降,随后保持稳定[38];Maurel等认为,己糖的存在是芽恢复生长能力的关键,植物休眠期间生长受限可能是由己糖含量不足而导致需冷量无法满足引起的,但也不排除是芽利用可溶性糖不足的可能性[39]。
2.5多胺
多胺(polyamine,PA)是大量存在于植物体内、具有强生物活性的低分子脂肪族含氮碱,包括腐胺、尸胺、亚精胺、精胺及其他胺类等。戴尧仁研究表明,多胺与植物体内许多信号分子的生成和植物在环境胁迫下的应激反应有关,具有刺激生长、延缓衰老的作用[40]。韦军对梨树叶芽和花芽的内源多胺进行研究发现,梨树的叶芽多胺含量在生长期较高,进入休眠期后多胺含量开始迅速下降,内源多胺和梨的休眠密切相关[41]。Santanen等研究表明,椴树在休眠芽形成后,芽的结合态多胺(腐胺、亚精胺)含量缓慢上升,在冬季深休眠期达到高峰,而在休眠解除阶段,许多游离态多胺含量上升,结合态多胺含量下降[42]。Wang等研究早花樱桃与晚花樱桃冬季生长过程中代谢产物的变化规律时发现,早花樱桃游离态内源多胺腐胺、亚精胺、精胺从较低水平缓慢升高,晚花樱桃游离态内源多胺一直保持在较高水平,而在临近萌芽时,2种材料的游离态内源多胺均快速升高[43]。范克欣研究发现,曙光油桃休眠期间花芽内多胺参与休眠的诱导与解除,与油桃花芽休眠过程密切相关,腐胺有助于诱导花芽进入休眠,亚精胺和精胺含量升高对休眠解除有促进作用[44]。
2.6抗氧化酶
低温作为一种非常重要的环境信号参与多年生植物芽休眠的调控。许多研究者认为,含氧化合物是低温响应并影响休眠解除与诱导的可能信号[6,43]。Vyas等研究认为,茶树芽休眠时间与芽内活性氧分子(ROS)积累量密切相关,ROS的积累量与休眠时间呈极显著正相关,休眠期短的品种其体内抗氧化酶类活性高[45]。Fuchigami等研究苹果芽休眠解除过程中抗氧化酶类的变化发现,休眠解除过程中,苹果芽抗氧化酶类变化明显,抗氧化酶类及活性氧的清除与苹果芽休眠进程密切相关[46]。对梨、油桃和葡萄等植物芽休眠的研究表明,芽休眠诱导及解除过程中,CAT活性开始下降,深度休眠时降到最低水平,后逐渐上升;POD活性变化与CAT活性相反;SOD活性初期上升并保持较高水平,随休眠的加深而逐渐下降[47-48]。毕磊研究发现,在休眠期,七月酥梨的SOD活性一直较低,自然休眠结束呈上升趋势;POD活性在自然休眠期从较低水平缓慢提高,休眠结束后迅速上升[49]。Zhuang等在对果梅休眠机制的研究过程中,成功鉴定出谷胱甘肽过氧化物酶、锰超氧化物歧化酶、抗坏血酸过氧化物酶等与氧化还原相关的蛋白质,进一步证实抗氧化酶参与芽休眠进程的调控作用[50]。
3芽休眠的分子调控过程
芽休眠是一个复杂的过程,包括休眠状态、休眠深度。随着研究的深入,许多学者利用组学的方法从分子水平上研究参与多年生植物芽休眠调控的基因,如与光调控、开花诱导相关的基因PHYA、CO、FT,与温度调控、春化相关的基因FLC、SOCI及转录因子MADs-box,与休眠相关的转录因子DAM及基因家族GH17等,从基因层面构建休眠的复杂调控网络。Rinne等基于低温促进1,3-β-D-葡聚糖酶产物的增加提出一种解释休眠周期的分子机制,并认为1-3-β-D-葡聚糖从胞间连丝中的移除能够恢复原生质间物质能量交换网络,促进植物从休眠状态向休眠解除过渡[51]。Rinne等在杨树GH17基因家族成员中鉴定出3类能够在低温条件和GA生物合成中上调表达的基因,第1类GH17家族基因在短日照条件下诱导上调表达,能够维持共质体产生途径并促进芽的形成;第2、第3类GH17家族基因通过GA3和长期冷诱导上调表达,协助导管中胼胝体的移除并重新打开导管,使FT能够运输到顶端,待需冷量满足后,随温度上升,在GA4介导下上调生长相关的基因表达来促进萌芽。PHYA、CO、FT是植物光调控的相关基因。拟南芥早春开花与日照长度有关,基因CO、FT调控光周期诱导过程及从萌芽到开花所需的时间[52]。Hsu等鉴定出2个FT同源基因FT1、FT2,而FT1、FT2的表达具有时空差异性,FT1在冬季的表达变化与植物从营养生长向生殖生长的过渡期相一致,而FT2的表达能够在长日和较高温度条件下促进植物的生长,并抑制休眠芽的形成[53]。Bhlenius等研究表明,杨树上PtFT1是能够调控短日的相关基因,可诱导植株生长停止和休眠芽的形成[54],李属植物中过表达杨树FT基因会抑制植物进入休眠[55]。光周期相关的基因表达调控是一系列级联反应,PHYA作为光周期调节因子和其他生物钟组分一起调节CO表达,进而诱导FT转录导致开花。
Amasino等研究表明,温度控制拟南芥休眠转变和开花是通过春化途径实现的,主要由FLC调节,而FLC是一个MAD-box转录因子,可控制开花诱导因子FT、SOCI的表达来抑制低温下的开花[52]。Seo等研究发现,SOCI、FLC调控存在反馈机制,阻止植物在寒冷条件下提前结束休眠、完成开花转变[56],而SOCI通过直接抑制CBF/DREB1转录因子负反馈调控低温响应途径,CBF/DREBI的表达促进FLC的表达,进而抑制FT、SOCI的表达,实现延迟开花和休眠转变。Horvath 提出低温调节休眠诱导的图解模型,并指出CBF转录因子可通过染色质重塑促进DAM基因的表达[57]。
DAM基因属于MAD-box轉录因子的SVP分支,因其蛋白序列与SVP相似,常被认为是SVP-like基因。对拟南芥进行研究时发现,SVP是一个MAD-box基因,可调节开花转变和花芽分生组织的形成[58]。DAM基因编码转录因子对休眠的重要调控作用是在桃的1个突变体上发现的,该突变体被命名为EG(evergrowing),其侧芽打破内休眠的需冷量比其他正常植物需冷量更少[59]。DAM基因编码转录因子相继在梨、树莓、猕猴桃中被鉴定[60-62],双子叶植物中存在许多DAM-like基因,但仅有少量基因的表达模式与休眠过程一致。对杨树休眠过渡期的基因芯片分析表明,部分DAM-like基因在内休眠与生态休眠时期的调控作用会受到限制[63],DAM-like基因的差异性表达和猕猴桃、梨、果梅的休眠进程相关。此外,茶树上克隆出1个DAM-like基因,该基因不仅在自然休眠期间上调表达,其在杨树上的过表达还会调控芽的物候期[64]。QTLs的研究应用进一步验证DAM基因在休眠调控过程中发挥重要作用。Fan等在2个桃树品种Contender、Fla.92-2C的杂交体中鉴定出4个与需冷量相关的QTLs[65],随后Sánchez-Pérez在扁桃基因组的染色体连锁区域鉴定出1个与需冷量相关的QTL[66],这些QTLs通过比对和分析序列差异,可识别鉴定与休眠相关的候选基因[67]。
另外,有学者阐述DAM基因在芽休眠和开花中的功能,如Horvath提出低温调节休眠诱导模型,寒冷温度下DAM基因会优先表达,且在大戟属植物中过表达会延迟开花,并负反馈调节FT或FT-like基因,导致生长停止并进入休眠[63]。DAM、FT和FT-like基因CENL有着重要的功能,CBF可在短期寒冷条件下诱导DAM基因表达,而在长期低温条件下则能够通过染色质重组使DAM基因表达下调而解除休眠。同样,Jimenez等提出一个简单的概念模型去解释DAM5/DAM6在内休眠和生态休眠转变过程行使的功能:短日照条件下诱导DAM5/DAM6的表达,而在低温条件则会打断光周期调控的生物钟感应,抑制DAM5/DAM6的表达,使相关能够在有利条件下恢复生长的基因开始表达[68]。
4展望
休眠是植物为应对外界环境变化进化而来的一种适应性特性,需冷量对植物打破休眠至关重要,而全球气候变暖很可能导致需冷量不足,造成植物休眠无法完整进行,因此,可从这个角度对芽休眠展开深入研究,以探讨全球气候变化对植物休眠特性的影响。另外,植物芽休眠的解除与成花诱导过程中代谢途径有许多相同之处,调控这2个过程的基因也有很多相似性,从更深层次上研究二者的共性与差异势必会促进对休眠的理解。此外,理解植物上游感受器如何感知光周期、温度等季节性变化并传递至下游,从生理、细胞、分子等多个层次共同调控植物休眠的诱导、维持和解除对农业生产至关重要,这也要求学者从生物钟的角度,用基因组学、蛋白组学、代谢组学等方法和手段对休眠过程的信号转导、基因表达、蛋白翻译、代谢途径等进行广泛而深入的研究,以揭开休眠这一“生命隐蔽现象”的面纱。
参考文献:
[1]Lang G A. Dormancy:a new universal terminology[J]. HortScience,1987,22(5):817-820.
[2]Rohde A,Bhalerao R P. Plant dormancy in the perennial context[J]. Trends in Plant Science,2007,12(5):217-223.
[3]Nagel D,Kay S. Complexity in the wiring and regulation of plant circadian networks[J]. Current Biology,2012,22(16):R648-R657.
[4]Edgar R,Green E,Zhao Y,et al. Peroxiredoxins are conserved markers of circadian rhythms[J]. Nature,2012,485(7399):459-464.
[5]Harmer S. The circadian system in higher plants[J]. Annual Review of Plant Biology,2009,60:357-377.
[6]Horvath D,Sung S,Kim D,et al. Characterization,expression and function of dormancy associated mads-box genes from leafy spurge[J]. Plant Molecular Biology,2010,73(1/2):169-179.
[7]Johansson M,Mcwatters H,Bakó L,et al. Partners in time:early bird associates with zeitlupe and regulates the speed of the Arabidopsis clock[J]. Plant Physiology,2011,155(4):2108-2122.
[8]Huang W,Pérez-García P,Pokhilko A,et al. Mapping the core of the Arabidopsis circadian clock defines the network structure of the oscillator[J]. Science,2012,336(677):75-79.
[9]Helfer A,Nusinow D,Chow B,et al. Lux arrhythmo encodes a nighttime repressor of circadian gene expression in the Arabidopsis core clock[J]. Current Biology,2011,21(2):126-133.
[10]Welling A,Palva E. Involvement of CBF transcription factors in winter hardiness in birch[J]. Plant Physiology,2008,147(3):1199-1211.
[11]Cooke J,Eriksson M,Junttila O. The dynamic nature of bud dormancy in trees:environmental control and molecular mechanisms[J]. Plant,Cell & Environment,2012,35(10):1707-1728.
[12]Hepler P K,Wayne R O. Calcium and plant development[J]. Annual Review of Plant Physiology,1985,136:397-439.
[13]Bush D S. Calcium regulation in plant cells and its role in signaling[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1995,46,95-122.
[14]Jian L,Li J,Li P. Seasonal alteration in amount of Ca2+ in apical bud cells of mulberry (Morus bombciz Koidz):an electron microscopy-cytochemical study[J]. Tree Physiology,2000,20(9):623-628.
[15]Or E,Vilozny I,Eyal Y,et al. The transduction of the signal for grape bud dormancy breaking induced by Hydrogen cyanamide may involve the SNF-like protein kinase GDBRPK[J]. Plant Molecular Biology,2000,43(4):483-494.
[16]Anil V,Harmon A,Rao K. Spatio-temporal accumulation and activity of calcium-dependent protein kinases during embryogenesis,seed development,and germination in sandalwood[J]. Plant Physiology,2000,122(4):1035-1043.
[17]Abbasi F,Onodera H,Toki S,et al. OsCDPK13,a calcium-dependent protein kinase gene from rice,is induced by cold and gibberellin in rice leaf sheath[J]. Plant Molecular Biology,2004,55(4):541-552.
[18]Faust M,Liu D,Line M J,et al. Conversion of bound to free water in endodormant buds of apple is an incremental process[J]. Dormancy and the Related Problems of Deciduous Fruit Trees,1994,395:113-118.
[19]Erez A,Faust M,Line M J. Changes in water status in peach buds on induction,development and release from dormancy[J]. Scientia Horticulturae,1998,73(2):111-123.
[20]Morris C,Anderberg R,Goldmark P,et al. Molecular cloning and expression of abscisic acid-responsive genes in embryos of dormant wheat seeds[J]. Plant Physiology,1991,95(3):814-821.
[21]Frewen B,Chen T,Howe G,et al. Quantitative trait loci and candidate gene mapping of bud set and bud flush in populus[J]. Genetics,2000,154(2):837-845.
[22]Yakovlev I,Asante D,Fossdal C,et al. Dehydrins expression related to timing of bud burst in Norway spruce[J]. Planta,2008,228(3):459-472.
[23]Tanino K K. Hormones and endodormancy induction in woody plants[J]. Journal of Crop Improvement,2004,10(1/2):157-199.
[24]Ruttink T,Arend M,Morreel K,et al. A molecular timetable for apical bud formation and dormancy induction in poplar[J]. The Plant Cell,2007,19(8):2370-2390.
[25]Nagar P K. Changes in endogenous abscisic acid and phenols during winter dormancy in tea(Camellia sinesis L.(O)Kunze)[J]. Acta Physiologiae Plantarum,1996,18(1):33-38.
[26]Powell L E. The chilling requirement in apple and its role in regulating time of flowering in spring in cold-winter climates[C]. International Symposium on Growth Regulators in Fruit Production,1985:129-140.
[27]Or E,Belausov E,Popilevsky I,et al. Changes in endogenous ABA level in relation to the dormancy cycle in grapevines grown in a hot climate[J]. Journal of Horticultural Science & Biotechnology,2000,75(2):190-194.
[28]Peng J,Harberd N. The role of GA-mediated signalling in the control of seed germination[J]. Current Opinion in Plant Biology,2002,5(5):376-381.
[29]高東升,束怀瑞,李宪利. 桃自然体眠过程中外源激素对花芽碳水化合物的调控效应[J]. 果树学报,2002,19(2):104-107.
[30]Rinne P L,Welling A,Vahala J,et al. Chilling of dormant buds hyperinduces flowering locus T and recruits GA-Inducible 1,3-beta-glucanases to reopen signal conduits and release dormancy in populus[J]. The Plant Cell,2011,23(1):130-146.
[31]王海波. 桃芽自然休眠诱导与短时间高温破眠机制研究[D]. 乌鲁木齐:新疆农业大学,2006.
[32]马海燕. 葡萄生长过程中内源激素含量变化的研究[D]. 杨凌:西北农林科技大学,2007.
[33]Suttle J C. Ethylene is not involved in hormone-and bromoethane-induced dormancy break in russet Burbank minitubers[J]. American Journal of Potato Research,2009,86(4):278-285.
[34]Hartmann A,Senning M,Hedden P,et al. Reactivation of meristem activity and sprout growth in potato tubers require both cytokinin and gibberellin[J]. Plant Physiology,2011,155(2):776-796.
[35]Gibson S. Control of plant development and gene expression by sugar signaling[J]. Current Opinion in Plant Biology,2005,8(1):93-102.
[36]Yang Y S,Hori Y,Ogata R. Studies on retranslocation of accumulated assimilates in‘Delawaregrapevines.Ⅱ.Retranslocation of assimilates accumulated during the previous growing season[J]. Tohoku Journal of Agricultural Research,1980,31(2):109-119.
[37]Elle D,Sauter J J. Seasonal changes of activity of a starch granule bound endoamylase and of a starch phosphorylase in poplar wood(Populus×canadensis Moench〈robusta〉)and their possible regulation by temperature and phytohormones[J]. Journal of Plant Physiology,2000,156(5):731-740.
[38]Ben M H,Vadel A M,Geuns J M. Biochemical changes in dormant grapevine shoot tissues in response to chilling:possible role in dormancy release[J]. Scientia Horticulturae,2010,124(4):440-447.
[39]Maurel K,Leite G,Bonhomme M,et al. Trophic control of bud break in peach (Prunus persica) trees:a possible role of hexoses[J]. Tree Physiology,2004,24(5):579-588.
[40]戴尧仁. 多胺及其在植物体内的生理作用[J]. 植物学通报,1988,5(2):69-76.
[41]韋军. 苹果叶芽和花芽在生长期和休眠期内源多胺的变化[J]. 园艺学报,1995,22(1):99-101.
[42]Santanen A,Simola L K. Polyamine levels in buds and twigs of Tilia cordata from dormancy onset to bud break[J]. Trees,2007,21(3):337-344.
[43]Wang S Y,Faust M,Steffens G L. Metabolic changes in cherry flower buds associated with breaking of dormancy in early and late blooming cultivars[J]. Physiologia Plantarum,1985,65(1):89-94.
[44]范克欣. 桃花芽休眠进程中多胺代谢机制的研究[D]. 泰安:山东农业大学,2014.
[45]Vyas D,Kumar S,Ahuja P. Tea (Camellia sinensis) clones with shorter periods of winter dormancy exhibit lower accumulation of reactive oxygen species[J]. Tree Physiology,2007,27(9):1253-1259.
[46]Fuchigami L H,Wisniewski M. Quantifying bud dormancy:physiological approaches[J]. HortScience,1997,32(4):618-623.
[47]韩浩章,姜卫兵,费宪进,等. 葡萄和油桃自然休眠解除过程中H2O2含量和抗氧化酶活性的变化[J]. 南京农业大学学报,2007,30(1):50-54.
[48]邵好好. 梨樹花芽休眠解除与活性氧代谢关系的研究[D]. 杨凌:西北农林科技大学,2003.
[49]毕磊. 七月酥梨休眠期内含物变化及生理代谢研究[D]. 保定:河北农业大学,2009.
[50]Zhuang W,Shi T,Gao Z,et al. Differential expression of proteins associated with seasonal bud dormancy at four critical stages in Japanese apricot[J]. Plant Biology,2013,15(1):233-242.
[51]Rinne P H,Kaikuranta P M,van der Schoot C.The shoot apical meristem restores its symplasmic organization during chilling-induced release from dormancy[J]. The Plant Journal,2001,26(3):249-264.
[52]Amasino R,Michaels S. The timing of flowering[J]. Plant Physiology,2010,154(2):516-520.
[53]Hsu C,Adams J,Kim H,et al. Flowering locus T duplication coordinates reproductive and vegetative growth in perennial poplar[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(26):10756-10761.
[54]Bhlenius H,Huang T,Charbonnel-Campaa L,et al. CO/FT regulatory module controls timing of flowering and seasonal growth cessation in trees[J]. Science,2006,312(5776):1040-1043.
[55]Srinivasan C,Dardick C,Callahan A,et al. Plum (Prunus domestica) trees transformed with poplar FT1 result in altered architecture,dormancy requirement,and continuous flowering[J]. PLoS One,2012,7(7):e40715.
[56]Seo E,Lee H,Jeon J,et al. Crosstalk between cold response and flowering in Arabidopsis is mediated through the flowering-time gene SOC1 and its upstream negative regulator FLC[J]. The Plant Cell,2009,21(10):3185-3197.
[57]Horvath D. Common mechanisms regulate flowering and dormancy[J]. Plant Science,2009,177(6):523-531.
[58]Gregis V,Andrés F,Sessa A,et al. Identification of pathways directly regulated by short vegetative phase during vegetative and reproductive development in Arabidopsis[J]. Genome Biology,2013,14(6):R56.
[59]Wang Y,Georgi L,Reighard G,et al. Genetic mapping of the evergrowing gene in peach [Prunus persica (L.) Batsch][J]. Journal of Heredity,2003,93(5):352-358.
[60]Ubi B E,Sakamoto D,Ban Y,et al. Molecular cloning of dormancy-associated MADS-box gene homologs and their characterization during seasonal endodormancy transitional phases of Japanese pear[J]. Journal of the American Society for Horticultural Science,2010,135(2):174-182.
[61]Mazzitelli L,Hancock R,Haupt S,et al. Co-ordinated gene expression during phases of dormancy release in raspberry (Rubus idaeus L.) buds[J]. Journal of Experimental Botany,2007,58(5):1035-1045.
[62]Wu R,Walton E,Richardson A,et al. Conservation and divergence of four kiwifruit SVP-like MADS-box genes suggest distinct roles in kiwifruit bud dormancy and flowering[J]. Journal of Experimental Botany,2012,63(2):797-807.
[63]Horvath D P. Dormancy-associated MADS-BOX genes:a review[M]//Advances in plant dormancy. Springer International Publishing,2015:137-146.
[64]Hao X,Chao W,Yang Y,et al. Coordinated expression of Flowering locus T and dormancy associated mads-box-like genes in leafy spurge[J]. PLoS One,2015,10(5):e0126030.
[65]Fan S,Bielenberg D,Zhebentyayeva T,et al. Mapping quantitative trait loci associated with chilling requirement,heat requirement and bloom date in peach (Prunus persica)[J]. New Phytologist,2010,185(4):917-930.
[66]Sánchez-Pérez R,Dicenta F,Martínez-Gómez P. Inheritance of chilling and heat requirements for flowering in almond and QTL analysis[J]. Tree Genetics & Genomes,2012,8(2):379-389.
[67]Zhebentyayeva T N,Fan S H,Chandra A A,et al. Dissection of chilling requirement and bloom date QTLs in peach using a whole genome sequencing of sibling trees from an F-2 mapping population[J]. Tree Genetics & Genomes,2014,10(1):35-51.
[68]Jiménez S,Lawton-Rauh A,Reighard G,et al. Phylogenetic analysis and molecular evolution of the dormancy associated MADS-box genes from peach[J]. BMC Plant Biology,2009,9(1):81.
