青岛地区胃黏膜病变患者幽门螺杆菌及其相关抗体的分析
2017-06-29张成栋路艳艳孙莉娟刘希双
陈 力, 张成栋, 殷 洁, 路艳艳, 韩 越, 孙莉娟, 刘希双
1.青岛大学附属医院崂山院区消化内科,山东 青岛 266000; 2.山东省千佛山医院
青岛地区胃黏膜病变患者幽门螺杆菌及其相关抗体的分析
陈 力1, 张成栋1, 殷 洁2, 路艳艳1, 韩 越1, 孙莉娟1, 刘希双1
1.青岛大学附属医院崂山院区消化内科,山东 青岛 266000; 2.山东省千佛山医院
目的 探讨幽门螺杆菌(H.pylori)、H.pylori相关抗体与不同胃黏膜疾病的关系及其临床意义。方法 对2015年6月-2016年5月青岛大学附属医院收治的294例符合条件的胃黏膜疾病患者进行研究。其中慢性非萎缩性胃炎56例,慢性萎缩性胃炎68例,胃溃疡64例,胃黏膜上皮内瘤变54例,胃癌52例。所有患者通过胃镜下表现及病理结果确定疾病分组,分别行血清H.pylori抗体测定,确定H.pylori感染率、H.pylori现症感染率(即组织染色H.pylori阳性率)、H.pylori分型,并进行统计学分析。结果 慢性非萎缩性胃炎、慢性萎缩性胃炎、胃溃疡、上皮内瘤变、胃癌患者的H.pylori感染率分别为85.7%、79.4%、93.8%、92.6%、96.2%。现症感染率分别为75.0%、70.6%、90.6%、85.2%、78.8%。胃癌患者CagA抗体和VacA抗体的阳性率分别为86.5%、84.6%,显著高于其他胃黏膜病变患者。后者各组间的CagA抗体阳性率(58.9%~71.9%)和VacA抗体阳性率(57.1%~68.8%)差异无统计学意义(P>0.05)。胃溃疡组的UreA抗体和UreB抗体阳性率最高(90.6%、93.8%),与慢性胃炎组比较(66.9%、67.7%),差异有统计学意义(P<0.05),但与胃癌、上皮内瘤变组比较,差异无统计学意义(P>0.05)。在H.pylori感染的262例患者中,Ⅰ型菌株183例(69.8%),Ⅱ型菌株50例(19.1%),中间型菌株29例(11.1%)。胃癌组Ⅱ型所占比例(2.0%)显著低于其他各组(20.0%~29.2%);Ⅰ型及中间型所占比例在各组患者中比较,差异无统计学意义(P>0.05)。结论H.pylori与胃黏膜病变密切相关,随着胃黏膜病变的加重,H.pylori感染率及毒力呈上升趋势。H.pylori抗体测定对预测胃癌发生的风险具有重要意义,其临床价值高于H.pylori组织染色检测结果。
胃癌;幽门螺杆菌;CagA;VacA
幽门螺杆菌(Helicobacter pylori,H.pylori)是一种单极、多鞭毛、末端钝圆、螺旋形弯曲的、寄生在胃黏膜上皮与黏膜间微需氧的革兰阴性杆菌。H.pylori感染导致的临床后果与H.pylori的毒力因子密切相关。研究最多的H.pylori毒力因子就是细胞毒素相关基因A(cytotoxin-associated gene A,CagA)蛋白和空泡毒素A(vacuolating cytotoxin,VacA),它们都能促进胃黏膜上皮细胞的炎症反应。
CagA蛋白是H.pylori的Cag致病岛(cag pathogenicity island,CagPAI)上CagA基因的编码产物,也是H.pylori感染导致宿主发生炎性反应的重要效应蛋白。CagA蛋白能够影响细胞骨架的重排,抑制细胞凋亡,损伤上皮细胞DNA,增加c-fos等原癌基因表达,增加前列腺素表达[1]。VacA蛋白能够引起细胞膜通道的改变,通过线粒体途径引起细胞色素C的释放导致细胞凋亡,并结合细胞膜上的特定受体引起一系列炎性通道的激活和反应[2]。
部分研究认为两者互相促进对胃黏膜的损伤。CagA蛋白能通过Ⅳ型分泌系统注入胃上皮细胞,在细菌附着点处打开上皮细胞间的紧密连接,有利于VacA蛋白穿越上皮细胞屏障,进入胃黏膜下层,共同参与了细胞信号传导的多个环节,引起细胞骨架重排和细胞增殖特征的改变[3]。通过基因型研究发现,VacA基因型中,s1m1型细胞毒性最强,与胃黏膜萎缩、消化性溃疡及胃癌的发生密切相关[4-5],而且s1m1基因型与CagA基因显著相关[6]。
但也有研究[7-8]表明两者间存在明显的拮抗作用,即VacA蛋白和CagA蛋白都能拮抗彼此对胃黏膜上皮细胞的作用:CagA蛋白能够通过磷酸化依赖和非磷酸化依赖两条途径下调VacA蛋白对细胞的空泡毒性和对线粒体的损伤,相反,VacA蛋白通过降低EGFR和HER2/Neu的活性下调CagA蛋白引起的MAPK的激活和蜂鸟型细胞形成的作用。
本研究通过比较不同胃黏膜病变患者中H.pylori感染率、现症感染率(即H.pylori组织染色阳性率)及CagA抗体、VacA抗体阳性率,探讨胃黏膜病变与H.pylori及H.pylori相关抗体的关系及临床意义。
1 资料与方法
1.1 一般资料 选取2015年6月-2016年5月在青岛大学附属医院崂山院区消化内科收治的294例符合条件的不同胃黏膜病变患者,男152例,女142例,年龄18~79岁,平均年龄56.9岁。排除标准:(1)近1个月内服用过抗生素、铋剂、H2受体拮抗剂或质子泵抑制剂;(2)孕妇和儿童;(3)有免疫性疾病或正服用免疫抑制剂。其中慢性非萎缩性胃炎56例,慢性萎缩性胃炎68例,胃溃疡64例,胃黏膜上皮内瘤变54例,胃癌52例。H.pylori感染(既往或现症)的判定:H.pylori组织染色阳性或任一H.pylori相关抗体阳性。H.pylori现症感染的判定:H.pylori组织染色阳性。
1.2 方法H.pylori抗体检测方法:采集受试对象静脉血,采用免疫印迹试剂盒(深圳市伯劳特公司),严格按照按试剂盒提供的说明书操作。将印迹膜上的显色区带与试剂盒提供的标准带对照,即可判断出相关抗体是否阳性。共分为3种4型抗体:CagA抗体、VacA抗体及尿素酶抗体(UreA、UreB)。
H.pylori组织学检测方法:活检标本取自胃黏膜组织(胃镜下活检或手术切除标本),送病理室制快速石蜡切片行改良Giemsa染色。
1.3 观察指标 所有患者通过胃镜下表现及病理学检测结果确定疾病分组。分组后均行血清H.pylori抗体测定、改良Giemsa染色。检测结果分为阴性、阳性。
通过组织染色结果及抗体检测确定有无H.pylori感染。通过组织染色结果确定是否存在H.pylori现症感染。通过CagA抗体和VacA抗体是否表达,将H.pylori分为Ⅰ型(CagA抗体和VacA抗体均为阳性)、Ⅱ型(CagA抗体和VacA抗体均为阴性)和中间型(CagA和VacA抗体仅其中1种为阳性)[9]。
1.4 统计学处理 采用SPSS 19.0软件对数据进行统计学分析,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1H.pylori在不同胃黏膜病变患者中的感染率H.pylori的总感染率为90.1%。胃癌患者的H.pylori感染率最高(96.2%,50/52),其次为胃溃疡(93.8%,60/64)、上皮内瘤变(92.6%,50/54)、非萎缩性胃炎(85.7%,48/56)、萎缩性胃炎(79.4%,57/68)。慢性胃炎组H.pylori感染率显著低于胃溃疡和胃癌组(Fisher’sExactTest,P<0.05),其他组相比,差异无统计学意义(Fisher’sExactTest,P>0.05)。
2.2H.pylori在不同胃黏膜病变患者中的现症感染率 在统计的疾病中,H.pylori的总现症感染率为79.9%(235/294)。胃溃疡患者的H.pylori现症感染率最高(90.6%,58/64),其次为上皮内瘤变(85.2%,46/54)、胃癌(78.8%,41/52)、非萎缩性胃炎(75.0%,42/56)、萎缩性胃炎(70.6%,48/68)。仅慢性胃炎(非萎缩性胃炎+萎缩性胃炎)与胃溃疡组相比,差异有统计学意义(χ2=8.206,P<0.05)。其余各组间相比,差异无统计学意义(P>0.05)。
2.3 不同胃黏膜病变患者的H.pylori抗体阳性率 CagA抗体、VacA抗体、UreA抗体、UreB抗体在所有患者中的总体阳性率分别为68.7%、66.0%、78.2%、79.6%,基本以胃癌组最高,其次为胃溃疡组、上皮内瘤变组和慢性胃炎组。
胃癌组患者的CagA抗体阳性率最高,显著高于其他病变组(χ2=10.245、9.071、5.804,P<0.05),但与胃溃疡组相比,差异无统计学意义(χ2=3.649,P>0.05)。
胃癌组患者的VacA抗体阳性率较其他病变组均显著升高,差异有统计学意义(χ2=9.760、10.269、3.944、5.471,P<0.05)。
慢性胃炎组UreA抗体阳性率显著低于其他病变组(χ2=12.634、3.894、7.098,P<0.05),其他三组相比,差异无统计学意义(χ2=2.093,P>0.05)。
慢性胃炎组UreB抗体阳性率显著低于胃溃疡和胃癌组(χ2=15.928、8.147,P<0.05),与上皮内瘤变组相比,差异无统计学意义(χ2=3.516,P>0.05),其他三组相比,差异无统计学意义(χ2=4.250,P>0.05)(见表1)。
表1 不同胃黏膜病变患者的H.pylori抗体阳性率[例数(%)]
Tab 1 The positive rate ofH.pyloriantibody in patients with different gastric mucosal lesions [n(%)]
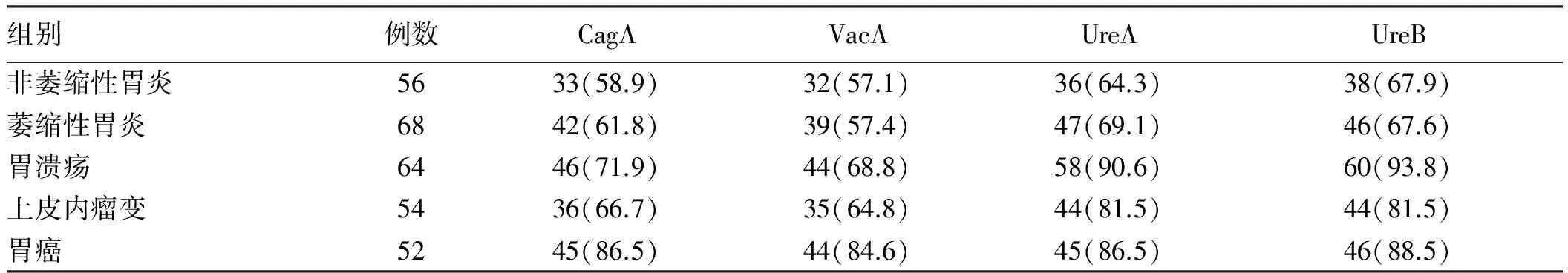
组别例数CagAVacAUreAUreB非萎缩性胃炎5633(58.9)32(57.1)36(64.3)38(67.9)萎缩性胃炎6842(61.8)39(57.4)47(69.1)46(67.6)胃溃疡6446(71.9)44(68.8)58(90.6)60(93.8)上皮内瘤变5436(66.7)35(64.8)44(81.5)44(81.5)胃癌5245(86.5)44(84.6)45(86.5)46(88.5)
2.4H.pylori感染患者中3种H.pylori分型的分布
在H.pylori感染(既往或现症)的262例患者中,Ⅰ型183例(69.8%)、Ⅱ型50例(19.1%)、中间型29例(11.1%)。Ⅰ型及中间型所占比例在胃癌组中均为最高,但各组间比较,差异无统计学意义(χ2=4.037、2.791,P>0.05)。Ⅱ型所占比例在胃癌组中显著低于其他病变组(χ2=13.943、8.583、8.479、10.698,P<0.05)。Ⅱ型所占比例在其他病变组间比较,差异无统计学意义(χ2=1.568,P>0.05)(见表2)。
表2H.pylori感染患者中3种H.pylori分型的分布[例数(%)]
Tab 2 Distribution of 3 types ofH.pyloriin patients withH.pyloriinfection [n(%)]
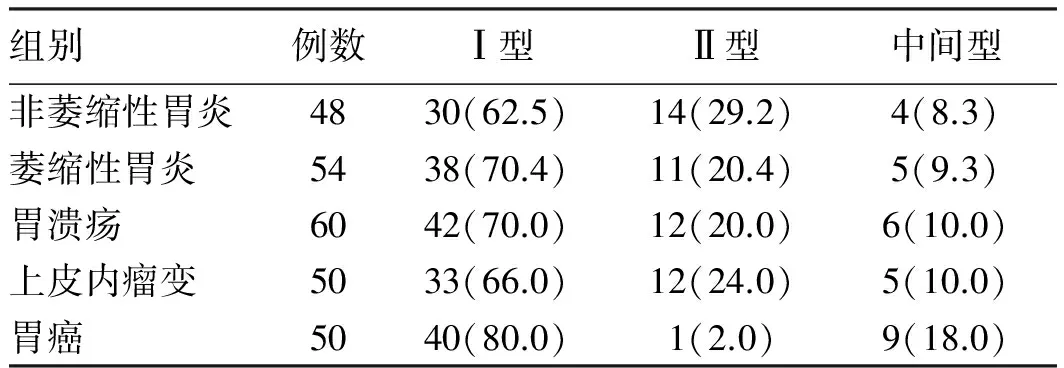
组别例数Ⅰ型Ⅱ型中间型非萎缩性胃炎4830(62.5)14(29.2)4(8.3)萎缩性胃炎5438(70.4)11(20.4)5(9.3)胃溃疡6042(70.0)12(20.0)6(10.0)上皮内瘤变5033(66.0)12(24.0)5(10.0)胃癌5040(80.0)1(2.0)9(18.0)
3 讨论
我国是世界上胃癌高发的国家之一,2003年-2007年胃癌发病率居恶性肿瘤发病率第2位,死亡率居恶性肿瘤死因第3位,在老年人群中病死率有增加趋势。多数学者认为H.pylori感染及多种抑癌基因失活与胃癌的发生密切相关。1994年,世界卫生组织下属的国际癌症研究机构根据前瞻性流行病学调查资料和胃癌发生过程中的演变规律,将H.pylori列为第一类致癌物。
关于H.pylori导致胃癌发生机制的研究极受关注。从基础到临床,从流行病学到致病机理,包括其分子机制的研究,都在不断深入。肠型胃癌是最主要的胃癌类型,根据Correa和Piazuelo的理论假说[10],肠型胃癌的发生和发展遵循以下步骤和阶段:正常胃黏膜→非萎缩性胃炎→多灶萎缩性胃炎不伴肠化生→完全型肠化生→不完全型肠化生→低度异型增生→高度异型增生→胃癌。
本研究发现,胃黏膜病变患者的H.pylori感染率较高,近90%,基本以胃癌组的H.pylori感染率、H.pylori组织染色阳性率和抗体阳性率为最高,H.pylori现症感染率以胃溃疡(90.6%)最高,这与部分流行病学研究相符。这一结果进一步证明了H.pylori感染在胃黏膜病变中的重要作用。
在部分H.pylori组织染色阴性的胃癌患者中也能发现H.pylori抗体,而H.pylori抗体要比H.pylori存在的时间更长。本次研究也发现,在所有胃黏膜病变分组中均有部分患者的H.pylori病理检测结果为阴性,而CagA抗体或VacA抗体为阳性。在部分H.pylori组织染色阴性的胃癌患者中也能发现H.pylori抗体,而H.pylori抗体要比H.pylori存在的时间更长。这可能是因为,随着胃黏膜病变的发展,胃内环境不再适合H.pylori生长,H.pylori菌落数量可能会逐渐减少,但是CagA血清抗体可以长期存在。表明H.pylori抗体测定在H.pylori组织染色结果阴性的患者中具有重要的临床价值。H.pylori抗体对判断H.pylori既往感染具有重要意义。
H.pylori感染导致的临床后果与H.pylori的毒力因子密切相关。H.pylori的毒力因子主要包括鞭毛、CagA蛋白、VacA、尿素酶、磷脂酶、脂肪酶、溶血素、脂多糖、血小板活化因子等。
尿素酶是H.pylori产生的最重要的酶之一,H.pylori尿素酶单体由UreA和UreB 2个亚单位组成。尿素酶催化尿素水解形成“氨云”保护细菌在高酸环境下生存,也为H.pylori产生的其他酶提供合适的pH[11]。本研究发现,UreA、UreB抗体阳性率、H.pylori感染率、现症感染率在慢性胃炎中均显著低于其他胃病。慢性胃炎患者不仅H.pylori感染率低,菌株毒力也相对较弱,其发生严重胃黏膜疾病的风险也相对较低,故是否所有H.pylori感染的慢性胃炎患者均需根除H.pylori治疗,尚有待商榷。
CagA基因存在于H.pylori的高毒力菌株中,其编码的CagA蛋白是一种亲水性强的、暴露于菌体表面的外膜蛋白[12]。有研究表明,CagA基因阳性的H.pylori与胃黏膜病变的临床结局密切相关[13],携带CagA基因的H.pylori菌株较CagA基因阴性菌株更易导致胃癌[14]。
欧洲和非洲国家的H.pylori菌株有20%~40%为CagA基因阴性,在东亚国家中,几乎所有的H.pylori菌株都具有CagA基因,并且产CagA蛋白[15]。日本的H.pylori菌株中有96.3%含有CagA基因[16]。但不是全部具有CagA基因的H.pylori感染者都产生抗体。在日本,CagA血清抗体阳性率约为75%[17]。所以,对判断H.pylori菌株的毒力而言,CagA抗体可能较CagA基因更具有临床意义。
与CagA基因相似,VacA基因存在于所有H.pylori菌株中,但仅有一半左右的菌株有VacA蛋白的表达[18]。本研究发现,胃癌患者CagA抗体和VacA抗体阳性率显著高于其他胃黏膜病变患者,表明CagA蛋白和VacA蛋白与胃癌的发生有密切关系,通过H.pylori抗体检测有助于预测发生胃癌的风险。
Ⅰ型和中间型菌株都可以看成H.pylori的高毒力类型。本研究发现,胃癌患者相较于其他胃病患者,Ⅰ型及中间型所占的比例均为最高,如果两种菌株相加,则胃癌组显著高于其他各组。这一结果进一步说明VacA蛋白和CagA蛋白分别都能导致胃癌,在预测胃癌发生的风险方面有重要意义。
综上所述,通过研究H.pylori感染率、现症感染率及H.pylori抗体阳性率,我们发现,各组胃黏膜病变患者的H.pylori感染率均较高,近90%,说明H.pylori与胃黏膜病变密切相关,而且随病变的进展,H.pylori感染率及毒力均呈上升趋势,这种趋势在肠型胃癌的发生、发展过程中表现尤为明显。本研究同时发现,在部分H.pylori组织染色阴性的胃癌患者也能发现H.pylori抗体,H.pylori抗体要比H.pylori存在的时间更长,这可能与胃内环境的改变有关。H.pylori相关抗体包括CagA、VacA、UreA、UreB抗体阳性率在胃癌患者中均显著高于其他胃黏膜病变,H.pylori抗体测定对预测胃癌发生的风险具有重要意义,其临床价值高于组织中H.pylori检测结果。
[1]Asahi M, Azuma T, Ito S, et al. Helicobacter pylori CagA protein can be tyrosine phosphorylated in gastric epithelial cells [J]. J Exp Med, 2000, 191(4): 593-602.
[2]Franco AT, Johnston E, Krishna U, et al. Regulation of gastric carcinogenesis by Helicobacter pylori virulence factors [J]. Cancer Res, 2008, 68(2): 379-387.
[3]Segal ED, Cha J, Lo J, et al. Altered states: involvement of phosphorylated CagA in the induction of host cellular growth changes by Helicobacter pylori [J]. Proc Natl Acad Sci U S A, 1999, 96(25): 14559-14564.
[4]Shiota S, Suzuki R, Yamaoka Y. The significance of virulence factors in Helicobacter pylori [J]. J Dig Dis, 2013, 14(7): 341-349.
[5]Ogiwara H, Sugimoto M, Ohno T, et al. Role of deletion located between the intermediate and middle regions of the Helicobacter pylori vacA gene in cases of gastroduodenal diseases [J]. J Clin Microbiol, 2009, 47(11): 3493-3500.
[6]Erzin Y, Koksal V, Altun S, et al. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA, babA2 genotypes and correlation with clinical outcome in Turkish patients with dyspepsia [J]. Helicobacter, 2006, 11(6): 574-580.
[7]Argent RH, Thomas RJ, Letley DP, et al. Functional association between the Helicobacter pylori virulence factors VacA and CagA [J]. J Med Microbiol, 2008, 57(Pt 2): 145-150.
[8]Gangwer KA, Shaffer CL, Suerbaum S, et al. Molecular evolution of the Helicobacter pylori vacuolating toxin gene vacA [J]. J Bacteriol, 2010, 192(23): 6126-6135.
[9]俞庆宪, 严格, 陈忆诺. 幽门螺杆菌毒力因子与胃癌前变化的研究[J]. 上海医学, 2002, 25(9): 572-574. Yu QX, Yan G, Chen YN. Study of virulent factor of Helicobacter pylori with the gastric precancerous changes [J]. Shanghai Med J, 2002, 25(9): 572-574.
[10]Correa P, Piazuelo MB, Wilson KT. Pathology of gastric intestinal metaplasia: clinical implications [J]. Am J Gastroenterol, 2010, 105(3): 493-498.
[11]Dunn BE. Pathogenic mechanisms of Helicobacter pylori [J]. Gastroenterol Clin North Am, 1993, 22(1): 43-57.
[12]刘红强. cagA与胃癌发生的关系[D]. 重庆医科大学, 2012.
[13]Blaser MJ, Perez-Perez GI, Kleanthous H, et al. Infection with Helicobacter pylori strains possessing cagA is associated with an increased risk of developing adenocarcinoma of the stomach [J]. Cancer Res, 1995, 55(10): 2111-2115.
[14]Nomura A, Stemmermann GN, Chyou PH, et al. Helicobacter pylori infection and gastric carcinoma among Japanese Americans in Hawaii [J]. N Engl J Med, 1991, 325(16): 1132-1136.
[15]Shiota S, Yamaoka Y. Biomarkers for Helicobacter pylori infection and gastroduodenal diseases [J]. Biomark Med, 2014, 8(9): 1127-1137.
[16]Yamaoka Y, Kodama T, Kita M, et al. Relationship of vacA genotypes of Helicobacter pylori to cagA status, cytotoxin production, and clinical outcome [J]. Helicobacter, 1999, 3(4): 241-253.
[17]Shiota S, Murakami K, Okimoto T, et al. Serum Helicobacter pylori CagA antibody titer as a useful marker for advanced inflammation in the stomach in Japan [J]. J Gastroenterol Hepatol, 2014, 29(1): 67-73.
[18]Polk DB, Peek RM Jr. Helicobacter pylori: gastric cancer and beyond [J]. Nat Rev Cancer, 2010, 10(6): 403-414.
(责任编辑:李 健)
Analysis of Helicobacter pylori and its related antibodies in patients with gastric mucosal diseases in Qingdao
CHEN Li1, ZHANG Chengdong1, YIN Jie2, LU Yanyan1, HAN Yue1, SUN Lijuan1, LIU Xishuang1
1.Department of Gastroenterology, Laoshan Hospital Affiliated to Qingdao University, Qingdao 266000; 2.Qianfoshan Hospital of Shandong Province, China
Objective To investigate the relationship of Helicobacter pylori (H.pylori),H.pylori-associated antibodies with different gastric mucosal diseases and their clinical significance. Methods From Jun. 2015 to May. 2016, 294 eligible patients with gastric mucosal disease were studied, including 56 cases of chronic non-atrophic gastritis, 68 cases of chronic atrophic gastritis, 64 cases of gastric ulcer, 54 cases of gastric mucosal intraepithelial neoplasia, 52 cases of gastric cancer. All the patients were grouped by endoscopic manifestations and histopathological findings, and serumH.pyloriantibodies were measured in each group. The infection rate ofH.pylori, current infection rate ofH.pylori(positive inH.pyloritissue staining),H.pylorityping were determined, respectively. The results were analyzed statistically. Results The infection rates ofH.pyloriin patients with chronic non-atrophic gastritis, chronic atrophic gastritis, gastric ulcer, intraepithelial neoplasia and gastric cancer were 85.7%, 79.4%, 93.8%, 92.6% and 96.2%, respectively. The current infection rates ofH.pyloriwere 75.0%, 70.6%, 90.6%, 85.2% and 78.8%, respectively. The positive rates of CagA antibody and VacA antibody in gastric cancer patients were 86.5% and 84.6%, respectively, which were significantly higher than those of other gastric mucosal lesions. The positive rates of CagA antibody and VacA antibody of other gastric mucosal lesions were 58.9%~71.9% and 57.1%~68.8%, respectively. The positive rates of UreA and UreB antibodies were the highest in gastric ulcer group (90.6%, 93.8%), which were significantly different compared with chronic gastritis group (66.9%, 67.7%), but not different compared with gastric carcinoma and intraepithelial neoplasia. Among the 262 patients infected withH.pylori, 183 were type Ⅰ strain (69.8%), 50 were type Ⅱ strain (19.1%), and 29 were intermediate type (11.1%). Type Ⅱ in the gastric cancer group (2.0%) was significantly lower than that in other groups (20.0%~29.2%). There was no significant difference in the proportions of typeⅠ and intermediate type among all the groups. ConclusionH.pyloriis closely related to gastric mucosal lesion. With the aggravation of gastric mucosal lesion,H.pyloriinfection rate and virulence are increasing.H.pyloriantibody test has great significance in predicting the risk of gastric cancer, and its clinical value is higher than that ofH.pyloritissue staining.
Gastric cancer; Helicobacter pylori; CagA; VacA
10.3969/j.issn.1006-5709.2017.06.015
陈力,住院医师,研究方向:胃肠病学。E-mail:chenli19880806@163.com
刘希双,博士,主任医师,研究方向:消化系统内镜。E-mail:liuxishuang1@sina.com
R378;R57
A
1006-5709(2017)06-0682-04
2016-11-22
