ACG临床指南:幽门螺杆菌感染的治疗
2017-06-29李雨濛段芳龄
李雨濛 译,马 军,段芳龄 审
郑州大学第二附属医院 郑州大学消化疾病研究所,河南 郑州 450014
共识
ACG临床指南:幽门螺杆菌感染的治疗
李雨濛 译,马 军,段芳龄 审
郑州大学第二附属医院 郑州大学消化疾病研究所,河南 郑州 450014
幽门螺杆菌(Helicobacter pylori,H.pylori)感染是一种常见的全球性感染疾病,是消化性溃疡和胃癌的重要病因。H.pylori和功能性消化不良、低剂量阿司匹林或非甾体类抗炎药溃疡风险、不明原因的缺铁性贫血、特发性血小板减少性紫癜有关。进行H.pylori治疗方案前,应了解患者前期抗生素应用史并将此纳入决策过程。对于无大环内酯类治疗史、又生活于克拉霉素耐药率较低地区的患者,一线治疗可用克拉霉素三联疗法。大多数患者更适合采用含铋剂的四联疗法,或含有PPI、克拉霉素、阿莫西林、甲硝唑的同步治疗。一线治疗失败时,补救治疗应避免使用已使用过的抗生素。如果患者用含克拉霉素的一线治疗,补救治疗可用铋剂四联疗法或左氧氟沙星方案;如果患者一线用铋剂四联疗法,优先选择含克拉霉素或左氧氟沙星的补救治疗方案。有关药物选择、使用剂量、持续时间、一线治疗和补救方案参见本指南。
幽门螺杆菌;治疗;指南
前言
幽门螺杆菌(Helicobacter pylori,H.pylori)感染仍是影响人类健康最常见的慢性细菌感染之一。自从美国胃肠病学学院(ACG)2007临床指南出版以来,H.pylori感染的治疗已取得显著进步。因此,本指南旨在为在北美洲工作的临床医师提供治疗H.pylori感染治疗的最新建议。就本文而言,北美是指美国和加拿大,该指南主要基于高水平的北美洲相关文献,也参照了一些国际范围的研究和专家共识数据。
本指南使用GRADE(推荐分级的评价、制定与评估)系统确定建议级别[1],它用PICO(患者群体、干预措施或指征的评价、分组、结果)格式,为指南的生成提供了证据等级和推荐强度。在编写指南之前,我们专门进行了H.pylori感染相关PICO专题讨论,并和McMaster大学科研方法学家合作,收集高水平文献。主要检索了MEDLINE、EMBASE和Cochrane CENTRAL数据库里2000年-2014年9月11日的相关文献。检索词包括“pylori、treat*、therap*、manag*、eradicat*”,全文检索策略见在线附件。在评价偏差、间接性、不一致性和不确定的风险后,对每一项建议的证据水平分级,“高”(进一步研究不影响证据的可信性),“中”(进一步研究可能会对证据有效性有影响),“低”(进一步研究会对证据效果有明显影响),或“非常低”(证据效果很不确定)。建议的可靠性确定为“强”或“有条件的”是基于证据的质量、治疗的效果和副作用、患者的情况、数据应用是否合理。本指南内容简要列举在表1中。每个陈述的证据质量评估的理由见下文。
表1 推荐陈述
Tab 1 Recommendation statements

问题1:H.pylori感染在北美地区的流行情况如何?高危群体有哪些?H.pylori感染是一种慢性感染,感染通常始于儿童时期[2⁃6],获得感染的确切途径尚不清楚。其发病率和患病率通常在北美之外出生的人群中高于北美地区出生的人群。在北美地区,H.pylori感染的患病率在特定的种族和少数民族、社会弱势群体和移民到北美的人群中更高(事实陈述;低质量证据)[6⁃9]。问题2:H.pylori感染检测和治疗的指征是什么?由于所有H.pylori活动性感染检测阳性的患者都应该接受治疗,因此关键问题是哪些患者应接受感染检测(强烈推荐;证据质量:不适用)。所有活动性消化性溃疡(PUD)、既往有PUD病史、低度胃黏膜相关淋巴组织(MALT)淋巴瘤或者有内镜下早期胃癌(EGC)切除术病史的患者,应接受H.pylori感染检测(强烈推荐;证据等级:活动性感染或PUD病史证据等级高;MALT淋巴瘤、EGC切除证据等级低)。<60岁无预警症状的不明原因消化不良患者,可考虑非内镜H.pylori检测。检测阳性的患者应接受根除治疗(有条件的推荐;证据质量:疗效高,年龄划界低)。当对消化不良患者进行上消化道内镜检查时,应同时进行胃黏膜活检以评估H.pylori感染。感染的患者应接受根除治疗(强烈推荐,高质量证据)。无PUD病史、但有典型症状的胃食管反流病(GERD)患者不需要进行H.pylori感染检测,然而对于那些接受检测发现被感染的患者,应对其进行治疗,治疗对于这些患者GERD症状改善效果不明(强烈推荐,证据质量,高)。对于长期服用低剂量阿司匹林的患者,检测H.pylori可降低溃疡出血的风险,检测阳性患者需要接受根除治疗(有条件的推荐,中等质量证据)。使用非甾体抗炎药(NSAIDs)开始进行慢性治疗的患者应接受H.pylori感染检测。检测阳性患者应接受根除治疗(强烈推荐,中等质量证据)。对于已服用NSAIDs的患者进行H.pylori检测和治疗的益处尚不清楚(有条件的推荐,低质量证据)。不明原因缺铁性(ID)贫血的患者应对H.pylori感染进行适当评估,检测阳性的患者应接受根除性治疗(有条件的推荐,高质量证据)。患有原发性血小板减少性紫癜(ITP)的患者应检测H.pylori感染,检测阳性的患者应该接受根除性治疗(有条件的推荐,极低质量证据)。没有充分证据支持对有胃癌家族史的无症状个体及淋巴细胞性胃炎、增生性胃息肉和妊娠剧吐的患者进行H.pylori常规检测与治疗(不推荐;极低质量证据)。问题3:北美地区基于循证的一线治疗策略是什么?1.当选择H.pylori治疗方案时,应问诊和考虑患者之前的抗生素暴露史(有条件的推荐;中等质量证据)。2.在H.pylori克拉霉素耐药率<15%的地区及无其他任何疾病而使用大环内酯类药物史的患者,仍然推荐使用由一种质子泵抑制剂(PPI)、克拉霉素、阿莫西林或甲硝唑组成的克拉霉素三联疗法进行14d治疗(有条件的推荐;低质量证据。治疗持续时间:中等质量证据)。3.由一种PPI、铋剂、四环素和一种硝基咪唑组成的铋剂四联疗法进行10~14d治疗,是推荐的一线治疗方案之一。对于有任何大环内酯类抗生素暴露史的或者对青霉素过敏的患者,是一可行治疗方案(强烈推荐;低质量证据)。4.使用由一种PPI、克拉霉素、阿莫西林和一种硝基咪唑组成的联合疗法进行10~14d治疗,是推荐的一线治疗方案之一(强烈推荐;低质量证据。治疗持续时间:极低质量证据)。5.先使用一种PPI和阿莫西林进行5~7d治疗,再使用一种PPI、克拉霉素和一种硝基咪唑进行5~7d治疗的贯续疗法是推荐的一线治疗方案之一(有条件的推荐;低质量证据。治疗持续时间:极低质量证据)。6.先使用一种PPI和阿莫西林进行7d治疗,再使用一种PPI、阿莫西林、克拉霉素和一种硝基咪唑进行7d治疗的镶嵌疗法是推荐的一线治疗方案之一(有条件的推荐;低质量证据。治疗持续时间:极低质量证据)。7.使用由一种PPI、左氧氟沙星和阿莫西林组成的左氧氟沙星三联疗法进行10~14d治疗是推荐的一线治疗方案之一(有条件的推荐;低质量证据。治疗持续时间:极低质量证据)。8.使用一种PPI和阿莫西林进行5~7d治疗,再使用一种PPI、氟喹诺酮和硝基咪唑进行5~7d治疗的氟喹诺酮序贯疗法是推荐的一线治疗方案之一(有条件的推荐;低质量证据。治疗持续时间:极低质量证据)。问题4:哪些是H.pylori根除诊疗的预测因素?H.pylori根除治疗成功的决定因素是治疗方案的选择、患者对频繁发生副作用的多种药物治疗方案的依从性及H.pylori对于联合使用抗生素的敏感性(事实陈述,中等质量证据)。问题5:北美地区H.pylori耐药情况如何?
续表1

缺乏北美地区H.pylori菌株耐药性数据。需要有组织的协作调研,了解局地、区域和国家H.pylori耐药模式,以指导抗H.pylori治疗方案(强烈推荐;低质量证据)。问题6:有哪些方法可用来检测H.pylori抗菌素耐药性,何时检测?虽然H.pylori抗菌素耐药性可通过菌种培养和/或分子检测来确定(强烈推荐;中等质量证据),这些检测目前在美国未被广泛应用。问题7:在进行H.pylori根除治疗后,我们是否应检测治疗是否成功?H.pylori感染一旦被确诊并且治疗,在抗生素治疗结束4周后以及PPI治疗停止1~2周后,都应使用尿素呼气试验、粪便抗原测试以及基于活检的检测了解根除治疗效果(强烈推荐;低质量证据。根治检测方法的选择:中等质量证据)。问题8:初次治疗失败后,如何挽救治疗方案?对于持续H.pylori感染的患者,应尽量避免使用既往使用过的抗生素(与之前ACG指南一致)(强烈推荐;中等质量证据)。如患者既往接受过包含克拉霉素的一线治疗,优选铋剂四联疗法或左氧氟沙星挽救疗法。最佳挽救治疗方案需要结合当地的抗菌素耐药数据以及患者既往抗生素暴露史来制定(有条件的推荐;证据质量见以下个别陈述)。如果患者既往接受过铋剂四联一线治疗,优选包含克拉霉素或者左氧氟沙星的补救治疗方案。最佳补救治疗方案需要结合当地的抗菌素耐药数据以及患者既往抗生素暴露史来制定(有条件的推荐;证据质量见以下个别陈述)。以下治疗方案可以考虑用作补救治疗:14d铋剂四联治疗是推荐的补救治疗方案(强烈推荐,低质量证据)。14d左氧氟沙星三联疗法是推荐的补救治疗方案(强烈推荐;中等质量证据。治疗持续时间:低质量证据)。10~14d的联合疗法是建议的补救治疗方案(有条件的推荐;极低质量证据)。应该避免使用克拉霉素三联疗法作为补救治疗方案(有条件的推荐;低质量证据)。使用一种PPI、阿莫西林和利福布汀进行10d治疗的利福布汀三联疗法是建议的补救治疗方案(有条件的推荐;中等质量证据。治疗持续时间:极低质量证据)。使用一种PPI和阿莫西林进行14d治疗的大剂量二联疗法是建议的补救治疗方案(有条件的推荐;低质量证据。治疗持续时间:极低质量证据)。问题9:何时考虑H.pylori感染的患者青霉素过敏试验?大部分有青霉素过敏病史的患者并非真正的青霉素过敏反应。在一线治疗失败后,这类患者应该考虑推荐其进行过敏原筛检,绝大多数患者最终可安全地使用含阿莫西林的补救治疗方案(强烈推荐;低质量证据)。
问题1:北美地区H.pylori感染的流行情况如何?哪些是高危人群?见表1。
H.pylori感染通常在儿童时期获得,其确切感染途径仍不明确。感染危险因素包括社会经济地位低、兄弟姐妹较多、父母有H.pylori感染(尤其是母亲受感染)[10]。来自德国乌尔姆出生队列研究分析发现,如果孩子母亲是感染者,孩子感染的危险度(OR)为13.0(95%CI:3.0~55.2)[10]。除了家庭内传播,感染也可通过被污染的水传播,特别是在发展中国家[11]。
虽然男性和女性儿童的感染率相似,但男性似乎更高些[3,12]。一项荟萃分析[12]报道,男性H.pylori阳性率略高于女性,OR=1.16(95%CI:1.11~1.22)。加拿大Ontario的研究证实,H.pylori总血清阳性率为23.1%,其中男性(29.4%)高于女性(14.9%)[13]。女性血清阳性率较低的原因之一可能是女性患者因其他疾病使用抗生素的几率更高、更可能清除H.pylori[12]。有证据表明,出生时期对H.pylori患病率有影响:例如,20世纪30年代出生的人比60年代出生的人在童年时期更容易被感染。美国7 310个退伍军人胃肠道症状的一项研究显示:1920年前出生的退伍军人其感染率为73%,1980年后出生的感染率为22%[14]。这些退伍军人的整体患病率从1997年的70.8%下降到2002年后的50%并保持稳定。
在美国北部,H.pylori感染患病率随社会经济地位和种族/族裔的不同而发生变化[14-17]。一般来说,非西班牙裔白人比其他种族/族裔群体(包括非裔美国人、西班牙裔美国人、印第安人和阿拉斯加土著人)的患病率要低。有报道[5,14-15,18]显示,非洲血统较高的非裔美国人比非洲血统较低的非裔美国人的H.pylori感染率要高,这表明H.pylori易感性可能和种族/遗传因素相关,而与社会经济因素无关。住在靠近美国和墨西哥边境地区的居民具有高患病率[19-20];一项研究[19]显示这一地区居民粪便H.pylori抗原检出率为38.2%。据报道,阿拉斯加土著人[18]和加拿大第一民族人口的患病率也很高[21]。
和世界其他许多地方相比,美国H.pylori感染率普遍较低,特别是亚洲和美国的中部和南部相比较[8,22]。但是,初步证据表明一些以前患病率较高地区的感染率可能会下降[22]。从亚洲和世界其他地方移民到北美的人比在美国北部出生的人有更高的感染率。一项研究显示,来自东亚的移民的血清阳性率为70.1%[24]。从西班牙移民到北美居民的感染率高于出生于这里的第一代或第二代西班牙裔人[25]。
问题2:H.pylori感染检测和治疗的指征是什么?见表1。
ACG’s 2007治疗指南对H.pylori感染的处理[26]列出以下诊治指征:
活动性PUD(胃或十二指肠)
曾诊断为PUD(没有针对H.pylori感染进行过治疗)
胃黏膜相关淋巴组织(MALT)淋巴瘤(低级别)
内镜下早期胃癌(EGC)切除术后
本指南扩展了H.pylori感染检测的指征。不同程度的证据在下面详述。其中一些检测指征受临床判断和患者病情的影响。并非所有潜在指征都给予了明确的建议,所以临床医师可针对患者具体情况具体分析。没有证据提示必须在北美洲进行全面的或人群H.pylori筛查。
PUD
2007年指南的依据已经很充分,相关建议仍可应用。新诊断出PUD或有PUD既往史的患者都应进行H.pylori感染检测。识别H.pylori活动性感染的测试包括尿素呼气试验、粪便抗原测试,或基于内镜检查的黏膜活检。由于患者感染的可能性较高,有PUD记录的患者代表着一组罕见人群,可用H.pyloriIgG抗体检测。在大多数其他感染可能性较低情况下,更适合使用检测活动性感染的方法。有PUD病史且接受过H.pylori感染治疗的患者应当用尿素呼气试验或粪抗原检测,以明确是否清除了H.pylori。有持续感染的患者应接受适当治疗。
胃黏膜相关淋巴组织(MALT)淋巴瘤
“MALT淋巴瘤”这一术语在很大程度上被“边缘带B细胞淋巴瘤MALT型”所取代。鉴别这一肿瘤仍是检验和根除H.pylori感染的关键指征。
2009年发表了总结六项关于H.pylori感染的胃MALT淋巴瘤(也被称为“胃局部B细胞淋巴瘤”)治疗的前瞻性队列研究,但却没有系统综述或RCTs[27]。根除H.pylori感染后,有60%~93%患者的肿瘤消退,但反应并不一致,一些患者在治疗后延迟出现反应,患者在治疗后1年内肿瘤复发。
最近的许多研究证实了这些结果。日本一项系列研究中,420例进行H.pylori感染治疗的患者中,虽然有10例(3%)患者平均在6.5年内复发[28],但77%的患者显示存在完全的组织学应答或可能的微小残留灶(研究者对反应的定义)。对根除治疗无反应患者中,有27%的患者疾病发生进展。德国的120例患者中(随访时间中位数为122个月),H.pylori感染治疗后有80%患者完全缓解[29]。其中3%患者在24个月内出现疾病复发,17%的患者在48个月(中位数为48个月)后发现有组织学残留灶。
最近的一项研究[30]表明,胃弥漫性大B细胞淋巴瘤患者也可受益于H.pylori感染的治疗。
早期胃癌
最近的三项荟萃分析[31-33]发现,胃肿瘤内镜下切除术后,根除H.pylori感染可减少异时性胃癌的发病率。Yoon等[33]报道最全面,包括13项研究(3项前瞻性和10项回顾性),共6 687例患者。治愈H.pylori感染后发生胃癌的OR值为0.42(95%CI:0.32~0.56);3个前瞻性研究的亚组分析中,OR为0.39(95%CI:0.20~0.75)[33-34]。其他两个荟萃分析得到类似结果[31,32]。最近一个包括了24项研究的荟萃分析(其中亚洲22项)证实了治愈H.pylori感染后异时性ECG发病率降低,其发病率OR为0.54(95%CI:0.46~0.65)[34]。
消化不良(未调查的)
消化不良(定义为上腹部的疼痛或不适)在北美洲和其他地方非常常见。在北美洲,多数消化不良患者没有严重的潜在器质性疾病来解释他们的症状。也就是说,大多数是功能性消化不良(FD),本指南的其他地方另行讨论。ACG 2007H.pylori处理指南[26]将消化不良(取决于H.pylori的流行)作为H.pylori感染诊治指征。55岁以下有消化不良症状和无预警症状的人群需要进行H.pylori诊治。
英国BristolH.pylori项目随机抽取1 517名H.pylori阳性的成人并给予抗H.pylori感染治疗或安慰剂治疗,并对其进行前瞻性随访[35]。90%以上根除成功,治疗组再次因消化不良到初级医疗机构就诊的人数有一个小的但有差异的减少(P<0.05)。
2005年Cochrane协作组发表了对消化不良初始处理策略的综述[36]。截至2016年初,尚未更新。H.pylori“检测和治疗”策略对于消化不良的疗效比使用质子泵抑制剂(PPI)或H2受体拮抗剂进行经验性抑酸更有效(相对危险度RR=0.59;95%CI:0.42~0.83)。这一结论不同于一项个体患者数据的荟萃分析,该文包括1 537例患者的3个RCTs,患者随机接受“检测和治疗”或经验性抑酸治疗[37]。虽然在12个月时症状改善在两组间无显著差异,但“测试和治疗”组有总花费降低的趋势。
另一个体患者资料的荟萃分析(包括5个RCTs研究),将1 924例患者随机分为“检测和治疗”组或即刻上消化道内镜检查组,对消化不良症状进行评估[38]。1年后,仍然有症状的RR为0.95(95%CI:0.92~0.99),更支持即刻内镜检查。然而,“检测和治疗”方案的成本较低。对所有消化不良患者进行内镜检查既不可行,费用也高。
功能性消化不良(FD)
发表于2006年的Cochrane系统评价得出一个具有统计学意义的结论:治疗H.pylori感染对FD患者有益[39]。17个RCTs(3 500多例患者)发现H.pylori感染治疗后的RR减少了10%(95%CI:6%~14%),14例需要治疗人数(NNT)中有1例成功根除(95%CI:10%~25%)。随后更新的Cochrane评价研究了包括4 331例患者的21个试验[40]。大多数试验都是评估治疗12个月后患者的症状。这一研究证实NNT为14,但95%CI较窄:10~20。
罗马Ⅳ标准建议将FD患者分为两组:上腹痛综合征(腹痛和/或烧灼感)或餐后不适综合征(用餐相关早饱和/或胀满),同时也承认这两组之间可能会有相当大的重叠[41]。虽然旧的治疗试验并没有采用这些新的标准,但是这些试验表明根除H.pylori感染治疗后,上腹部疼痛或运动功能障碍型的症状得到改善[40]。
由于H.pylori感染的FD患者根除治疗后会持久获益,因此我们推荐对FD患者行H.pylori的检测和治疗。这和美国胃肠病协会最近的一项指南相符,它建议对有消化不良症状的患者在内镜检查时取正常胃黏膜组织对H.pylori进行活检[42]。
在编制本指南时,ACG和加拿大胃肠病学协会正在编写未明确的消化不良和FD的诊疗指南。
GERD
无H.pylori感染与胃食管反流存在因果关系的明确证据。在地理分布上,H.pylori感染的患病率与GERD的患病率和严重程度呈负相关[44]。Barrett’s食管在未感染H.pylori的个体中更常见[45]。Barrett’s食管患者患食管腺癌的风险较H.pylori感染患者低[45]。
ACG 2007年指南[26]对根除H.pylori感染后GERD症状和严重程度进行回顾。北美最有可能感染H.pylori的是胃窦炎、高胃泌素血症、壁细胞增生和胃酸分泌增加等相关人群,根除H.pylori后患者GERD症状可能会改善,因为胃酸分泌下降,胃窦炎和高胃泌素血症得以缓解[46]。8个十二指肠溃疡H.pylori治疗的RCTs的因果分析显示,根除治疗是否成功对糜烂性食管炎或GERD症状的影响无显著性差异[47]。既往有GERD患者中,治愈感染后7%患者恶化,持续感染患者15%恶化(OR=0.47,95%CI:0.24~0.91,P=0.02)。
根除H.pylori后胃体胃炎患者理论上可能出现GERD症状或GERD症状恶化,因为胃壁细胞数量增加和胃酸分泌增多。然而,这种情况在北美相对少见。
英国BristolH.pylori项目中一项社区研究发现,H.pylori感染的治疗和胃烧灼感或其他反流症状的患病率增加是不相关的[48]。同样,治疗H.pylori感染并没有改善患者原有的症状[49]。
对27项研究进行系统回顾分析发现,十二指肠溃疡患者根除H.pylori感染后不影响GERD进程或使GERD症状加重。
有报道称,在使用PPI治疗糜烂性食管炎之前,先根除H.pylori感染并不影响治愈率或症状[50-52]。
因此,根据现有的可靠证据,无任何迹象表明需要对有GERD症状的患者进行H.pylori感染检测,除非患者有PUD病史或消化不良症状。GERD患者若因其他原因进行H.pylori感染检测并阳性,应进行根除治疗,尽管不太可能改善GERD症状。H.pylori阳性胃体炎患者长期用PPIs可能会促进萎缩性胃炎的进展[53-54]。虽然PPI治疗根除H.pylori前可能会阻止萎缩性胃炎的进展[55],但临床相关性还不清楚。
服用低剂量阿司匹林
阿司匹林(乙酰水杨酸,ASA)常用于有心血管危险因素或曾有心血管病的患者[56]。ASA增加上消化道溃疡的风险。低剂量阿司匹林治疗时,H.pylori感染是公认的溃疡发展和出血的危险因素[57-58]。
在加拿大、澳大利亚、英国和西班牙进行的187例中老年患者的一项研究表明,每日服用ASA 75~325 mg,内镜下消化性溃疡的患病率为10.7%(95%CI:6.3%~15.1%)[59]。H.pylori感染是ASA相关十二指肠溃疡发生的一个显著风险因素(OR=18.5,95%CI:2.3~149.4),但不是胃溃疡的风险因素(OR=2.3,95%CI:0.7~7.8)。
一项来自香港的研究观察,服用低剂量ASA时可出现消化性溃疡出血H.pylori感染患者情况。H.pylori感染被治愈后重新服用ASA的患者,出血复发率和无出血史初次小剂量服用ASA的未出血患者类似。ASA相关溃疡出血的患者根除H.pylori可减少出血复发的风险。
至于其他抗血小板药物,由ACG、美国心脏病基金会和美国心脏协会联合发表的2010专家共识指出:使用噻吩吡啶类抗血小板药物的患者中,H.pylori感染是上消化道出血的明确风险因素[61],但对于服用这些药物的患者没有针对检测、治疗的明确建议。然而,服用这类药物的患者大多数也服用ASA,因此通常也进行H.pylori检测。
在北美,针对根除H.pylori治疗是否增加不良心血管事件的风险缺乏前瞻性随机对照研究,我们建议对预防性服用低剂量阿司匹林的患者行H.pylori检测,尽管这个建议的证据较弱。
使用非甾体类抗炎药(NSAIDs)
H.pylori感染是NSAID引起溃疡及溃疡出血的一个独立危险因素[62-63]。服用NSAID前根除H.pylori感染可减少溃疡和溃疡出血的危险性[64-65]。
2005年一个包括五个RCTs的荟萃分析[66]表明,服用NSAID患者根除H.pylori,消化性溃疡的发病率减少57%(OR=0.43,95%CI:0.20~0.93)。对于未服用过NSAID的患者,根除H.pylori意义最显著。开始NSAID治疗前根除H.pylori,可能是成人预防NSAIDs相关溃疡单项成本效益比最佳的策略[67]。
已服用NSAID患者,根除H.pylori的益处尚不完全明确[68]。RCTs表明,长期服用NSAID患者根除H.pylori不降低新的消化性溃疡的发生率[69];PPI治疗比根除H.pylori能更有效地降低溃疡发生的风险。
ACG关于预防NSAID相关溃疡并发症的最新指南指出:H.pylori感染增加了NSAID相关消化道并发症的风险,需要长期服用NSAID治疗的患者进行H.pylori检测有一定益处;当确诊感染时需要进行根除治疗。
缺铁性贫血(IDA)
H.pylori感染与缺铁(ID)和IDA有关。一项观察性研究的荟萃分析发现,H.pylori感染的ID和IDA的合并OR分别为1.4(95%CI:1.2~1.6)和2.0(95%CI:1.5~2.9)。另一个15项观察性研究的荟萃分析还发现,H.pylori感染的患者与H.pylori阴性患者相比,IDA的发生更多见(OR=2.2,95%CI:1.5~3.2)[70]。据报道,患IDA的青少年更易发生H.pylori感染[71]。
H.pylori感染的青少年和成人IDA不论是否同时进行根除H.pylori口服铁剂治疗均有效。但有H.pylori感染的IDA患者根除H.pylori可增强铁剂的治疗效果[71-72]。16个H.pylori感染的IDA的RCTs荟萃分析发现:口服铁剂的同时根除H.pylori优于单独口服铁剂,它可增加血红蛋白(Hgb)、血清铁和血清铁蛋白(SF)的水平(P<0.00001)[73]。包含4个干预试验的荟萃分析发现,根除H.pylori治疗联合口服铁剂和单独口服铁剂Hgb水平的加权平均差为4.1 g/dl(95%CI:2.6~10.7);另5项临床试验的SF差值为9.5 μg/L(95%CI:0.5~19.4)[70]。
正在进行一项针对ID患者根除H.pylori感染的Cochrane系统评价,但其研究结果尚未报道[74]。
原发性血小板减少性紫癜(ITP)
小规模的随机和非随机试验的证据表明,在部分成人ITP患者中,根除H.pylori感染后血小板计数持续改善[75-77]。儿童ITP患者的试验证据尚不确切[78]。
包括25项研究(1 555例成人患者)的一项系统回顾显示,至少15例ITP患者,在H.pylori根除后血小板计数有增加趋势[79]。696例可评价的患者中,43%达到完全缓解(定义为血小板计数≥100×109个/L),另50%有治疗反应(血小板计数≥30×109个/L并比基线血小板计数至少增加一倍)。基线血小板计数<30×109个/L的患者反应率较低。总体来说,H.pylori流行地区和轻度血小板减少症患者的应答率较高。
美国血液学协会(ASH)发表于2011年的实践指南[80]建议:“如果检测是阳性可接受根除治疗的成人ITP患者,考虑进行H.pylori筛查”(证据等级2C)。ASH还建议,检测出活动性H.pylori感染的成人ITP患者需进行根除治疗(证据等级1B)。ASH不支持儿童ITP患者进行H.pylori感染检测[80]。
无症状的个体与胃癌发生风险
根除H.pylori感染和逆转胃黏膜萎缩、肠上皮化生的胃癌前病变是矛盾的。2009年发表的一个包括12项研究(2 658例)的荟萃分析显示,根除治疗可降低胃体萎缩性胃炎的发生(P=0.006)而不降低胃窦萎缩性胃炎的发生(P=0.06);没有证据表明对胃体(P=0.42)或胃窦(P=0.76)的肠上皮化生有影响[81]。
一项Cochrane系统评价了6个RCTs(5个亚洲种群),无症状患者、成年健康感染者进行根除H.pylori治疗、安慰剂或不进行治疗,对比其胃癌发生情况[82]。所有试验项目随访至少2年,证据质量评定为中等。3 294例治疗组胃癌发病率为1.6%,3 203例未治疗的对照组发病率为2.4%(RR=0.66,95%CI:0.46~0.95)。总NNT为124(95%CI:78~843)。然而,假设根除H.pylori的持续终生,在中国男性中NNT可低至15。在美国由于胃癌的风险较低,相应的NNT男性为95,女性为163。
最近一项含24篇研究的荟萃分析(22项在亚洲进行)对无症状成人感染者根除H.pylori治疗可降低胃癌发生率。胃癌发病率最高地区的人们获益最大;胃癌发生率低、中与高地区的RR分别为0.80、0.49、0.45[34]。
其他胃肠道和非胃肠道疾病
H.pylori感染与许多其他疾病相关[83]。大多数情况下,生物学的合理性和证据支持水平欠缺。因此,无正式建议可提供。
对照试验表明,根除H.pylori对于淋巴细胞性胃炎的治疗[84]和改善增生性胃息肉有益[85]。
有一些数据表明,肝硬化患者中H.pylori感染与高血氨症和肝性脑病(HE)之间有微弱的关联[86];对HE患者治疗H.pylori感染试验的评估取得了和预期相矛盾的结果。
一项观察性研究的荟萃分析发现,妊娠剧吐孕妇的H.pylori感染率明显高于对照组[87]。
有学者假定H.pylori感染与常见心血管疾病(包括心肌梗死和中风)相关。然而,低质量的证据不足以证明因果关系[88]。
有关帕金森氏病和H.pylori感染的Cochrane系统评价[89]分析了3个临床试验无足够的证据支持在这一人群中进行H.pylori感染的筛查。少量证据表明,根除H.pylori可能会改善帕金森病的症状,这可能是增加了左旋多巴的吸收和生物利用度,需进一步的RCTs验证。
证据调查显示荨麻疹患者治疗H.pylori感染之间的联系,仅存在一些低质量证据[90];10个相关试验中有9个表明根除H.pylori后患者无收益。
一项荟萃分析提示,H.pylori阳性的Ⅰ型糖尿病患者与非感染患者相比,糖化血红蛋白水平更高[91]。然而,在根除H.pylori后短期内血糖控制并没有改善。
H.pylori感染与肥胖的患病率呈负相关[92]。H.pylori感染与过敏性或变应性疾病之间存在一种微弱的负相关[93-94],包括嗜酸性粒细胞性食管炎[95-100]及腹腔疾病[101]和炎症性肠病[102]。
问题3:北美地区基于循证的一线治疗策略是什么?见表1。
H.pylori是一种感染性疾病,治疗时通常用2~3种抗生素和PPI一起服用,根据协同方案或序贯方案,治疗周期从3~14 d。在临床上,初始根除治疗,即“一线”治疗,根除的可能性最大。因此,应谨慎选择最合适的一线根除方案。无任何一个治疗方案能保证100%治愈H.pylori感染,事实上,目前很少有治疗方案能始终超过90%根除率[103]。在北美制定这一指南时,我们进行了全面的美国和加拿大的随机、对照试验文献检索。我们尽量用这些数据作为指南的基础。然而,虽然在21世纪前十年北美进行很多H.pylori的随机、对照试验,评估新疗法试验的数量依然较少。因此,在考虑治疗方案时,我们还需依靠世界其他地区的临床试验数据。指南中已明确,在北美地区,对于新治疗方案的疗效、H.pylori的耐药性,需要更多的临床试验。为了让读者理解作者的倾向性,在列举每一个治疗方案时,我们在有意用“推荐”和“建议”这两个词。可用的一线治疗见表2。图1是帮助选择最佳治疗方法的流程。
表2 推荐的治疗H.pylori一线治疗方案
Tab 2 Recommended first-line therapies forH.pyloriinfection

方案药物(剂量)使用频率疗程(d)FDA批准克拉霉素三联疗法PPI(标准或双倍剂量)BID14是a克拉霉素(500mg)阿莫西林(1grm)或甲硝唑(500mgTID)铋剂四联疗法PPI(标准剂量)BID10~14否b枸橼酸铋钾(120~300mg)或次水杨酸铋(300mg)QID四环素(500mg)QID甲硝唑(250~500mg)QID(250)TIDtoQID(500)伴同疗法PPI(标准剂量)BID10⁃14否克拉霉素(500mg)阿莫西林(1grm)硝基咪唑(500mg)c序贯疗法PPI(标准剂量)+阿莫西林(1grm)BID5~7否PPI,克拉霉素(500mg)+硝基咪唑(500mg)cBID5~7混合疗法PPI(标准剂量)+阿莫西林(1grm)BID7否PPI,阿莫西林,克拉霉素(500mg),硝基咪唑(500mg)cBID7左氧氟沙星三联疗法PPI(标准剂量)BID10~14否左氧氟沙星(500mg)QD阿莫西林(1grm)BID左氧氟沙星序贯疗法PPI(标准或双倍剂量)+阿莫西林(1grm)BID5~7否PPI,阿莫西林,左氧氟沙星(500mgQD),硝基咪唑(500mg)cBID5~7负荷疗法左氧氟沙星(250mg)QD7~10否PPI(双倍剂量)QD硝唑尼特(500mg)BID多西环素(100mg)QD
注:BID:2次/d;FDA:食品与药物管理局;PPI:质子泵抑制剂;TID:3次/d;QD:1次/d;QID:4次/d。a:一些PPI、克拉霉素和阿莫西林的组合已经获得FDA批准。PPI、克拉霉素和甲硝唑不是FDA批准的治疗方案。b:PPI、铋、四环素和甲硝唑单独规定不是FDA批准的治疗方案。然而,Pylera,一个含铋、四环素结合的产物,与甲硝唑结合PPI 10 d是FDA批准的治疗方案。c:甲硝唑或替硝唑。
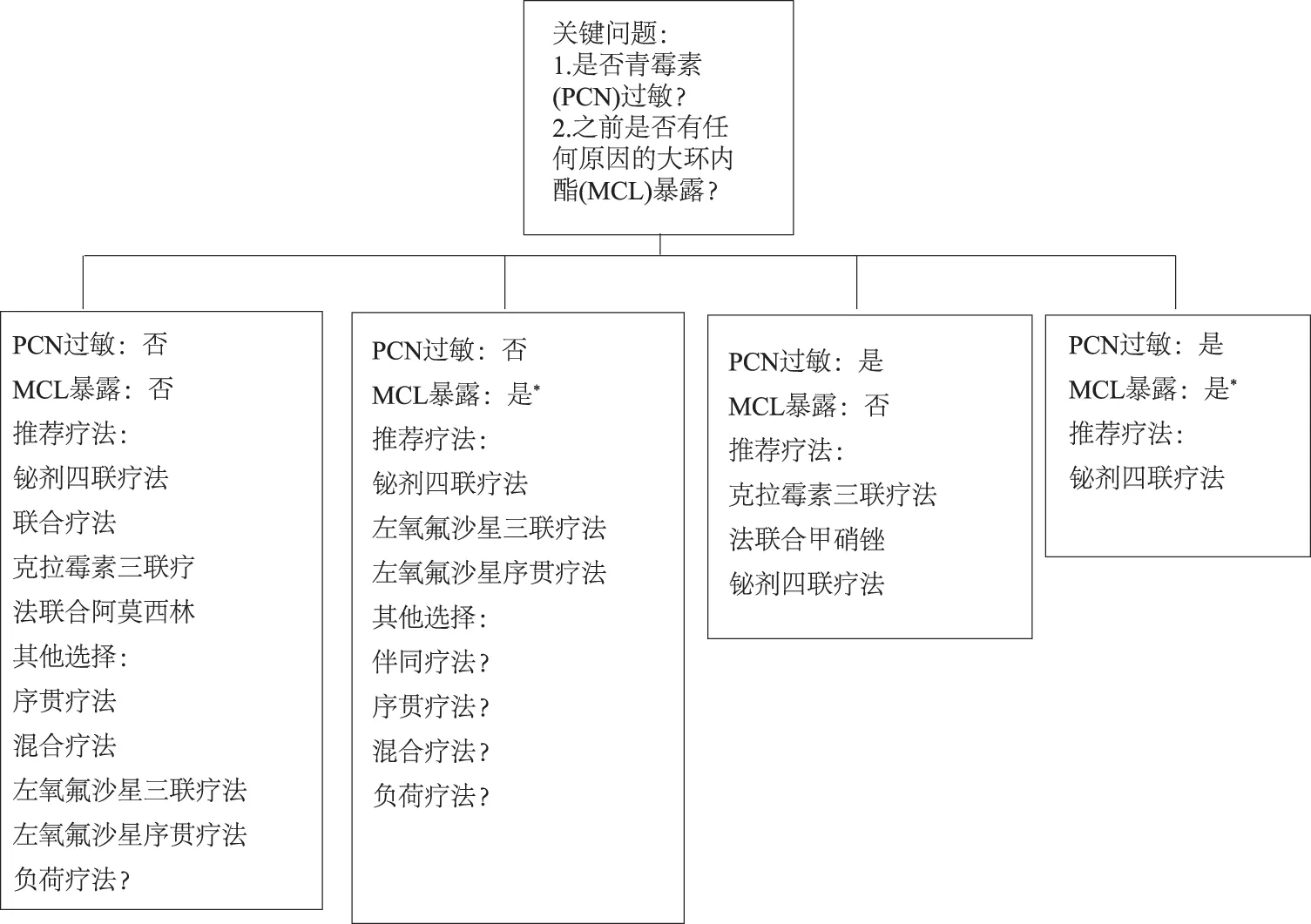
注:*在已知克拉霉素耐药率>15%的地区且有大环内酯类药物暴露史的患者推荐用药方案。对于药物、剂量和持续时间的具体的一线治疗方案,见表2。
图1 一线H.pylori治疗方案的选择
Fig 1 Selection of a first-lineH.pyloritreatment regimen
除了极少数例外,用于治疗H.pylori感染的抗生素相关的最常见不良反应是胃肠道方面的(例如:恶心、味觉障碍、消化不良、腹痛、腹泻)。因此,我们未列出大多数疗法的不良反应,特殊的不良反应有相应说明。
克拉霉素三联疗法
2007年的ACG指南推荐用PPI、克拉霉素和阿莫西林(克拉霉素三联疗法)14 d治疗,当患者对青霉素过敏时,用甲硝唑替代阿莫西林。当时,克拉霉素三联疗法的根除率为70%~85%,并受到克拉霉素耐药的影响[26]。然而,人们越来越关注克拉霉素三联疗法的疗效问题。在制定本指南时,考虑的关键问题包括在北美克拉霉素三联疗法的预期根除率、最合适的疗程及根除率是否随着时间的推移而下降。
世界其他地区的数据表明,克拉霉素三联疗法根除率低于80%[103]。在更新指南时,我们评估了美国或加拿大所有RCTs,这些试验评价了2000年以来该方案的疗效[100,104-119]。与其他的荟萃分析结果一致,在美国或加拿大7 d或10 d克拉霉素三联疗法的根除率确实低于80%。14 d的三联疗法根除率较高,但仅包括2个研究、195名受试者。该发现和最新最完整的荟萃分析以及Cochrane协作网发表的相关文献是一致的[120]。关于克拉霉素三联疗法,14 d疗法比7 d疗法根除率要高(34个研究,RR=0.65,95%CI:0.57~0.75;NNT=12,95%CI:9~16),14 d比10 d疗法根除率也要高(10个研究,RR=0.69,95%CI:0.52~0.91)。根据现有数据,在北美使用三联疗法时应给予14 d。
由于缺少最近克拉霉素三联疗法的RCT数据,无法说明其根除率的时间趋势。为解决该问题,我们回顾性分析密歇根大学2001年-2015年克拉霉素三联疗法的根除率。数据分为5年一组,作为一线治疗10~14 d。在662例患者中,总根除率为79.5%(95%CI:77.2%~82.4%),按3年或5年分组的根除率无显著性差异(见图2,数据未公布)。
克拉霉素耐药性对克拉霉素三联疗法疗效的影响报道已很多。2010年的一项荟萃分析指出克拉霉素耐药菌株的根除率为22%,克拉霉素敏感性菌株的根除率为90%[121]。因此,在克拉霉素耐药率高的地区不能应用克拉霉素三联疗法[55]。2012年发表的Maastricht/Fiorentina共识文件要求:克拉霉素耐药率超过15%~20%时不使用三联疗法。虽然目前尚无北美地区对H.pylori抗生素耐药性的大规模数据,但最近来自休斯敦的数据表明,克拉霉素耐药率在该地区降至这一范围[122]。如果无该地区H.pylori耐药数据,询问患者因其他原因的抗生素使用史非常重要,尤其是大环内酯类和氟喹诺酮类,不作为H.pylori耐药性参考[123-124]。最近的一项研究证实了用过抗生素的数量与抗生素耐药风险增加有关[125]。同样,大环内酯类药物治疗的持续时间>2周则克拉霉素三联疗法治疗失败的风险更大[126]。
根据现有的数据我们推荐:由PPI、克拉霉素、阿莫西林或甲硝唑组成的克拉霉素三联疗法14 d治疗在H.pylori克拉霉素耐药较低地区仍可作为一线治疗。在克拉霉素耐药率>15%的地区,如北美的许多地区,应避免使用克拉霉素三联疗法。所有患者都应询问大环内酯类药物暴露史。用过大环内酯类抗生素的患者中,应避免使用克拉霉素三联疗法。
在已知克拉霉素耐药率>15%的地区且有大环内酯类药物暴露史的患者推荐用药方案。对于药物、剂量和持续时间的具体的一线治疗方案(见表2)。

图2 密歇根大学一线的克拉霉素三联疗法根除率(2001-2015)
Fig 2 Eradication rates with first-line clarithromycin triple therapy at the university of Michigan(2001-2015)
铋剂四联疗法
以前的ACG指南也支持由PPI或H2受体拮抗剂、铋剂、甲硝唑和四环素组成的铋剂四联疗法使用10~14 d,在北美资料有限。文献检索发现只有2个RCTs,其中包括铋剂四联疗法组(n=172)。此方案10 d的平均根除率为91%(95%CI:81%~98%)。
一项荟萃分析比较了世界各地的克拉霉素三联与铋剂四联疗法后发现,这两种治疗方案具有相似的疗效、耐受性和依从性[121]。一项最新的荟萃分析(包括12个RCTs和2 753例患者)报道:铋剂四联疗法意向治疗(ITT)根除率为77.6%,克拉霉素三联疗法根除率68.9%(风险差异为0.06,95%CI:-0.01~0.13)。这些数据集存在显著的不均一性,包括治疗时间、药物剂量和区域。10 d的铋剂四联疗法比7 d的克拉霉素三联疗法更有效。然而,当都给予10~14 d治疗时,两个方案的疗效无显著性差异[127]。最近的H.pylori治疗荟萃分析还发现,10~14 d铋剂四联疗法优于7 d克拉霉素三联疗法(85%vs73%,RR=1.17,95%CI:1.12~1.21)[103]。根据这些数据,我们推荐铋剂四联疗法的治疗时间为10~14 d。美国曾有一段时间存在四环素供应问题,限制了铋剂四联疗法。目前这些问题均已解决。
与克拉霉素三联疗法不同,铋剂四联疗法的疗效不受克拉霉素耐药性的影响。此外,虽然甲硝唑耐药性对铋剂四联疗法的疗效有一定的影响,但它不如克拉霉素耐药性对克拉霉素三联疗法的影响那样深刻[127]。因此,在已知克拉霉素耐药率较高的地区,或患者先前因任何原因曾用大环内酯类抗生素药物治疗,应强烈推荐铋剂四联疗法作为初始的治疗方案。
伴同疗法
所谓的“伴同疗法”包括PPI、阿莫西林、克拉霉素和硝基咪唑(替硝唑或甲硝唑),3~10 d的治疗[128]。在北美尚无伴同疗法RCTs的疗效。一项针对伴同疗法的荟萃分析(包括19个临床试验,2 070例H.pylori感染者)显示平均治愈率为88%(95%CI:85%~91%)。比较伴同疗法(481例)与克拉霉素三联疗法(503例)的RCTs,ITT根除率分别为90%和78%(OR=2.36,95%CI:1.67~3.34)[129]。几乎所有的试验都在欧洲或亚洲进行,只有一项研究在拉丁美洲进行。最近的一次网络荟萃分析得到了非常相似的结果[103]。对超过2 000例患者、6项研究的序贯疗法数据[130]进行综合荟萃分析后发现,10 d序贯疗法(81.3%,95%CI:74.9%~87%)与5~10 d伴同疗法(81.7%,95%CI:76.1%~86.7%)的疗效无显著性差异。
Gisbert等[129]的荟萃分析显示治疗时间延长治愈率也随之增高。拉丁美洲最近的一项大型、多中心、RCTs显示:14 d克拉霉素三联疗法比5 d伴同疗法(82.2%vs73.6%,差异= 8.6%,95%CI:2.6%~14.5%)有更高根除率[131],间接指出伴同疗法至少需要7 d时间。目前尚无RCTs评价14 d伴同疗法疗效。有限的数据表明,克拉霉素耐药H.pylori感染患者伴同疗法的疗效可能会降低,但降低幅度要小于克拉霉素三联疗法[129]。试验表明,伴同疗法的耐受性和依从性与克拉霉素三联疗法或序贯疗法相似[103,130]。
由于北美的相关数据缺乏,我们的结论是,伴同疗法治疗是一种很有前途的治疗方案,在国际研究报道中有很高的治愈率,但尚需在北美的验证。因为伴同疗法与克拉霉素三联疗法一样有效且具有相似的耐受性,因此它可作为北美推荐的一线治疗方案。如果推荐伴同疗法,10~14 d的疗程较合适。延长伴同疗法的治疗时间至14 d是否可提高根除率,亟需进一步研究。
序贯疗法
序贯疗法,先服用PPI+阿莫西林5 d,然后服用PPI、克拉霉素和硝基咪唑类药物5 d,在2000年开始作为一种替代克拉霉素三联疗法的方案[132]。最近的一项系统回顾和荟萃分析(46个RCTs包括13 532例患者)比较了序贯疗法和现有的新疗法[130]。序贯治疗的总根除率为84.3%(95%CI:82.1%~86.4%)。序贯疗法优于7 d的克拉霉素三联疗法(RR=1.21,95%CI:1.17~1.25)。然而,序贯治疗只是略优于10 d克拉霉素三联疗法(RR=1.11,95%CI:1.04~1.19),并未优于14 d克拉霉素三联疗法(RR=1,95%CI:0.94~1.06)或10~14 d铋剂四联疗法(RR=1.01,95%CI:0.95~1.06)。
不同地区序贯疗法的疗效差异较大,虽然来自意大利的研究报告显示有很高的根除率[133],但一个多中心临床试验(包含六个拉美国家的1 463名成年人)发现14 d克拉霉素三联疗法比10 d序贯疗法的根除率更高(82.2%vs76.5%,差异=5.6%;95%CI:-0.04%~11.6%)[131]。另一项来自台湾的大样本研究发现,克拉霉素耐药时序贯治疗根除率降低,但与克拉霉素三联疗法相比降低程度较低。这也是率先建议可通过延长序贯疗法治疗时间至14 d来提高根除率的研究之一[134]。
文献检索发现只有2个RCTs评估了在美国和加拿大的序贯治疗[100,104]。在2014年的一篇摘要中,来自达拉斯州和德克萨斯州的研究人员将134例H.pylori感染患者随机分为10 d序贯疗法或克拉霉素三联疗法。观察发现两种治疗方案的根除率之间无显著性差异(RR=0.95,95%CI:0.79~1.15)。在加拿大的另一个试验中,126例患者被随机分配到10 d的序贯疗法或克拉霉素三联疗法。这次试验仍未能确定两个方案疗效之间的显著性差异(RR=0.83,95%CI:0.62~1.06)。这两个试验的随机效应荟萃分析显示,合并RR为0.91(95%CI:0.78~1.06)。序贯疗法的耐受性和依从性与克拉霉素三联疗法相似[103]。
现有数据表明,10 d序贯疗法可替代14 d克拉霉素三联疗法。然而,在北美洲10 d的序贯治疗并不优于14 d克拉霉素三联疗法。同时,序贯治疗的复杂性降低了其在北美作为一线治疗方案的应用。延长序贯疗法治疗时间到14 d可能会提高根除率,但仍需进一步研究。
混合疗法
混合疗法是连续和伴随疗法的结合。混合疗法包括:首先服用PPI、阿莫西林7 d后,再服用PPI、阿莫西林、克拉霉素和一种硝基咪唑类药物7 d[135]。
迄今为止,在北美尚无RCTs评估混合疗法的疗效或耐受性。最近几个荟萃分析总结了在世界其他地区进行的RCTs结果[103,136-137]。Wang等[136]荟萃分析确定6个RCTs评估混合疗法与序贯疗法/伴同疗法,混合疗法的ITT根除率为88.6%。其他两个最近的荟萃分析证实了这一ITT根除率(Li等[103]89%(95%CI:81%~94%),He等[137]86.6%(95%CI:82%~91%)。混合疗法比7 d克拉霉素三联疗法更有效 (89%vs73%,网络分析RR=1.22;95%CI:1.11~1.29)。混合疗法的耐受性与克拉霉素三联疗法相似[103]。此外,混合疗法、序贯疗法和伴同疗法的疗效、耐受性和依从性似乎无显著性着差异[136-137]。
由于缺乏北美数据,从现有的数据可以看出:为期14 d的混合疗法是一种很有前途的治疗方案,在国际研究中已取得很高的治愈率,但有待在北美得到验证。由于混合疗法与克拉霉素的三联疗法有相似的耐受性和疗效,所以建议作为克拉霉素三联疗法的一种替代方案。混合治疗的复杂性可能会限制其在临床实践中的使用。
左氧氟沙星为基础的疗法
左氧氟沙星是一种氟喹诺酮类药物,在体外具有抗革兰阳性菌和革兰阴性菌的抗菌活性(包括H.pylori),已用于抗H.pylori的一线治疗和补救治疗方案。左氧氟沙星主要被用作三种一线治疗方案:(1)PPI、阿莫西林三联疗法;(2)改良序贯疗法包括5~7 d的PPI和阿莫西林后5~7 d PPI,左氧氟沙星和一种硝基咪唑类; (3)左氧氟沙星四联疗法:PPI、硝唑尼特和多西环素给药7 d或10 d。
目前尚无RCTs评估北美一线左氧氟沙星三联疗法的疗效。来自世界其他地区七项试验的荟萃分析发现,7 d左氧氟沙星三联疗法和7 d克拉霉素三联疗法有类似的根除率(分别为79%和81%,风险比为0.97,95%CI:0.93~1.02)。另一项荟萃分析(9项研究和2 502例患者)证实了这些结果,根除率有区域差异性,左氧氟沙星三联疗法在欧洲根除率更好,克拉霉素三联疗法根除率在亚洲地区会更高[139]。另一方面,Li等[103]网络荟萃分析发现,10~14 d左氧氟沙星三联疗法被证明优于7 d克拉霉素三联疗法(90%,95%CI:84%~94%与73%,95%CI:71%~75%;RR=1.23,95%CI:1.16~1.29)。虽然未正式比较,左氧氟沙星三联疗法的合并根除率也高于10~14 d克拉霉素三联疗法(81%,95%CI:78%~84%)。左氧氟沙星三联疗法的耐受性与克拉霉素三联疗法相似[103,138]。
左氧氟沙星和环丙沙星也被用于修订版的序贯疗法(一种PPI和阿莫西林治疗5~7 d后再由一种PPI、氟喹诺酮类和硝基咪唑治疗5~7 d)。目前尚无来自北美的、评价氟喹诺酮类疗效和耐受性的研究。一项荟萃分析(包括六个试验和来自世界其他地区的738个初始治疗的患者)比较了10~14 d氟喹诺酮类序贯疗法与7~14 d克拉霉素三联疗法或10 d标准序贯疗法的疗效。使用随机效应模型,氟喹诺酮类药物序贯疗法合并根除率为87.8%,克拉霉素三联疗法和标准序贯疗法合并根除率为71.1%(RR=1.21,95%CI:1.09~1.35)。亚组分析显示左氧氟沙星序贯疗法优于克拉霉素三联疗法(83.6%vs64%,RR=1.32,95%CI:1.09~1.60)或标准序贯疗法(87.4%vs78.9%,RR=1.12,95%CI:1.04~1.21)。氟喹诺酮类药物序贯疗法的根除率和治疗时间、PPI药物选择或氟喹诺酮类药物的剂量关系不大。这两组治疗方案总的不良事件发生率与脱落事件的发生率是相似的[140]。
一线四联疗法中有一种被称为“LOAD疗法”的治疗方案,由左氧氟沙星、奥美拉唑、硝唑尼特(Alinia)和多西环素组成。一项开放试验随机研究了270例美国患者,给予7 d或10 d的LOAD疗法,根除率分别为89%和90%,而10 d兰索拉唑、阿莫西林、克拉霉素疗法的根除率为73%[106]。关于左氧氟沙星耐药性影响LOAD疗法疗效尚无报道,对于这种非传统、昂贵的治疗方案的其他研究值得期待。
和许多其他新的H.pylori治疗方法类似,缺少北美左氧氟沙星的一线治疗方案疗效的数据。北美氟喹诺酮类药物的耐药率或耐药对含氟喹诺酮类药物治疗方案疗效的影响方面的数据很少。现有少数数据表明,在北美氟喹诺酮类药物的耐药可能很高,或许要高于克拉霉素耐药[122,141-142]。10~14 d左氧氟沙星三联疗法似乎可替代克拉霉素三联疗法。10~14 d包括氟喹诺酮类药物的序贯疗法或7~10 d LOAD疗法是最有前途的。
一线治疗中益生菌的选择
在美国,益生菌作为H.pylori感染的辅助治疗越来越引起人们的兴趣。新的证据表明乳酸杆菌和双歧杆菌类可抑制H.pylori。此外,这些益生菌菌株也可能有助于减少清除治疗的副作用,提高治疗的依从性[143-144]。
包含益生菌在H.pylori感染患者中疗效的荟萃分析(包括10个临床试验)显示,补充益生菌可增加治愈率(合并OR=2.07,95%CI:1.40~3.06)。益生菌也降低副作用的发生率(合并OR=0.31,95%CI:0.12~0.79)。然而,这些研究大多在中国进行,由于缺乏双(单)盲和随机分配隐藏不足而导致高偏倚风险。此外,在选择治疗方案时,使用的益生菌和方案有很大的差异。虽然益生菌治疗H.pylori感染很有前途,但仍存在许多问题,包括最佳剂量、服用时机(根除治疗之前,期间或之后)和治疗时间。
问题4:治疗H.pylori感染时,哪些因素可预测根除治疗成功?见表1。
成功根除H.pylori的决定因素可分为宿主因素和H.pylori相关因素。宿主方面,在使用铋剂-四环素-甲硝唑三联疗法根除H.pylori时,患者的依从性是重要因素[145]。随后的研究发现,临床试验中的脱失率与每天给药次数[146]有关。发生不良事件的可能性和严重性也影响依从性。然而,如果患者意识到可能发生的潜在不良事件并了解哪些在停止治疗后会消失,那患者更易接受治疗[147]。因此,与患者全面而坦诚地讨论H.pylori清除疗法的益处和面临的挑战非常重要,可提高患者的依从性。
遗传因素也可能影响H.pylori根除治疗的成功率[148]。例如,PPI是根除H.pylori治疗方案的重要组成部分,有多种抗H.pylori机制,包括直接的抗菌性能及降低胃内酸度来提高抗生素在胃黏膜和胃腔内的效应。CYP2C19(肝细胞色素酶P450系统的一个组成部分)的基因多态性决定PPI的代谢率。东南亚地区普遍缺乏有功能的CYP2C19变异体,它和含PPI治疗方案的根除率有重要联系(亚洲人为10%~20%,美国人低于5%)。这种“弱代谢者”变异体导致PPI的生物利用度增加,显著提高抑酸性和H.pylori根除率。CYP2C19基因多态性在北美洲的影响尚未得到系统评价。
其他多种临床因素在根除治疗的成功率中发挥作用,荟萃分析发现,与治疗失败相关因素中主要是吸烟和糖尿病[149-150],吸烟治疗失败的OR为1.95,糖尿病为2.19。然而,关于糖尿病分析只有8项研究,其中4项来自土耳其,缺少来自北美的研究。可以想象的是,这些结果可能会受低药物依从性或抗生素暴露史导致的耐药影响,因为这些研究没有对这些重要的因素加以控制。
H.pylori相关因素中,抗生素敏感性是最重要的因素,是临床试验和以人群为基础的H.pylori根除重要的预后因素[151-153]。克拉霉素、甲硝唑和越来越多的左氧氟沙星耐药性限制了常用根除方案成功率,多重耐药的频率正在增加。H.pylori通常对阿莫西林、四环素、利福布汀发生耐药较小(目前<5%)。
如前所述,使克拉霉素三联疗法成功率降低50%[151-152]。虽然关于左氧氟沙星耐药性对临床影响的数据非常有限,但现有数据显示左氧氟沙星耐药性降低左氧氟沙星方案的成功率的20%~40%[154-155]。对于甲硝唑,全球范围体外试验的耐药率相当高,对于H.pylori根除效果难以预测。甲硝唑耐药可降低三联疗法根除率的25%,但在四联疗法以及含PPI方案根除率降低较小[152]。增加甲硝唑剂量和治疗时间也改善甲硝唑耐药菌株的治疗效果,这表明,不同于克拉霉素和左氧氟沙星,体外甲硝唑耐药不是预测根除失败的绝对因素[156]。事实上,H.pylori甲硝唑耐药有多种机制,H.pylori甲硝唑耐药性的定义和检测仍有待规范。
问题5:我们所了解的北美地区H.pylori耐药性情况如何?见表1。
在2008年进行的一项多中心欧洲调查显示,甲硝唑耐药率为35%,克拉霉素为17.5%(10年前的一倍),左氧氟沙星为14%[124]。在个别欧洲国家,耐药性与门诊使用喹诺酮类药物和长效的大环内酯类药物相关,这表明H.pylori耐药性和社区抗生素使用具有因果关系。同样,在南美洲[157]和世界大多数其他地区[158],对克拉霉素耐药率较高,甲硝唑耐药率更高。一般来说,随着时间推移,抗生素耐药率有上升趋势[158]。在世界其他地区相关报道中,克拉霉素为50%,甲硝唑为65%,左氧氟沙星为50%[158]。
与许多国家精心挑选菌株和记录抗生素耐药率以期指导选择更合理的治疗方案相比,北美国家尚未组织开展对H.pylori耐药模式的系统化研究。最近在美国抽样研究了从1998年-2002年11家医院的347株菌株,显示甲硝唑的耐药率为21%,克拉霉素的耐药率为13%[159]。十年后,对来自休斯顿退伍军人医疗中心的128株菌株进行研究发现甲硝唑耐药率和以前相似(20%),而对克拉霉素耐药已上升至16%,左氧氟沙星耐药率为31%。菌株的多重耐药率为17%,只有一半菌株对所有5种抗生素均敏感[122]。阿拉斯加土著人2000年的样本发现,甲硝唑的耐药率为42%,克拉霉素为30%和左氧氟沙星为19%[141]。来自北美少量数据提示,H.pylori的抗生素耐药率值得关注(见表3)。可以想象,美国人平均每人每年接受一个门诊抗生素处方,其中大环内酯类抗生素阿奇霉素是最常见的处方抗生素[160],将这些有限数据扩展到更广泛的人群中时,需要谨慎小心。这些初始数据提示系统监测北美的抗生素耐药情况的紧迫性。
问题6:有哪些方法可评估H.pylori抗菌素耐药性,可进行哪些检测?见表1。
胃组织活检分离培养可检测H.pylori的抗生素耐药性。H.pylori培养需要几天时间,即使有经验的医师也很不易。PPI和抗生素使用让H.pylori培养更为复杂。因此,北美多数医疗中心H.pylori培养成功后,有几种不同的方法来测试抗生素耐药性,包括琼脂稀释法、药物纸片扩散法和E-test法,每种方法各有利弊[156]。
已开发和应用的更为简单快捷的分子检测方法,可用于新鲜、冷冻或石蜡包埋的胃黏膜活检样本,也可用于粪便样本,减少了内镜检查的需求。分子生物学方法如聚合酶链反应或荧光标记的核酸杂交技术可用于检测多个抗生素耐药有关的突变[161]。目前的检测集中在少数已知的克拉霉素和左氧氟沙星耐药突变,这两种抗生素对于临床治疗更重要。克拉霉素耐药通常是由于H.pylori的23S核糖体亚基RNA的两个位点之一发生突变,23S rRNA的多个位点或其他基因均可发生突变,但通常和耐药无关。左氧氟沙星耐药通常由DNA解旋酶亚基A两个位点中的一个发生突变引起。另一方面,分子生物学技术不适用于甲硝唑耐药性的研究,因为甲硝唑耐药性是由多种机制引起的。目前,美国FDA和CLIA尚未批准分子检测。
表3H.pylori在美国的耐药率(2009-2011)
Tab 3 Antibiotic resistance rates ofH.pyloristrains in the United States, 2009-2011

抗生素耐药率(%)甲硝唑20克拉霉素16左氧氟沙星31四环素<2阿莫西林<2利福布丁<2
注:数据来源于参考文献122,200。
细菌感染的抗生素常规治疗包括根据微生物的体外敏感试验,或者根据当地微生物敏感数据选择。而H.pylori治疗依赖于经验性抗生素治疗。在美国以外地区,根除H.pylori的难度越来越大,这促使一些专家提倡进行更为开放的抗生素耐药性检测,尤其是在一次或多次失败的治疗后或是在高耐药人群。因此,Maastricht指南推荐:在克拉霉素耐药常见地区(在许多地区存在耐药性)、尤其二线治疗失败后,若选择克拉霉素三联治疗前应进行克拉霉素耐药测试[55]。
根据细菌对抗生素敏感性和经验性选择抗生素孰优孰劣一直存在争议。新近一项针对12篇文献的荟萃分析更加青睐依据敏感性选择抗生素。选择7~10 d三联疗法时,需进行内镜活检和培养检测抗生素敏感性[162]。其他研究表明,依据抗生素敏感性的二线治疗[163]和三线治疗具有很高的清除率[164],但这种策略的成本效益需要得到严格的评估。在美国,治疗失败后的重复的胃镜活检成本高昂。非侵入(粪便或其他)的药敏检测更为划算。同时,临床医师应常规询问患者既往抗生素使用史和推定的抗生素暴露史,以便在左氧氟沙星、克拉霉素、甲硝唑发生耐药时选择替代方案。
毫无疑问,在北美需要对H.pylori抗生素敏感性进行分析和跟踪,尤其在美国,确定最合适的一线和抢救治疗方案对于H.pylori感染者很重要。目前在欧洲进行一项广泛的研究,每年登记数以千计的病例,从而提供H.pylori抗生素耐药性的实时数据,用来指导最合适的治疗[165]。在美国缺乏抗生素耐药性的相关数据与欧洲的情形形成了鲜明的对比,是循证治疗的障碍。
问题7:H.pylori根除治疗后,是否应该检测治疗是否成功?见表1。
随着H.pylori根除治疗成功率的下降,许多患者在治疗后持续存在感染,并有发生H.pylori相关并发症的风险,例如消化性溃疡和胃恶性肿瘤。不依靠内镜的呼气试验或粪便测试可检测治疗是否成功且价格相对便宜,尽管患者应当在根除治疗结束后4周并停用PPI类药物2周后才能接受测试[166-167]。尿素呼气试验、粪便抗原测试和基于活检的测试对于检测持续H.pylori感染都具有高度敏感性和特异性,因此,患者的测试选择取决于一些其他因素,包括需要重复胃镜检查的必要性、局部可用性、成本和第三方支付。
H.pylori治疗后若有明确治疗指征,治疗后检测理所应当。然而,从成本-效益方面的考虑并不支持这一观点。但是也存在例外:H.pylori相关的消化性溃疡出血的模型研究支持用常规检测H.pylori根除[168-169];与此相反,这种策略不适用于简单的十二指肠溃疡,即使根除率低至70%[170]。
患有FD的情况下,即使成功根除H.pylori后症状依然存在,治疗后的检测有助于决定是否寻求其他诊断或针对病因的经验性治疗。不到10%FD患者根除治疗后症状缓解,因此再次测试比再次治疗更重要,甚至产生了“H.pylorineurosis”。同时,需要考虑患者是否愿意接受根除性检测,如果他们希望摆脱这些潜在性致癌细菌,他们就会接受再次检测。
最后一个支持治疗后测试重点是要提供证据帮助社区医疗决策。如果没有再次检测,就无法获得从业者或社区居民根除成功信息和方案调整。
在临床中,可能会出现以下情况:如无条件进行根除测试或者医师、患者认为不必要。然而,在绝大多数情况下,如果给患者抗H.pylori治疗,就应当进行根除测试。
问题8:初次治疗失败后,补救治疗方案该如何选择?见表1。
在一个或多个根除方案失败后选择合适补救方案是胃肠病专家所面临的普遍问题。和一线治疗一样,我们不得不在补救治疗依靠经验做出选择而不是基于细菌培养和药敏试验结果。虽然大部分补救治疗的试验是在北美以外区域进行,我们尽可能从2000年以来北美进行的相关研究的基础上制订推荐建议。如果没有相关数据,我们就关注相关的国际研究。值得注意的是,亚洲报告的补救治疗根除率一直高于北美或欧洲。下面列出的所有根除率来自ITT分析。
正如本指南其他部分所解释的,根除治疗成功的最重要因素是H.pylori对抗生素的敏感性或耐药力;反之,对抗生素的耐药性与既往使用过这种特定抗生素使用史密切相关(对于H.pylori感染或其他感染)[153]。这主要适用于克拉霉素、氟喹诺酮类、利福布丁(一种不常用的一线抗生素),应避免经验性的重复使用,因为增加剂量、延长治疗时间或增加给药频率不能改善抗生素耐药[151-153]。然而,阿莫西林或四环素可重新使用,即使以前曾使用这两种抗生素,出现耐药仍很少见[122]。即使甲硝唑的耐药性可通过增加其剂量、使用时间或给药频率而部分克服[151-152]重复使用一般也应避免。如果预计其他方案不佳,甲硝唑可纳入14 d秘剂四联疗法重复使用,特别是以前只是短暂或低剂量使用。表3中列出了可用的补救治疗方案选项。图3提供了一个推荐建议流程,以协助持续性H.pylori感染的治疗方案选择。
铋剂四联疗法
自2000年以来,有30个RCTs比较了铋剂四联疗法与其他方案,或一种或几种根除治疗失败后铋剂四联疗法不同的治疗时间作为补救治疗方案。其中,23项研究是一线治疗失败的患者;有20项研究是克拉霉素三联疗法失败的患者。剩下3个一线治疗方案不明,其中一项[171]既往接受铋剂四联疗法的患者特别排除。
Marin等荟萃分析发现,在克拉霉素三联疗法失败后,使用铋剂四联疗法时延长治疗时间的清除率无显著性差异,7 d为76%,10 d为77%,14 d为82%。对2000年以来的4个RCTs进行系统回顾,确定了(两个来自亚洲[173-174],两个来自欧洲[175-176])比较了14 d与7 d铋剂四联疗法,14 d铋剂四联疗法的根除率更高(RR=1.14,95%CI:1.02~1.28)。鉴于通过延长疗程可部分克服甲硝唑耐药[151-152],14 d铋剂四联补救方案是合理的。
自2000年以来,共有11个RCTs进行作为补救治疗的14 d铋剂四联疗法与其他治疗方案的比较,其中一个在美国[177],三个在欧洲[175-176,178]和其余七个在亚洲[173,179-184]。这些研究中的八个研究包含了使用克拉霉素三联疗法治疗一次根除失败的患者。美国唯一研究[177]包括多种方案中的一种治疗方案治疗失败的患者(有67%的患者是选择铋剂四联疗法或雷尼替丁枸橼酸铋、甲硝唑、四环素方案治疗后失败)。一个来自欧洲[178],一个来自亚洲[179]的两项研究也是一种或多种根除治疗失败的患者。14 d铋剂四联疗法的合并根除率为80%(95%CI:76%~84%),与欧洲或美国相比(74%;68%~81%),来自亚洲研究根除率更高(82%;77%~86%)。美国[177]14 d铋剂四联疗法的根除率为71%,但对于曾使用7~14 d铋剂四联治疗失败的患者(根除率53%;28%~77%)和不含铋剂的三联或双联克拉霉素治疗失败的患者(根除率100%,72%~100%)根除率存在差别。
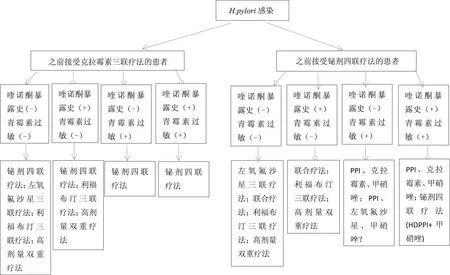
注:(-)表示无;(+)表示有。
发表自2000年以来的15个RCTs比较了作为补救治疗时的左氧氟沙星三联疗法和其他方案。只有一个研究评估了14 d左氧氟沙星三联疗法;它研究了台湾101例7 d克拉霉素三联疗法治疗失败的患者,发现7 d左氧氟沙星三联疗法和14 d左氧氟沙星三联疗法(86%,95%CI:77%~96%)和14 d铋剂四联疗法(PBMT,86%,76%~96%)之间的根除率无显著性差异[181]。4个在欧洲进行的RCTs评估了为期10 d的左氧氟沙星三联疗法方案[176,185-187],发现合并根除率为84%(73%~92%)。10个RCTs(7个来自亚洲,3个来自欧洲)评估了7 d的左氧氟沙星三联疗法,合并根除率为66%(95%CI:60%~73%),亚洲和欧洲之间的研究无显著性差异。RCTs的队列研究和类似研究的荟萃分析表明,在19项研究中克拉霉素三联疗法治疗失败后再使用左氧氟沙星三联疗法,其根除率为76%(95%CI:72%~81%);在5项研究中,序贯疗法治疗失败后再使用左氧氟沙星三联疗法,其根除率为81%(95%CI:71%~91%)[172]。
左氧氟沙星三联疗法作为三线治疗方案似乎有效,Gisbert等[188]总结了欧洲6个队列研究,为两次治疗失败后选择10 d左氧氟沙星三联疗法(大多数患者选择克拉霉素三联疗法作为一线治疗,铋剂四联疗法作为二线治疗),总清除率为73%。
关于左氧氟沙星三联补救治疗最合适的治疗时间,对来自于本指南的荟萃分析进行的亚组分析(所做的研究之间比较)表明,10 d或14 d的左氧氟沙星三联疗法比7 d左氧氟沙星三联疗法更有效。只有一个RCTs比较了左氧氟沙星三联疗法治疗时间的差异;Di Caro等[186]比较了在意大利两种类型的10 d PAL方案和两种类型的7 d PAL方案,发现持续时间较长的疗效更好(88%vs78%)。来自土耳其的RCTs证实了这一观点,PAL作为一线治疗时间较长时,其疗效更好(14 d的治疗方案清除率为72%,7 d治疗时其清除率为34%)[189]。
左氧氟沙星的最佳剂量尚不清楚。两个RCTs评估了在补救治疗时不同剂量的左氧氟沙星,发现500 mg左氧氟沙星每日1次或2次在7 d治疗方案和10 d治疗方案中无显著差异[186,190]。
即使铋剂四联疗法用于治疗的初始过程,左氧氟沙星三联疗法依然可用于持续性H.pylori感染的患者。在64例持续性H.pylori感染的青霉素过敏患者中,尽管一线治疗中使用了秘剂四联疗法或甲硝唑-克拉霉素三联疗法,10 d的左氧氟沙星-克拉霉素三联疗法还具有64%的根除率[191]。在同一试验中,甲硝唑-克拉霉素为基础的三联疗法治疗失败后给予铋剂四联疗法,其根除率为37%(24例中有9例治愈)。曾报道过28例日本青霉素过敏患者(包括17例之前未能根除患者),使用1周或2周的PPI、甲硝唑和西他沙星方案,其根除率为100%(95%CI:90%~100%)[192]。西他沙星是一种对H.pylori具有高抗菌活性的喹诺酮类药物,甚至对左氧氟沙星耐药菌株也有很好的疗效;但目前在北美尚未使用。
伴同疗法
自2000年以来,只有两个RCTs比较了作为补救治疗的伴同疗法与另外一种补救治疗方案[193-194]。两个试验中的患者都是接受一线克拉霉素三联疗法失败的患者。日本试验随机选取了104例患者分别给于7 d PPI、阿莫西林、甲硝唑三联疗法或7 d伴同疗法,发现其根除率分别为83%(95%CI:73%~93%)和89%(95%CI:80%~97%)。然而,这些结果不一定适用于其他国家;日本的H.pylori对甲硝唑的耐药率较低,因此含甲硝唑治疗方案的疗效在日本特别高,这反过来又可能是由于甲硝唑在全国限制使用[195]。在韩国的试验,随机选取124例患者接受10 d铋剂四联疗法或10 d伴同治疗,发现其根除率大致一样(根除率分别为92%和90%)[194]。
间接证据表明,伴同疗法作为一线治疗和作为二线治疗疗效相似。首先,它是一种最有效的一线治疗方案之一[129]。其次,来自西班牙和台湾的有限数据表明,对克拉霉素和甲硝唑都耐药的患者,伴同疗法仍有效[196-197]。
关于伴同疗法最佳疗程的证据很有限。无RCTs比较作为补救治疗时的治疗时间。RCTs的19个队列研究和系统评价表明,作为一线治疗时,随着治疗时间延长,伴同疗法疗效无显著增加,3 d(85%)、4 d(88%)、5 d(83%)、7 d(91%)和10 d(90%)[129]。
克拉霉素三联疗法
在北美的临床实践中,克拉霉素常用于一线治疗,除非患者具有高风险的克拉霉素耐药。从理论上讲,无证据显示需要避免克拉霉素用于二线治疗。指南委员会推荐采用包含克拉霉素的伴同疗法,而不是克拉霉素三联疗法。
支持克拉霉素三联疗法作为补救治疗的证据是有限的。2000年以后,在美国或欧洲的三个RCTs评估了作为二线治疗时的PPI、克拉霉素、阿莫西林三联疗法[177,198-199];而没有作为二线治疗用甲硝唑取代阿莫西林的三联疗法的相关报道。在美国,Magaret等[177]所做RCTs结果,将接受过一种一线治疗失败的患者随机分为14 d PAC或14 d铋剂四联疗法。虽然文中没有报道,但其中32例患者接受10~14 d铋剂四联疗法或7~10 d雷尼替丁、枸橼酸铋、甲硝唑、四环素作为一线治疗,克拉霉素三联疗法根除率为79%(95%CI:49%~95%),铋剂四联疗法(P=NS)根除率为53%(28%~77%)。在德国所做的RCTs[198],84例患者接受一线的7 d PPI、克拉霉素、甲硝唑治疗失败;毫无疑问,7 d克拉霉素三联疗法要劣于7 d铋剂四联疗法[43%(28%~59%)和68%(51%~81%),P=0.03],在一线治疗后79%有克拉霉素耐药菌株的患者中差异更明显。法国RCTs表明[199],172例患者在一线克拉霉素三联疗法(克拉霉素三联疗法为87%,PPI、阿莫西林、甲硝唑为7%,克拉霉素三联疗法+甲硝唑3%,H2RA、克拉霉素、阿莫西林3%)失败后,7 d或14 d的PPI、克拉霉素和阿莫西林三联疗法与14 d的PPI、克拉霉素、甲硝唑三联相比有较低的清除率(47%vs63%)。
综上所述,应避免重复使用三联疗法作为补救治疗。RCTs队列研究荟萃分析表明,所进行的8项重复使用克拉霉素三联疗法作为二线治疗的研究(同方案一线治疗失败后)中,其合并根除率非常低(46%;95%CI:34%~58%)[172]。
基于利福布汀的三联疗法(PPI、阿莫西林、利福布汀:PAR)
利福布丁在H.pylori感染治疗中的疗效应和其高成本相平衡,它很少发生骨髓抑制(几乎总是可逆)和诱导结核分枝杆菌菌株耐药[200-201]。
4个RCTs比较由PPI、利福布汀、阿莫西林组成的利福布汀三联疗法与其他治疗方案[171,202-204]。Perri等[204]在欧洲对接受1~3种一线治疗失败患者135例进行一个RCTs,评估了10 d利福布汀三联疗法。300 mg/d利福布汀的10 d三联疗法(利福布汀三联疗法根除率87%;95%CI:76%~96%)150 mg/d 10 d疗法和10 d铋剂四联治疗更有效,后两者有相同的67%清除率(95%CI:53%~80%)。其他三个RCTs,包括欧洲的两个[171,203]和亚洲一个[202],评估了7 d 150 mg bid利福布汀的三联疗法;合并根除率为66%(45%~83%),但这些研究存在大量异质性。在西班牙,Navarro等[174]发现利福布丁三联疗法的清除率低于其他的RCTs:99例克拉霉素三联疗法失败的患者,7 d利福布丁三联疗法根除率为44%,明显低于7 d铋剂四联疗法(根除率70%)。
RCTs队列研究荟萃分析表明,使用PAR作为补救治疗,作为二线治疗时其合并根除率为79%(95%CI:67%~92%),作为三线治疗根除率为66%(55%~77%),作为四线或五线治疗为70%(60%~79%)[200]。
很少有证据显示PAR作为补救治疗的最佳治疗时间。还没有RCTs比较不同的治疗时间。亚组(研究间比较)间荟萃分析表明,当PAR作为二线治疗时,10~12 d治疗方案根除率高于7 d治疗方案(95%vs69%)。值得注意的是,发生骨髓抑制的概率很低,即使利福布丁>600 mg/d的剂量或长期使用[200]。因此,利福布丁三联疗法的推荐剂量为300 mg/d,持续时间10 d为宜。
阿莫西林高剂量二联疗法
高剂量二联治疗作为补救治疗的原因是:H.pylori很少发展为阿莫西林耐药[122],阿莫西林的疗效随胃pH值增加而增加[205]。
自2000年以来,有三个RCTs比较了作为补救治疗时14 d高剂量双重疗法(每日阿莫西林≥3 g/d,每日给药≥3/次以试图避免每日2次阿莫西林的低水平)与其他方案[178,203,206]。其中两项研究由Miehlke等在德国进行。第一项研究包括至少一种治疗失败的84例患者(大多数患者有两种或两种以上治疗失败),并比较了14 d 的高剂量二联疗法(奥美拉唑40 mg和750 mg阿莫西林,qid)与14 d铋剂四联疗法。两种方案根除率无显著性差异(双重疗法:76%,95%CI:60%~88%,铋剂四联疗法:81%,95%CI:67%~92%)[178]。第二项研究纳入145例,至少有根除失败一次且甲硝唑与克拉霉素双耐药)的患者,随机分到14 d高剂量二联治疗或7 d利福布丁三联疗法。两组之间比较差异无显著性(双重治疗:70%,95%CI:58%~80%与利福布丁三联疗法:74%,62%~84%)[203]。通过荟萃分析,在欧洲高剂量双重补救治疗的合并根除率为71%(63%~79%)。最后,Yang等[206]在台湾的研究,包括168例一种或多种先前根除失败的患者,发现14 d高剂量双重疗法(雷贝拉唑20 mg、阿莫西林750 mg,qid)的根除率为89%(81%~98%),和7 d左氧氟沙星三联疗法无显著差异(79%,67%~90%),但明显高于10 d序贯疗法(52%,38%~65%)。在所有三项研究中,高剂量二联补救治疗的合并根除率为78%(95%CI:65%~89%)。
值得注意的是,其他三个研究均来自日本,评估10~14 d的高剂量二联补救方案,本方案包含高剂量PPI(标准剂量但4次/d)与标准剂量阿莫西林(即500 mg 4次/d)[207-209]。这些研究结果具有高度异质性,根除率分别为0、54%和91%。
其他补救的治疗:序贯疗法、混合疗法、含呋喃唑酮方案序贯疗法主要作为一线治疗,只有两个RCTs评估其作为补救治疗的疗效,结果令人沮丧。一个在台湾进行的RCTs,共纳入168例一种或多种方案根除治疗失败的患者;10 d序贯疗法根除率(52%,95%CI:38%~65%)显著低于14 d高剂量双重阿莫西林治疗(89%,81%~98%)或7 d左氧氟沙星三联疗法(79%,67%~90%)[206]。另一个RCTs在韩国进行,包括158例克拉霉素三联疗法治疗失败的患者;10 d序贯疗法明显不如10 d铋剂四联疗法(根除率57%vs84%)[210]。由于缺乏来自北美的数据和令人沮丧的亚洲数据,不推荐序贯疗法为补救治疗。
表4H.pylori感染的补救治疗
Tab 4 Salvage therapies forH.pyloriinfection

方案药物(剂量)使用频率疗程(d)FDA批准铋剂四联疗法PPI(标准剂量)BID14否a枸橼酸铋钾(120~300mg)或次水杨酸铋(300mg)QID四环素(500mg)QID甲硝唑(500mg)TIDorQID左氧氟沙星三联疗法PPI(标准剂量)BID14否左氧氟沙星(500mg)QD阿莫西林(1grm)BID伴同疗法PPI(标准剂量)BID10~14否克拉霉素(500mg)BID阿莫西林(1grm)BID硝基咪唑(500mg)BIDorTID利福布汀三联疗法PPI(标准剂量)BID利福布汀(300mg)QD阿莫西林(1grm)BID高剂量双联疗法PPI(标准或双倍剂量)TIDorQID14否阿莫西林(1grmTID或750mgQID)TIDorQID
注:BID:2次/d;FDA:食品与药物管理局;PPI:质子泵抑制剂;TID:3次/d;QD:1次/d;QID:4次/d。a:PPI、铋、四环素和甲硝唑单独规定不是FDA批准的治疗方案。然而,Pylera,一个含铋、四环素结合的产物,与甲硝唑结合PPI 10 d是FDA批准的治疗方案。
我们未检索到作为补救治疗的混合疗法与其他方案的比较资料。因此,无足够证据支持混合疗法可作为补救治疗。
目前在美国不能使用硝基呋喃类抗生素呋喃唑酮。无文献显示呋喃唑酮在北美洲可用于补救治疗。来自俄罗斯、爱尔兰和澳大利亚的非随机研究利用3种和4种药物方案,报道显示呋喃唑酮补救治疗方案的ITT根除率为60%~86%[211-213]。有关呋喃唑酮作为补救治疗时的疗效及其危害(包括低血压、荨麻疹、胃肠道症状和可逆性溶血)缺少RCTs,使它不可能推荐作为补救治疗。
问题9:在H.pylori感染的患者中,如何考虑青霉素过敏者?(见表1)
阿莫西林是治疗H.pylori感染的一线治疗和补救治疗的重要药物。幸运的是,有许多已获证明的方案不包含阿莫西林,这些方案(尤其是铋剂四联疗法)可用于真正过敏患者。如果“青霉素过敏”的患者尝试1~2次根除治疗均失败,最好考虑患者是否有真正的青霉素过敏。许多研究表明,虽然5%~10%的美国人表示他们对青霉素过敏,但这些患者中有90%的人皮试为阴性,并且能耐受青霉素而不过敏[214]。此外,对证实过敏的患者,逃避使用青霉素在美国是公认的一个公共健康问题,它促使非β-内酰胺类抗生素的过度使用(http://www.choosingwisely.org/clinician-lists/american-academy-allergy-asthma-immunlogynon beta-lactam-antibiotics-penicillin-allergy/)。因此,这些“青霉素过敏”患者的皮肤测试可发现大多数非真正的过敏。排除真正过敏的患者后,他们可安全地使用含有阿莫西林的补救治疗。
总结
自2007版ACG指南出版以来,H.pylori感染治疗可选方案大幅增加(见表2、表4)。所有现代治疗方案,包括伴同疗法、混合疗法、包含左氧氟沙星的方案,已被国际研究证实最有效,但在北美洲未进行相关评估。因此在北美,关于这些治疗方案的有效性,我们不可能给出有足够证据的建议。由于伴同疗法、序贯疗法和混合疗法一般都是由相同的四种药物组成,现有数据表明它们的疗效和耐受性类似,因此相对简单实用的方案更具有重要性。因此,克拉霉素四联的伴同疗法似乎为一线和补救治疗的最佳选择。关于左氧氟沙星治疗方案,尚无在北美进行的评估,基于已有的国际试验,我们认为左氧氟沙星序贯疗法是最强有力的一线疗效数据。目前,从循证角度考虑左氧氟沙星三联疗法仍是可选的补救治疗方案。我们鼓励临床医师根据当地抗生素耐药性数据选择治疗方案。因在大多数北美地区缺乏相关数据,因此推荐临床医师在选择治疗方案时询问既往抗生素暴露史和是否有青霉素过敏。这些信息可用来缩小个体患者的治疗选择。
本指南与最近公布多伦多治疗成人H.pylori感染的共识具有一致性,但多伦多共识仅局限于治疗选择[215]。这两个指南都试图限制克拉霉素三联疗法的使用,并强调铋剂四联疗法和伴同疗法的作用。这两个指南都提倡选择治疗时间较长的方案(多伦多共识建议均治疗14 d;ACG指南建议均治疗10~14 d)。两个指南之间存在差异很小,且受到区域限制,是低质量证据。多伦多共识建议反对使用序贯疗法(不作为一线治疗和补救治疗),而ACG指南有条件地推荐作为一线治疗。混合疗法和高剂量二联疗法未经过多伦多共识认可,而ACG指南推荐作为一线治疗和补救治疗。
鉴于抗生素耐药性几率的上升和H.pylori治疗的复杂性[216],预防或治疗性疫苗对于H.pylori感染管理仍是一个有吸引力的长期解决方案。虽然进展缓慢,Zeng等[217]目前在中国进行的3期临床试验为H.pylori疫苗提供了方向性证据。在这份报告中,基于重组尿素酶B的口服H.pylori疫苗为儿童提供了约70%的保护。尽管一年后该疫苗疗效开始减弱,但这一具有里程碑意义的研究将可能促使进一步研发能用于临床上的疫苗,并促进抗生素替代疗法的进展来预防H.pylori相关疾病,而不仅仅是清除已有的H.pylori感染。
鸣谢:这个指南是与美国胃肠病学会实践委员会合作产生。Erik-Jan Wamsteker MD在本指南指标监控方面做出了巨大贡献,我们对此特别感谢。
[1]Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations [J]. BMJ, 2008, 336(7650): 924-926.
[2]Opekun AR, Gilger MA, Denyes SM, et al. Helicobacter pylori infection in children of Texas [J]. J Pediatr Gastroenterol Nutr, 2000, 31(4): 405-410.
[3]Parkinson AJ, Gold BD, Bulkow L, et al. High prevalence of Helicobacter pylori in the Alaska native population and association with low serum ferritin levels in young adults [J]. Clin Diagn Lab Immunol, 2000, 7(6): 885-888.
[4]Malaty HM, El-Kasabany A, Graham DY, et al. Age at acquisition of Helicobacter pylori infection: a follow-up study from infancy to adult hood [J]. Lancet, 2002, 359(9310): 931-935.
[5]Sinha SK, Martin B, Gold BD, et al. The incidence of Helicobacter pylori acquisition in children of a Canadian First Nations community and the potential for parent-to-child transmission [J]. Helicobacter, 2004, 9(1): 59-68.
[6]Schwarz S, Morelli G, Kusecek B, et al. Horizontal versus familial transmission of Helicobacter pylori [J]. PLoS Pathog, 2008, 4(10): e1000180.
[7]Bruce MG, Maaroos HI. Epidemiology of Helicobacter pylori infection [J]. Helicobacter, 2008, 13 Suppl 1: 1-6.
[8]Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection [J]. Helicobacter, 2014, 19 Suppl 1: 1-5.
[9]Ford AC, Forman D, Bailey AG, et al. Effect of sibling number in the household and birth order on prevalence of Helicobacter pylori: a cross-sectional study [J]. Int J Epidemiol, 2007, 36(6): 1327-1333.
[10]Weyermann M, Rothenbacher D, Brenner H. Acquisition of Helicobacter pylori infection in early childhood: independent contributions of infected mothers, fathers, and siblings [J]. Am J Gastroenterol, 2009, 104(1): 182-189.
[11]Krumbiegel P, Lehmann I, Alfreider A, et al. Helicobacter pylori determination in non-municipal drinking water and epidemiological findings [J]. Isotopes Environ Health Stud, 2004, 40(1): 75-80.
[12]de Martel C, Parsonnet J. Helicobacter pylori infection and gender: a meta-analysis of population-based prevalence surveys [J]. Dig Dis Sci, 2006, 51(12): 2292-2301.
[13]Naja F, Kreiger N, Sullivan T. Helicobacter pylori infection in Ontario: prevalence and risk factors [J]. Can J Gastroenterol, 2007, 21(8): 501-506.
[14]Nguyen T, Ramsey D, Graham D, et al. The prevalence of Helicobacter pylori remains high in African American and Hispanic veterans [J]. Helicobacter, 2015, 20(4): 305-315.
[15]Everhart JE, Kruszon-Moran D, Perez-Perez GI, et al. Seroprevalence and ethnic differences in Helicobacter pylori infection among adults in the United States [J]. J Infect Dis, 2000, 181(4): 1359-1363.
[16]Epplein M, Cohen SS, Sonderman JS, et al. Neighborhood socio-economic characteristics, African ancestry, and Helicobacter pylori seroprevalence [J]. Cancer Causes Control, 2012, 23(6): 897-906.
[17]Epplein M, Signorello LB, Zheng W, et al. Race, African ancestry, and Helicobacter pylori infection in a low-income United States population [J]. Cancer Epidemiol Biomarkers Prev, 2011, 20(5): 826-834.
[18]Goodman KJ, Jacobson K, Veldhuyzen van Zanten S. Helicobacter pylori infection in Canadian and related Arctic Aboriginal populations [J]. Can J Gastroenterol, 2008, 22(3): 289-295.
[19]Cardenas VM, Mena KD, Ortiz M, et al. HyperendemicH.pyloriand tapeworm infections in a U.S.-Mexico border population [J]. Pub Health Reports, 2010, 125(3): 441-447.
[20]Goodman KJ, O'Rourke K, Day RS, et al. Helicobacter pylori infection inpregnant women from a U.S.-Mexico border population [J]. J Immigr Health, 2003, 5(6): 99-107.
[21]Cheung J, Goodman KJ, Girgis S, et al. Disease manifestations of Helicobacter pylori infection in Arctic Canada: using epidemiology to address community concerns [J]. BMJ Open, 2014, 4(1): e003689.
[22]Peleteiro B, Bastos A, Ferro A, et al. Prevalence of Helicobacter pylori infection worldwide: a systematic review of studies with national coverage [J]. Dig Dis Sci, 2014, 59(8): 1698-1709.
[23]Siao D, Somsouk M. Helicobacter pylori: evidence-based review with a focus on immigrant populations [J]. J Gen Intern Med, 2014, 29: 520-528.
[24]Perez-Perez GI, Olivares AZ, Foo FY, et al. Seroprevalence of Helicobacter pylori in New York City populations originating in East Asia [J]. J Urban Health, 2005, 82(3): 510-526.
[25]Tsai CJ, Perry S, Sanchez L, et al. Helicobacter pylori infection in different generations of Hispanics in the San Francisco Bay Area [J]. Am J Epidemiol, 2005, 162(4): 351-357.
[26]Chey WD, Wong BC, Practice Parameters Committee of the American College of Gastroenterology. American College of Gastroenterology guideline on the management of Helicobacter pylori infection [J]. Am J Gastroenterol, 2007, 102(8): 1808-1825.
[27]Leontiadis GI, Moayyedi P, Ford AC. Helicobacter pylori infection [J]. BMJ Clin Evid, 2009, pii: 0406.
[28]Nakamura S, Sugiyama T, Matsumoto T, et al. Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicentre cohort follow-up study of 420 patients in Japan [J]. Gut, 2012, 61(4): 507-513.
[29]Wundisch T, Dieckhoff P, Greene B, et al. Second cancers and residual disease in patients treated for gastric mucosa-associated lymphoid tissue lymphoma by Helicobacter pylori eradication and followed for 10 years [J]. Gastroenterology, 2012, 143(4): 936-942. quiz e13-e14.
[30]Ferreri AJ, Govi S, Ponzoni M. The role of Helicobacter pylori eradication in the treatment of diffuse large B-cell and marginal zone lymphomas of the stomach [J]. Curr Opin Oncol, 2013, 25(5): 470-479.
[31]Bang CS, Baik GH, Shin IS, et al. Helicobacter pylori eradication for prevention of metachronous recurrence after endoscopic resection of early gastric cancer [J]. J Korean Med Sci, 2015, 30(6): 749-756.
[32]Jung DH, Kim JH, Chung HS, et al. Helicobacter pylori eradication on the prevention of metachronous lesions after endoscopic resection of gastric neoplasm: a meta-analysis [J]. PLoS One, 2015, 10(4): e0124725.
[33]Yoon SB, Park JM, Lim CH, et al. Effect of Helicobacter pylori eradicationon metachronous gastric cancer after endoscopic resection of gastric tumors: a meta-analysis [J]. Helicobacter, 2014, 19(4): 243-248.
[34]Lee YC, Chiang TH, Chou CK, et al. Association between Helicobacter pylori eradication and gastric cancer incidence: a systematic review and meta-analysis [J]. Gastroenterology, 2016, 150(5): 1113-1124. e5.
[35]Harvey RF, Lane JA, Nair P, et al. Clinical trial: prolonged beneficial effect of Helicobacter pylori eradication on dyspepsia consultations-the Bristol Helicobacter Project [J]. Aliment Pharmacol Ther, 2010, 32(3): 394-400.
[36]Delaney B, Ford AC, Forman D, et al. Initial management strategies for dyspepsia [J]. Cochrane Database Syst Rev, 2005, (4): CD001961.
[37]Ford AC, Moayyedi P, Jarbol DE, et al. Meta-analysis: Helicobacter pylori 'test and treat' compared with empirical acid suppression for managing dyspepsia [J]. Aliment Pharmacol Ther, 2008, 28(5): 534-544.
[38]Ford AC, Qume M, Moayyedi P, et al. Helicobacter pylori "test and treat" or endoscopy for managing dyspepsia: an individual patient data meta-analysis [J]. Gastroenterology, 2005, 128(7): 1838-1844.
[39]Moayyedi P, Soo S, Deeks J, et al. Eradication of Helicobacter pylori for non-ulcer dyspepsia [J]. Cochrane Database Syst Rev, 2006, (2): CD002096.
[40]Suzuki H, Moayyedi P. Helicobacter pylori infection in functional dyspepsia [J]. Nat Rev Gastroenterol Hepatol, 2013, 10(3): 168-174.
[41]Stanghellini V, Chan FK, Hasler WL, et al. Gastroduodenal disorders [J]. Gastroenterology, 2016, 150(6): 1380-1392.
[42]Yang YX, Brill J, Krishnan P, et al. American Gastroenterological Association Institute Guideline on the role of upper gastrointestinal biopsy to evaluate dyspepsia in the adult patient in the absence of visible mucosal lesions [J]. Gastroenterology, 2015, 149(4): 1082-1087.
[43]Moayyedi P. American College of Gastroenterology and Candian Association of Gastroenterology guidelines on the management of dyspepsia [J]. Am J Gastroenterol, 2017.
[44]Hong SJ, Kim SW. Helicobacter pylori infection in gastroesophageal reflux disease in the Asian Countries [J]. Gastroenterol Res Pract, 2015, 2015: 985249.
[45]Gatenby P, Soon Y. Barrett's oesophagus: evidence from the current meta-analyses [J]. World J Gastrointest Pathophysiol, 2014, 5: 178-187.
[46]Vakil N, Talley NJ, Stolte M, et al. Patterns of gastritis and the effect of eradicating Helicobacter pylori on gastrooesophageal reflux disease in Western patients with non-ulcer dyspepsia [J]. Aliment Pharmacol Ther, 2006, 24(1): 55-63.
[47]Laine L, Sugg J. Effect of Helicobacter pylori eradication on development of erosive esophagitis and gastroesophageal reflux disease symptoms: a posthoc analysis of eight double blind prospective studies [J]. Am J Gastroenterol, 2002, 97(12): 2992-2997.
[48]Harvey RF, Lane JA, Murray LJ, et al. Randomised controlled trial of effects of Helicobacter pylori infection and its eradication on heart-burn and gastro-oesophageal reflux: Bristol helicobacter project [J]. BMJ, 2004, 328(7453): 1417.
[49]Raghunath AS, Hungin AP, Wooff D, et al. Systematic review: the effect of Helicobacter pylori and its eradication on gastro-oesophageal reflux disease in patients with duodenal ulcers or reflux oesophagitis [J]. Aliment Pharmacol Ther, 2004, 20(7): 733-744.
[50]Pilotto A, Perri F, Leandro G, et al. Effect of Helicobacter pylori eradication on the outcome of reflux esophagitis and chronic gastritis in the elderly. A randomized, multicenter, eight-month study [J]. Gerontology, 2006, 52(2): 99-106.
[51]Schwizer W, Menne D, Schutze K, et al. The effect of Helicobacter pylori infection and eradication in patients with gastro-oesophageal reflux disease: A parallel-group, double-blind, placebo-controlled multicentre study [J]. United European Gastroenterol J, 2013, 1(4): 226-235.
[52]Xue Y, Zhou LY, Lin SR, et al. Effect of Helicobacter pylori eradication on reflux esophagitis therapy: a multi-center randomized control study [J]. Chin Med J (Engl), 2015, 128(8): 995-999.
[53]Kuipers EJ, Lundell L, Klinkenberg-Knol EC, et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication [J]. N Engl J Med, 1996, 334(16): 1018-1022.
[54]Moayyedi P, Wason C, Peacock R, et al. Changing patterns of Helicobacter pylori gastritis in long-standing acid suppression [J]. Helicobacter, 2000, 5(4): 206-214.
[55]Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection--the Maastricht IV/Florence Consensus Report [J]. Gut, 2012, 61(5): 646-664.
[56]Bhatt DL, Scheiman J, Abraham NS, et al. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents [J]. J Am Coll Cardiol, 2008, 52(18): 1502-1517.
[57]Lanas A, Fuentes J, Benito R, et al. Helicobacter pylori increases the risk of upper gastrointestinal bleeding in patients taking low-dose aspirin [J]. Aliment Pharmacol Ther, 2002, 16(4): 779-786.
[58]Stack WA, Atherton JC, Hawkey GM, et al. Interactions between Helicobacter pylori and other risk factors for peptic ulcer bleeding [J]. Aliment Pharmacol Ther, 2002, 16(3): 497-506.
[59]Yeomans ND, Lanas AI, Talley NJ, et al. Prevalence and incidence of gastroduodenal ulcers during treatment with vascular protective doses of aspirin [J]. Aliment Pharmacol Ther, 2005, 22(9): 795-801.
[60]Chan FK, Ching JY, Suen BY, et al. Effects of Helicobacter pylori infection on long-term risk of peptic ulcer bleeding in low-dose aspirin users [J]. Gastroenterology, 2013, 144(3): 528-535.
[61]Abraham NS, Hlatky MA, Antman EM, et al. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use [J]. Am J Gastroenterol, 2010, 105(12): 2533-2549.
[62]Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis [J]. Lancet, 2002, 359(9300): 14-22.
[63]Lanza FL, Chan FK, Quigley EM. Guidelines for prevention of NSAID-related ulcer complications [J]. Am J Gastroenterol, 2009, 104(3): 728-738.
[64]Chan FK, Sung JJ, Chung SC, et al. Randomised trial of eradication of Helicobacter pylori before non-steroidal anti-inflammatory drug therapy to prevent peptic ulcers [J]. Lancet, 1997, 350(9083): 975-979.
[65]Chan FK, To KF, Wu JC, et al. Eradication of Helicobacter pylori and risk of peptic ulcers in patients starting long-term treatment with non-steroidal anti-inflammatory drugs: a randomised trial [J]. Lancet, 2002, 359(9300): 9-13.
[66]Vergara M, Catalan M, Gisbert JP, et al. Meta-analysis: role of Helicobacter pylori eradication in the prevention of peptic ulcer in NSAID users [J]. Aliment Pharmacol Ther, 2005, 21(12): 1411-1418.
[67]Leontiadis GI, Sreedharan A, Dorward S, et al. Systematic reviews of the clinical effectiveness and cost-effectiveness of proton pump inhibitors in acute upper gastrointestinal bleeding [J]. Health Technol Assess, 2007, 11(51): iii-iv, 1-164.
[68]Lai KC, Lau CS, Ip WY, et al. Effect of treatment of Helicobacter pylori on the prevention of gastroduodenal ulcers in patients receiving long-term NSAIDs: a double-blind, placebo-controlled trial [J]. Aliment Pharmacol Ther, 2003, 17(6): 799-805.
[69]de Leest HT, Steen KS, Lems WF, et al. Eradication of Helicobacter pylori does not reduce the incidence of gastroduodenal ulcers in patients on long-term NSAID treatment: double-blind, randomized, placebo-con-trolled trial [J]. Helicobacter, 2007, 12(5): 477-485.
[70]Qu XH, Huang XL, Xiong P, et al. Does Helicobacter pylori infection play a role in iron deficiency anemia? A meta-analysis [J]. World J Gastroenterol, 2010, 16(7): 886-896.
[71]Xia W, Zhang X, Wang J, et al. Survey of anaemia and Helicobacter pylori infection in adolescent girls in Suihua, China and enhancement of iron intervention effects byH.pylorieradication [J]. Br J Nutr, 2012, 108(2): 357-362.
[72]Chen LH, Luo HS. Effects ofH.pyloritherapy on erythrocytic and iron parameters in iron deficiency anemia patients withH.pylori-positive chronic gastristis [J]. World J Gastroenterol, 2007, 13(40): 5380-5383.
[73]Yuan W, Li Y, Yang K, et al. Iron deficiency anemia in Helicobacter pylori infection: meta-analysis of randomized controlled trials [J]. Scand J Gastroenterol, 2010, 45(6): 665-676.
[74]Sakai K, Koichi F, Sozu T, et al. Eradication of Helicobacter pylori for iron deficiency [J]. Cochrane Database of Systematic Reviews, 2015, (1): CD011480.
[75]Jackson S, Beck PL, Pineo GF, et al. Helicobacter pylori eradication: novel therapy for immune thrombocytopenic purpura? A review of the literature [J]. Am J Hematol, 2005, 78(2): 142-150.
[76]Suzuki T, Matsushima M, Masui A, et al. Effect of Helicobacter pylori eradication in patients with chronic idiopathic thrombocytopenic purpura-arandomized controlled trial [J]. Am J Gastroenterol, 2005, 100: 1265-1270.
[77]Tsutsumi Y, Kanamori H, Yamato H, et al. Randomized study of Helicobacter pylori eradication therapy and proton pump inhibitor monotherapy for idiopathic thrombocytopenic purpura [J]. Ann Hematol, 2005, 84(12): 807-811.
[78]Jaing TH, Yang CP, Hung IJ, et al. Efficacy of Helicobacter pylori eradication on platelet recovery in children with chronic idiopathic thrombocy-topenic purpura [J]. Acta Paediatr, 2003, 92(10): 1153-1157.
[79]Stasi R, Sarpatwari A, Segal JB, et al. Effects of eradication of Helicobacter pylori infection in patients with immune thrombocytopenic purpura: a systematic review [J]. Blood, 2009, 113(6): 1231-1240.
[80]Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia [J]. Blood, 2011, 117(16): 4190-4207.
[81]Wang J, Xu L, Shi R, et al. Gastric atrophy and intestinal metaplasia before and after Helicobacter pylori eradication: a meta-analysis [J]. Digestion, 2011, 83(4): 253-260.
[82]Ford AC, Forman D, Hunt RH, et al. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomised controlled trials [J]. BMJ, 2014, 348: g3174.
[83]Leontiadis GI, Sharma VK, Howden CW. Non-gastrointestinal tract associations of Helicobacter pylori infection [J]. Arch Intern Med, 1999, 159(9): 925-940.
[84]Madisch A, Miehlke S, Neuber F, et al. Healing of lymphocytic gastritis after Helicobacter pylori eradication therapy--a randomized, double-blind, placebo-controlled multicentre trial [J]. Aliment Pharmacol Ther, 2006, 23(4): 473-479.
[85]Ji F, Wang ZW, Ning JW, et al. Effect of drug treatment on hyperplastic gastric polyps infected with Helicobacter pylori: a randomized, controlled trial [J]. World J Gastroenterol, 2006, 12(11): 1770-1773.
[86]Schulz C, Schütte K, Malfertheiner P. DoesH.pylorieradication therapy benefit patients with hepatic encephalopathy?: systematic review [J]. J Clin Gastroenterol, 2014, 48(6): 491-499.
[87]Li L, Li L, Zhou X. Helicobacter pylori infection is associated with an increased risk of hyperemesis gravidarum: a meta-analysis [J]. Gastroenterol Res Pract, 2015, 2015: 278905.
[88]Budzynski J, Kozinski M, Klopocka M, et al. Clinical significance of Helicobacter pylori infection in patients with acute coronary syndromes: an overview of current evidence [J]. Clin Res Cardiol, 2014, 103(11): 855-886.
[89]Rees K, Stowe R, Patel S, et al. Helicobacter pylori eradication for Parkin-son's disease [J]. Cochrane Database Syst Rev, 2011, (11): CD008453.
[90]Shakouri A, Compalati E, Lang DM, et al. Effectiveness of Helicobacter pylori eradication in chronic urticaria: evidence-based analysis using the grading of recommendations assessment, development, and evaluation system [J]. Curr Opin Allergy Clin Immunol, 2010, 10(4): 362-369.
[91]Dai YN, Yu WL, Zhu HT, et al. Is Helicobacter pylori infection associated with glycemic control in diabetics? [J]. World J Gastroenterol, 2015, 21(17): 5407-5416.
[92]Lender N, Talley NJ, Enck P, et al. Review article: associations between Helicobacter pylori and obesity--an ecological study [J]. Aliment Pharmacol Ther, 2014, 40(1): 24-31.
[93]McCune A, Lane A, Murray L, et al. Reduced risk of atopic disorders in adults with Helicobacter pylori infection [J]. Eur J Gastroenterol Hepatol, 2003, 15(6): 637-640.
[94]Taye B, Enquselassie F, Tsegaye A, et al. Is Helicobacter pylori infection inversely associated with atopy? A systematic review and meta-analysis [J]. Clin Exp Allergy, 2015, 45(5): 882-890.
[95]Dellon ES, Peery AF, Shaheen NJ, et al. Inverse association of esophageal eosinophilia with Helicobacter pylori based on analysis of a US pathology database [J]. Gastroenterology, 2011, 141(5): 1586-1592.
[96]Elitsur Y, Alrazzak BA, Preston D, et al. Does Helicobacter pylori protect against eosinophilic esophagitis in children? [J]. Helicobacter, 2014, 19(5): 367-371.
[97]Furuta K, Adachi K, Aimi M, et al. Case-control study of association of eosinophilic gastrointestinal disorders with Helicobacter pylori infection in Japan [J]. J Clin Biochem Nutr, 2013, 53(1): 60-62.
[98]Ronkainen J, Talley NJ, Aro P, et al. Prevalence of oesophageal eosinophils and eosinophilic oesophagitis in adults: the population-based Kalixanda study [J]. Gut, 2007, 56(5): 615-620.
[99]von Armin U, Wex T, Link A, et al. Helicobacter pylori infection is associated with a reduced risk of developing eosinophilic oesophagitis [J]. Aliment Pharmacol Ther, 2016, 43(7): 825-830.
[100]Van Zanten SV, Aplin L, Chang HJ, et al. Su1198 CommunityH.pyloriProject Treatment Trial results from the Canadian Arctic [J]. Gastroenterology, 2014, 146: S-400.
[101]Lebwohl B, Blaser MJ, Ludvigsson JF, et al. Decreased risk of celiac disease in patients with Helicobacter pylori colonization [J]. Am J Epidemiol, 2013, 178(12): 1721-1730.
[102]Rokkas T, Gisbert JP, Niv Y, et al. The association between Helicobacter pylori infection and inflammatory bowel disease based on meta-analysis [J]. United European Gastroenterol J, 2015, 3(6): 539-550.
[103]Li BZ, Threapleton DE, Wang JY, et al. Comparative effectiveness and tolerance of treatments for Helicobacter pylori: systematic review and network meta-analysis [J]. BMJ, 2015, 351: h4052.
[104]Coss E, Geta RM, Dunbar KB, et al. Sequential therapy is not better ateradication of primary Helicobacter pylori infection when compared to standard triple therapy in the United States-a prospective, randomized evaluation in a United States population [J]. Gastroenterology, 2014, 146: S-399.
[105]Fallone CA, Barkun AN, Szilagyi A, et al. Prolonged treatment duration is required for successful Helicobacter pylori eradication with proton pump inhibitor triple therapy in Canada [J]. Can J Gastroenterol, 2013, 27(7): 397-402.
[106]Basu PP, Rayapudi K, Pacana T, et al. A randomized study comparing levofloxacin, omeprazole, nitazoxanide, and doxycycline versus triple therapy for the eradication of Helicobacter pylori [J]. Am J Gastroenterol, 2011, 106(11): 1970-1975.
[107]Chen YK, Jajodia P, DeGuzman L, et al. Randomized controlled trial comparing proton pump inhibitor-based eradication regimens versus low-cost eradication regimen for patients with Helicobacter pylori with uninvestigated dyspepsia [J]. The Journal of Applied Research, 2006, 6(3): 214-222.
[108]Vakil N, Lanza F, Schwartz H, et al. Seven-day therapy for Helicobacter pylori in the United States [J]. Aliment Pharmacol Ther, 2004, 20(1): 99-107.
[109]Bochenek WJ, Peters S, Fraga PD, et al. Eradication of Helicobacterpylori by 7-day triple-therapy regimens combining pantoprazole with clarithromycin, metronidazole, or amoxicillin in patients with peptic ulcer disease: results of two double-blind, randomized studies [J]. Helicobacter, 2003, 8(6): 626-642.
[110]Veldhuyzen van Zanten S, Fedorak RN, Lambert J, et al. Absence of symptomatic benefit of lansoprazole, clarithromycin, and amoxicillin triple therapy in eradication of Helicobacter pylori positive, functional (nonulcer) dyspepsia [J]. Am J Gastroenterol, 2003, 98(9): 1963-1969.
[111]Lara LF, Cisneros G, Gurney M, et al. One-day quadruple therapy compared with 7-day triple therapy for Helicobacter pylori infection [J]. Arch Intern Med, 2003, 163(17): 2079-2084.
[112]Laine L, Hunt R, El-Zimaity H, et al. Bismuth-based quadruple therapy using a single capsule of bismuth biskalcitrate, metronidazole, and tetracycline given with omeprazole versus omeprazole, amoxicillin, and clarithromycin for eradication of Helicobacter pylori in duodenal ulcer patients: a prospective, randomized, multicenter, North American trial [J]. Am J Gastroenterol, 2003, 98(3): 562-567.
[113]Sullivan B, Coyle W, Nemec R, et al. Comparison of azithromycin and clarithromycin in triple therapy regimens for the eradication of Helicobacter pylori [J]. Am J Gastroenterol, 2002, 97(10): 2536-2539.
[114]Chiba N, Van Zanten SJ, Sinclair P, et al. Treating Helicobacter pylori infection in primary care patients with uninvestigated dyspepsia: the Canadian adult dyspepsia empiric treatment-Helicobacter pylori positive (CADET-Hp) randomised controlled trial [J]. BMJ, 2002, 324(7344): 1012-1016.
[115]Stevens VJ, Shneidman RJ, Johnson RE, et al. Helicobacter pylori eradication in dyspeptic primary care patients: a randomized controlled trial of a pharmacy intervention [J]. West J Med, 2002, 176(2): 92-96.
[116]Bardhan K, Bayerd?rffer E, Veldhuyzen Van Zanten SJ, et al. The HOMER study: the effect of increasing the dose of metronidazole when given with omeprazole and amoxicillin to cure Helicobacter pylori infection [J]. Helicobacter 2000, 5(4): 196-201.
[117]Veldhuyzen Van Zanten S, Lauritsen K, Delchier JC, et al. One-week triple therapy with esomeprazole provides effective eradication of Helicobacterpylori in duodenal ulcer disease [J]. Aliment Pharmacol Ther, 2000, 14(12): 1605-1611.
[118]Veldhuyzen Van Zanten S, Farley A, Marcon N, et al. Bismuth-based triple therapy with bismuth subcitrate, metronidazole and tetracycline in the eradication of Helicobacter pylori: a randomized, placebo controlled, double-blind study [J]. Can J Gastroenterol, 2000, 14(7): 599-602.
[119]Laine L, Fennerty MB, Osato M, et al. Esomeprazole-based Helicobacter pylori eradication therapy and the effect of antibiotic resistance: results of three US multi center, double-blind trials [J]. Am J Gastroenterol, 2000, 95(12): 3393-3398.
[120]Yuan Y, Ford AC, Khan KJ, et al. Optimum duration of regimens for Helicobacter pylori eradication [J]. Cochrane Database Syst Rev, 2013, (12): CD008337.
[121]Luther J, Higgins PD, Schoenfeld PS, et al. Empiric quadruple vs. triple therapy for primary treatment of Helicobacter pylori infection: Systematic review and meta-analysis of efficacy and tolerability [J]. Am J Gastroenterol, 2010, 105: 65-73.
[122]Shiota S, Reddy R, Alsarraj A, et al. Antibiotic resistance of Helicobacter pylori among male United States veterans [J]. Clin Gastroenterol Hepatol, 2015, 13(9): 1616-1624.
[123]McMahon BJ, Hennessy TW, Bensler JM, et al. The relationship among previous antimicrobial use, antimicrobial resistance, and treatment outcomes for Helicobacter pylori infections [J]. Ann Intern Med, 2003, 139(6): 463-469.
[124]Megraud F, Coenen S, Versporten A, et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption [J]. Gut, 2013, 62(1): 34-42.
[125]McNulty CA, Lasseter G, Shaw I, et al. Is Helicobacter pylori antibiotic resistance surveillance needed and how can it be delivered? [J]. Aliment Pharmacol Ther, 2012, 35(10): 1221-1230.
[126]Lim SG, Park RW, Shin SJ, et al. The relationship between the failure to eradicate Helicobacter pylori and previous antibiotics use [J]. Dig Liver Dis, 2016, 48(4): 385-390.
[127]Venerito M, Krieger T, Ecker T, et al. Meta-analysis of bismuth quadruple therapy versus clarithromycin triple therapy for empiric primary treatment of Helicobacter pylori infection [J]. Digestion, 2013, 88: 33-45.
[128]Treiber G, Ammon S, Schneider E, et al. Amoxicillin/metronidazole/omeprazole/clarithromycin: a new, short quadruple therapy for Helicobacter pylori eradication [J]. Helicobacter, 1998, 3(1): 54-58.
[129]Gisbert JP, Calvet X. Update on non-bismuth quadruple (concomitant) therapy for eradication of Helicobacter pylori [J]. Clin Exp Gastroenterol, 2012, 5: 23-34.
[130]Gatta L, Vakil N, Vaira D, et al. Global eradication rates for Helicobacter pylori infection: systematic review and meta-analysis of sequential therapy [J]. BMJ, 2013, 347: f4587.
[131]Greenberg ER, Anderson GL, Morgan DR, et al. 14-day triple, 5-day concomitant, and 10-day sequential therapies for Helicobacter pylori infection in seven Latin American sites: a randomised trial [J]. Lancet, 2011, 378(9790): 507-514.
[132]Zullo A, Rinaldi V, Winn S, et al. A new highly effective short-term therapy schedule for Helicobacter pylori eradication [J]. Aliment Pharmacol Ther, 2000, 14(6): 715-718.
[133]Gatta L, Vakil N, Leandro G, et al. Sequential therapy or triple therapy for Helicobacter pylori infection: systematic review and meta-analysis of randomized controlled trials in adults and children [J]. Am J Gastroenterol, 2009, 104(12): 3069-3079, quiz 1080.
[134]Liou JM, Chen CC, Chen MJ, et al. Sequential versus triple therapy for the first-line treatment of Helicobacter pylori: a multicentre, open-label, randomised trial [J]. Lancet, 2013, 381(9862): 205-213.
[135]Hsu PI, Wu DC, Wu JY, et al. Modified sequential Helicobacter pylori therapy: proton pump inhibitor and amoxicillin for 14 days with clarithromycin and metronidazole added as a quadruple (hybrid) therapy for the final 7 days [J]. Helicobacter, 2011, 16(2): 139-145.
[136]Wang B, Wang YH, Lv ZF, et al. Review: efficacy and safety of hybrid therapy for Helicobacter pylori infection: a systematic review and meta-analysis [J]. Helicobacter, 2015, 20(2): 79-88.
[137]He L, Deng T, Luo H. Meta-analysis of sequential, concomitant and hybrid therapy for Helicobacter pylori eradication [J]. Intern Med, 2015, 54(7): 703-710.
[138]Peedikayil MC, Alsohaibani FI, Alkhenizan AH. Levofloxacin-based first-line therapy versus standard first-line therapy for Helicobacter pylori eradication: meta-analysis of randomized controlled trials [J]. PLoS One, 2014, 9(1): e85620.
[139]Xiao SP, Gu M, Zhang GX. Is levofloxacin-based triple therapy an alternative for first-line eradication of Helicobacter pylori? A systematic review and meta-analysis [J]. Scand J Gastroenterol, 2014, 49(5): 528-538.
[140]Kale-Pradhan PB, Mihaescu A, Wilhelm SM. Fluoroquinolone sequential therapy for Helicobacter pylori: a meta-analysis [J]. Pharmacotherapy, 2015, 35(8): 719-730.
[141]Tveit AH, Bruce MG, Bruden DL, et al. Alaska sentinel surveillance study of Helicobacter pylori isolates from Alaska Native persons from 2000 to 2008 [J]. J Clin Microbiol, 2011, 49(10): 3638-3643.
[142]Eng NF, Ybazeta G, Chapman K, et al. Antimicrobial susceptibility of Canadian isolates of Helicobacter pylori in Northeastern Ontario [J]. Can J Infect Dis Med Microbiol, 2015, 26(3): 137-144.
[143]Wang ZH, Gao QY, Fang JY. Meta-analysis of the efficacy and safety of Lactobacillus-containing and Bifi dobacterium-containing probiotic compound preparation in Helicobacter pylori eradication therapy [J]. J Clin Gastroenterol, 2013, 47(1): 25-32.
[144]Zhang MM, Qian W, Qin YY, et al. Probiotics in Helicobacter pylori eradication therapy: a systematic review and meta-analysis [J]. World J Gastroenterol, 2015, 21(14): 4345-4357.
[145]Graham DY, Lew GM, Malaty HM, et al. Factors influencing the eradication of Helicobacter pylori with triple therapy [J]. Gastroenterology, 1992, 102(2): 493-496.
[146]Buring SM, Winner LH, Hatton RC, et al. Discontinuation rates of Helicobacter pylori treatment regimens: a meta-analysis [J]. Pharmacotherapy, 1999, 19(3): 324-332.
[147]Lee M, Kemp JA, Canning A, et al. A randomized controlled trial of an enhanced patient compliance program for Helicobacter pylori therapy [J]. Arch Intern Med, 1999, 159(19): 2312-2316.
[148]Tang HL, Li Y, Hu YF, et al. Effects of CYP2C19 loss-of-function variants on the eradication ofH.pyloriinfection in patients treated with proton pump inhibitor-based triple therapy regimens: a meta-analysis of randomized clinical trials [J]. PLoS One, 2013, 8(4): e62162.
[149]Suzuki T, Matsuo K, Ito H, et al. Smoking increases the treatment failure for Helicobacter pylori eradication [J]. Am J Med, 2006, 119(3): 217-224.
[150]Horikawa C, Kodama S, Fujihara K, et al. High risk of failing eradicationof Helicobacter pylori in patients with diabetes: a meta-analysis [J]. Diabetes Res Clin Pract, 2014, 106(1): 81-87.
[151]Dore MP, Leandro G, Realdi G, et al. Effect of pretreatment antibiotic resistance to metronidazole and clarithromycin on outcome of Helicobacter pylori therapy: a meta-analytical approach [J]. Dig Dis Sci, 2000, 45(1): 68-76.
[152]Fischbach L, Evans EL. Meta-analysis: the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori [J]. Aliment Pharmacol Ther, 2007, 26(3): 343-357.
[153]Graham DY, Lee YC, Wu MS. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence [J]. Clin Gastroenterol Hepatol, 2014, 12(2): 177-186.
[154]Kuo CH, Hu HM, Kuo FC, et al. Efficacy of levofloxacin-based rescue therapy for Helicobacter pylori infection after standard triple therapy: a randomized controlled trial [J]. J Antimicrob Chemother, 2009, 63(5): 1017-1024.
[155]Perna F, Zullo A, Ricci C, et al. Levofloxacin-based triple therapy for Helicobacter pylori re-treatment: role of bacterial resistance [J]. Dig Liver Dis, 2007, 39(11): 1001-1005.
[156]Smith SM, O'Morain C, McNamara D. Antimicrobial susceptibility testing for Helicobacter pylori in times of increasing antibiotic resistance [J]. World J Gastroenterol, 2014, 20(29): 9912-9921.
[157]Camargo MC, García A, Riquelme A, et al. The problem of Helicobacter pylori resistance to antibiotics: a systematic review in Latin America [J]. Am J Gastroenterol, 2014, 109(4): 485-495.
[158]Thung I, Aramin H, Vavinskaya V, et al. Review article: the global emergence of Helicobacter pylori antibiotic resistance [J]. Aliment Pharmacol Ther, 2016, 43(4): 514-533.
[159]Duck WM, Sobel J, Pruckler JM, et al. Antimicrobial resistance incidence and risk factors among Helicobacter pylori-infected persons, United States [J]. Emerg Infect Dis, 2004, 10(6): 1088-1094.
[160]Hicks LA, Taylor TH Jr, Hunkler RJ. U.S. outpatient antibiotic prescribing, 2010. [J]. N Engl J Med, 2013, 368(15): 1461-1462.
[161]Nishizawa T, Suzuki H. Mechanisms of Helicobacter pylori antibiotic resistance and molecular testing [J]. Front Mol Biosci, 2014, 1: 19.
[162]López-Góngora S, Puig I, Calvet X, et al. Systematic review and meta-analysis: susceptibility-guided versus empirical antibiotic treatment for Helicobacter pylori infection [J]. J Antimicrob Chemother, 2015, 70(9): 2447-2455.
[163]Fiorini G, Vakil N, Zullo A, et al. Culture-based selection therapy for patients who did not respond to previous treatment for Helicobacter pylori infection [J]. Clin Gastroenterol Hepatol, 2013, 11(5): 507-510.
[164]Liou JM, Chen CC, Chang CY, et al. Efficacy of genotypic resistance-guided sequential therapy in the third-line treatment of refractory Helicobacter pylori infection: a multicentre clinical trial [J]. J Antimicrob Chemother, 2013, 68(2): 450-456.
[165]McNicholl AG, Gasbarrini A, Tepes B, et al. Pan-European registry onH.pyloriManagement (HP-EuReg): Bacterial Resistance [J]. Gastroenterology, 2015, 148: S-417.
[166]Chey WD, Metz DC, Shaw S, et al. Appropriate timing of the 14C-ureabreath test to establish eradication of Helicobacter pylori infection [J]. Am J Gastroenterol, 2000, 95(5): 1171-1174.
[167]Laine L, Estrada R, Trujillo M, et al. Effect of proton-pump inhibitor therapy on diagnostic testing for Helicobacter pylori [J]. Ann Intern Med, 1998, 129(7): 547-550.
[168]Ofman J, Wallace J, Badamgarav E, et al. The cost-effectiveness of competing strategies for the prevention of recurrent peptic ulcer hemorrhage [J]. Am J Gastroenterol, 2002, 97(8): 1941-1950.
[169]Pohl H, Finlayson SR, Sonnenberg A, et al. Helicobacter pylori-associatedulcer bleeding: should we test for eradication after treatment? [J]. Aliment Pharmacol Ther, 2005, 22(6): 529-537.
[170]Gené E, Calvet X, Azagra R. Diagnosis of Helicobacter pylori after triple therapy in uncomplicated duodenal ulcers-a cost-effectiveness analysis [J]. Aliment Pharmacol Ther, 2000, 14(4): 433-442.
[171]Navarro-Jarabo JM, Fernández N, Sousa FL, et al. Efficacy of rifabutin-based triple therapy as second-line treatment to eradicate helicobacter pylori infection [J]. BMC Gastroenterol, 2007, 7: 31.
[172]Marin AC, McNicholl AG, Gisbert JP. A review of rescue regimens after clarithromycin-containing triple therapy failure (for Helicobacter pylori eradication) [J]. Expert Opin Pharmacother, 2013, 14(7): 843-861.
[173]Chung JW, Lee JH, Jung HY, et al. Second-line Helicobacter pylori eradication: a randomized comparison of 1-week or 2-week bismuth-containing quadruple therapy [J]. Helicobacter, 2011, 16(4): 289-294.
[174]Lee SK, Lee SW, Park JY, et al. Effectiveness and safety of repeated quadruple therapy in Helicobacter pylori infection after failure of second-line quadruple therapy: repeated quadruple therapy as a third-line therapy [J]. Helicobacter, 2011, 16(5): 410-414.
[175]Mantzaris GJ, Petraki C, Petraki K, et al. Prospective, randomized study of seven versus fourteen days omeprazole quadruple therapy for eradication of Helicobacter pylori infection in patients with duodenal ulcer after failure of omeprazole triple therapy [J]. Ann Gastroenterol, 2005, 18: 330-335.
[176]Nista EC, Candelli M, Cremonini F, et al. Levofloxacin-based triple therapy vs. quadruple therapy in second-line Helicobacter pylori treatment: a randomized trial [J]. Aliment Pharmacol Ther, 2003, 18(16): 627-633.
[177]Magaret N, Burm M, Faigel D, et al. A randomized trial of lansoprazole, amoxycillin, and clarithromycin versus lansoprazole, bismuth, metronidazole and tetracycline in the retreatment of patients failing initial Helicobacter pylori therapy [J]. Dig Dis, 2001, 19(2): 174-178.
[178]Miehlke S, Kirsch C, Schneider-Brachert W, et al. A prospective, randomized study of quadruple therapy and high-dose dual therapy for treatment of Helicobacter pylori resistant to both metronidazole and clarithromycin [J]. Helicobacter, 2003, 8(4): 310-319.
[179]Cao Z, Chen Q, Zhang W, et al. Fourteen-day optimized levofloxacin-based therapy versus classical quadruple therapy for Helicobacter pylori treatment failures: a randomized clinical trial [J]. Scand J Gastroenterol, 2015, 50(10): 1185-1190.
[180]Kim MS, Kim N, Kim SE, et al. Long-term follow up Helicobacter pylori reinfection rate after second-line treatment: bismuth-containing quadruple therapy versus moxifloxacin-based triple therapy [J]. BMC Gastroenterol, 2013, 13: 138.
[181]Chuah SK, Tai WC, Hsu PI, et al. The efficacy of second-line anti-Helicobacter pylori therapy using an extended 14-day levofloxacin/amoxicillin/proton-pump inhibitor treatment--a pilot study [J]. Helicobacter, 2012, 17(5): 374-381.
[182]Lee BH, Kim N, Hwang TJ, et al. Bismuth-containing quadruple therapy as second-line treatment for Helicobacter pylori infection: effect of treatment duration and antibiotic resistance on the eradication rate in Korea [J]. Helicobacter, 2010, 15(1): 38-45.
[183]Uygun A, Ozel AM, Yildiz O, et al. Comparison of three different second-line quadruple therapies including bismuth subcitrate in Turkish patients with non-ulcer dyspepsia who failed to eradicate Helicobacter pylori with a 14-day standard first-line therapy [J]. J Gastroenterol Hepatol, 2008, 23(1): 42-45.
[184]Kang JM, Kim N, Lee DH, et al. Second-line treatment for Helicobacter pylori infection: 10-day moxifl oxacin-based triple therapy versus 2-week quadruple therapy [J]. Helicobacter, 2007, 12(6): 623-628.
[185]Bilardi C, Dulbecco P, Zentilin P, et al. A 10-day levofloxacin-based therapy in patients with resistant Helicobacter pylori infection: a controlled trial [J]. Clin Gastroenterol Hepatol, 2004, 2(11): 997-1002.
[186]Di Caro S, Franceschi F, Mariani A, et al. Second-line levofloxacin-based triple schemes for Helicobacter pylori eradication [J]. Dig Liver Dis, 2009, 41(7): 480-485.
[187]Karatapanis SS, Skorda L, Georgopoulos S, et al. Levofloxacin-based tripletherapy versus bismuth-based quadruple therapy as a second line treatment for the eradication ofH.pyloriinfection [J]. Annals of Gastroenterology, 2009, 22(4): 263-267.
[188]Gisbert JP,H.pyloriStudy Group of the Spanish Gastroenterology Association. Letter: third-line rescue therapy with levofl oxacin after failure of two treatments to eradicate Helicobacter pylori infection [J]. Aliment Pharmacol Ther, 2012, 35(12): 1484-1486.
[189]Ercin CN, Uygun A, Toros AB, et al. Comparison of 7-and 14-day first-line therapies including levofloxacin in patients with Helicobacter pylori positive non-ulcer dyspepsia [J]. Turk J Gastroenterol, 2010, 21(1): 12-16.
[190]Cheng HC, Chang WL, Chen WY, et al. Levofloxacin-containing triple therapy to eradicate the persistentH.pyloriafter a failed conventional triple therapy [J]. Helicobacter, 2007, 12(4): 359-363.
[191]Gisbert JP, Barrio J, Modolell I, et al. Helicobacter pylori first-line and rescue treatments in the presence of penicillin allergy [J]. Dig Dis Sci, 2015, 60(2): 458-464.
[192]Furuta T, Sugimoto M, Yamade M, et al. Eradication ofH.pyloriinfectionin patients allergic to penicillin using triple therapy with a PPI, metroni-dazole and sitafloxacin [J]. Intern Med, 2014, 53(6): 571-575.
[193]Ueki N, Miyake K, Kusunoki M, et al. Impact of quadruple regimen of clarithromycin added to metronidazole-containing triple therapy against Helicobacter pylori infection following clarithromycin-containing triple-therapy failure [J]. Helicobacter, 2009, 14(2): 91-99.
[194]Jheng GH, Wu IC, Shih HY, et al. Comparison of second-line quadruple therapies with or without bismuth for Helicobacter pylori infection [J]. Biomed Res Int, 2015, 2015: 163960.
[195]Hori K, Miwa H, Matsumoto T. Efficacy of 2-week, second-line Helicobacter pylori eradication therapy using rabeprazole, amoxicillin, and metronidazole for the Japanese population [J]. Helicobacter, 2011, 16(3): 234-240.
[196]Molina-Infante J, Romano M, Fernandez-Bermejo M, et al. Optimizednonbismuth quadruple therapies cure most patients with Helicobacter pylori infection in populations with high rates of antibiotic resistance [J]. Gastroenterology, 2013, 145(1): 121-128.
[197]Wu DC, Hsu PI, Wu JY, et al. Sequential and concomitant therapy with four drugs is equally effective for eradication ofH.pyloriinfection [J]. Clin Gastroenterol Hepatol, 2010, 8(1): 36-41.
[198]Peitz U, Sulliga M, Wolle K, et al. High rate of post-therapeutic resistance after failure of macrolide-nitroimidazole triple therapy to cure Helicobacter pylori infection: impact of two second-line therapies in a randomized study [J]. Aliment Pharmacol Ther, 2002, 16: 315-324.
[199]Lamouliatte H, Mégraud F, Delchier JC, et al. Second-line treatment for failure to eradicate Helicobacter pylori : a randomized trial comparing four treatment strategies [J]. Aliment Pharmacol Ther, 2003, 18(8): 791-797.
[200]Gisbert JP, Calvet X. Review article: rifabutin in the treatment of refractory Helicobacter pylori infection [J]. Aliment Pharmacol Ther, 2012, 35(2): 209-221.
[201]Liu X, Wang H, Lv Z, et al. Rescue therapy with a proton pump inhibitor plus amoxicillin and rifabutin for helicobacter pylori infection: a systematic review and Meta-analysis [J]. Gastroenterol Res Pract, 2015, 2015: 415648.
[202]Lim HC , Lee YJ , An B, et al. Rifabutin-based high-dose proton-pump inhibitor and amoxicillin triple regimen as the rescue treatment for Helicobacter pylori [J]. Helicobacter, 2014, 19(6): 455-461.
[203]Miehlke S, Hansky K, Schneider-Brachert W, et al. Randomized trial of rifabutin-based triple therapy and high-dose dual therapy for rescue treatment of Helicobacter pylori resistant to both metronidazole and clarithromycin [J]. Aliment Pharmacol Ther, 2006, 24(2): 395-403.
[204]Perri F, Festa V, Clemente R, et al. Randomized study of two "rescue" therapies for Helicobacter pylori-infected patients after failure of standard triple therapies [J]. Am J Gastroenterol, 2001, 96(1): 58-62.
[205]Labenz J. Current role of acid suppressants in Helicobacter pylori eradication therapy [J]. Best Pract Res Clin Gastroenterol, 2001, 15(3): 413-431.
[206]Yang JC, Lin CJ, Wang HL, et al. High-dose dual therapy is superior to standard first-line or rescue therapy for Helicobacter pylori infection [J]. Clin Gastroenterol Hepatol, 2015, 13(5): 895-905, e5.
[207]Nishizawa T, Suzuki H, Nakagawa I, et al. Gatifloxacin-based triple therapy as a third-line regimen for Helicobacter pylori eradication [J]. J Gastroenterol Hepatol, 2008, 23 Suppl 2: S167-S170.
[208]Murakami K, Furuta T, Ando T, et al. Multi-center randomized controlled study to establish the standard third-line regimen for Helicobacter pylori eradication in Japan [J]. J Gastroenterol, 2013, 48(10): 1128-1135.
[209]Shirai N, Sugimoto M, Kodaira C, et al. Dual therapy with high doses of rabeprazole and amoxicillin versus triple therapy with rabeprazole, amoxicillin, and metronidazole as a rescue regimen for Helicobacter pylori infection after the standard triple therapy [J]. Eur J Clin Pharmacol, 2007, 63(8): 743-749.
[210]Kim SB, Lee SH, Kim KO, et al. Ten-day sequential therapy versus bismuth based quadruple therapy as second line treatment for Helicobacter pylori infection [J]. Korean J Gastroenterol, 2015, 66(5): 261-267.
[211]Isakov V, Domareva I, Koudryavtseva L, et al. Furazolidone-based triple ‘rescue therapy’ vs. quadruple ‘rescue therapy’ for the eradication of Helicobacter pylori resistant to metronidazole [J]. Aliment Pharmacol Ther, 2002, 16(7): 1277-1282.
[212]Qasim A, Sebastian S, Thornton O, et al. Rifabutin- and furazolidone-based Helicobacter pylori eradication therapies after failure of standard first- and second-line eradication attempts in dyspepsia patients [J]. Aliment Pharmacol Ther, 2005, 21(1): 91-96.
[213]Tay CY, Windsor HM, Thirriot F, et al. Helicobacter pylori eradication in Western Australia using novel quadruple therapy combinations [J]. Aliment Pharmacol Ther, 2012, 36(11-12): 1076-1083.
[214]Macy E. Penicillin allergy: optimizing diagnostic protocols, public health implications, and future research needs [J]. Curr Opin Allergy Clin Immunol, 2015, 15(4): 308-313.
[215]Fallone CA, Chiba N, van Zanten SV, et al. The Toronto Consensus for the treatment of Helicobacter pylori infection in adults [J]. Gastroenterology, 2016, 151(1): 51-69.e14.
[216]Blanchard TG, Czinn SJ. Current status and prospects for a Helicobacter pylori vaccine [J]. Gastroenterol Clin North Am, 2015, 44(3): 677-689.
[217]Zeng M, Mao XH, Li JX, et al. Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial [J]. Lancet, 2015, 386(10002): 1457-1464.
自2007年美国胃肠病学院(American College of Gastroenterology,ACG)发布上一版临床指南以来,关于幽门螺杆菌感染诊治管理又取得了一些研究进展,尤其在药物治疗方面进行了重要改进。2017年1月,美国胃肠病学院(ACG)发布了幽门螺杆菌感染的治疗指南。美国密西根大学卫生系统消化科Chey等基于最新临床证据,于2月在The American Journal of Gastroenterology杂志上发表ACG新版指南,主要针对幽门螺杆菌感染的流行病学、高危人群,监测、治疗等问题提出循证指导意见。
幽门螺杆菌感染在全球范围内常见,是导致消化性溃疡和胃癌的重要原因,我国近一半人群感染幽门螺杆菌。本文译自Chey WD, Leontiadis GI, Howden CW, et al. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection [J]. Am J Gastroenterol, 2017, 112(2): 212-239. 旨在为我国临床医师提供幽门螺杆菌感染治疗的更新推荐。
ACG clinical guideline: treatment of Helicobacter pylori infection
LI Yumeng, MA Jun, DUAN Fangling
Institute of Digestive Diseases, Zhengzhou University, the Second Affiliated Hospital of Zhengzhou University, Zhengzhou 450014, China
Helicobacter pylori (H.pylori) infection is a common worldwide infection that is an important cause of peptic ulcer disease and gastric cancer.H.pylorimay also have a role in uninvestigated and functional dyspepsia, ulcer risk in patients taking low-dose aspirin or starting therapy with a non-steroidal anti-inflammatory medication, unexplained iron deficiency anemia, and idiopathic thrombocytopenic purpura. While choosing a treatment regimen forH.pylori, patients should be asked about previous antibiotic exposure and this information should be incorporated into the decision-making process. For first-line treatment, clarithromycin triple therapy should be confined to patients with no previous history of macrolide exposure who reside in areas where clarithromycin resistance amongstH.pyloriisolates is known to be low. Most patients will be better served by first-line treatment with bismuth quadruple therapy or concomitant therapy consisting of a PPI, clarithromycin, amoxicillin, and metronidazole. When first-line therapy fails, a salvage regimen should avoid antibiotics that were previously used. If a patient received a first-line treatment containing clarithromycin, bismuth quadruple therapy or levofloxacin salvage regimens are the preferred treatment options. If a patient received first-line bismuth quadruple therapy, clarithromycin or levofloxacin-containing salvage regimens are the preferred treatment options. Details regarding the drugs, doses and durations of the recommended and suggested first-line and salvage regimens can be found in the guideline.
Helicobacter pylor; Therapy; Guideline
10.3969/j.issn.1006-5709.2017.06.002
R378
A
1006-5709(2017)06-0601-24
2015-00-00
