棉花WOX转录因子家族基因的全基因组鉴定与分析
2017-06-28吕有军杨卫军赵兰杰刘子洋张永山
吕有军 ,杨卫军,赵兰杰 ,刘子洋,张永山
(1.安阳工学院,河南 安阳 455000;2.中国农业科学院 棉花研究所,河南 安阳 455000;3.棉花生物学国家重点实验室,河南 安阳 455000,4.萨斯喀彻温大学,加拿大 萨斯卡通 S7N 5A5 )
棉花WOX转录因子家族基因的全基因组鉴定与分析
吕有军1,2,3,杨卫军1,赵兰杰2,刘子洋4,张永山2
(1.安阳工学院,河南 安阳 455000;2.中国农业科学院 棉花研究所,河南 安阳 455000;3.棉花生物学国家重点实验室,河南 安阳 455000,4.萨斯喀彻温大学,加拿大 萨斯卡通 S7N 5A5 )
为了挖掘可用于棉花花器官或纤维发育研究的候选基因,基于已发布的陆地棉全基因组数据,利用生物信息学的分析方法鉴定了陆地棉WOX(WUSCHEL-related homeobox,WOX)转录因子基因家族,并从染色体分布、基因及蛋白理化性质、蛋白结构、多重序列比对、系统进化树和基因表达模式等方面对该基因家族的特征进行了比较分析。结果表明,鉴定到37个陆地棉WOX转录因子家族基因,命名为GhWOX1~GhWOX37。亚基因组定位结果显示,37个陆地棉WOX转录因子家族基因分布在除了A04、A06、A09、D04、D06和D09号亚基因组以外的20个亚基因组,A亚组比D亚组多1个GhWOX转录因子家族基因。多重序列比对分析棉花WOX转录因子家族成员均具有高度保守的同源异型结构域;系统进化树分析发现棉花WOX转录因子家族可以分为3个亚家族(Ⅰ类、Ⅱ类和Ⅲ类),各亚类分别含有23,7,7个GhWOX转录因子家族基因成员。对NCBI中陆地棉的EST数据库比对分析,有11个GhWOX转录因子家族成员没有可匹配的EST序列,其他26个GhWOX转录因子家族成员在棉花的根、茎、叶、花、胚珠、纤维和种子等组织和器官中广泛表达。为深入研究棉花和其他植物中WOX家族的鉴定和功能研究奠定了基础。
棉花;WOX;花;纤维发育
WUSCHEL(WUS)相关的同源异型盒WOX(WUSCHEL-related homeobox)转录因子在植物界广泛存在,并且是植物中一类比较大的转录因子家族,属于同源异型盒HB(Homebox)转录因子超家族的一个亚家族[1-4]。这类转录因子的蛋白包括一段能够特异结合DNA序列的60~66个氨基酸组成的同源异型结构域HD(Home domain),具有调控顶端分生组织的分化、侧生器官的发育、花器官的形成和胚发育等多种生物学功能[5-10]。
有关不同植物中WOX基因的功能研究越来越多。现已经在拟南芥基因组中发现15个WOX成员,分别是AtWUS和AtWOX1~AtWOX14[9-11],各个基因的功能已经研究得比较明确;水稻全基因组中共有13个WOX成员,其功能都有深入研究[12-15];玉米全基因组中共预测有21个WOX成员[15-17];番茄全基因组中已经预测到10个WOX成员[18]。此外,在杨树、高粱和茄子等植物中也有关于WOX基因的报道[15,19]。WOX家族成员众多,具有不同的生物学功能,如AtWUS基因维持和形成茎尖顶端分生组织,影响花药和子房的发育过程,通过WUS在根中异位表达,诱导产生茎尖分生组织,进而产生叶片,并产生花序[20-22]。拟南芥wus突变体表现出植株顶端分生组织和花序分生组织异常,花数目减少且花器官异常[23]。AtWOX3参与拟南芥两侧花瓣的发育过程,其突变体花瓣变窄或缺失[24]。AtWOX13和AtWOX14也参与影响根和花器官的发育[25]。拟南芥中AtWOX11和AtWOX12共同参与影响外植体根的器官发育[26]。水稻中OsWOX11是1个调控不定根生长发育的关键基因,对激活冠状根的生长发育具有重要的作用,抑制OsWOX11表达及其缺失突变体WOX11都会造成冠状根数目的减少和生长速率下降,而OsWOX11超表达促进冠状根提前产生,在高位茎节及小花基部产生不定根[13]。
棉花是世界上最重要的纤维作物之一。陆地棉遗传标准系TM-1全基因组序列测序工作的完成[27-28],为棉花功能基因的研究提供了基础。目前,关于棉花WOX转录因子家族的鉴定和分析研究还未见报道。本研究利用15个拟南芥WOX蛋白为探针,从陆地棉基因组数据库查找鉴定出可能的全部棉花WOX转录因子家族基因,并对这些基因进行生物信息学分析,并从染色体分布、基因及蛋白结构、序列比对、系统进化树及表达模式等方面分析该家族成员的结构和功能,挖掘可用于棉花花器官或纤维发育研究的候选基因,旨在为进一步研究棉花WOX转录因子家族基因的功能奠定基础。
1 材料和方法
1.1 陆地棉WOX转录因子家族成员的鉴定及序列分析
以TAIR数据库(http://www.arabidopsis.org/index.jsp)下载的15个拟南芥WOX转录因子家族成员的蛋白序列为探针,与四倍体陆地棉的基因组数据库(http://www.cottongen.org)进行Blast比对,获得陆地棉全基因组中WOX转录因子家族的所有成员及其CDS和氨基酸序列。
用ProtParam软件在线(http://web.expasy.org/protparam/)分析蛋白质的基本理化性质;SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)在线预测和分析蛋白质的二级结构组成形式;运用EBL-EBI(http://www.ebi.ac.uk/interpro/search/sequence-search)和NCBI的BlastP分析氨基酸序列的蛋白质保守区;IBS 2.0软件绘制蛋白结构域图。
1.2 亚基因组定位
利用四倍体陆地棉的基因组数据库(http://www.cottongen.org)获得染色体长度及GhWOX转录因子家族成员在亚基因组上的位置分布;用MapInspect软件绘制基因的染色体物理分布图。
1.3 跨膜结构及亚细胞定位
利用WOLF PSORT(http://psort.hgc.jp/)和TMHMM Server v.2.0(http://www.cbs.dtu.dk/services /TMHMM/)软件进行信号肽、跨膜区及亚细胞定位分析。
1.4 多重序列比对及系统进化树分析
将陆地棉、拟南芥及水稻的WOX蛋白序列利用ClustalW软件进行多重序列比对,参数选为默认值。利用MEGA 6.0软件邻接法(Nerghbor-join,NJ)构建系统进化树分析,Bootstrap值设定为1 000。
1.5 棉花WOX在棉花不同组织中的表达分析
以陆地棉GhWOX基因的CDS序列为Query,在NCBI网站的EST数据库中通过Blast搜索,获得GhWOX基因在不同组织表达的信息,明确GhWOX基因的表达情况。
2 结果与分析
2.1 棉花WOX基因家族的鉴定及序列分析
利用15个拟南芥AtWOX蛋白(AtWUS和AtWOX1~AtWOX14)作为探针,与四倍体陆地棉基因组数据库比对,共鉴定获得37个棉花GhWOX家族基因,根据这些基因在染色体出现的先后顺序分别命名为GhWOX1~GhWOX37(表1)。这37个GhWOX基因的编码区长度为564~1 134 bp,编码蛋白序列长度为187~377个氨基酸(表1)。
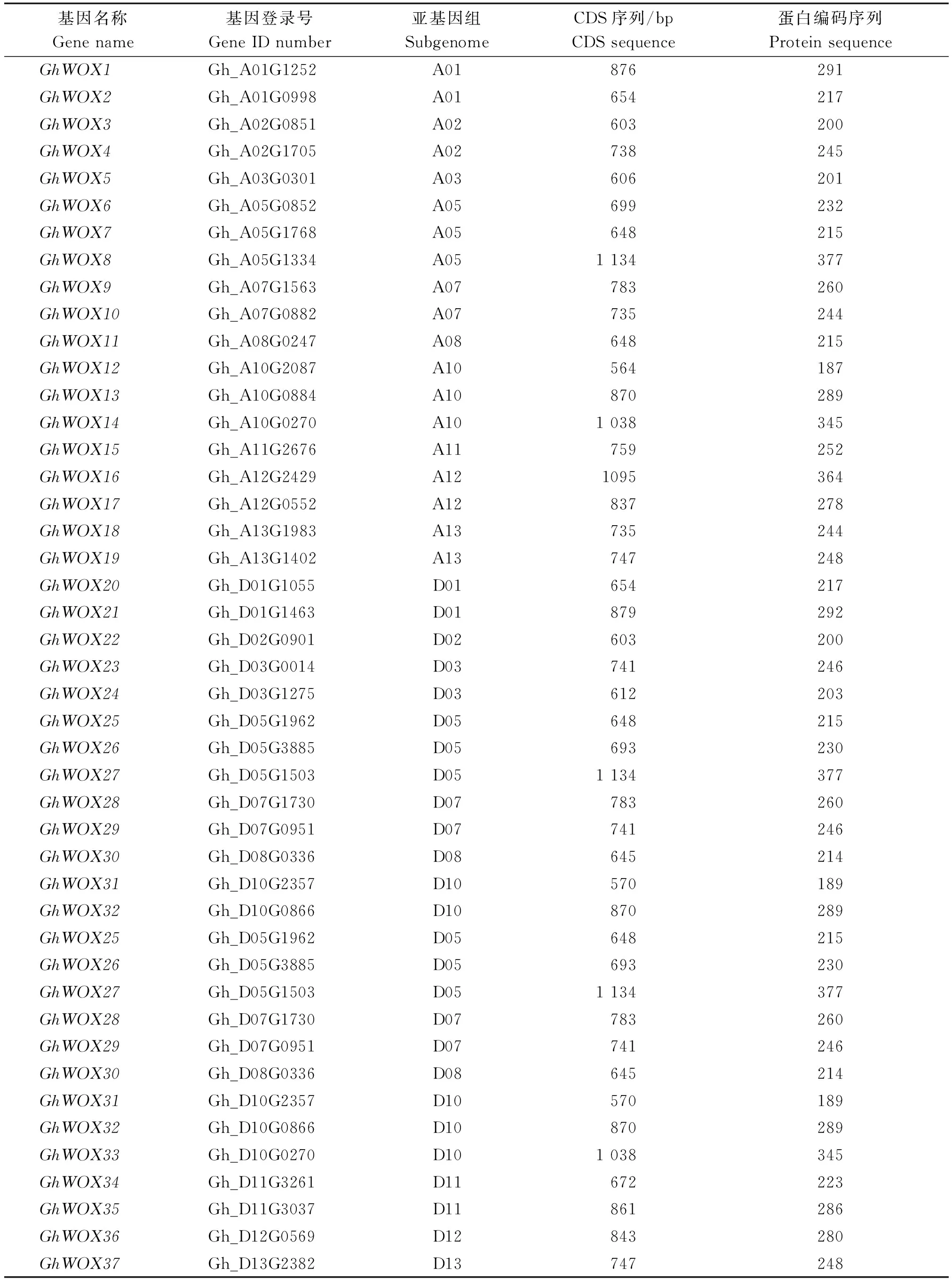
表1 陆地棉WOX家族基因序列信息
2.2 棉花WOX转录因子家族基因的物理定位
陆地棉的这37个GhWOX转录因子家族基因在A和D亚基因组存在不均匀分布,在A亚基因组中共有19个GhWOX转录因子家族基因,在D亚基因中共有18个GhWOX转录因子家族基因,A亚基因组中比D亚基因组中多分布了1个GhWOX转录因子家族基因。在A亚基因组中A04、A06和A09没有GhWOX转录因子家族基因的存在,同样对应的D亚基因组中D04、D06和D09也没有GhWOX转录因子家族基因。在A亚基因组和D亚基因组有GhWOX转录因子家族基因分布的对应亚基因组间,都存在有成对的平行结合同源基因,在A05和D05、A10和D10这2对亚基因组中有3对平行进化的同源基因,在A01和D01、A07和D07这2对亚基因组中有2对平行进化的同源基因,其他成对的亚基因组中仅有1对平行同源基因(图1)。这37个陆地棉WOX基因在染色体的物理定位如图1所示。
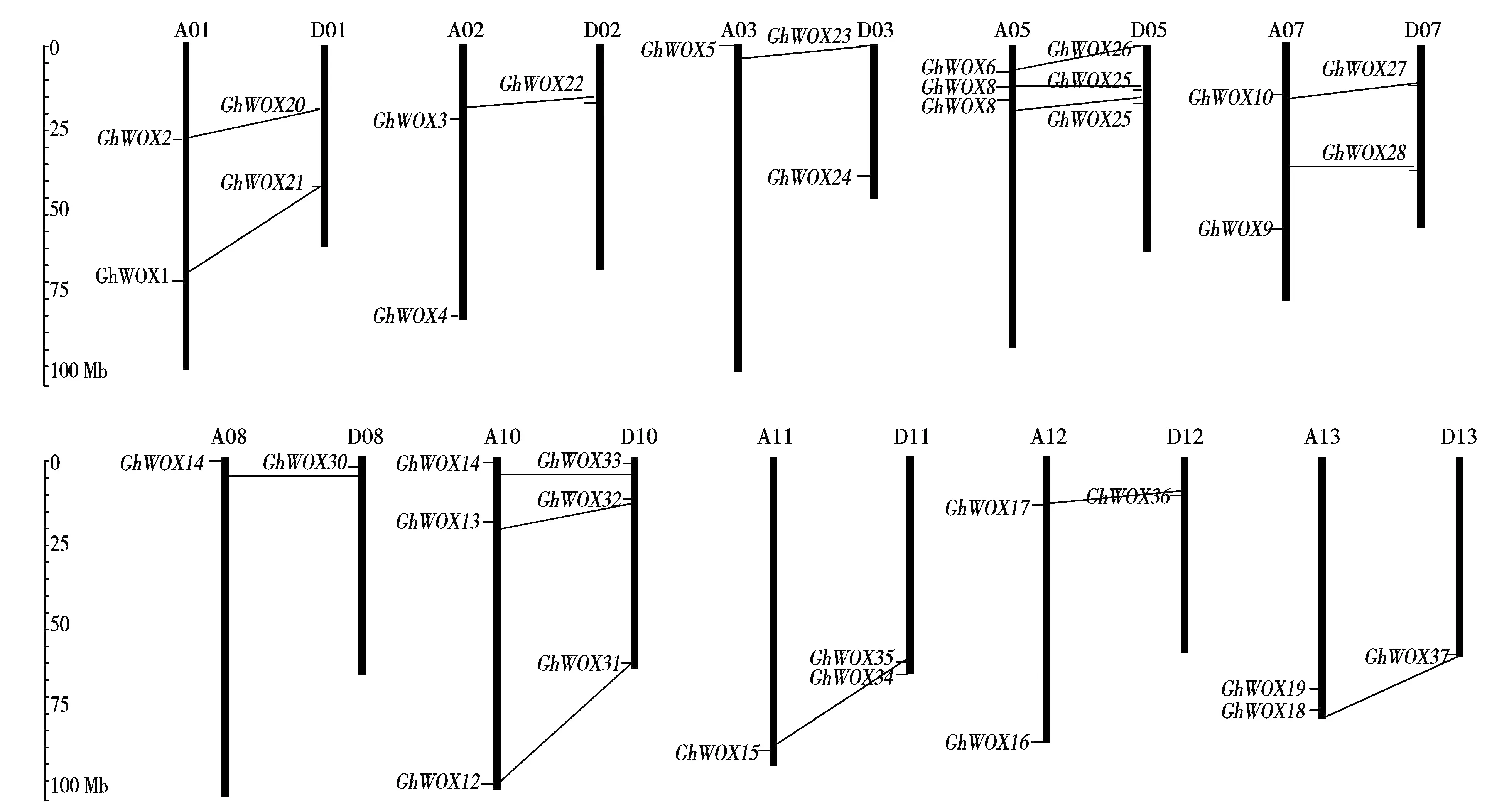
图1 陆地棉亚基因组上的GhWOX基因的分布
2.3 棉花WOX转录因子家族蛋白功能结构域分析
利用ProtParam预测分析37个棉花WOX家族基因蛋白的基本理化性质(表2),结果表明,这37个棉花WOX蛋白的分子量为21.78~41.84 kDa,理论等电点为4.98~9.47,负电荷的氨基酸残基数(Asp+Glu)为14~44,正电荷的氨基酸残基数(Arg+Lys)为20~41,脂肪系数为46.37~79.48,总平均亲水性为-0.279~-1.069,不稳定系数为45.55~74.35,均为亲水性不稳定蛋白质。
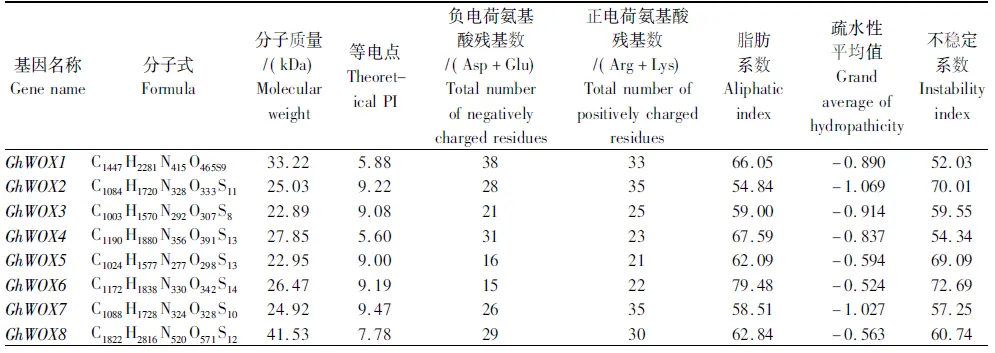
表2 陆地棉WOX家族基因蛋白理化性质分析

表2(续)
利用SOPMA在线预测分析棉花WOX家族基因蛋白的二级结构(表3),结果表明,这37个棉花WOX基因家族蛋白的二级结构都是以α-螺旋、延伸直链、β-转角和无规则卷曲4种结构形式组成。其中,GhWOX11、GhWOX30、GhWOX34蛋白二级结构以α-螺旋为主,其他GhWOX蛋白以无规则卷曲为主。
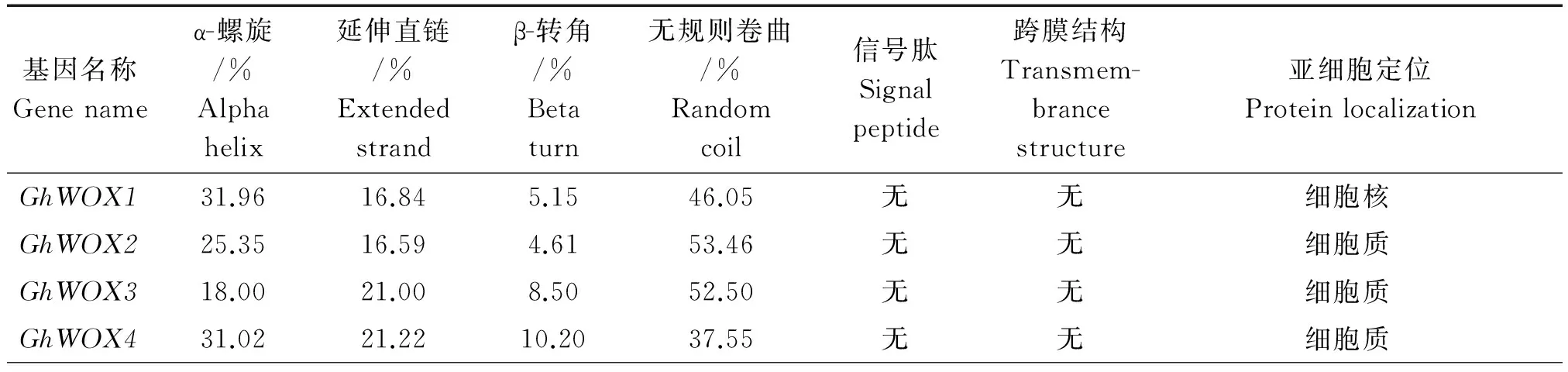
表3 陆地棉WOX家族基因蛋白二级结构、信号肽、跨膜区及亚细胞定位的预测
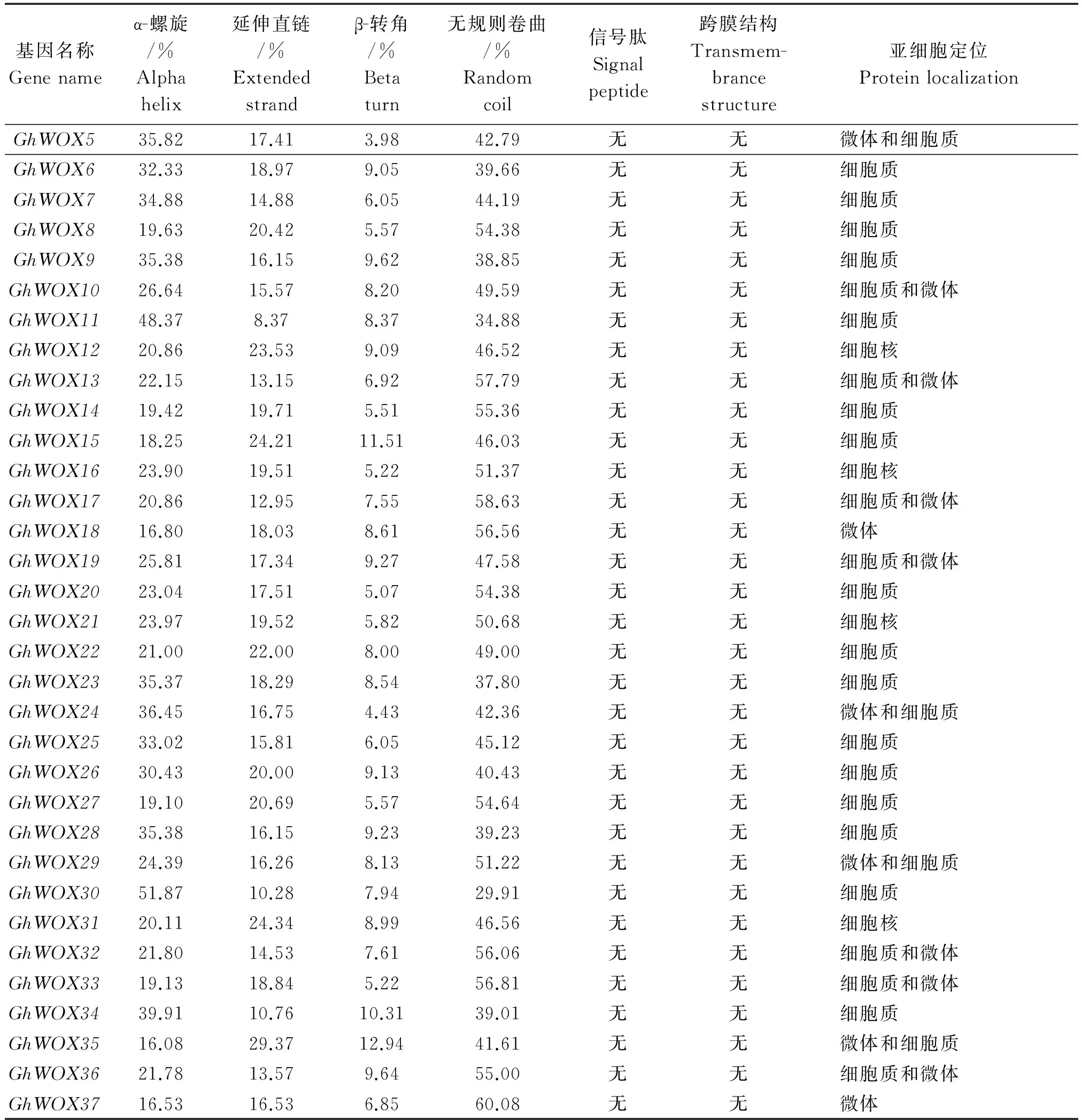
表3(续)
为了进一步确定筛选的37个棉花WOX基因是否属于WOX蛋白家族,利用EBL-EBI在线分析,结合NCBI 中BlastP比对,对该基因氨基酸序列进行蛋白质保守区分析,发现37个棉花WOX家族基因成员均具有同源异型结构域,其位置如图2所示。由于棉花WOX蛋白质氨基酸序列的长度不同,棉花WOX家族基因同源异型结构域出现的位置和长度也不同,GhWOX6和GhWOX26从第2个氨基酸开始就已是同源异型结构域,而GhWOX9和GhWOX28的同源异型结构域从99位氨基酸才开始;棉花WOX家族基因蛋白同源异型结构域最短的仅有68个氨基酸(GhWOX5和GhWOX24),最长的有88个氨基酸(GhWOX13和GhWOX32),之间相差20个氨基酸(图2)。这些同源异型结构域是GhWOX家族基因蛋白行使其正常功能所必需的。
由WOLF PSORT软件和TMHMM软件在线预测该蛋白的信号肽、跨膜区及亚细胞定位情况。结果表明,这37个棉花WOX均没有信号肽和跨膜区,其中有5个棉花WOX蛋白(GhWOX1、GhWOX12、GhWOX16、GhWOX21和GhWOX31)定位在细胞核上,其他的棉花WOX家族基因蛋白均定位在细胞质和微体上(表3)。由于这些蛋白定位的不同,故推测WOX蛋白具有不同的功能,且某些成员具有特殊功能。

黑色区域表示GhWOX家族基因蛋白HD结构域。Black areas represent the GhWOX family gene proteins HD domain of protein.
2.4 棉花WOX基因家族蛋白进化关系
利用DNAMAN和ClustalX将37个棉花WOX家族基因蛋白与拟南芥和水稻WOX蛋白同源异型结构域进行多重序列比较(图3-A),结果表明,其同源区域主要集中在同源异型结构域。为了明确37个陆地棉WOX家族基因蛋白的进化关系,利用MEGA 6.0软件构建系统进化树,结果显示,棉花WOX家族分为3个亚家族、依次命名为Ⅰ亚家族、Ⅱ亚家族、Ⅲ亚家族,各家族分别含有23,7,7个GhWOX成员,进一步明确了37个WOX棉花家族基因蛋白在植物WOX家族中的类别(图3-B)。
2.5 棉花WOX家族基因的表达模式分析
以陆地棉37个WOX基因的CDS序列作为探针在NCBI陆地棉EST数据库中Blast,获得54条相关的EST序列,根据EST序列的信息分析这37个基因的转录表达情况(表4)。分析表明,有11个GhWOX基因没有可匹配的EST序列,其他26个GhWOX基因在棉花的根、茎、叶、花、胚珠、纤维和种子等组织中广泛表达。其中,有6个GhWOX基因(GhWOX2/3/4/7/23/25)在分生组织、根、茎、叶、花、胚珠和纤维中都有表达,GhWOX36在花药中有表达,GhWOX13除了在花药中有表达还在种子中表达,这些基因可能参与调控顶端分生组织的分化、花器官的形成和胚发育等多种生物学功能。除了GhWOX17和GhWOX36基因,其他的24个基因在纤维中都有表达,表明这些基因可能参与纤维的发育过程,与纤维发育相关。

表4 陆地棉GhWOX转录因子家族基因组织的表达模式
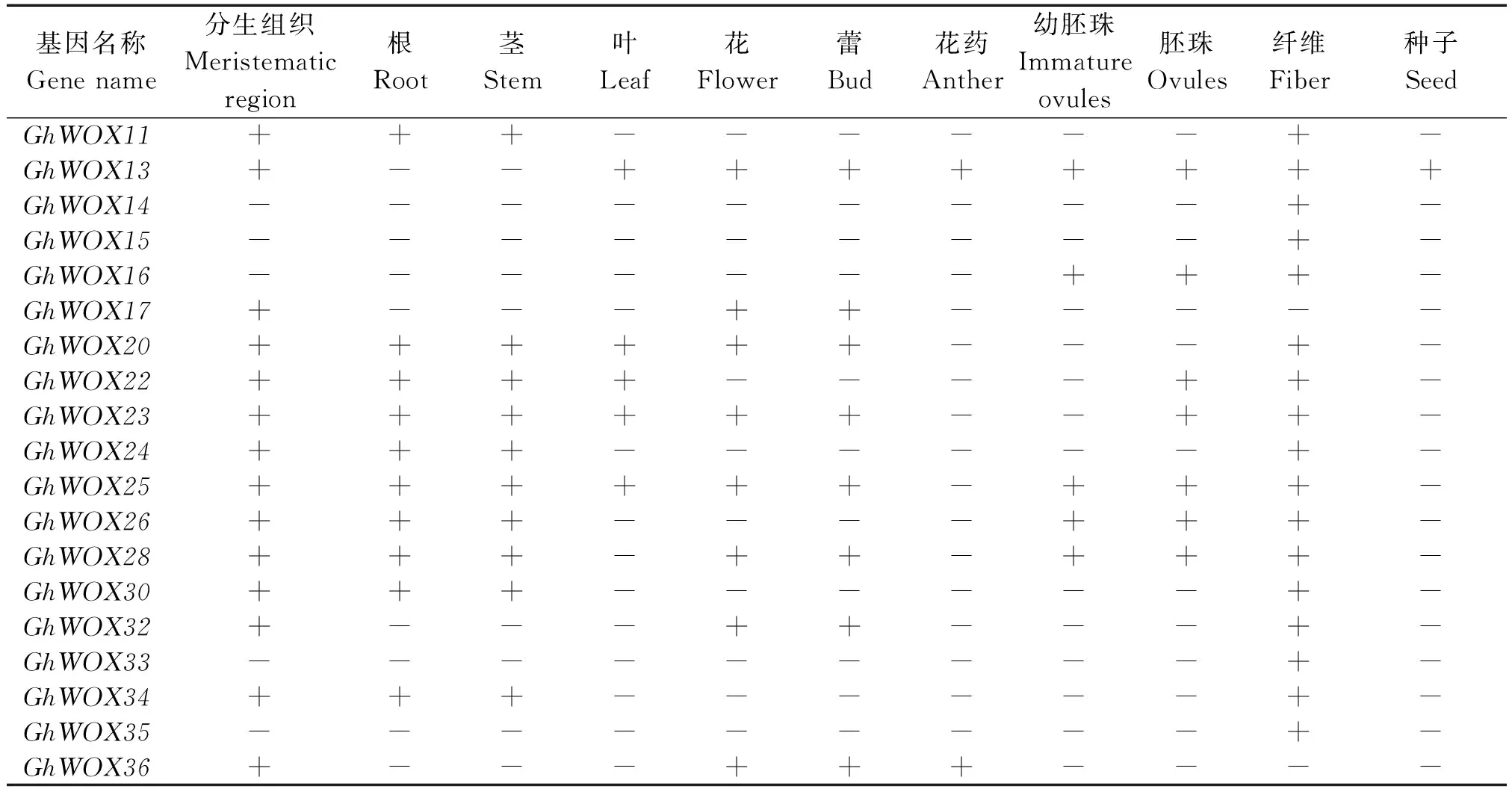
表4(续)
注:+.WOX基因有表达;-.WOX基因没有表达。
Note:+.Expression ofWOXgenes;-.No expression ofWOXgenes.

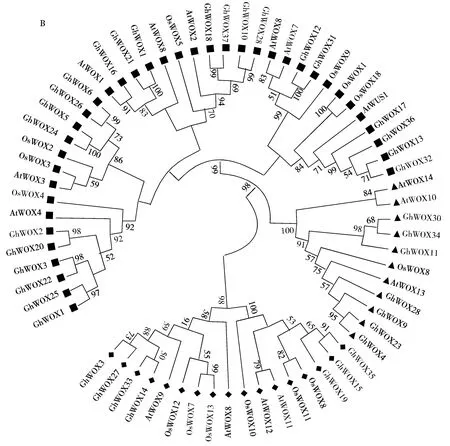
A.棉花WOX家族基因蛋白与拟南芥和水稻WOX蛋白的HD同源异型结构域多重序列比;B.棉花、拟南芥和水稻WOX家族基因蛋白的进化树分析;系统树各分支上数字是Bootstrap 1000次循环检验的置信度;标尺代表遗传距离。
A.Amino acid sequences alignment ofGhWOX,AtWOXandOsWOXfamily genes proteins;B.Phylogenic relationship ofGhWOX,AtWOXandOsWOXfamily genes proteins;The numbers on the tree branches represent bootstrap confidence values as Bootstrap is 1000;The scale bar represents genetic distance.
图3 棉花WOX家族蛋白与拟南芥和水稻WOX蛋白的同源异型结构域多重序列比对及系统进化树
Fig.3 Amino acid sequences alignment and phylogenic relationship of GhWOX,AtWOXandOsWOXfamily genes proteins
3 结论与讨论
通过对陆地棉全基因组数据库进行分析,共鉴定出37个陆地棉WOX基因。本研究鉴定出的37个陆地棉WOX家族基因在四倍体陆地棉基因组中A亚组和D亚组存在不均匀分布,A亚基因组中比D亚基因组中多分布了1个GhWOX转录因子家族基因,并且具有GhWOX基因分布的成对的A、D亚组都有共线性基因存在,共有16对共线性基因;其中,A04亚组和D04亚组、A06亚组和D06亚组、A09亚组和D09亚组都是成对的没有GhWOX转录因子家族基因的存在。本研究鉴定出的37个陆地棉WOX家族基因在四倍体陆地棉基因组中A亚组和D亚组的分布,与前人研究发现A亚组和D亚组的基因存在很高的共线性结果一致[29]。
WOX蛋白正常行使其生物学功能依赖自身的功能结构域。多重序列比对分析发现37个陆地棉WOX家族基因主要集中在保守性较高的同源异型结构域,该结构域能够特异特得与DNA序列结合[30],表明其在棉花WOX转录因子家族成员的功能行使中起着重要的作用。由于棉花WOX各个成员功能域的不同,表明棉花WOX基因家族成员间可能存在功能上的差异性;蛋白理化性质预测结果表明,37个陆地棉WOX蛋白都为亲水性不稳定蛋白,相似的理化性质预示各个成员间可能具有某些相似的功能。研究报道AtWUS、AtWOX3、AtWOX4、AtWOX6、OsWOX3、OsWOX9和OsWOX11亚细胞定位在核内[13,31-35],AtWOX1同时定位在细胞核内和细胞质中[36]。而本研究中预测到的37个陆地棉WOX蛋白中有5个定位在细胞核,19个定位在细胞质,2个定位在微体,其他的均定位在细胞质和微体上。推测WOX在棉花生长发育调控以及逆境适应过程中具有重要作用。通过研究了解棉花中GhWOX家族基因结构特征及进化演变过程,从而为认识陆地棉基因组的复杂性和棉属物种的进化多样性奠定了基础。
前人对其他植物中WOX基因的组织表达研究发现,在拟南芥中,AtWOX13和AtWOX14在拟南芥的根和花中表达,AtWOX13参与根的发育和花器官的形成,AtWOX14与侧根的早起形成和花药的发育相关[25]。本研究对棉花WOX基因的组织表达研究也发现,正常生长条件下26个棉花WOX基因中有6个GhWOX基因在分生组织、根、茎、叶、花、胚珠和纤维中都有表达,这符合WOX基因家族的特点。GhWOX16在花药中有表达,GhWOX13除了在花药中有表达还在种子中表达,这些基因可能参与调控顶端分生组织的分化、花器官的形成和胚发育等多种生物学功能。除了GhWOX17和GhWOX36基因,其他的24个基因在纤维中都有表达,表明这些基因在纤维的发育过程具有重要作用,可能参与纤维发育调控。
通过分析WOX基因在陆地棉基因组的存在情况,获得了37个棉花WOX基因,从而为深入研究WOX转录因子家族的分子生物学功能提供了基础理论依据。
[1] Yadav R K,Reddy G V.WUSCHEL protein movement and stem cell homeostasis.[J].Plant Signaling & Behavior,2012,7(5):592-594.
[2] 王占军,陈金慧,施季森.植物干细胞中WUS/CLV反馈调控机制的研究进展[J].林业科学,2011,47(4):159-165.
[3] 高 丽,孙祎敏,邵铁梅,等.植物WUSCHEL-related homeobox(WOX)家族研究进展[J].生物技术通报,2015,34(5):7-12.
[4] 王俞程,何瑞萍,彭献军,等.WOX转录因子家族研究进展[J].草业科学,2015,32(5):760-769.
[5] Mannervik M.Target genes of homeodomain proteins[J].BioEssays,1999,21(4):267-270.
[6] Stahl Y,Wink R H,Ingram G C,et al.A signaling module controlling the stem cell niche inArabidopsisroot Meristems[J].Current Biology,2009,19(11):909-914.
[7] Shimizu R,Ji J,Kelsey E,et al.Tissue specificity and evolution of meristematic WOX3 function[J].Plant Physiology,2009,149(2):841-850.
[8] Ueda M,Zhang Z,Laux T,et al.Transcriptional activation ofArabidopsisaxis patterning genes WOX8/9 links zygote polarity to embryo development[J].Developmental Cell,2011,20(2):264-270.
[9] van der Graaff E,Laux T,Rensing S A.The WUS homeobox-containing(WOX)protein family[J].Genome Biol,2009,10(12):248.
[10] Haecker A,Grosshardt R,Geiges B,et al.Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning inArabidopsisthaliana[J].Development,2004,131(3):657-668.
[11] Laus T,Mayer K F X,Berger J,et al.The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis[J].Development-cambridge,1996,122(1):87-96.
[12] Kamiya N,Nagasaki H,Morikami A,et al.Isolation and characterization of a rice WUSCHEL-type homeobox gene that is specifically expressed in the central cells of a quiescent center in the root apical meristem[J].Plant Journal,2003,35(4):429-441.
[13] Zhao Y,Hu Y,Dai M,et al.The WUSCHEL-related homeobox geneWOX11 is required to activate shoot-borne crown root development in rice[J].The Plant Cell,2009,21(3):736-748.
[14] Ohmori Y,Tanaka W,Kojima M,et al.WUSCHEL-RELATED HOMEOBOX4 is involved in meristem maintenance and is negatively regulated by the CLE geneFCP1 in rice[J].The Plant Cell,2013,25(1):229-241.
[15] Zhang X,Zong J,Liu J,et al.Genome-wide analysis of WOX gene family in rice,sorghum,maize,Arabidopsisand poplar.[J].Journal of Integrative Plant Biology,2010,52(11):1016-1026.
[16] Nardmann J,Werr W.The shoot stem cell niche in angiosperms:expression patterns of WUS orthologues in rice and maize imply major modifications in the course of mono-and dicot evolution[J].Molecular biology and evolution,2006,23(12):2492-2504.
[17] Nardmann J,Ji J,Werr W,et al.The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene function in a lateral domain of shoot apical meristems[J].Development,2004,131(12):2827-2839.
[18] 李晓旭,刘 成,李 伟,等. 番茄WOX转录因子家族的鉴定及其进化、表达分析[J].2016,38(5):444-460.
[19] Han H Q,Liu Y,Zhou Z L,et al.Cloning,subcellular localization and sequence analysis of WUSCHEL-related homeobox 13-like gene(SmWOX13)in Eggplant(Solanummelongena)[J].上海交通大学学报:农业科学版,2015,33(2):1-17.
[20] Grosshardt R,Lenhard M,Laux T,et al.WUSCHEL signaling functions in interregional communication duringArabidopsisovule development.[J].Genes & Development,2002,16(9):1129-1138.
[21] Deyhle F,Sarkar A,Tucker E J,et al.WUSCHEL regulates cell differentiation during anther development[J].Developmental Biology,2007,302(1):154-159.
[22] Gallois J,Nora F R,Mizukami Y,et al.WUSCHEL induces shoot stem cell activity and developmental plasticity in the root meristem[J].Genes & Development,2004,18(4):375-380.
[23] Laux T,Mayer K F,Berger J A,et al.The WUSCHEL gene is required for shoot and floral meristem integrity inArabidopsis.[J].Development,1996,122(1):87-96.
[24] Vandenbussche M,Horstman A,Zethof J,et al.Differential recruitment of WOX transcription factors for lateral development and organ fusion inPetuniaandArabidopsis[J].The Plant Cell,2009,21(8):2269-2283.
[25] Deveaux Y,Toffanonioche C,Claisse G,et al.Genes of the most conserved WOX clade in plants affect root and flower development inArabidopsis[J].BMC Evolutionary Biology,2008,8:291.
[26] Liu J,Sheng L,Xu Y,et al.WOX11 and 12 are involved in the first-step cell fate transition during de novo root organogenesis inArabidopsis[J].The Plant Cell,2014,26(3):1081-1093.
[27] LI F G,Fan G Y,Lu C R,et al.Genome sequence of cultivated Upland cotton(GossypiumhirsutumTM-1)provides insights into genome evolution[J].Nature Biotechnology,2015,33(5):524-530.
[28] Zhang T,Hu Y,Jiang W,et al.Sequencing of allotetraploid cotton(GossypiumhirsutumL.acc.TM-1)provides a resource for fiber improvement[J].Nature Biotechnology,2015,33(5):531-537.
[29] Li F,Fan G,Wang K,et al.Genome sequence of the cultivated cottonGossypiumarboreum[J].Nature Genetics,2014,46(6):567-572.
[30] Gehring W J,Muller M,Affolter M,et al.The structure of the homeodomain and its functional implications[J].Trends in Genetics,1990,6(10):323-329.
[31] Mayer K F,Schoof H,Haecker A,et al.Role of WUSCHEL in regulating stem cell fate in theArabidopsisshoot meristem[J].Cell,1999,95(6):805-815.
[32] Matsumoto N,Okada K.A homeobox gene,PRESSED FLOWER,regulates lateral axis-dependent development ofArabidopsisflowers[J].Genes & Development,2001,15(24):3355-3364.
[33] Hirakawa Y,Kondo Y,Fukuda H,et al.TDIF peptide signaling regulates vascular stem cell proliferation via theWOX4 homeobox gene inArabidopsis[J].The Plant Cell,2010,22(8):2618-2629.
[34] Park S O,Zheng Z,Oppenheimer D G,et al.The phenotype ofArabidopsisovule mutants mimics the morphology of primitive seed plants[J].Development,2005,132(4):841-849.
[35] Wang W,Li G,Zhao J,et al.DWARF TILLER1,a WUSCHEL-related homeobox transcription factor,is required for tiller growth in rice[J].PLOS Genetics,2013,10(3):1340.
[36] Zhang Y,Wu R,Qin G,et al.Over-expression of WOX1 leads to defects in meristem development and polyamine homeostasis inArabidopsis[J].Journal of Integrative Plant Biology,2011,53(6):493-506.
Genome-wide Identification and Analysis ofWOXFamily Genes inGossypiumhirsutumL.
LÜ Youjun1,2,3,YANG Weijun1,ZHAO Lanjie2,LIU Ziyang4,ZHANG Yongshan2
(1.Anyang Institute of Technology,Anyang 455000;2.Institute of Cotton Research,Chinese Academy of Agricultural Sciences,Anyang 455000;3.State Key Laboratory of Cotton Biology,Anyang 455000;4.University of Saskatchewan,Saskatoon,S7N 5A5,Canada)
The purpose of this study was to find the relevant candidate genes for development of fiber or floral organ in cotton.Based on the available genome data of cotton,theWOXgene family was identified by bioinformatics analysis.The chromosome distribution,gene and protein structures,phylogenetic relationship and gene expression patterns of this family were comprehensively compared.The results showed that a total of 37WOXgenes in cotton genome were found and then designated asGhWOX1-GhWOX37,which were distributed in 20 subgenomes except for A04,A06,A09,D04,D06 and D09.A subgenome had one moreGhWOXgene than D subgenme.The multiple sequence analysis ofGhWOXgene family presented the highly conserved homeodomain.Phylogenetic tree analysis showed that 37WOXgenes could be divided into Ⅰ,Ⅱ and Ⅲ subfamily and the subfamily respectively contained 23,7 and 7WOXfamily genes in cotton.A Blast search on the NCBI EST database showed that 11GhWOXgenes had no matching EST sequence,and other 26GhWOXgenes were expressed in various tissues of root,stem,leaf,flower,ovule,fiber and seed.The results would be helpful for further analysis of WOX family proteins in other plants.
Cotton;WOX;Flower;Fiber development
2017-02-06
河南省科技厅基础与前沿项目(112300410019);棉花生物学国家重点实验室开放课题(CB2014A10)
吕有军(1974-),男,河南安阳人,副教授,硕士,主要从事棉花种质创新和植物生理生化方面的教学和研究。
张永山(1971-),男,河南安阳人,研究员,博士,主要从事棉花遗传育种研究。
Q78;S562.03
A
1000-7091(2017)02-0021-11
10.7668/hbnxb.2017.02.004
