江苏省禽源空肠弯曲杆菌的分离鉴定及耐药性研究
2017-06-28唐梦君张小燕唐修君刘茵茵高玉时
周 倩,唐梦君,张小燕,张 静,唐修君,顾 荣,刘茵茵,高玉时
江苏省禽源空肠弯曲杆菌的分离鉴定及耐药性研究
周 倩,唐梦君,张小燕,张 静,唐修君,顾 荣,刘茵茵,高玉时
目的 了解江苏省禽源空肠弯曲杆菌的流行情况及耐药特征。方法 从江苏徐州、淮安和扬州等7市采集禽肉产品和泄殖腔棉拭子样品共753份,分离细菌,PCR方法鉴定空肠弯曲杆菌后,根据WHO推荐的K-B法测定9大类27种抗生素的敏感性。结果 753份样品共分离出空肠弯曲杆菌207株,分离率为27.5%。药敏结果显示,所有菌株除了对美罗培南、庆大霉素、卡那霉素、氟苯尼考和磷霉素保持高度敏感性,对其它抗生素产生不同程度耐药,对磺胺类、喹诺酮类、β-内酰胺类和四环素类抗生素耐药率最高,其中对甲氧苄氨嘧啶、诺氟沙星、头孢曲松和四环素耐药率分别高达100%、84.02%、80.9%和79.4%,一株分离自徐州的菌株对92.6%的抗生素产生耐受性。测试菌株出现多重耐药现象,优势耐药谱为LIN/CTX/CRO/NOR/CIP/T/TE,菌株耐药类型在40%~60%数量最多,各市菌株耐药类型不一。结论 江苏省禽源空肠弯曲杆菌耐药性比较普遍,多重耐药菌株较突出,应严格监管养殖场抗生素的使用及流通阶段食品源空肠弯曲杆菌的监测。
江苏省;空肠弯曲杆菌;分离鉴定;抗生素耐药性
食源性疾病作为一个日益严峻的公共卫生问题,正威胁着消费者的健康和利益,且与食品污染问题广泛存在于发展中国家甚至发达国家[1]。空肠弯曲杆菌(Campylobacterjejuni,C.jejuni)被认为是引起人类腹泻常见病原菌,世界流行疾病研究指出空肠弯曲杆菌主要由食品传染,禽肉产品是主要的传染源。由于空肠弯曲杆菌能够在家禽肠道内大量定植,在屠宰的过程中如果肠道破裂很容易污染屠宰场地、设施和水从而污染禽肉产品[2-3]。据2010年欧盟食品和饲料快速预警系统(RASSF)通报的数据[4],引起禽肉食品安全的微生物因素中弯曲杆菌仅次于沙门氏菌和李斯特杆菌,该菌能够通过环境或食物链进入动物和人体从而引起各种空肠弯曲病,能够引起家禽腹泻、肝炎及奶牛流产不孕等[5],人感染后其临床症状从水样腹泻到血便,同时伴有头痛、腹痛、发热、偶有呕吐[6-7]。近些年来,大量的抗生素被滥用到集约化养殖生产中,导致了动物弯曲杆菌耐药问题日益严重。目前,江苏省畜禽养殖业发展迅速,其中以苏北地区的养殖户和养殖小区为主[],因此本试验对江苏省采集的样品进行空肠弯曲杆菌分离纯化并进行抗生素敏感性分析,了解空肠弯曲菌的污染状况及耐药情况,为有效控制空肠弯曲菌污染及抗生素耐药提供科学依据和技术支撑,在提高食品安全风险管理等方面具有重要意义。
1 材料与方法
1.1 材料
1.1.1 样品采集及处理 2016年6月至2016年11月,分离江苏省徐州、盐城和扬州等市及其区县的超市和农贸市场的禽肉产品,养殖场和农贸市场泄殖腔棉拭子。禽肉样品采用灭菌PBS棉球擦拭,泄殖腔棉拭子保存至半固体运输培养基(Cary-Blair)中,共753份。所有样品低温运送至实验室,样品采用PBS适当稀释后涂板。
1.1.2 试剂及培养基 Cary-Blair半固体培养基、含6种抗生素(头孢哌酮、多粘菌素B、两性霉素B、利福平、三甲氧氨苄嘧啶、放线菌酮)的选择性CCDA培养基、MH平板、BHI培养基、27种药敏纸片均购买于英国OXOID公司;脱纤维绵羊血购买于青岛海博生物技术有限公司;引物由上海生工生物技术公司合成;rTaq酶、DNA Marker购买于宝生物工程(大连)有限公司;厌氧罐购自日本MGC公司;混合气(5%O2、10%CO2和85%N2)购于南京特种气体厂有限公司;细菌基因组DNA提取试剂盒购买于北京天根生物科技有限公司;其它为微生物试验常规试剂。
1.2 方法
1.2.1 细菌分离纯化 取100 μL PBS稀释液到含有6种抗生素的改良CCDA选择性平板上,无菌L棒涂匀后倒置于厌氧罐,充入混合气,42 ℃微需氧培养36 h后挑取可疑菌落(扁平、有金属光泽、像水滴样菌落)接种于MH血平板42 ℃微需氧培养36 h,重复2-3次,直至得到单一纯培养菌落。
1.2.2 模板DNA提取 将MH血平板纯化培养的细菌用无菌棉签刮下洗入PBS缓冲溶液,离心后去除上层液体,采用试剂盒提取基因组DNA。
1.2.3 PCR鉴定 采用二重PCR方法鉴定空肠弯曲杆菌,引物序列见表1。25 μL PCR反应体系:rTaq premix 12.5 μL,上下游引物两对(10 μM/L)各1 μL,无菌去离子水9.5 μL,模板DNA 1 μL。PCR循环参数:95 ℃预变性1 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;再72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳成像。
表1 靶基因引物序列及片段长度
Tab.1 Primer sequence and gene length
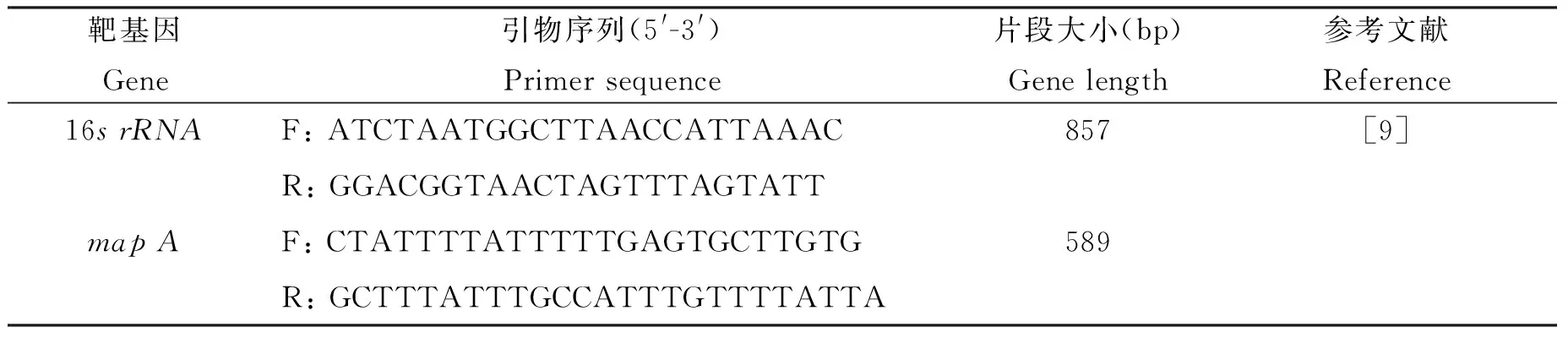
靶基因Gene引物序列(5'-3')Primersequence片段大小(bp)Genelength参考文献Reference16srRNAF:ATCTAATGGCTTAACCATTAAAC857[9]R:GGACGGTAACTAGTTTAGTATTmapAF:CTATTTTATTTTTGAGTGCTTGTG589R:GCTTTATTTGCCATTTGTTTTATTA
1.2.4 菌种保存 经PCR鉴定为空肠弯曲杆菌菌株收集于含有20%甘油的BHI培养基中,标记记录,置于-80 ℃冷冻保存。
1.2.5 药物敏感性检测
1.2.5.1 抗菌药物的选择 根据养殖场用药情况和对公共卫生的影响,选择9类27种抗生素,按照美国临床实验室标准化协会(CLSI)的标准[10],27种药敏纸片名称、含量及判断标准见表2。菌液稀释到0.5麦氏浓度后根据药敏纸片说明书进行测试,42 ℃微需氧培养36~48 h后用直尺测定抑菌圈直径(mm)。数据采用Excel2015整理分析。
表2 抗生素名称及判定标准
Tab.2 Antibiotic drugs and criterion of sensitivity tests
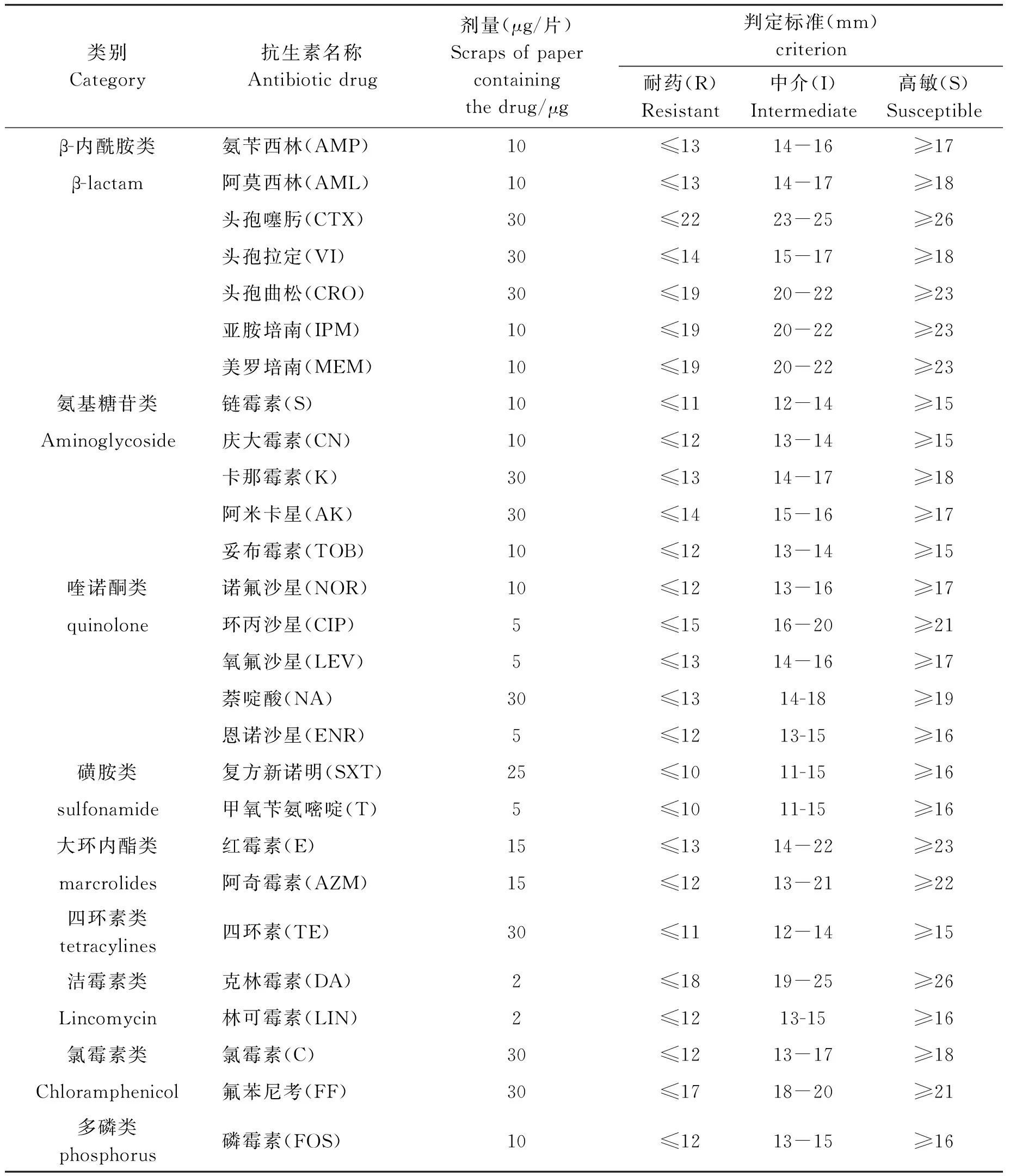
类别Category抗生素名称Antibioticdrug剂量(μg/片)Scrapsofpapercontainingthedrug/μg判定标准(mm)criterion耐药(R)Resistant中介(I)Intermediate高敏(S)Susceptibleβ-内酰胺类氨苄西林(AMP)10≤1314-16≥17β-lactam阿莫西林(AML)10≤1314-17≥18头孢噻肟(CTX)30≤2223-25≥26头孢拉定(VI)30≤1415-17≥18头孢曲松(CRO)30≤1920-22≥23亚胺培南(IPM)10≤1920-22≥23美罗培南(MEM)10≤1920-22≥23氨基糖苷类链霉素(S)10≤1112-14≥15Aminoglycoside庆大霉素(CN)10≤1213-14≥15卡那霉素(K)30≤1314-17≥18阿米卡星(AK)30≤1415-16≥17妥布霉素(TOB)10≤1213-14≥15喹诺酮类诺氟沙星(NOR)10≤1213-16≥17quinolone环丙沙星(CIP)5≤1516-20≥21氧氟沙星(LEV)5≤1314-16≥17萘啶酸(NA)30≤1314-18≥19恩诺沙星(ENR)5≤1213-15≥16磺胺类复方新诺明(SXT)25≤1011-15≥16sulfonamide甲氧苄氨嘧啶(T)5≤1011-15≥16大环内酯类红霉素(E)15≤1314-22≥23marcrolides阿奇霉素(AZM)15≤1213-21≥22四环素类tetracylines四环素(TE)30≤1112-14≥15洁霉素类克林霉素(DA)2≤1819-25≥26Lincomycin林可霉素(LIN)2≤1213-15≥16氯霉素类氯霉素(C)30≤1213-17≥18Chloramphenicol氟苯尼考(FF)30≤1718-20≥21多磷类phosphorus磷霉素(FOS)10≤1213-15≥16
1.2.5.2 质控菌株 ATCC25922大肠杆菌(Escherichiacoli)为扬州大学兽医学院惠赠。
2 结 果
2.1 空肠弯曲菌分离鉴定结果 在改良的CCDA平板上,空肠弯曲杆菌呈圆形、金属光泽菌落或扁平半透明不整齐边缘菌落生长。PCR扩增后能成功扩增出两条目的条带,857 bp为属特异性条带,589 bp为种特异性条带,图1为部分菌株鉴定结果。
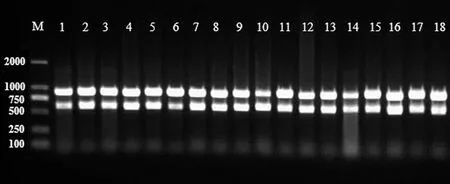
图1 部分菌株PCR鉴定结果(M: DL2000 Marker,1-18为样品编号)Fig.1 Agarose gel electrophoresis of PCR amplification
2.2 江苏省不同地区禽源空肠弯曲杆菌流行情况 从表3可以明显看出,753份样品中,共分离到207株空肠弯曲杆菌,平均分离率为27.5%,其中38份来自禽肉产品,169份来自泄殖腔棉拭样,分离率分别为24.5%和28.7%。7个城市样品分离率分别为20%(徐州)、30.9%(淮安)、25%(扬州)、23.2%(盐城)、41.9%(宿迁)、14.3%(南通)和28%(常州),宿迁空肠弯曲杆菌污染明显,南通污染程度最低。
2.3 药敏结果分析
2.3.1 抗生素敏感性检测结果 207株空肠弯曲杆菌中有194株复苏成功,对27种抗生素产生不同的敏感性,见表4。从总敏感率(敏感菌株占菌株总数的百分比)来看,对美罗培南、庆大霉素、阿米卡星、氟苯尼考和磷霉素仍具有高度敏感性,且各市敏感程度具有一致性;对于抗生素卡那霉素、红霉素、阿奇霉素和氯霉素各市敏感程度不一;所有菌株对抗生素甲氧苄氨嘧啶敏感性极低。反之,从表4可以看出,多数菌株对抗生素已经产生明显耐药性,且具有多重耐药。
表3 不同地区的空肠弯曲杆菌分离情况
Tab.3 Distribution ofC.jujeniisolated from different places and sources
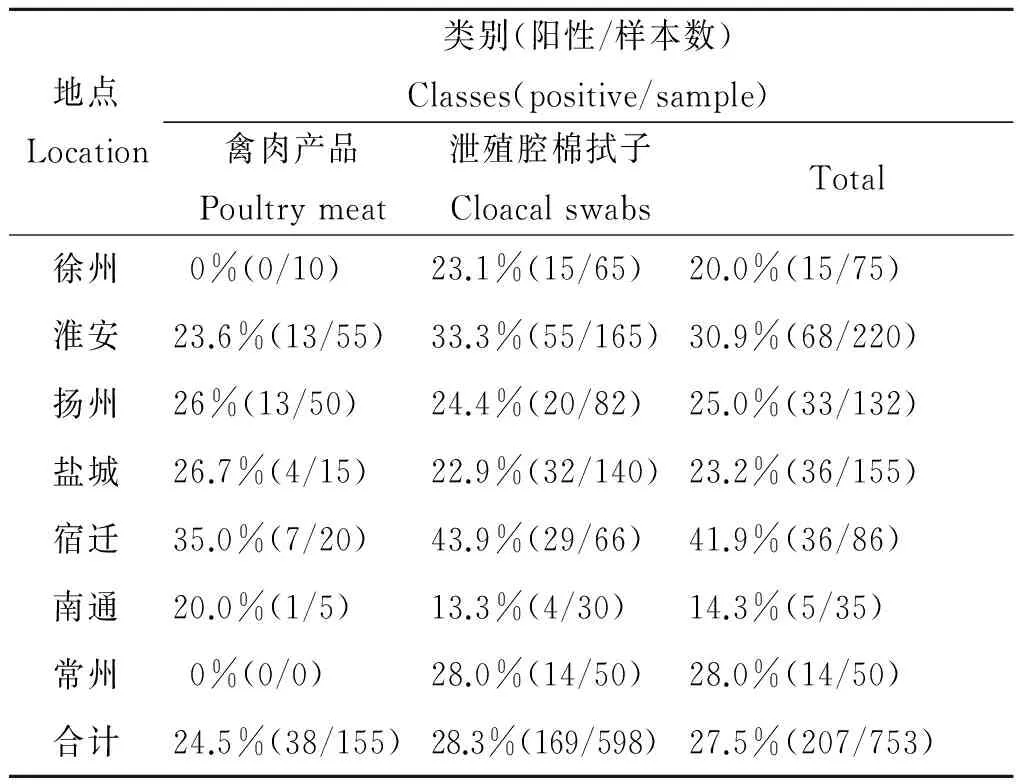
地点Location类别(阳性/样本数)Classes(positive/sample)禽肉产品Poultrymeat泄殖腔棉拭子CloacalswabsTotal徐州0%(0/10)23.1%(15/65)20.0%(15/75)淮安23.6%(13/55)33.3%(55/165)30.9%(68/220)扬州26%(13/50)24.4%(20/82)25.0%(33/132)盐城26.7%(4/15)22.9%(32/140)23.2%(36/155)宿迁35.0%(7/20)43.9%(29/66)41.9%(36/86)南通20.0%(1/5)13.3%(4/30)14.3%(5/35)常州0%(0/0)28.0%(14/50)28.0%(14/50)合计24.5%(38/155)28.3%(169/598)27.5%(207/753)
表4 27种抗生素敏感性检测结果
Tab.4 Result of sensitivity test
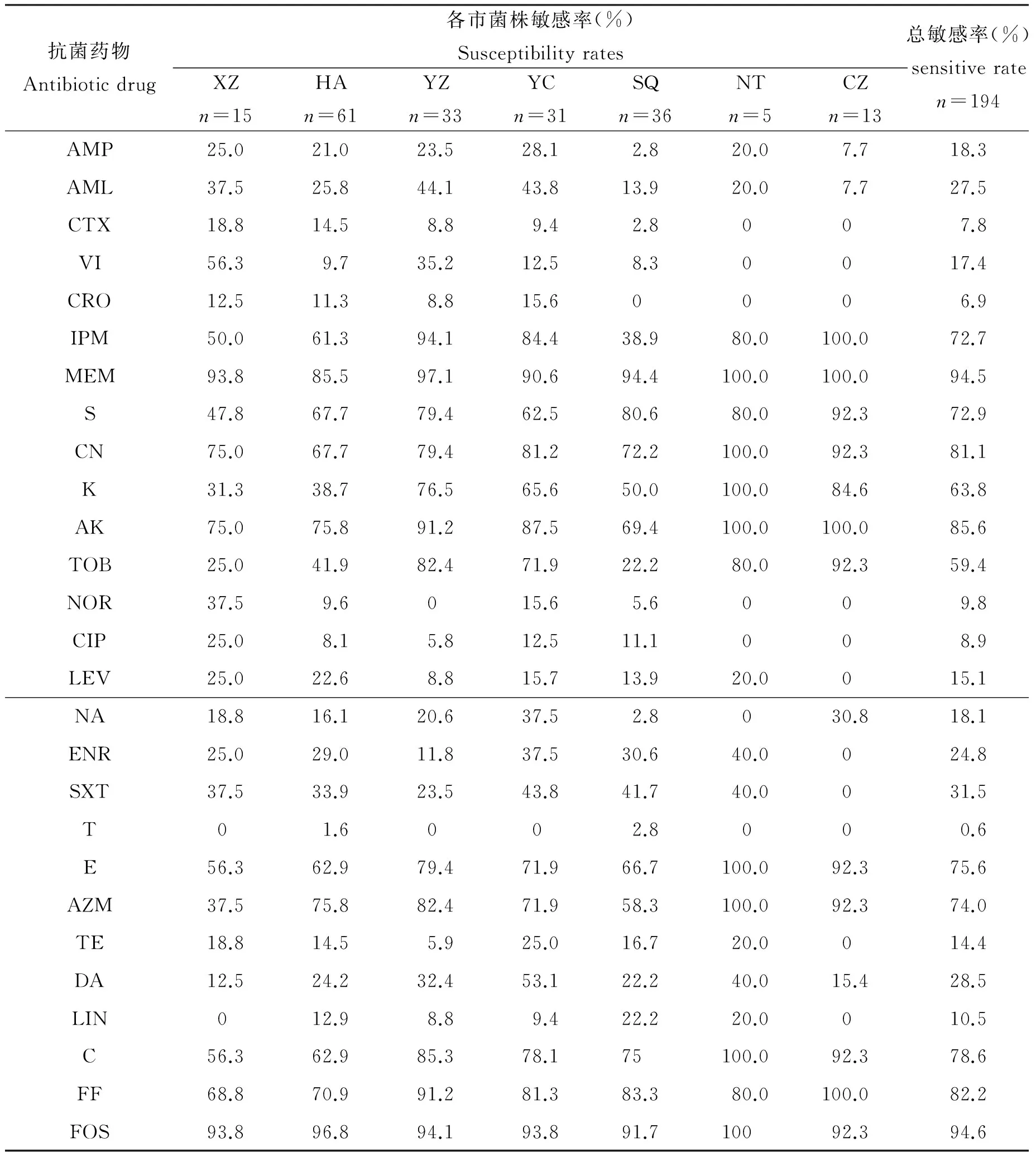
抗菌药物Antibioticdrug各市菌株敏感率(%)SusceptibilityratesXZn=15HAn=61YZn=33YCn=31SQn=36NTn=5CZn=13总敏感率(%)sensitiveraten=194AMP25.021.023.528.12.820.07.718.3AML37.525.844.143.813.920.07.727.5CTX18.814.58.89.42.8007.8VI56.39.735.212.58.30017.4CRO12.511.38.815.60006.9IPM50.061.394.184.438.980.0100.072.7MEM93.885.597.190.694.4100.0100.094.5S47.867.779.462.580.680.092.372.9CN75.067.779.481.272.2100.092.381.1K31.338.776.565.650.0100.084.663.8AK75.075.891.287.569.4100.0100.085.6TOB25.041.982.471.922.280.092.359.4NOR37.59.6015.65.6009.8CIP25.08.15.812.511.1008.9LEV25.022.68.815.713.920.0015.1NA18.816.120.637.52.8030.818.1ENR25.029.011.837.530.640.0024.8SXT37.533.923.543.841.740.0031.5T01.6002.8000.6E56.362.979.471.966.7100.092.375.6AZM37.575.882.471.958.3100.092.374.0TE18.814.55.925.016.720.0014.4DA12.524.232.453.122.240.015.428.5LIN012.98.89.422.220.0010.5C56.362.985.378.175100.092.378.6FF68.870.991.281.383.380.0100.082.2FOS93.896.894.193.891.710092.394.6
注:n代表菌株总数
Note: n means the number of strains.
2.3.2 分离菌株对27种抗生素的耐药谱分析 194株菌对27种抗生素呈现出不同的耐药性。值得注意的是,分离菌株耐药率在40%~60%数量最多(图2)。9类受试药物中,空肠弯曲杆菌对β-内酰胺类、喹诺酮类、磺胺类和四环素类抗生素的耐药率最高。其中对头孢曲松、诺氟沙星、甲氧苄氨嘧啶和四环素耐药率分别为80.9%、84.02%、100%和79.4%,一株分离自徐州的菌株对92.6%的抗生素产生耐受性。

图2 分离菌株耐药类型Fig.2 Types of resistant isolates
194株空肠弯曲杆菌对27种抗生素共产生21种耐药谱,且有相同耐药谱出现。所有菌株至少耐4种抗生素,100%菌株为多重耐药菌株(耐3种抗生素以上),药敏结果显示优势耐药谱为LIN/CTX/CRO/NOR/CIP/T/TE,分离菌株表现出耐药谱型多样性。
统计耐药类型最高(40%~60%)的菌株(共125株)的分离地域,见表5,常州多达92.9%,扬州最低,为42%。由此可见,各市菌株耐药类型不尽相同,淮安和扬州为一类,徐州、宿迁、南通、常州和盐城为一类。
表5 耐药率40%~60%分离地域分析
Tab.5 Analysis of isolation in 40%-60% resistance
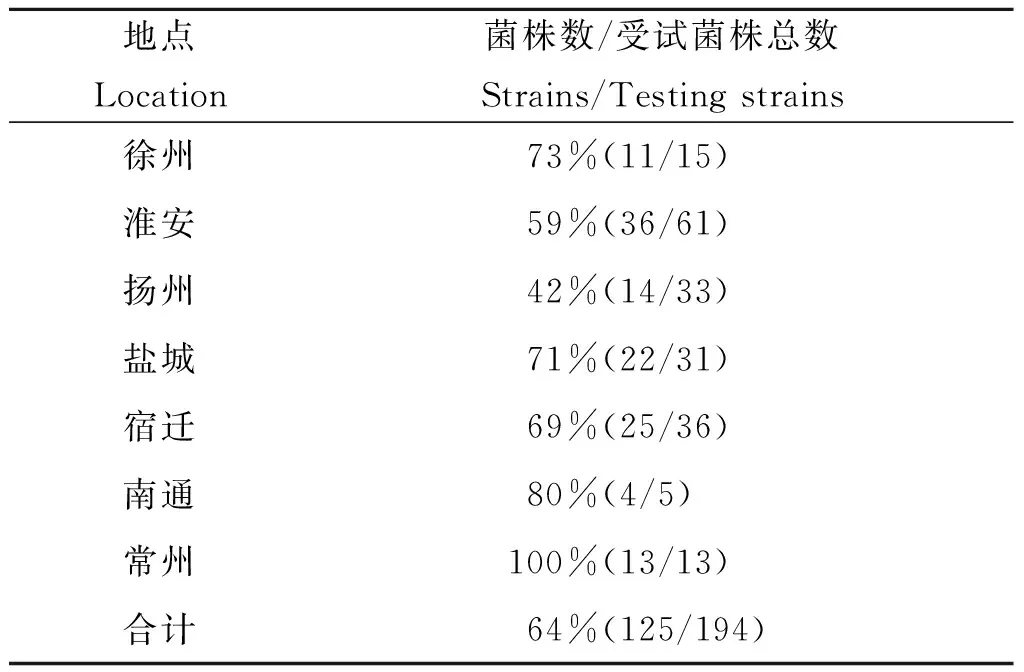
地点Location菌株数/受试菌株总数Strains/Testingstrains徐州73%(11/15)淮安59%(36/61)扬州42%(14/33)盐城71%(22/31)宿迁69%(25/36)南通80%(4/5)常州100%(13/13)合计64%(125/194)
3 讨 论
从江苏地区采集的753份样品中分离到207株空肠弯曲杆菌,分离率为27.5%,来源于养殖场的泄殖腔棉拭子阳性率略高于禽肉产品。该结果与我国一些地区有的近似,有的有较大差距。说明空肠弯曲杆菌的污染地域特征明显,受环境因素影响[11]。
成功复苏的194株空肠弯曲杆菌对9类27种抗生素耐药程度不一。其中对甲氧苄氨嘧啶、诺氟沙星、头孢曲松和四环素耐药率分别高达100%、84.02%、80.9%和79.4%,但耐药菌株对美罗培南、庆大霉素、卡那霉素、氟苯尼考和磷霉素敏感性较高,出现多重耐药现象。总体来说,菌株表现出对β-内酰胺类、喹诺酮类和磺胺类抗生素高度耐药,这与国内许多研究人员报道一致,反映出国内养殖和临床用药过程中抗生素使用情况,尤其是喹诺酮类抗生素作为治疗动物空肠弯曲杆菌病的首选药物,耐药趋势更为显著[12-14]。
在动物的养殖过程中,可根据药敏显示结果,科学地采用轮换用药等方式,有针对性地使用抗菌药物,避免抗生素滥用。同时提高养殖人员对细菌耐药性的专业意识,加强从农场到餐桌空肠弯曲杆菌监测。
[1] Xiang HQ. Food safety and foodborne disease control[J]. J Med Res,2005, 34(6): 71-73. (in Chinese)
相洪琴. 食品安全与食源性疾病控制. 医学研究通讯, 2005, 34(6): 71-73.
[2] Gripp E, Hlahla D, Didelot X, et al. Closely relatedCampylobacterjejunistrains from different sources reveal a generalist rather than a specialist lifestyle[J]. BMC Genomics, 2011, 12: 584.
[3] Rasschaert G, Houf K, Van Hende J, et al.Campylobactercontamination during poultry slaughter in Belgium[J]. J Food Prot, 2006, 69(1): 27-33.
[4] Liang CB, Zhou GC. The summary of EU food and feed rapid alert in 2010[J]. Meat Indus, 2011, 3: 44-45. (in Chinese)
梁成彪, 周广灿. 2010年欧盟食品和饲料快速预警通报(RASSF)中肉类产品汇总分[J]. 肉类工业, 2011, 3: 44-45.
[5] Ang CW, Van Doorn PA, Endtz HP, et al. A case of guillain-barre syndrome following a family out break ofCampylobacterjejunienteritis[J]. J Neuroimmunol, 2000, 11(2): 2229-2233.
[6] Snelling WJ, Matsuda M, Moore JE, et al.Campylobacterjejuni[J]. Lett Appl Microbiol, 2005, 41(4): 297-302. DOI: 10.1111/j.1472-765X.2005.01788.x
[7] Black RE, Levine MM, Clements ML, et al. ExperimentalCampylobacterjejuniinfection in humans[J]. J Infect Dis, 1988, 157(3): 472-479.
[8] Fang Y, Zhou CH. The present situation and the analysis of Jiangsu animal husbandry scale cultivation[J]. Guide Chinese Poul, 2007, 24(11): 17-18. (in Chinese)
方昳, 周春红. 江苏省畜牧规模养殖现状与分析[J]. 中国禽业导刊, 2007, 24(11): 17-18.
[9] He R, Huang JL, Xu HY, et al. Development and application of multiplex PCR assay for the detection ofCampylobacterspp[J]. J Yangzhou Uni (Agri Life Sci Edit), 2007, 28(1): 5-8. (in Chinese)
何蕊, 黄金林, 许海燕, 等. 弯曲菌多重PCR检测方法的建立及其初步应用[J]. 扬州大学学报(农业与生命科学版), 2007, 28(1): 5-8.
[10] Clinical and Laboratory Standards Instiute. Mwthods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically[S]. NCCLS; 2009.
[11] Chen X, Liu SL, Wu CM. Contamination analysis and PFGE typing ofCampylobacterjejuniisolated from chicken production chain[J]. Chin J Zoonoses, 2012, 28(10): 1012-1016. (in Chinese)
陈荀, 刘书亮, 吴聪明. 鸡肉生产链中空肠弯曲杆菌的污染分析及PFGE分型研究[J]. 中国人兽共患病学报, 2012, 28(10): 1012-1016.
[12] Pang JP, Yang FE, Hou JJ, et al. Distribution of antibiotic resistance of animal-originCampylobacterjejuni[J]. Chin J Vter Med, 2009, 43(1): 10-13. (in Chinese)
潘剑平, 杨凤娥, 侯建军, 等. 动物源性空肠弯曲杆菌耐药性地域差异性分析[J]. 中国兽药杂志, 2009, 43(1): 10-13.
[13] Hang XF, Liu SL, Chen X, et al. Antimicrobial resistance analysis ofCampylobacterjejuniisolates from chicken production chain[J]. Chin J Zoonoses, 2013, 29(2): 199-204. (in Chinese)
韩新锋, 刘书亮, 陈荀, 等. 鸡肉生产链空肠弯曲杆菌的耐药性研究[J]. 中国人兽共患病学报, 2013, 29(2): 199-204.
[14] Zeng H, Peng JF, Huang J, et al. Isolation, antimicrobial resistance profile and virulence gene analysis of Campylobacter spp. originated from duck[J]. Chin J Zoonoses, 2017, 33(1): 15-21. (in Chinese)
曾杭, 彭峻烽, 黄静, 等. 鸭源弯曲菌的分离鉴定及其耐药性、毒力基因分析[J]. 中国人兽共患病学报, 2017, 33(1): 15-21.
Isolation, identification and antimicrobial resistance ofCampylobacterjejuniisolates from poultry in Jiangsu Province
ZHOU Qian, TANG Meng-jun, ZHANG Xiao-yan, ZHANG Jing, TANG Xiu-jun,GU Rong, LIU Yin-yin, GAO Yu-shi
(PoultryInstitute,ChineseAcademyofAgriculturalScience,Yangzhou225125,China)
The aim of the research is to study the prevalence and antimicrobial resistance ofCampylabocterjejuniisolated from poultry in Jiangsu Province. A total of 753 samples from poultry meat and cloacal swabs were investigated, after the pure culture and the polymerase chain reaction of themapAgene, 207 isolates were examined for antimicrobial resistance by using K-B method according to World Health Organization. Results showed that all isolates performed different degree of antimicrobial resistance except meropenem, gentamycin, kanamycin, florfenicol and fosfomycin, the resistance rates of 194 strains to trimethoprim, norfloxacin, ceftriaxone and tetracycline were 100%, 84.02%, 80.9% and 79.4% respectively, 1 strain isolated from Xuzhou was resistant to 92.6% antibiotics. The multi-drug resistance appeared and the advantage of drug-resistant spectrum was LIN/CTX/CRO/NOR/CIP/T/TE, the resistant type focused on 40%-60%. The research provided evidence for surveillance of the antimicrobial resistance ofC.jejuniand highlighted the need to employ more prudent use of critically important antimicrobial.
Jiangsu Province;Campylobacterjejuni; isolation and identification; antimicrobial resistance
Gao Yu-shi,Email: gaoys100@sina.com
10.3969/j.issn.1002-2694.2017.06.005
十三五国家重点研发计划高危金属中毒病防控技术研究(2016YFD0501208)、扬州市社会发展(YZ2016058)、2017国家农产品质量安全风险评估重大专项(GJFP2017007)、扬州市家禽质量安全科技服务平台建设项目(yz2015162)联合资助
高玉时,Email:gaoys100@sina.com
中国农业科学院家禽研究所,扬州 225125
R378
A
1002-2694(2017)06-0495-06
2016-12-29 编辑:李友松
Supported by the National Key Research and Development Program of China(No.2016YFD0501208), the Social Development Project of Yangzhou(YZ2016058),the National Major Project for Agro-product Quality & Safety Risk Assessment (No.GJFP2017007), the Yangzhou Technology Service Platform Construction of the Quality and Safety of Poultry Science (No.yz2015162)
