3-甲基-5-羟基-1-取代-1H-吡唑的合成及其光谱性质
2017-06-27周冬雪吕成伟
安 悦, 周冬雪, 王 宁, 吕成伟
(辽宁师范大学 化学化工学院,辽宁 大连 116029)
3-甲基-5-羟基-1-取代-1H-吡唑的合成及其光谱性质
安 悦, 周冬雪, 王 宁, 吕成伟
(辽宁师范大学 化学化工学院,辽宁 大连 116029)
以取代羧酸和氨基硫脲为初始原料,经多步反应合成中间体2-肼基-5-取代-1,3,4-噻二唑,再将其与乙酰乙酸乙酯反应,设计合成9个含l,3,4-噻二唑取代基的3-甲基-5-羟基-1-取代-1H-吡唑类化合物(4a~4i),其中,8个为新化合物.借助IR、NMR、元素分析等技术手段对所合成化合物的结构进行了表征.运用高斯程序对9种化合物中可能存在的异构体的能量进行了理论计算.计算结果表明:化合物以烯醇式结构存在时的能量最低,稳定性最好.此外,通过紫外光谱测试讨论了烯醇式与酮式的互变异构现象及其影响因素.通过荧光光谱测试,发现化合物4c的荧光强度最强,将其对金属阳离子做离子识别筛选实验,其对Cu2+有选择性识别作用.将化合物4c作为Cu2+荧光猝灭型探针,不受其他常见的阳离子干扰,对Cu2+具有较高的选择性响应.
羟基吡唑;烯醇式互变;合成;荧光探针;Cu2+
随着杂环化合物的发展,吡唑类衍生物因具有较强的药理活性备受关注,出现在大量的药剂和天然产物中,如吡唑类药物塞来昔布(COX-2抑制剂)和吡唑呋喃菌素等.羟基吡唑因自身的结构特点,具有广泛的生物活性和较强的配位能力,因此一直受到人们的青睐,其中,以5-羟基吡唑为骨架的化合物在医药、配位、荧光等领域更得到了广泛的应用[1-3].在医药方面,此类化合物具有重要的生物活性,如抗朊病毒抗炎抗菌活性,拮抗胰高血糖素受体的作用等[4-5].在配位方面,由于含有N、O杂原子,可作为有机配体.在荧光方面,通过分子荧光技术,可以作为分子识别的重要手段[6].铜是生命系统中重要的微量元素和必需的营养素,毒性很小,铜的缺乏可导致生长和代谢的紊乱[7],其在细胞中平衡的改变会导致抑制神经性疾病的发生,如Menkes综合征、家族遗传性脊侧索硬化、Alzheimers病和Prion病等[8].由于铜对生命活动的重要性,其在细胞中的分布受到严格的控制,因此检测Cu2+,尤其是在生命活动过程中的作用具有重要意义[9].因此,本文比较详细地探讨了化合物4c对Cu2+的快速选择和识别作用.
1 实验部分
1.1 仪器和试剂
X-5型熔点测定仪(北京泰克仪器有限公司);TENSOR-27傅立叶变换红外光谱仪(KBr压片,瑞士Bruker 公司);Bruker Avance-500Mz型核磁共振仪(瑞士Bruker公司),DMSO-d6为溶剂,TMS为内标;Vario Elcube CHNS/O元素分析仪;UV-240紫外光谱仪(日本岛津公司);HITACHI F-7000荧光光谱仪(日本日立公司).所用试剂均为分析纯,中间体1~3按文献[10]方法制备.
1.2 目标化合物4a~4i的合成:以目标化合物4a为例
合成路线如图1.

图1 目标化合物的合成路线Fig.1 Target compounds synthesis routes
向两口反应瓶中,分别加入5.76 g(0.03 mol)5-苯基-1,3,4-噻二唑-2-肼与4.55 g(0.035 mol)乙酰乙酸乙酯,于95 ℃加热10 min,然后再缓慢加入2 mL冰醋酸,待有大量固体析出,TLC监测,反应物消失,反应完毕后,冷却至室温,减压抽滤,将所得粗产物用无水乙醇重结晶,得到淡黄色针状化合物4a,产率66.3%.同样方法制得化合物4b~4i.
相关测试数据如下:
3-甲基-5-羟基-1-(5-苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4a):淡黄色针状晶体,收率:66.3%,m.p.239~241 ℃(文献值[11]:241 ℃).1H NMR(DMSO-d6,500 MHz)δ:12.93(s,1H,OH),7.92(m,2H,Ph),7.40(m,1H,Ph),7.52(m,2H,Ph),5.33(s,1H,Pyrazole),2.25(s,3H,CH3);13C NMR (125 MHz,DMSO-d6)δ:160.54,131.35,129.65,128.85,128.04,113.67,110.64,97.45,57.10,13.57;IR(KBr)ν/cm-1:3 115,3 020,2 856,2 711,1 634,1 556,1 462,1 395,1 348,1 255,1 182,970,778,690,685.Anal.calcd.for C12H10N4OS:C 55.80,H 3.90,N 21.69;Found:C 55.75,H 3.86,N 21.65.
3-甲基-5-羟基-1-(5-4-甲基苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4b):黄色粉末状固体,收率:64.5%,m.p.258~260 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.91(s,1H,OH),7.87(d,2H,J=8.0 Hz,Ph),7.36(d,2H,J=8.0 Hz,Ph),5.32(s,1H,Pyrazole),2.41(s,3H,CH3),2.24(s,3H,CH3);13C NMR(125 MHz,DMSO-d6)δ:161.80,157.79,154.96,131.35,128.85,124.04,113.67,111.96,91.45,57.10,12.87;IR(KBr)ν/cm-1:3 446,3 147,2 908,2 887,2 853,1 646,1 567,1 477,1 397,1 353,1 252,1 187,958,789,734,669.Anal.calcd.for C13H12N4OS:C 57.34,H 4.44,N 20.57;Found:C 55.30,H 4.41,N 20.54.
3-甲基-5-羟基-1-(5-4-氯苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4c):浅黄色针状晶体,收率:70.5%,m.p.271~273 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.89(s,1H,OH),8.06(d,2H,J=8.6 Hz,Ph),7.61(d,2H,J=8.6 Hz,Ph),5.33(s,1H,Pyrazole),2.26(s,3H,CH3);13C NMR(125 MHz,DMSO-d6)δ:161.80,154.96,131.35,128.85,124.04,113.67,111.96,91.45,57.10,12.87;IR(KBr)ν/cm-1:3 448,3 113,2 912,2 845,2 726,1 632,1 550,1 468,1 386,1 237,1 170,969,783,672.Anal.calcd.for C12H9N4OSCl:C 49.23,H 3.10,N 19.14;Found:C 49.20,H 3.06,N 19.11.
3-甲基-5-羟基-1-(5-4-氟苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4d):黄色针状晶体,收率:68.5%,m.p.271.3~273.4 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.94(s,1H,OH),8.06(d,J=10.0 Hz,2H,Ph),7.41(d,J=10.0 Hz,2H,Ph),5.33(s,1H,Pyrazole),2.26(s,3H,CH3);13C NMR(125 MHz, DMSO-d6)δ:162.10,144.79,134.96,131.35,128.85,113.67,111.75,91.45,57.10,12.87;IR(KBr)ν/cm-1:3 423,3 000,2 813,1 651,1 547,1 445,125,1164,1061,1033,901,799,733.Anal.calcd.for C12H9N4OSF:C 52.17,H 3.28,N 20.28;Found:C 52.14,H 3.24,N 20.23.
3-甲基-5-羟基-1-(5-2-氟苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4e):土黄色针状晶体,收率:60.8%,m.p.244~246 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.94(s,1H,OH),8.23(m,1H,Ph),7.63(dd,J=7.33 Hz,J=6.55 Hz ,1H,Ph),7.48(m,1H,Ph),7.41(m,1H,Ph),5.32(s,1H,Pyrazole),2.26(s,3H,CH3);13C NMR(125 MHz,DMSO-d6)δ:163.36,158.10,154.57,143.79,134.86,130.39,129.85,124.57,113.55,92.35,57.10,12.87;IR(KBr)ν/cm-1:3 429,3 110,3 015,2 850,2 338,1 638,1 543,1 508,1 465,1 360,1 093,971,763,677.Anal.calcd.for C12H9N4OSF:C 52.17,H 3.28,N 20.28;Found:C 52.14,H 3.24,N 20.23.
3-甲基-5-羟基-1-(5-4-甲氧基苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4f):白色针状晶体,收率:57.5%,m.p.259~260 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.87(s,1H,OH),7.92(d,J=8.8Hz,2H,Ph),7.09(d,J=8.6 Hz,2H,Ph),5.31(s,1H,Pyrazole),3.84(s,3H,OCH3),2.25(s,3H,CH3);13C NMR (125 MHz,DMSO-d6)δ:163.60,160.53,144.53,133.56,128.35,127.43,115.35,111.76,91.45,57.10,12.87;IR (KBr) ν/cm-1:3 441,3 029,2 842,2 720,1 632,1 558,1 474,1 277,1 164,1 052,911,780,677.Anal.calcd.for C13H12N4O2S:C 54.15,H 4.20,N 19.43;Found:C 54.13,H 4.18,N 19.41.
3-甲基-5-羟基-1-(苯乙烯基-1,3,4-噻二唑-2-基)-1H-吡唑(4g):黄色粉末状固体,收率:69.7%,m.p.249~251 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.95(s,1H,OH),7.73(d,J=7.6 Hz,2H,Ph),7.51(d,J=7.4 Hz,2H,Ph),7.42(m,1H,Ph),7.38(d,J=6.8 Hz,1H,CH),7.36(d,J=6.8,1H,CH),5.33(s,1H,Pyrazole),2.23(s,3H,CH3);13C NMR(125 MHz,DMSO-d6)δ:156.62,146.73,134.76,133.56,130.85,127,93,125.75,111.76,106.78,101.68,91.45,14.27;IR(KBr)ν/cm-1:3 423,3 000,2 860,2 776,1 623,1 548,1 454,1 360,1 183,948,807,752,658.Anal.calcd.for C14H12N4OS:C 59.14,H 4.25,N 19.70;Found:C 59.10,H 4.23,N 19.68.
3-甲基-5-羟基-1-(5-3-氯-4-甲氧基苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4h):无色针状固体,收率:67.5%,m.p.249~251 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.99(s,1H,OH),8.05(s,1H,Ph),7.92(d,J=7.4 Hz,1H,Ph),7.31(d,J=7.4 Hz,1H,Ph),5.33(s,1H,Pyrazole),3.95(s,3H,OCH3),2.25(s,3H,CH3);13C NMR(125 MHz,DMSO-d6)δ:162.72,156.53,144.66,136.46,130.85,128,73,127.63,118.59,106.78,101.54,91.35,54.67,14.25;IR(KBr)ν/cm-1:3 450,3 010,2 916,2 851,2 757,2 354,1 632,1 567,1 454,1 277,1 173,1 014,799.Anal.calcd.for C13H11N4O2SCl:C 48.37,H 3.44,N 17.36;Found:C 48.34,H 3.41,N 17.34.
3-甲基-5-羟基-1-(5-3-溴-4-甲氧基苯基-1,3,4-噻二唑-2-基)-1H-吡唑(4i):橘黄色针状固体,收率:61.7%,m.p.229~231 ℃;1H NMR(DMSO-d6,500 MHz)δ:12.95(s,1H,OH),8.15(d,J=7.6 Hz,1H,Ph),7.96(d,J=7.6 Hz,1H,Ph),7.25(s,1H,Ph),5.32(s,1H,Pyrazole),3.94(s,3H,OCH3),2.25(s,3H,CH3);13C NMR(125 MHz,DMSO-d6)δ:165.67,155.63,144.76,135.46,130.76,127.63,127.25,119.80,108.68,101.54,91.45,54.87,14.27;IR(KBr)ν/cm-1:3 413,2 982,2 842,2 354,1 623,1 558,1 454,1 277,1 200,1 052,892,799,658.Anal.calcd.for C13H11N4O2SBr:C 42.52,H 3.03,N 15.26;Found:C 42.50,H 3.00,N 15.24.
2 结果与讨论
2.1 理论计算[12]
5-羟基吡唑与吡唑啉酮为互变异构体.利用Gauss View软件,得到化合物4c的结构模型,采用HF方法,3-21G基组,通过使用Gaussian 09W软件对其中2种异构形式的能量进行计算,结果如图2.化合物4a~4i都有2种可能的互变异构形式A与B,由计算结果可以看出,烯醇式的能量较低,可稳定存在.这一结论与红外、核磁氢谱、核磁碳谱等数据是一致的.
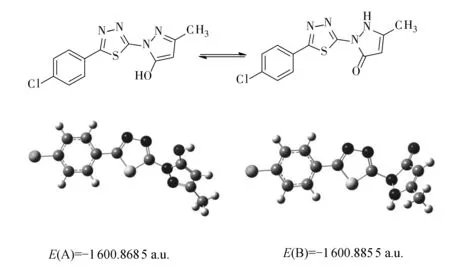
图2 互变异构体的构象及最低能量值Fig.2 The conformational and lowest energy values of tautomers
2.2 紫外光谱
2.2.1 化合物4a~4i紫外吸收特征 以二甲基亚砜为溶剂,将化合物配成浓度为1×10-5mol·L-1的溶液,在260~450 nm范围内测定紫外光谱,结果如图3所示.从图3可以看出,化合物4a~4i在260~350 nm的紫外区均产生2条强吸收带,290 nm处的紫外吸收主要是由于吡唑环上的π→π*跃迁所致,320 nm处的紫外吸收主要是由于吡唑环上的n→π*跃迁所致.9个化合物相比,化合物4g的紫外吸收峰发生明显的红移现象,这是由于4g化合物结构中苯环与噻二唑环间通过碳碳双键连接,共轭程度大,使其最大波长向长波方向移动.其他化合物的紫外吸收峰位置大致相近,这是由于这些化合物结构相似,只有苯环上的取代基不同,因此影响较小,紫外吸收峰位置无明显变化.

图3 化合物4a~4i紫外吸收光谱Fig.3 Compounds 4a~4i UV absorption spectra
2.2.2 pH对紫外吸收的影响 向浓度为1×10-5mol·L-1的4a~4i溶液中加入10 μL,1 mol·L-1的NaOH溶液(pH=9),最大吸收波长均发生了蓝移,紫外光谱如图4所示.以化合物4b为例,当向其中加入10 μL,1 mol·L-1的盐酸(pH=2.7),最大吸收波长没有变化.其主要原因是在碱性条件下,化合物以酮式结构存在; 而在酸性条件下,化合物以烯醇式结构存在.
2.2.3 光照对紫外吸收的影响 在室温下通过日光灯照射,裸眼即可观察到溶液颜色由无色变为黄色.如图5所示,随光照时间的延长,最大吸收波长发生蓝移现象,这是由于吡唑环上的羟基在空气中被氧化,转变为酮式结构,同时也证明了在溶液中,化合物主要以烯醇式存在,与理论计算,红外,核磁等表征均相符.

图4 化合物4b加酸和加碱的紫外吸收光谱Fig.4 The UV absorption spectra of compound 4b with acid and base addition

图5 光照对化合物4b紫外吸收光谱的影响Fig.5 The effect of light on the absorption spectra of compound 4b
2.3 荧光光谱分析
2.3.1 化合物4a~4i荧光性质 配制浓度为1×10-5mol·L-1的化合物4a~4i的溶液,以320 nm波长光激发,狭缝宽度为5 nm/5 nm,电压为500 V测试,在370~410 nm出现最大发射峰,与其他化合物相比,4c的荧光强度较强,这是由于苯环上连的氯原子电负性大,具有较强的吸电子作用,吡唑环上连有羟基和甲基等供电子基团,增大了电子转移程度,使荧光强度较强.
2.3.2 化合物4c对各金属离子的选择性荧光识别 由于化合物4c的荧光强度较强,配制浓度为1×10-5mol·L-1的4c的二甲基亚砜溶液,分别加入15 μL,10 mmol·L-1的K+、Na+、Ni2+、Pb2+、Al3+、Cr3+、Mn2+、Cu2+、Fe2+、Co2+、Hg2+、Cd2+、Zn2 +、Ag+、Ba2+、Fe3+等金属阳离子的溶液,分析其荧光光谱的变化情况.实验结果表明:Cu2+能引起4c明显的荧光猝灭,其他金属离子对其影响很小,甚至没有影响,如图6.因此可以得出结论:化合物4c能够选择性地识别Cu2+,可作为Cu2+的荧光猝灭型探针.
2.3.3 Cu2+对探针分子4c的荧光滴定试验 图7为探针分子4c的1.0×10-5mol·L-1的二甲基亚砜溶液,随着Cu2+浓度的增加,探针分子的荧光强度逐渐减弱,当Cu2+的浓度为5.4×10-5mol·L-1时,荧光强度不再发生变化,即达到饱和浓度.
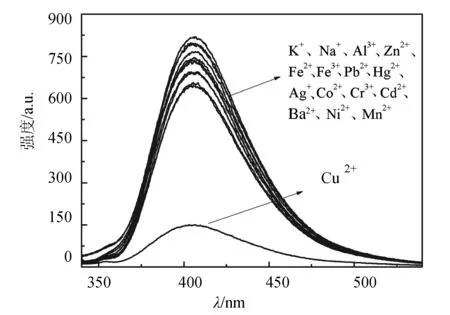
图6 化合物4c(1×10-5mol·L-1)对各种金属离子的荧光响应Fig.6 Fluorescence response of compound 4c(1×10-5mol·L-1) to various metal ions

图7 在4c中加入不同浓度Cu2+的荧光变化曲线插图:Cu2+滴定4c的荧光变化情况Fig.7 The fluorescence curves of Cu2+ at different concentrations were added to 4c Inset:The variations of fluorescence intensity of Cu2+ titration 4c
2.3.4 探针4c与Cu2+的络合研究 为了确定探针分子4c与金属离子之间的络合比,绘制了探针4c和Cu2+的络合曲线,利用Job’s Plot方法[13],按照总浓度为2.0×10-5mol·L-1,浓度比分别为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2和9∶1的比例,配制一系列4c与Cu2+的混合溶液.从图8曲线可以清楚地看出,当Cu2+的摩尔分数是0.5时,紫外吸收峰出现交叉点,表明探针化合物4c与Cu2+络合比为1∶1.
2.3.5 竞争性研究 为了考察其他金属离子对Cu2+干扰,在4c的二甲基亚砜溶液中加入等体积的,浓度为5.4×10-3mol/L的其他金属离子,再分别加入Cu2+后,其荧光强度的变化如图9所示.从图9可以看出,在其他干扰离子存在时,探针4c对Cu2+的荧光强度基本保持不变.实验结果证明探针4c对Cu2+的抗干扰能力较强,是一个有着高选择性的荧光猝灭型探针.

图8 4c-Cu2+的Job’s plot曲线图(化合物总浓度为2.0×10-5 mol·L-1)Fig.8 Job’s plot of 4c-Cu2+ (Total concentration is 2.0×10-5 mol·L-1)

图9 其他金属离子对4c-Cu2+识别的干扰实验Fig.9 Interference experiment of the other metal ions on 4c-Cu2+
2.3.6 猝灭机理 据文献[14]报道,如果羟基吡唑环上的5位没有羟基,就不能识别Cu2+,而且对其他金属离子也没有响应,因此可以推测:羟基吡唑上的O原子、噻二唑环上的N原子都有可能参与了Cu2+的络合作用,从而对其进行有效识别,Cu2+的加入会导致吡唑环上电子或者能量从激发态的4c上转移到金属离子Cu2+,导致其荧光猝灭.
3 结 论
设计合成9个含l,3,4-噻二唑取代基的3-甲基-5-羟基-1-取代-1H-吡唑类化合物,通过红外、核磁氢谱、碳谱及对异构体能量的理论计算,证明此类化合物以烯醇式形式稳定存在,并测定了其紫外光谱和荧光光谱.荧光光谱测试表明:合成的3-甲基-5-羟基-1-取代-1H-吡唑类化合物均发射紫色荧光,由于化合物4c的荧光强度较强,研究了其对常见金属阳离子的选择性识别作用.发现化合物4c可作为Cu2+荧光猝灭型探针,受常见的阳离子干扰较小,对Cu2+有较高的选择性.研究结果为进一步对该类化合物可作为性能优越的Cu2+荧光探针提供参考.
[1] CADIEUX J A,ZHANG Z,MATTICE M,et al.Synthesis and biological evaluation of substituted pyrazoles as blockers of divalent metal transporter 1 (DMT1)[J].Bioorganic & Medicinal Chemistry Letters,2012,22(1):90-95.
[2] CHENG X Y,WANG M F,YANG Z Y,et al.Synthesis,characterization,crystal structure,and biological activities of transition metal complexes with 1-Phenyl-3-methyl-5-hydroxypyrazole-4-methylene-8′-quinolineimine[J].Zeitschrift für anorganische und allgemeine Chemie,2013,639(5):832-841.
[3] NING T,LIU L,JIA D,et al.Aggregation-induced emission,photochromism and self-assembly of pyrazolone phenlysemicarbazones[J].Journal of Photochemistry and Photobiology A:Chemistry,2014,291(1):48-53.
[4] BEKHIT A A,ABDEL-RAHMAN H M,GUEMEI A A.Synthesis and biological evaluation of some hydroxypyrazole derivatives as anti-inflammatory-antimicrobial agents[J].Archivder Pharmazie,2006,339(2):81-87.
[5] KIMATA A,NAKAGAWA H,OHYAMA R,et al.New series of antiprion compounds:pyrazolone derivatives have the potent activity of inhibiting protease-resistant prion protein accumulation[J].Journal of Medicinal Chemistry,2007,50(21):5053-5056.
[6] QIN J C,CHENG X,FANG R,et al.Two schiff-base fluorescent sensors for selective sensing of aluminum(Ⅲ):experimental and computational studies[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2016,152(5):352-357.
[7] 金晶,王禹晴,曲秀娟.一个 Cu(Ⅱ)配位超分子的研制及光物理性质[J].辽宁师范大学学报(自然科学版),2014,37(1):83-87.
[8] LI H G,YANG Z Y,QIN D D.A new schiff-base type selective fluorescent chemosensor for Cu2+[J].Inorganic Chemistry Communications,2009,12(6):494-497.
[9] 吴婧,徐助雄,王炳祥.1,5-二芳基-3-(2-羟基-4,6-二甲氧基苯基)-2-吡唑啉的合成及氟离子荧光探针行为[J].高等学校化学学报,2010,31(11):2201-2205.
[10] 姚明星,安悦,闫杰,等.含吡唑取代基的1,2,4-三唑[3,4-b]-1,3,4-噻二唑类衍生物的合成及生物活性[J].有机化学,2013,33(5):1015-1021.
[11] 金岡又雄.Synthesis of related compounds of thiosemicarbazide.Ⅳ.1-(1,3,4-thiadiazol-2-yl)-2-pyrazolin-5-one and tetrazolo [4,5-a]-1,3,4-thiadiazole derivatives[J].Chemical and Pharmaceutical Bulletin,1958,6(4):382-386.
[12] CIOLKOWSKI M,PANETH P,LORENZ I P,et al.Tautomeric forms study of 1 H-(2′-pyridyl)-3-methyl-5-hydroxypyrazole and 1 H-(2′-pyridyl)-3-phenyl-5-hydroxypyrazole.Synthesis,structure,and cytotoxic activity of their complexes with palladium (Ⅱ) ions[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2009,24(6):1257-1268.
[13] LI M M,ZHAO W B,ZHANG T T,et al.A new thiophenyl pyrazoline fluorescent probe for Cu2+in aqueous solution and imaging in live cell[J].Journal of fluorescence,2013,23(6):1263-1269.
[14] 张婷婷.基于吡唑啉结构的荧光探针的合成,结构表征,光学性质研究及应用[D].济南:山东大学,2014.
Synthesis and spectral properties of 3-methyl-5-hydroxy-1-substituted-1H-pyrazole
ANYue,ZHOUDongxue,WANGNing,LÜChengwei
(School of Chemistry and Chemical Engineering, Liaoning Normal University, Dalian 116029, Chian)
The intermediate 2-hydrazino-5-substituted-1,3,4-thiadiazole was synthesized by a series of reactions with carboxylic acid and thiosemicarbazone as raw materials,and then reacted with ethyl acetoacetate,3-methyl-5-hydroxy-1-substituted-1H-pyrazole compounds (4a~4i) were synthesized of nine compounds containing the substituent with 1,3,4-thiadiazole,eight of them were new compounds.The structures of all the compounds were confirmed by means of infrared spectrum,NMR and elemental analysis.The energies of the isomers in the nine compounds were calculated by Gaussian program.The calculated results show that the compounds in the enol structure of the lowest energy,it can be stable existence.In addition,the isomerization phenomena of enol and keto forms and their affect factors were discussed by UV spectroscopy.By using fluorescence spectroscopy,these results suggest that compound 4c had the significant increase of the fluorescence intensity then, in the ion selective screening experiment of metal cations, it was found that it had selective recognition of Cu2+.The probe 4c was used as a Cu2+fluorescence quenching probe,and found that other common cationic did not induce obvious fluorescence change,indicating the high selectivity of the probe 4c to Cu2+.
hydroxypyrazole;enol-type interconversion;synthesis;fluorescence probe;copper ions
2016-11-15
国家自然科学基金资助项目(21403100);辽宁省教育厅科学技术研究一般项目(L2014421)
安悦(1963-),女,辽宁兴城人,辽宁师范大学教授,硕士.E-mail:anyue_11@163.com
1000-1735(2017)02-0215-07
10.11679/lsxblk2017020215
O626.25
A
