高铁酸钾对水中锑的去除机理研究
2017-06-27周雪婷何诗韵郑刘春蓝冰燕李来胜
周雪婷, 何诗韵, 郑刘春, 蓝冰燕, 李来胜
(华南师范大学化学与环境学院, 广州 510006)
高铁酸钾对水中锑的去除机理研究
周雪婷, 何诗韵, 郑刘春, 蓝冰燕*, 李来胜*
(华南师范大学化学与环境学院, 广州 510006)
用实验室制备的高铁酸钾对水溶液中的三价锑进行去除性能研究. 高铁酸钾对水中三价锑的去除包含2步:一是高铁酸钾对三价锑的氧化,二是原位生成的高铁酸钾分解产物对锑的吸附. XRD和FTIR检测表明高铁酸钾的分解产物符合无定型的2线水铁矿,比表面积大,孔隙率高. 吸附实验结果表明:低pH更有利于锑的吸附;而离子强度对锑的吸附,在pH 3.5~5.5与pH 5.5~7.0这2个区间有着截然相反的影响;吸附动力学过程拟合以准二级动力学拟合最好(R2=0.999 1),说明以化学吸附为主;吸附等温线拟合以Freundlich模型最优(R2=0.980 4),而使用Langmuir-Freundlich模型拟合时最大吸附量的理论值可达到129.93 mg/g. 通过吸附前后样品的FTIR表征显示在吸附锑的过程中形成了内层络合物和外层络合物.
高铁酸钾; 高铁酸钾分解产物; 锑; 吸附
锑有广泛的工业应用,如阻燃剂、合金和半导体等. 最新研究显示,全球每年的锑消耗超过1.0×105t. 湖南锡矿山是世界唯一的超大型锑矿床. 该矿区中锑在土壤和地表水中的含量高达100.6~5 045 mg/g和7 000 μg/L[1]. 锑矿的开采与冶炼已成为全球锑污染的主要人为源. 锑及其化合物通过饮水、呼吸、食物链进入人体具有致癌作用,已被欧盟和美国环境保护署列为优先控制污染物[2-3]. 美国环境保护局和我国生活饮用水卫生标准规定饮用水中锑的最大含量为5 μg/L[4]. 锑在环境中以五价和三价含氧阴离子形式存在,锑的不同存在形态在动植物体内引起不同生物效应,其毒性大小顺序为:Sb(0)>Sb(III)>Sb(V),其中Sb(III)的毒性比Sb(V)大10倍.
高质量浓度的锑进入地表水体,严重威胁了水生态系统和饮用水安全. 吸附法操作简便,特别适用于量大而质量浓度较低的水处理体系. 高铁酸钾(K2FeO4)是一种具有氧化、吸附、絮凝、消毒、杀菌、除臭等功能的绿色水处理剂. 在酸性条件下,它的氧化还原电位为2.20 V,比水处理中常用的氧化剂如臭氧和高锰酸盐等都高[5]. 高铁酸钾的分解产物是具有吸附和絮凝作用的铁氢氧化物[6]. 因此,利用高铁酸钾处理水中的锑,既可以起到氧化作用,又可起到吸附作用. 据报道,目前仅有JOHNSON和 LORENZ[7]利用Fe(II)和Fe(VI)混合物去除水中的锑,但未对吸附机理展开研究. 本研究以锑为目标污染物,利用高铁酸钾氧化三价锑后,原位生成氢氧化铁胶体,继而吸附水中的五价锑.
1 实验材料与方法
1.1 实验仪器
1.2 实验药品
次氯酸盐氧化法制备的高铁酸钾粉末[8]:质量分数>95%;Sb2O3标准储备液:300 mg/L;氢氧化钠:0.1 mol/L;盐酸体积分数为1%. 实验用水均为去离子水;实验试剂均为分析纯;玻璃器皿均经稀硝酸浸泡过夜,去离子水洗净后使用.
1.3 实验方法
在250 mL的磨口锥形瓶中加入一定离子强度的含锑溶液和K2FeO4粉末,放入恒温振荡器中,在25 ℃、200 r/min下振荡2 h. 10 mL针孔注射器取5 mL上层液过0.45 μm针孔滤膜,样品用10% HNO3酸化于4 ℃保存,ICP-AES测定样品中锑离子质量浓度.
1.3.1 pH和离子强度的影响 在磨口锥形瓶中分别加入150 mL锑离子质量浓度为2 mg/L的溶液和50 mg/L的K2FeO4粉末,预氧化1 min,再调初始pH为3.0~6.5,离子强度为0.001~0.1 mol/L NaNO3,在25 ℃振荡2 h,取样.
1.3.2 吸附动力学 在磨口锥形瓶中加入150 mL锑离子质量浓度为2 mg/L的溶液和50 mg/L的K2FeO4粉末,离子强度为0.01 mol/L NaNO3,预氧化1 min,再调节pH为6.5,一定时间间隔,取样.
1.3.3 吸附等温线 在磨口锥形瓶中加入150 mL离子强度为0.01 mol/L NaNO3的含锑溶液,锑质量浓度为1~10 mg/L,K2FeO4用量是50 mg/L,预氧化1 min,再调节pH为6.5,在25 ℃振荡2 h,取样.
1.3.4 高铁酸钾分解产物的制备 称取100 mg K2FeO4到200 mL去离子水中并调节溶液pH为6.5,溶液紫色迅速消失,用0.45 μm滤膜过滤,过滤物冷冻干燥. 在吸附试验中,K2FeO4分解产物吸附锑2 h后,用0.45 μm滤膜过滤,过滤物冷冻干燥.
目前,高中生物一线教师在培育学生生命观念的教学过程中存在一定的问题。例如,教师对生命观念的内涵缺少深刻的理解、对生命观念在生物学中相应的锚定点缺少系统的把握、对三维目标和核心素养教学目标的转化缺少足够的认识、对培育学生生命观念的系统教学方案缺少应有的重视等。下面重点阐述生命观念及其培育策略。
1.4 表征手段
1.4.1 K2FeO4分解产物吸附锑前后的FTIR分析 取少量K2FeO4分解产物吸附锑前后的固体样品,采用KBr压片法,在傅里叶红外光谱分析仪(IRPrsetige-21,日本岛津公司)上进行测定. 测试条件:波数范围400~4 000 cm-1,扫描次数16次/min.1.4.2 K2FeO4分解产物的XRD分析 使用德国Bruker公司的BRUKER D8 ADVANCE型X射线粉末衍射仪. 测试条件:Cu靶Kα射线,=0.154 18 nm,管电压为40 kV,管电流为30 mA,扫描速度4°/min,扫描范围10°~80°.
2 结果与讨论
2.1 高铁酸钾分解产物的表征
K2FeO4在水溶液中很不稳定,会迅速分解成氢氧化铁胶体. K2FeO4分解产物的XRD表征如图1所示. 其峰少且宽,强度较弱,结构有序度低,在衍射角接近35°和62°处有2个很宽的峰出现,与标准衍射图样对比,可以确定是弱晶质的2线型水铁矿. 水铁矿是三价铁水解过程中最先出现的产物,粒径在1.5~3.0 nm间,比表面积大[9].
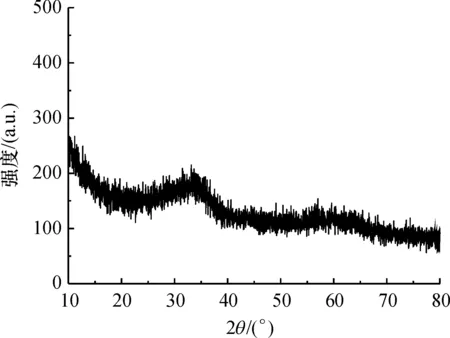
图1 高铁酸钾分解产物的XRD图Figure 1 XRD spectrum of DP/ferrate


(a)高铁酸钾分解产物;(b)pH4.0时高铁酸钾分解产物吸附锑;(c)pH6.5时高铁酸钾分解产物吸附锑
图2 不同样品的傅里叶红外图谱
Figure 2 FT-IR spectra of different samples
2.2 高铁酸钾对锑的去除效能研究


图3 pH和离子强度对高铁酸钾分解产物除锑的影响
Figure 3 Effect of pH and ionic strength on antimony sorption onto DP/ferrate
2.2.2 吸附动力学 在溶液初始pH 4.0和pH 6.5下进行了动力学实验(图4),在pH 6.5时发生了一定程度的脱附,这与在低pH时形成了外层络合物有关. 而在pH 4.0条件下,在最初的10 min内,Sb的去除率从31.06%迅速增至90.38%,且在前30 min内去除率随接触时间的增加迅速增加,而在30~120 min范围内,去除率的递增速率变得平缓,已基本达到吸附平衡,因此可以将120 min作为K2FeO4分解产物吸附Sb的平衡时间.
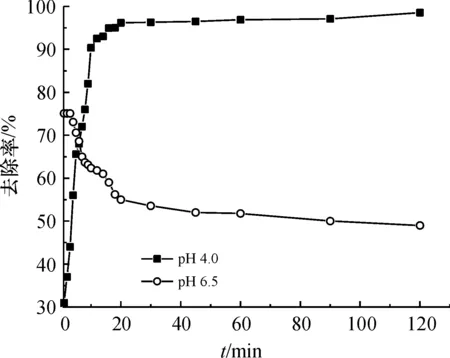
图4 吸附时间对高铁酸钾分解产物吸附锑的影响Figure 4 Effect of adsorption time on Sb sorption onto DP/ferrate
利用准二级动力学模型和离子扩散模型对实验数据进行拟合[14],结果如表1和表2所示. 以准二级吸附动力学方程拟合最好(R2=0.999 1),拟合曲线如图5所示,表明 K2FeO4分解产物吸附锑主要为化学吸附过程. 通过粒子扩散方程拟合(图6)得知,K2FeO4分解产物吸附Sb时呈现多级线性关系,所有的粒子内扩散速率常数都按照kt,1、kt,2、kt,3的顺序递减. 第1个快速上升的阶段归因于溶液中Sb通过扩散迅速聚集在K2FeO4分解产物表面的活性位点上;当外表面的活性位点吸附饱和后,Sb通过粒子内扩散进入到K2FeO4分解产物内部的空隙,并被内部的活性位点吸附,此过程为第2个缓慢上升的阶段,最后吸附逐渐接近平衡,吸附量不再上升,为第三阶段. 这主要是由于Fe(VI)在其被还原生成Fe(III)过程中,经历了由六价到三价不同电荷离子的中间形态的演变,产生具有较大的网状结构,表现出独特的吸附作用.

表1 准二级动力学模型拟合参数Table 1 Fitting parameters of pseudo-second-order kinetics model

表2 粒子扩散模型拟合参数Table 2 Fitting parameters of the intra-particle diffusion model

图5 准二级动力学拟合曲线Figure 5 Fitting curve of pseudo-second order kinetic equation

图6 粒子扩散模型拟合曲线Figure 6 Fitting curve of particle diffusion equation
2.2.3 吸附等温线 利用Langmuir、Freundlich等温吸附模型[14]和Langmuir-Freundlich等温吸附模型[15],对K2FeO4分解产物吸附锑进行拟合(表3),得到非线性拟合图(图7). Langmuir等温吸附模型线性拟合的R2值偏小,仅为0.717 4,Freundlich等温吸附模型和Langmuir-Freundlich吸附等温模型拟合出的R2值较高,为0.980 4和0.980 3,这说明吸附锑的过程不仅仅是单分子层的吸附,且主要为非均相的化学多层吸附,与动力学结论相吻合. 表4比较了不同吸附剂对锑的吸附等温模型参数,KF可以代表吸附剂的吸附容量,KF值越大表明吸附剂的吸附容量越大,K2FeO4(41.83 mg/g)大于新生态铁锰复合氧化物(FMBO)(1.24 mg/g)、羟基氧化铁(FeOOH)(0.93 mg/g)、MnO2(0.51 mg/g). 可以看出K2FeO4对锑的去除能力比徐伟等[16]报道的其他含铁吸附剂具有吸附优势.
当使用Langmuir-Freundlich等温吸附模型进行拟合时,K2FeO4最大吸附量的理论值可达到129.93 mg/g(表3). 表5比较了文献中报道的各吸附材料与高铁酸钾分解产物对锑的最大理论吸附量,表明高铁酸钾分解产物对锑的吸附去除具有优势.

表3 等温吸附模型拟合参数Table 3 Fitting parameters of isothermal adsorption model

图7 等温吸附模型的拟合图Figure 7 Fitting picture of isothermal adsorption model表4 不同吸附剂吸附锑的Freundlich等温 吸附模型拟合参数[16]Table 4 The fitting parameters of Langmuir isothermal adsorption model on the adsorption of antimony of different adsorbents[16]
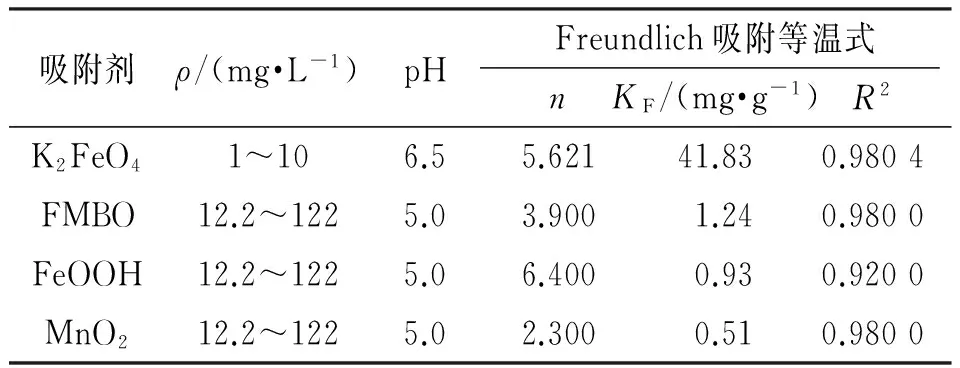
吸附剂ρ/(mg·L-1)pHFreundlich吸附等温式nKF/(mg·g-1)R2K2FeO41~106.55.62141.830.9804FMBO12.2~1225.03.9001.240.9800FeOOH12.2~1225.06.4000.930.9200MnO212.2~1225.02.3000.510.9800

表5 不同吸附剂吸附锑的最大吸附量[17-20]Table 5 Maximum adsorption capacities Qmax on the adsorption of antimony of different adsorbents[17-20]
2.3 FTIR对高铁酸钾吸附锑的表征

3 结论
(1)K2FeO4分解产物的XRD和FTIR分析表明K2FeO4分解产物是比表面积大、表面活性高、具有良好吸附作用的2线型水铁矿.
(2) K2FeO4对锑的去除效果受溶液pH和离子强度影响. 随着溶液pH的升高而下降,当pH 3.5~4.0时,锑的去除效果在95%以上. 当pH 3.5~5.5时,高的离子强度有利于锑的吸附,而在pH 5.5~7.0时,锑的吸附量随着离子强度的增加而减少.
(3)吸附动力学拟合中,以准二级动力学方程拟合得最好(R2=0.999 1),表明以化学吸附为主. 同时,通过粒子扩散方程得知,K2FeO4分解产物吸附Sb时呈现多级线性关系,所有的粒子内扩散速率常数都按照kt,1、kt,2、kt,3的顺序递减. 等温吸附拟合,以Freundlich模型最优(R2=0.980 4),而当使用Langmuir-Freundlich模型拟合时最大吸附量的理论值可达到129.93 mg/g.
(4) K2FeO4在去除水溶液中的锑时,通过形成内层络合物和外层络合物来达到除锑的效果.
[1] OKKENHAU G,ZHU Y G,HE J W,et al. Antimony (Sb) and Arsenic (As) in Sb mining impacted paddy soil from Xikuangshan,China:differences in mechanisms controlling soil sequestration and uptake in rice [J]. Environmental Science & Technology,2012,46(6):3155-3162.
[2] WU F C,ZHENG J,PAN X L,et al. Prospect on biogeochemical cycle and environmental effect of antimony [J]. Advances in Earth Science,2008,23(4):350-356.
[3] MCCALLUM R I. Occupational exposure to antimony compounds [J]. Journal of Environmental Monitoring,2005,7(12):1245-1250.
[4] UNGUREANU G,SANTOS S,RUI B,et al. Arsenic and antimony in water and wastewater:overview of removal techniques with special reference to latest advances in adsorption [J]. Journal of Environment Management,2015,151:326-342.
[5] SHARMA V K. Oxidation of inorganic compounds by Ferrate(VI) and Ferrate(V):one-electron and two-electron transfer steps [J]. Environmental Science & Technology,2010,44:5148-5152.
[6] JIANG Y,GOODWILL J E,TOBIASON J E,et al. Effect of different solutes,natural organic matter,and particulate Fe(III) on Ferrate(VI) decomposition in aqueous solutions [J]. Environmental Science & Technology,2015,9:2841-2848.
[7] JOHNSON M,LORENZ B. Antimony remediation using Ferrate(VI) [J]. Separation Science Technology,2015,50:1611-1615.
[8] 王颖馨,周雪婷,卜洪龙,等. 高铁酸钾的制备及其对水中As(III)、Pb(II)的去除效能研究[J]. 华南师范大学学报(自然科学版),2015,47(4):80-87.
WANG Y X,ZHOU X T,BU H L,et al. Preparation of potassium ferrate and its effectiveness on the removal of As(III) and Pb(II) [J]. Journal of South China Normal Uni-versity (Natural Science Edition),2015,47(4):80-87.
[9] JAMBOR J L,DUTRIZAC J E. Occurrence and constitution of natural and synthetic ferrihydrite,a widespread iron oxyhydroxide [J]. Chemical Reviews,1998,98:2549-2585.
[10]RUSSELL J D. Infrared spectroscopy of ferrihydrite:evidence for the presence of structural hydroxyl groups [J]. Clay Minerals,1979,1:109-114.
[11]JIA Y,XU L,WANG X,et al. Infrared spectroscopic and X-ray diffraction characterization of the nature of adsorbed arsenate on ferrihydrite [J]. Geochimica Et Cosmochimica Acta,2007,71:1643-1654.
[13]MCCOMB K A,CRAW D, MCQUILLAN A J,et al. ATR-IR spectroscopic study of antimonate adsorption to iron oxide [J]. Langmuir,2007,23(24):12125-12130.
[14]ÖZCAN A S,GÖK O,ÖZCAN A. Adsorption of lead(Ⅱ) ions onto 8-hydroxy quinoline-immobilized bentonite [J]. Journal of Hazardous Materials,2009,161:499-509.
[15]GAUTHAM P,JEPPU T,PRABHAKAR C. A modified Langmuir-Freundlich isotherm model for simulating pH-depengdent adsorption defects [J]. Journal of Contaminant Hydrology,2012(129/130):46-53.
[16] 徐伟,刘锐平,曲久辉,等. 铁锰复合氧化物吸附去除五价锑性能研究 [J]. 环境科学学报,2012,32(2):270-275.
XU W,LIU R P,QU J H,et al. The adsorption behaviors of Fe-Mn binary oxide towards Sb(V) [J]. Acta Scientiae Circumstantiae,2012,32(2):270-275.
[17]XU W,WANG H J,LIU R P,et al. The mechanism of antimony(III) removal and its reactions on the surfaces of Fe-Mn Binary Oxide [J]. Journal of Colloid and Interface Science,2011,363:320-326.
[18]LI X H,DOU X M,LI J Q. Antimony(V) removal from water by iron zirconium bimetal oxide:performance and mechanism[J]. Journal of Environment Science,2012,24:1197-1203.
[19]WANG X Q,HE M,LIN C Y,et al. Antimony(Ⅲ) oxidation and antimony(V) adsorption reactions on synthetic manganite[J]. Chemistry Der Erde Geochemistry,2012,72:41-47.
[20]KOLBE F,WEISS H,MORGENSTERN P,et al. Sorption of aqueous antimony and arsenic species onto akaganeite[J]. Colloid Interface Science,2011,357:460-465.
【中文责编:成文 编辑助理:冷佳奕 英文审校:李海航】
Removal of Antimony from Water by Potassium Ferrate
ZHOU Xueting, HE Shiyun, ZHENG Liuchun, LAN Bingyan*, LI Laisheng*
(School of Chemistry and Environment, South China Normal University, Guangzhou 510006)
The synthesized potassium ferrate (K2FeO4) was used to remove Sb(III) from water. The removal was accomplished via two steps: Sb(III) was first oxidized by ferrate, then Sb was adsorbed onto the ferrate decomposition product (DP/ferrate). XRD and FTIR characterized that ferrate decomposition product was amorphous 2-line ferrihydrite with large surface area and high porosity. Adsorption results show that low pH favored Sb adsorption, whereas when studying the effect of ionic strength, different adsorption behaviors were found in the range of pH3.5~5.5 and pH 5.5~7.0. Pseudo-second-order kinetic model described the sorption process very well. The values of correlation coefficient were extremely high (R2=0.999 1), indicating chemical adsorption was primary. The experimental data were found to follow the Freundlich isotherms with the best accuracy (R2=0.980 4). The value ofQmaxobtained from the Langmuir-Freundlich model was 129.93 mg/g. FTIR results revealed that in the adsorption of Sb by ferrate decomposition product, two forms of surface complexes: an inner-sphere and an outer-sphere surface complex were formed on the surface of ferrate decomposition product.
potassium ferrate; ferrate decomposition product; antimony; adsorption
2016-04-07 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
广东省公益研究与能力建设专项项目(2014A020216037)
X52
A
1000-5463(2017)03-0049-06
*通讯作者:蓝冰燕,讲师,Email:lanbingyan@m.scnu.edu.cn;李来胜,教授,Email:llsh@scnu.edu.cn.
