河南省小麦纹枯病菌对氟环唑及烯唑醇的敏感性
2017-06-27徐建强平忠良李慧凯朱艳阁刘庆涛
徐建强, 平忠良, 李慧凯, 杨 霞, 朱艳阁, 刘庆涛
(河南科技大学林学院,河南 洛阳 471003)
河南省小麦纹枯病菌对氟环唑及烯唑醇的敏感性
徐建强, 平忠良, 李慧凯, 杨 霞, 朱艳阁, 刘庆涛
(河南科技大学林学院,河南 洛阳 471003)
为了解河南省小麦纹枯病菌对氟环唑及烯唑醇的敏感性,采用菌丝生长速率法测定了2种杀菌剂对从河南省15个地市分离的98株病菌的毒力。结果表明,供试菌株对氟环唑和烯唑醇的EC50值分别分布为0.027 1~0.225 7 mg·L-1和0.033 8~0.346 3 mg·L-1。敏感性频率分布显示,小麦纹枯病菌群体中存在着对烯唑醇不敏感的亚群体,而对氟环唑则不存在。将其中呈连续单峰频次分布的大多数菌株群体的平均EC50值(0.087 7±0.048 0)mg·L-1和(0.063 6±0.023 6)mg·L-1分别作为病菌对氟环唑和烯唑醇的敏感性基线,氟环唑的平均EC50是烯唑醇的1.38倍,表明病菌对烯唑醇更为敏感。小麦纹枯病菌对2种杀菌剂的敏感性与菌株的地理来源无明显相关性;小麦纹枯病菌对氟环唑与烯唑醇的敏感性与其他9种杀菌剂间存在着一定程度的相关性。
小麦纹枯病菌;氟环唑;烯唑醇;敏感性;河南
小麦纹枯病,又称小麦尖眼斑病(Wheat sharp eyespot),是一种世界分布的土传真菌病害。该病主要危害小麦的茎杆基部,造成植株倒伏、枯死和白穗,影响小麦有效穗数,对产量影响较大[1]。近年来,随着小麦品种的更替及高产栽培措施的推广,该病在中国冬小麦种植区发生普遍,已成为黄淮平原及长江流域麦区的重要病害[2]。河南省是中国小麦主产区之一,近几年小麦纹枯病的发生面积持续扩大,危害严重[3]。目前,尚未发现高抗纹枯病的小麦品种[4],控制该病害主要依靠苯醚甲环唑和戊唑醇等种子处理、结合春季井冈霉素喷雾等来进行化学防治[5]。但随着同类药剂的连续使用,小麦纹枯病菌对井冈霉素及三唑酮的敏感性降低,或产生了不同程度的抗药性[6-7],生产中需储备对小麦纹枯病有较高防效的杀菌剂。氟环唑和烯唑醇同属于三唑类药剂,其中烯唑醇在室内及盆栽试验中,都表现出对小麦纹枯病菌很高的抑菌率[8];两者在田间对小麦纹枯病均有很好的防效[9-10]。但上述试验多是以田间分离的较少菌株为研究对象,并不能反映小麦纹枯病菌群体对药剂的敏感性水平。应检测河南省各地市小麦纹枯病菌对这2种药剂的敏感性,构建敏感性基线,为生产中施药及开展田间抗药性监测提供标准和参考。目前,尚未有河南省小麦纹枯病菌对氟环唑和烯唑醇敏感性研究的报道。本研究采用菌丝生长速率法测定了2013年从河南省15个地市分离的98株病菌对氟环唑和烯唑醇的敏感性,建立了相对敏感基线,分析了不同地区菌株的敏感性差异及病菌对2种杀菌剂敏感性间的相关性,以期为三唑类杀菌剂在小麦纹枯病防治中的合理利用提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 2013年的4—5月份,从河南省15个地市、22个县市采集茎杆基部具有典型云纹状病斑的小麦植株,采用组织分离法,共获得365株病菌,转入PSA斜面上,室温保存;每地随机选取2~6株进行单菌丝顶端纯化,共98株用于试验,根据菌株培养性状及细胞核染色,鉴定所有菌株均为禾谷丝核菌Rhizoctoniacerealis[11]。本研究供试菌株如表1所示。
1.1.2 供试药剂 96%氟环唑(epoxiconazole)原药和98%丙环唑(propiconazole)原药由江苏利民化工有限公司生产;92%烯唑醇(diniconazole)原药和95%三唑酮(triadimefon)原药由江苏建农农药化工有限公司生产;97%苯醚甲环唑(difenoconazole)原药和97.9%的咯菌腈(fludioxonil)原药由先正达(中国)投资有限公司生产;97%戊唑醇(tebuconazole)原药由广西田园生化股份有限公司生产; 97%噻呋酰胺(thifluzamide)原药由江苏省镇江农药厂生产;97%氟酰胺(flutolanil)原药由江阴苏利化学有限公司生产;62.5%井冈霉素(jinggangmycin)原药由浙江钱江生物化学股份有限公司生产;97.6%甲基立枯磷(tolclofos-methyl)原药由江苏省东海农药厂生产。井冈霉素预溶于灭菌超纯水,其他杀菌剂预溶于丙酮或甲醇中,均配成104mg·L-1母液,放于4 ℃冰箱中保存备用。
1.2 方法
1.2.1 病菌对2种杀菌剂的敏感性测定 采用菌丝生长速率法。将供试菌株在PSA平板上25 ℃培养3 d后,用打孔器在菌落边缘打制成直径5 mm的菌饼,菌丝面朝下分别接入含0.5、1、3、6 mg·L-1的氟环唑或1,2,4,8 mg·L-1烯唑醇的PSA平板上,根据菌丝生长抑制率确定药剂抑制纹枯病菌菌丝生长的最低抑制浓度(Minimum Inhibition Concentration, MIC值);参考氟环唑及烯唑醇的MIC值,将病菌分别接入含0.031 25、0.062 5、0.125、0.25、0.5、1 mg·L-1氟环唑或烯唑醇系列质量浓度的PSA平板上,每皿接种1个菌饼,每处理重复3次,以不含药剂的PSA平板为对照,25 ℃下培养5 d后,采用十字交叉法测量菌落直径(mm),按照下式计算各质量浓度处理下药剂对菌丝生长的抑制率。菌丝生长抑制率=(对照菌落直径平均值-处理菌落直径平均值)/(对照菌落直径平均值-菌饼直径)×100% 。
1.2.2 敏感性分布图的制作 参照祁之秋等[12]的方法。将病原菌群体对供试药剂的敏感性从高到低分成不同区间,统计EC50值在各个区间的菌株占整个群体的频率(敏感性频率,%)。以EC50值为x轴,敏感性频率为y轴作图,即得到病原菌群体对该种杀菌剂的敏感性分布图。根据病原菌的敏感性频率分布图建立其对氟环唑和烯唑醇的相对敏感基线。
1.2.3 小麦纹枯病菌对氟环唑及烯唑醇的敏感性同其它杀菌剂敏感性相关性的比较 参照齐永志等[13]的方法,采用菌丝生长速率法进行。选取对氟环唑及烯唑醇敏感性不同的10~30个菌株,在PSA平板上25 ℃培养3 d后,用打孔器在菌落边缘打制成直径5 mm的菌饼,菌丝面朝下接入含系列浓度杀菌剂的PSA平板上。其中,三唑酮分别为0.625、1.25、2.5、5、10、20 mg·L-1;苯醚甲环唑分别为0.025、0.05、0.1、0.5、2.5、5 mg·L-1;戊唑醇分别为0.003、0.005、0.01、0.03、0.05、0.1 mg·L-1;丙环唑分别为0.025、0.05、0.1、0.5、2.5、5 mg·L-1;咯菌腈分别为0.01、0.02、0.03、0.05、0.1、0.2 mg·L-1;噻呋酰胺分别为0.031 25、0.062 5、0.125、0.25、0.5、1 mg·L-1;氟酰胺分别为0.1、0.2、0.3、0.4、0.6、0.8 mg·L-1;井冈霉素分别为0.15、0.2、0.25、0.35、0.5、1 mg·L-1;甲基立枯磷分别为0.035、0.065、0.1、0.2、0.3、0.5 mg·L-1。试验及数据处理方法同1.2.1。将氟环唑或烯唑醇对菌株的EC50值作为x轴,其他药剂对菌株的EC50值为y轴,进行线性回归分析,求出线性回归方程y=bx+a,根据决定系数(R2)、b值及P值,分析氟环唑或烯唑醇与其它杀菌剂对纹枯病菌毒力之间的关系。P<0.05,b值为正,说明2种药剂间存在正相关性;b值为负,说明2种药剂间存在负相关性;决定系数越大,则相关性越强;P>0.05,说明2种药剂间无相关性[13]。

表1 供试菌株Table 1 Tested isolates
1.2.4 数据处理 敏感性测定所得数据利用EXCEL 2003进行处理,并利用DPS V6.55软件中的“数量型数据机值分析”,通过菌丝生长抑制率几率值和药剂质量浓度对数之间的线性回归分析,求出药剂对菌株的毒力回归方程、相关系数和有效质量浓度值(EC50值);利用DPS V6.55软件的“数据正态性检验”,就供试菌株对杀菌剂的敏感性频率分布进行Shapiro-Wilk正态性检验[14];利用SPSS 20.0进行聚类分析[12]。
2 结果与分析
2.1 小麦纹枯病菌对氟环唑及烯唑醇的敏感性和敏感性基线的建立
氟环唑抑制小麦纹枯病菌菌丝生长的最低抑制浓度(MIC值)为6 mg·L-1。供试98株病菌对氟环唑的敏感性基本呈连续性分布,EC50值在0.027 1~0.225 7 mg·L-1,平均EC50为(0.087 7±0.048 0)mg·L-1,最不敏感菌株是最敏感菌株的8.33倍。将上述EC50值分为4个区间,每个区间菌株出现的频率如图1所示。通过DPS分析Shapiro-Wilk正态性检验结果,显示菌株对氟环唑的敏感性频率符合正态性分布(W=0.930 9,P=0.051 9>0.05),表明小麦纹枯病菌对药剂的敏感性未发生分化,供试菌株全部为敏感性菌株,故可将EC50平均值(0.087 7±0.048 0)mg·L-1作为小麦纹枯病菌对氟环唑的相对敏感基线。
烯唑醇抑制小麦纹枯病菌菌丝生长的MIC值为4 mg·L-1。供试98株病菌对烯唑醇的敏感性基本呈连续性分布,EC50值在0.033 8~0.346 3 mg·L-1,最大值为最小值的10.25倍,平均EC50值为(0.088 9±0.063 9)mg·L-1。将上述EC50值分为5个区间,每个区间菌株出现的频率如图1所示。通过DPS分析Shapiro-Wilk正态性检验结果,显示菌株对烯唑醇的敏感性频率分布不符合正态性分布(W=0.738 9,P=0.000 005<0.05),表明小麦纹枯病菌对药剂的敏感性出现了分化,存在敏感性不高的亚群体。供试菌株对烯唑醇的敏感性虽已出现一定的分化,但仍有80%的菌株(78株)集中位于图1中相应的主峰范围内,其敏感性频率分布为连续单峰曲线,通过DPS分析Shapiro-Wilk正态性检验结果,显示该群体对烯唑醇的敏感性频次分布呈近似正态分布(W=0.924 6,P=0.073 7>0.05),其EC50平均值为(0.063 6±0.023 6)mg·L-1,故将此值作为小麦纹枯病菌对烯唑醇的相对敏感基线。
研究结果显示,氟环唑的平均EC50是烯唑醇的1.38倍,表明病菌对烯唑醇较氟环唑敏感。

图1 小麦纹枯病菌对氟环唑和烯唑醇的敏感性频率分布Fig.1 Frequency distribution of EC50 values of Rhizoctonia cerealis populations to epoxiconazole and diniconazole
2.2 不同地理来源菌株对氟环唑和烯唑醇敏感性水平的系统聚类分析
每地区随机选择3株病菌,共45株,采用SPSS软件对氟环唑和烯唑醇抑制病菌菌丝生长的EC50值进行聚类分析。结果表明(图2),氟环唑对45个菌株的EC50值共分在5个聚类组中,包括的菌株数分别为10、1、13、7、14个;烯唑醇对45个菌株的EC50值也分在5个聚类组中,包括的菌株数分别为15、13、12、4、1个。不同来源的菌株系列出现在同一聚类组中,表明小麦纹枯病菌对2种杀菌剂的敏感性差异与菌株来源的地理位置无明显相关性。尽管每种杀菌剂对菌株的EC50值可分为不同的聚类组,但2种杀菌剂的聚类组所包含的菌株并无相似之处。

图2 氟环唑和烯唑醇对小麦纹枯病菌EC50值的系统聚类分析Fig.2 Hierarchical cluster analysis on EC50 values of epoxiconazole and diniconazole to Rhizoctonia cerealis
2.3 小麦纹枯病菌对氟环唑及烯唑醇的敏感性与其他杀菌剂间的相关性
对EC50值进行线性回归分析得出,小麦纹枯病菌对氟环唑的敏感性与其对三唑酮、苯醚甲环唑、戊唑醇、丙环唑、咯菌腈、氟酰胺及甲基立枯磷的敏感性的决定系数分别是0.139、0.178、0.115、0.074、0.005、0.004及0.094,F检验的显著水平(P值)均小于0.05,即在P=0.05 水平上差异显著,且回归方程中的b值均为正值,说明小麦纹枯病菌对氟环唑的敏感性与以上7种药剂间存在着一定的正相关,但相关性强弱有差异,三唑酮、苯醚甲环唑、戊唑醇较强,咯菌腈、氟酰胺较弱;对井冈霉素的敏感性的决定系数为0.062,P=0.000 1﹤0.05,且b值为负,说明小麦纹枯病菌对氟环唑的敏感性与对井冈霉素的敏感性间存在着一定的负相关;对烯唑醇及噻呋酰胺的敏感性的决定系数分别为0.226及0.050,P值均大于0.05,说明小麦纹枯病菌对氟环唑的敏感性与其对烯唑醇及噻呋酰胺之间无相关性(表2)。
小麦纹枯病菌菌株对烯唑醇的敏感性与其对三唑酮、戊唑醇、丙环唑、咯菌腈及氟酰胺的敏感性的决定系数分别是0.200、0.140、0.592、0.003、0.001,F检验的显著水平(P值)均小于0.05,即在P=0.05 水平上差异均显著,且回归方程中的b值为正值,说明小麦纹枯病菌对烯唑醇的敏感性与以上5种药剂间存在着一定的正相关性,丙环唑、三唑酮、戊唑醇的相关性较强,而咯菌腈及氟酰胺较弱;对苯醚甲环唑、井冈霉素的敏感性的决定系数分别为0.001及0.075,P值均小于0.05,且b值为负,说明病菌对烯唑醇的敏感性与对苯醚甲环唑、氟酰胺素的敏感性间存在着一定的负相关,井冈霉素相关性较强,而苯醚甲环唑较弱;对氟环唑、噻呋酰胺及甲基立枯磷的敏感性的决定系数分别为0.226、0.057及0.539,P值均大于0.05,说明小麦纹枯病菌对烯唑醇的敏感性与对氟环唑、噻呋酰胺及甲基立枯磷间无相关性(表3)。
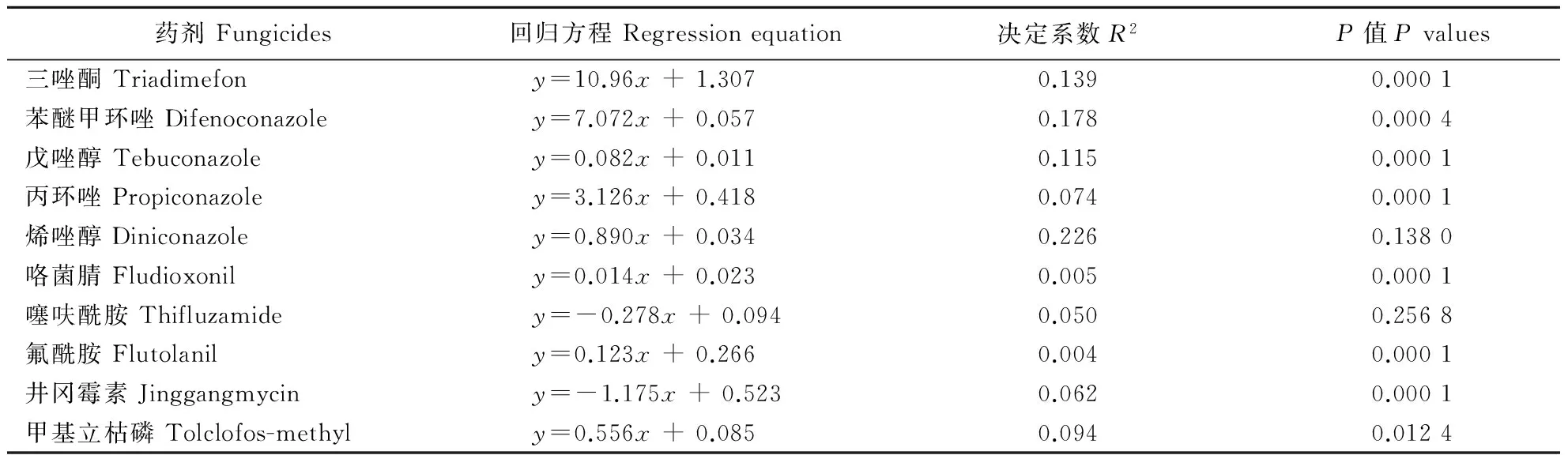
表2 小麦纹枯病菌对氟环唑与其他10种杀菌剂敏感性间的相关性Table 2 Cross-resistance between epoxiconazole and other ten fungicides in Rhizoctonia cerealis
注:x 和y分别为氟环唑和其他一种杀菌剂对同一菌株的EC50值。
Note: xandyaretheEC50valuesofthesameisolatetoepoxiconazoleandotherfungicide,respectively.
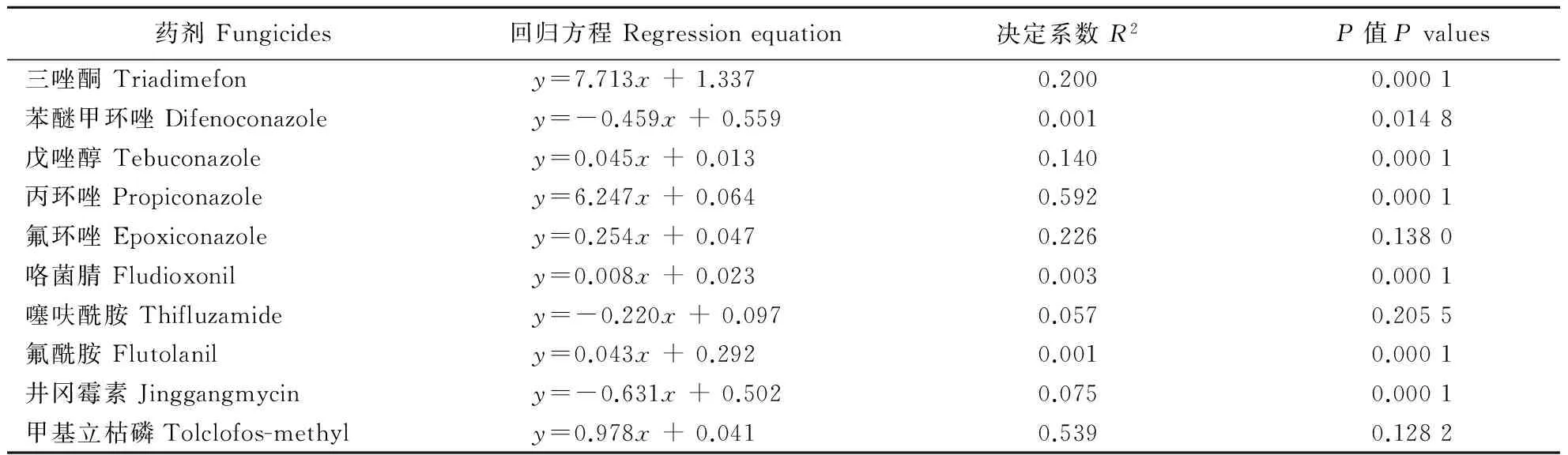
表3 小麦纹枯病菌对烯唑醇与其他10种杀菌剂敏感性间的相关性Table 3 Cross-resistance between diniconazole and other ten fungicides in Rhizoctonia cerealis
注:x和y分别为烯唑醇和其他一种杀菌剂对同一菌株的EC50值。
Note: xandyaretheEC50valuesofthesameisolatetodiniconazoleandotherfungicide,respectively.
3 结论与讨论
本研究结果表明,氟环唑和烯唑醇对河南省小麦纹枯病菌菌丝生长均有很强的抑制作用,烯唑醇对病菌的抑制效果优于氟环唑。病菌不同菌株之间对药剂的敏感性差异较大,这可能源自病菌本身存在的生理差异以及病菌群体组成的复杂多样性,也可能与生产中使用的药剂间存在微弱的交互抗性有关。不同地区的菌株出现在同一聚类组,说明目前不同地区或地块的用药水平仍不足以引起病原菌对氟环唑和烯唑醇敏感性的变化。病菌对氟环唑与烯唑醇的敏感性同其它杀菌剂间有一定的相关性,生产中可以利用负相关性的药剂来延缓病菌抗药性的产生。
氟环唑和烯唑醇在小麦纹枯病的综合防控上均有光明的应用前景。由于2种药剂对种子发芽有一定的延迟效应,限制了其在种子包衣上的应用,其施用方法是在小麦返青拔节期进行药剂喷雾;除对纹枯病外,对白粉病和条锈病也有很好的防治效果[15]。生产中可将氟环唑或烯唑醇和与之有负相关性的药剂混合使用或轮换使用,以防病菌对药剂的敏感性降低,延长药剂的使用寿命。另外,为配合农业生产上双减项目(减化肥、减农药)的开展,可探索化学防治同生物防治相结合的方法。PENG等[16]将苯醚甲环唑同枯草芽孢杆菌NJ-18协同防治小麦纹枯病,不但比单剂使用提高了防治效果,而且还降低了农药的使用量,延缓抗药性的产生。这为三唑类药剂在小麦纹枯病化学防治上的应用指明了新的方向。
[1] LEMANCAYK G, KWASNA H. Effects of sharp eyespot (Rhizoctoniacerealis) on yield and grain quality of winter wheat [J]. European Journal of Plant Pathology, 2013, 135(1): 187-200.
[2] HAMDA M S, YIN Y N, CHEN H G, et al. The escalating threat ofRhizoctoniacerealis, the causal agent of sharp eyespot in wheat [J]. Pest Management Science, 2011, 67(11): 1411-1419.
[3] 汪敏, 吕柏林, 邢小萍, 等. 河南省小麦纹枯病菌的群体组成及其致病力分化研究[J]. 植物病理学报, 2011, 41(5): 556-560.
[4] 李洪连, 袁红霞, 刁晓鸽, 等. 河南小麦主要品种纹枯病抗性评价[J]. 河南农业大学学报, 1998, 32(2): 107-111.
[5] 宋立妹, 张军民.小麦纹枯病菌对氟酰胺的敏感性[J].麦类作物学报, 2013, 33(6): 1284-1288.
[6] 胡燕, 王怀训, 夏晓明, 等. 四地区小麦纹枯病菌对6种杀菌剂的抗性比较 [J]. 植物保护学报, 2006, 33(4): 423-427.
[7] 孙海燕, 丁晓菲, 杜文珍, 等. 江苏、河南、安徽和山东四省小麦纹枯病菌对井冈霉素的敏感性监测 [J]. 农药学学报, 2011.13(6): 653-656.
[8] 孙炳剑, 雷小天, 袁红霞, 等. 小麦纹枯病化学防治药剂的筛选 [J]. 麦类作物学报, 2007, 27(5): 914-918.
[9] 杨共强, 宋玉立, 何文兰, 等. 几种杀菌剂对小麦纹枯病的防治效果[J]. 植物保护, 2010, 36(2): 167-169.
[10]陶玉连, 程玲娟, 吴长远, 等. 几种杀菌剂防治小麦纹枯病试验[J]. 安徽农学通报, 2014, 20(10): 80-81.
[11]侯颖, 徐建强, 孟秀利, 等. 小麦纹枯病菌对九种麦田除草剂的敏感性[J]. 麦类作物学报, 2013, 33(6): 1289-1293.
[12]祁之秋, 鞠雪娇, 纪明山, 等. 辽宁省稻瘟病菌对咪鲜胺敏感基线的建立[J]. 农药学学报, 2012, 14(6): 673-676.
[13]齐永志, 李海燕, 苏媛, 等. 小麦纹枯病菌对噻呋酰胺的敏感性及抗药性突变体的主要生物学性状 [J]. 农药学学报, 2014, 16(3): 271-280.
[14]甘林, 代玉立, 滕振勇, 等. 福建省玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的敏感性[J]. 农药学学报, 2016, 18(2): 194-200.
[15]陈万权. 小麦重大病虫害综合防治技术体系[J]. 植物保护, 2013, 39(5): 16-24.
[16]PENG D, LI S D, CHEN C J, et al. Combined application of Bacillus subtilis NJ-18 with fungicides for control of sharp eyespot of wheat[J]. Biological Control, 2014, 70: 28-34.
(责任编辑:蒋国良)
Sensitivity ofRhizoctoniacerealisto epoxiconazole and diniconazole in Henan Province
XU Jianqiang, PING Zhongliang, LI Huikai, YANG Xia, ZHU Yange, LIU Qingtao
(College of Forestry, Henan University of Science and Technology, Luoyang 471003, China)
The sensitivities ofRhizoctoniacerealisto epoxiconazole and diniconazole were determined by measuring the mycelial growth on the fungicide-amended media using 98 isolates collected from 15 cities of Henan province. The results indicated that 50% effective concentration (EC50) values of all isolates to epoxiconazole and diniconazole ranged from 0.027 1 to 0.225 7 mg·L-1and 0.033 8 to 0.346 3 mg·L-1, respectively. The results of the frequency analysis revealed that subpopulation, which was less sensitive to diniconazole, had been discovered in the tested isolates. However, most of the isolates were sensitive to epoxiconazole. The mean EC50values of (0.087 7±0.048 0) mg·L-1and (0.063 6±0.023 6) mg·L-1for most isolates showed a unimodal curve distribution, which was treated as the sensitivity baseline ofR.cerealisto epoxiconazole and diniconazole respectively. The mean EC50value of epoxiconazole was 1.38 times that of diniconazole, which meant thatR.cerealiswas more sensitive to diniconazole. The isolates collected from different regions demonstrated different sensitivities. Especially, there was correlation to some extent between epoxiconazole and diniconazole with other nine fungicides.
Rhizoctoniacerealis; epoxiconazole; diniconazole; sensitivity; Henan
2016-07-25
国家自然科学基金项目(31401774);公益性行业(农业)科研专项(201303023);河南科技大学大学生研究训练计划项目(2015148)
徐建强(1979-),男,河南商丘人,副教授,博士,从事杀菌剂毒理与应用方面的研究。
1000-2340(2017)01-0036-07
S482
A
