森林土壤融化期异养呼吸和微生物碳变化特征
2017-06-26吴浩浩徐星凯段存涛李团胜CHENGWeiGuo
吴浩浩,徐星凯,*,段存涛,李团胜,CHENG WeiGuo
1 中国科学院大气物理研究所大气边界层物理和大气化学国家重点实验室, 北京 100029 2 中国科学院大学地球科学学院大气化学与环境科学系, 北京 100049 3 长安大学地球科学与资源学院, 西安 710054 4 Faculty of Agriculture, Yamagata University, Tsuruoka 997- 8555, Japan
森林土壤融化期异养呼吸和微生物碳变化特征
吴浩浩1,2,徐星凯1,2,*,段存涛1,李团胜3,CHENG WeiGuo4
1 中国科学院大气物理研究所大气边界层物理和大气化学国家重点实验室, 北京 100029 2 中国科学院大学地球科学学院大气化学与环境科学系, 北京 100049 3 长安大学地球科学与资源学院, 西安 710054 4 Faculty of Agriculture, Yamagata University, Tsuruoka 997- 8555, Japan
采用室内土柱培养的方法,研究在不同湿度(55%和80%WFPS,土壤充水孔隙度)和不同氮素供给(NH4Cl和KNO3,4.5 g N/m2)条件下,外源碳添加(葡萄糖,6.4 g C/m2)对温带成熟阔叶红松混交林和次生白桦林土壤融化过程微生物呼吸和微生物碳的激发效应。结果表明:在整个融化培养期间,次生白桦林土壤对照CO2累积排放量显著高于阔叶红松混交林土壤。随着土壤湿度的增加,次生白桦林土壤对照CO2累积排放量和微生物代谢熵(qCO2)显著降低,而阔叶红松混交林土壤两者显著地增加(P<0.05)。两种林分土壤由葡萄糖(Glu)引起的CO2累积排放量(9.61—13.49 g C/m2)显著大于实验施加的葡萄糖含碳量(6.4 g C/m2),同时由Glu引起的土壤微生物碳增量为3.65—27.18 g C/m2,而施加Glu对土壤DOC含量影响较小。因此,这种由施加Glu引起的额外碳释放可能来源于土壤固有有机碳分解。融化培养结束时,阔叶红松混交林土壤未施氮处理由Glu引起的CO2累积排放量在两种湿度条件下均显著大于次生白桦林土壤(P<0.001);随着湿度的增加,两种林分土壤Glu引起的CO2累积排放量显著增大(P<0.001)。单施KNO3显著地增加两种湿度的次生白桦林土壤Glu引起的CO2累积排放量(P<0.01)。单施KNO3显著地增加了两种湿度次生白桦林土壤Glu引起的微生物碳(P<0.001),单施NH4Cl显著地增加低湿度阔叶红松混交林土壤Glu引起的微生物碳(P<0.001)。结合前期报道的未冻结实验结果,发现冻结过程显著地影响外源Glu对温带森林土壤微生物呼吸和微生物碳的刺激效应(P<0.05),并且无论冻结与否,温带森林土壤微生物呼吸和微生物碳对外源Glu的响应均与植被类型、土壤湿度、外源氮供给及其形态存在显著的相关性。
微生物呼吸;微生物碳;葡萄糖;外源氮;溶解性有机碳;激发效应;冻土融化
冻结过程中土壤微生物和细根的死亡以及团聚体的破碎,有利于土壤速效碳的堆积,从而可能刺激冻结后土壤融化过程中二氧化碳(CO2)的释放[1-6]。但也有室内培养实验[7-9]和野外观测[10-11]发现冻结土壤融化过程中未出现二氧化碳激发排放。冻结土壤融化过程中是否存在CO2激发排放,可能与冻结条件、土壤湿度、有效性碳和氮含量及相关微生物特性有关[5,12-15]。目前仍不明确冻结后土壤有效性碳和氮释放量增加是否影响融化过程土壤微生物呼吸和微生物量的激发效应。尽管不少研究曾报道了外源碳添加对未冻结土壤有机碳转化和有效碳含量的影响[16-20],但是其激发效应与冻结处理土壤的差异仍缺乏深入的研究。这些将不利于人们深入地认识高纬度和/或高海拔地区冻土融化过程中有机碳分解和微生物量变化规律以及影响机制[3,21]。
陆地生态系统每年秋季凋落物中存有大量的碳,其大部分会保存到来年春季融化期被复苏的土壤微生物利用[22-23]。研究表明外源碳的添加会促进土壤固有有机碳的分解,进而刺激土壤融化期CO2的激发排放[24-25]。另外,随着大气氮沉降的日益加剧,春季积雪融化为土壤输入大量氮。但这种氮输入如何影响冻土融化CO2排放以及与冻结后凋落物在融雪时碳素输入存在何种交互作用至今仍不清楚。
当前全球降水格局的变化、植被郁闭度的不同及春季积雪融化等因素导致春季融化过程中土壤湿度存在巨大的时空差异[26],而Stielstra等[15]认为土壤湿度是控制冬季森林土壤CO2排放的最重要因子。有研究表明[5,21,27]冻土融化过程CO2排放量随着土壤湿度的增加而增加,而Teepe等[29]的培养实验却显示: 随着土壤湿度的增加(42%—76%WFPS,土壤充水孔隙度),冻土融化过程中CO2排放量减少。因此,土壤湿度对冻结土壤融化过程中CO2排放的影响仍存在不确定性,而且积雪融化引起的氮输入和土壤湿度的变化如何交互影响外源碳对冻土融化过程CO2排放的刺激效应鲜有报道。
中国东北长白山地区每年11月末到次年3月初期间,日平均气温和土壤表面日均温度通常为-5—-30℃,每年土壤冻结深度高达1.0m[5],这可能深刻影响到该地区每年春末融化期陆地土壤碳素循环关键过程。不幸的是,以往实验室研究多数关注适度冻结处理(-3—-13℃)和频繁冻融干扰下土壤微生物呼吸和/或微生物量的变化[1,2,28],对于长期严重冻结后土壤融化过程的实验报道甚少。阔叶红松混交林为长白山地区地带性森林演替顶级群落,由于植被覆盖度和趋光性差异,该林分地表微环境水热条件明显有别于临近的次生白桦林。次生白桦林是阔叶红松混交林被破坏后的次生裸地上首先发生的先锋群落,在东北地区分布广泛。这种土地覆盖类型的转换可导致两种林分土壤有明显不同碳和氮有效性[19,29]。尽管以前曾报道干土湿润过程两种林分土壤微生物呼吸和微生物量对外源碳和氮添加的响应[19],然而,外源碳对这两种林分土壤深度冻结后融化过程中CO2排放的刺激效应及其对土壤湿度和外源氮的响应至今仍不清楚,这将不利于人们对东北地区林地土壤固碳能力未来变化趋势的合理评估,尤其是非生长期森林土壤微生物呼吸和微生量对环境变化的响应[30]。
基于此,本文以中国东北长白山地区阔叶红松混交林及其临近的次生白桦林土壤为研究对象,通过室内模拟土柱培养的方法,来研究(1)土壤湿度、外源碳和氮添加对不同演替阶段两种林分土壤融化过程微生物呼吸、溶解性有机碳及微生物碳含量影响的单一和交互作用;(2)结合土壤活性碳、氮含量等属性的变化,分析外源碳添加对森林土壤融化过程微生物呼吸刺激效应的主要影响机制;(3)结合以前报道的未冻结实验结果,综合评价外源碳对森林土壤微生物呼吸和微生物量的刺激效应,为正确认识森林土壤有机碳矿化以及碳氮耦合效应提供支撑。
1 材料与方法
1.1 研究区域的概况
研究区域位于中国科学院长白山森林生态系统定位站附近(42°24′N,128°28′E),地势平坦,平均海拔高度为738 m,年均气温约为4.1℃,年均降水量约为750 mm,属典型的温带大陆性气候;地下水位约为9 m。土壤为火山灰发育的温带森林暗棕壤,剖面土壤属性见文献[31]。选择该区域成熟阔叶红松混交林及临近的次生白桦林为目标林地,阔叶红松混交林平均树龄近200a,林分为复层结构,平均株高25 m,郁闭度0.8;白桦林为天然次生林,树龄70a左右,平均树高13 m,郁闭度0.6,林分结构简单[32]。两种林分土壤容重及研究区域土壤冻结深度、日平均气温和降雪量等气象资料参见文献[5]。
1.2 土壤采集与属性测定

1.3 土壤湿度调节与养分添加实验设计
基于上述两种林分土壤容重构建各自模拟土柱,研究两种湿度水平(55%和80% WFPS)、3种营养源添加及其组合对土壤融化过程CO2排放量的影响,这里添加的营养源包括: 葡萄糖(Glu,6.4 g C/m2)、氯化铵(NH4Cl,4.5 g N/m2)、葡萄糖和氯化铵(Glu+NH4Cl)、硝酸钾(KNO3,4.5 g N/m2)、葡萄糖和硝酸钾(Glu+KNO3);无营养源添加为对照(Control)。共6种处理,3次重复,总共72个模拟土柱。氮素和碳素添加量分别相当于两种林分森林穿透雨N年输入量的4倍和DOC年输入量的80%。

1.4 计算与统计分析
培养过程中根据每个处理与无土壤的空白容器中气体CO2浓度差异以及采样前密封时间算出每次采样时不同处理土壤CO2瞬间排放速率(mg CO2-C m-2h-1)。不同处理CO2累积通量是将培养期间每次采样测得的CO2排放量累加(g CO2-C/m2)。利用Box Lucas指数模型拟合实验各处理CO2累积排放量与培养时间之间的关系,如式(1):
Y=S0(1-e-kt)
(1)
式中,Y为CO2累积排放量(g CO2-C m-2);t为培养时间(h);S0为模型理论上限;S0×k为模型起始时的增长速率(回归确定系数,R2>0.95,P<0.001),定义为培养初期CO2排放速率,用以表征融化初期土壤CO2激发排放的强度(mg CO2-C m-2h-1)。基于本次培养实验较高频次采样,不同处理土壤CO2最大排放速率为培养过程中测得瞬间排放速率的最大值(mg CO2-C m-2h-1)。各处理培养期间CO2累积排放量和土壤微生物碳的比值为微生物代谢熵(qCO2)(mg CO2-C g-1生物量 C d-1)。
利用单施Glu处理与对照、Glu+NH4Cl处理与NH4Cl处理及Glu+KNO3处理与KNO3处理土壤活性碳库、CO2瞬间排放速率和CO2累积排放量的差值,来研究外源氮对Glu引起的融化培养期间森林土壤有机碳激发效应的影响,分别用Glu-对照,(Glu+NH4Cl)-NH4Cl和(Glu+KNO3)-KNO3表示,并分析不同湿度和不同林分之间的差异。用培养期间CO2瞬间排放速率差值的最大值来表示由Glu引起的融化培养期间CO2最大排放速率。用式(1)来拟合CO2累积排放量的差值随培养时间的变化,取S0×k值表示由Glu引起的培养期间CO2排放速率。利用高湿度未施氮、低湿度施氮或高湿度施氮处理分别与低湿度未施氮处理Glu引起的CO2累积排放量或微生物碳含量的比值再减去1乘以100%,分析湿度增加、施氮及其组合对Glu引起的融化培养期间森林土壤有机碳激发效应的影响。所有处理3次重复,均计算平均值和标准误差。所有数据利用Tukey比例估计公式进行正态转化并确认方差齐性后再进行统计分析。利用多因素方差分析研究: (1)湿度、碳和氮添加及其组合对两种林分土壤融化培养初期CO2排放速率、培养期最大排放速率和累积排放量以及qCO2的影响;(2)林分、土壤湿度和施氮及其组合对由Glu引起的融化培养期间土壤有机碳分解激发效应的影响;(3)结合以前报道的未冻结实验结果,综合分析冻结、土壤湿度和施氮及其组合对由Glu引起的土壤有机碳分解激发效应的影响。利用图基(Tukey)检验的Honestly显著性差异(HSD0.05)表示培养期间每次采样不同处理CO2排放速率和累积排放量以及由Glu引起的土壤CO2排放速率和累积排放量的差异性;利用t检验比较不同处理两组数据之间的差异,显著性检验的置信水平设定为95%。通过多元线性逐步回归分析,阐述两种林分土壤CO2排放的主要影响因子。所有的统计分析均利用SPSS 19.0软件实现。
2 结果与讨论
2.1 湿度与外源氮对未施Glu土壤融化过程CO2排放动态变化的影响
图1显示单施NH4Cl和KNO3时不同湿度两种林分土壤融化过程中CO2排放速率和累积排放量动态变化。由图可见,两种土壤对照CO2排放速率在开始融化后2天内达到峰值,随后逐渐降到近似稳态。与未冻结实验相比[19],冻结过程增加两种林分土壤培养前期CO2激发排放的持续时间和峰值,并且培养结束时对照CO2累积排放量增加至1.5—1.8倍(表1),这种刺激倍数与我们之前所做的原状土培养实验[5]以及Goldberg等[2]的观测结果一致。与阔叶红松混交林土壤相比,低湿度条件下的整个培养期以及高湿度条件下融化6天后,次生白桦林土壤对照CO2排放速率及累积排放量均显著较大(P<0.05)。相对于低湿度而言,高湿度两种林分土壤对照CO2排放速率达到峰值时间较晚,峰值显著较低(表1,P<0.05)。培养结束时,随着土壤湿度的增加,次生白桦林土壤对照CO2累积排放量和qCO2显著地降低,而阔叶红松混交林两者显著地增加(P<0.05)(表1),这种土壤CO2累积排放量随着湿度的变化规律与未冻结实验结果一致[19]。Panikov和Dedysh[37]报道湿地土壤(90%—92%体积含水量)CO2排放在融化后的2天内持续增大,第3天达到最大值,直到第5天降低到近似稳态。然而,湿度为50%最大持水量的针叶林土壤仅在融化后一天内出现CO2脉冲式排放[4]。综上可得,土壤湿度显著地影响冻土融化过程CO2激发排放的强度和持续时间[15],并可能随着土壤类型及其基质条件的不同存在差异。

图1 单施NH4Cl和KNO3时不同湿度两种林分土壤融化过程中CO2排放速率和累积排放量动态变化Fig.1 Dynamic of cumulative CO2 fluxes and instant rates of CO2 fluxes during thawing of frozen WBF and BKPF soils treated with NH4Cl and KNO3 alone under different moisture conditions空心图标表示次生白桦林土壤;实心图标表示阔叶红松混交林土壤;(a)和(b)表示低湿度;(c)和(d)表示高湿度;HSD0.05竖线表示每次采样各个处理的Honestly显著性差异(P=0.05)
低湿度条件下,单施NH4Cl显著地抑制次生白桦林土壤CO2培养前期排放速率和累积排放量(P<0.05,t检验结果)(表1);高湿度条件下,单施KNO3显著抑制阔叶红松混交林CO2累积排放量(P<0.05,t检验结果)(表1)。但上述两种处理外源氮对土壤CO2累积排放量的抑制率(7.5%—10.2%)均显著小于未冻结实验[19]相应处理(17.7%—20.5%)(P<0.001,t检验结果),这可能与冻土融化过程中释放大量矿质氮有关[38]。低湿度条件下,与对照相比,阔叶红松混交林土壤单施KNO3处理CO2累积排放量较大(P<0.05)(表1),这可能与其较高的水溶性DOC含量(P<0.05)(表2)和较大的qCO2有关(P<0.05)(表1)。

表1 次生白桦林和阔叶红松混交林土壤CO2排放及方差分析结果(1)
*P<0.05; **P<0.01; ***P<0.001; n.s., 不显著2.2 湿度与外源氮对施加Glu土壤融化过程CO2排放动态变化的影响
图2显示Glu及其与外源氮组合施加时,不同湿度两种林分土壤融化过程中CO2排放速率和累积排放量动态变化。与图1相比,施加Glu各处理培养前期CO2激发排放的峰值更大且持续时间更长,尤其是高湿度条件下直至培养后第4天才达到峰值。融化培养结束时,次生白桦林和阔叶红松混交林土壤单施Glu处理CO2累积排放量分别增至18.7—19.9和16.7—19.2 g C/m2,约为其相应对照的2.1—2.4倍和3.2—3.6倍(表1)。湿度和Glu交互影响次生白桦林土壤CO2培养初期排放速率以及两种土壤CO2累积排放量(P<0.05)(表1);硝态氮和Glu交互影响两种林分土壤CO2累积排放量(P<0.05)(表1),同时两种形态氮均与湿度和Glu三者交互影响阔叶红松混交林土壤CO2累积排放量(P<0.05)(表1)。Jacinthe等[24]发现施加高剂量的小麦残渣(70.4 g C/m2)显著地促进冬末和春季冻融期耕地土壤CO2的排放量,约为未施残渣处理的2.0—2.3倍,而施加低剂量(35.2 g C/m2)无显著影响。Lukas等[25]发现施加玉米残渣(1.2 mg C/g 干土和 42.5 μg N/g 干土)的土壤(36%最大持水量)微生物呼吸在融化后第7天达到峰值,较未施残渣处理晚4d,其峰值大小约为未施残渣处理的6倍,培养结束时累积排放量增至约7倍。因此,外源碳对冻土融化过程微生物呼吸的刺激强度和持续时间,可能依赖于土壤类型和外源碳的种类及施加剂量,并受到土壤湿度和氮素有效性的影响。

图2 葡萄糖及其与外源氮组合施加时不同湿度两种林分土壤融化过程中CO2排放速率和累积排放量动态变化Fig.2 Dynamic of cumulative CO2 fluxes and instant rates of CO2 fluxes during thawing of frozen WBF and BKPF soils treated with Glu and in combination with NH4Cl or KNO3 addition under different moisture conditions空心图标表示次生白桦林土壤;实心图标表示阔叶红松混交林土壤;(a)和(b)表示低湿度;(c)和(d)表示高湿度;HSD0.05竖线表示每次采样各个处理的Honestly显著性差异(P=0.05)
2.3 林分、湿度和施氮对由Glu引起的融化期土壤有机碳分解和微生物量的影响
图3显示不同湿度和外源氮添加条件下,两种林分土壤融化过程中由Glu引起的CO2排放速率和累积排放量动态变化。低湿度条件下,阔叶红松混交林土壤由Glu引起的CO2排放速率达到峰值时间较次生白桦林土壤晚;高湿度条件下,两种林分土壤由Glu引起的CO2排放速率在融化后第4天均达到峰值,并且后者土壤CO2排放峰值显著地增加(P<0.05)。融化培养结束时,阔叶红松混交林土壤未施氮处理由Glu引起的CO2累积排放量在两种湿度条件下均显著地大于次生白桦林土壤(P<0.001)(表2)。单施KNO3显著增加两种湿度的白桦林土壤由Glu引起的CO2累积排放量(P<0.01)(表2);林分、湿度和KNO3施加三者交互影响两种林分土壤Glu引起的培养期间CO2最大排放速率(P<0.001)(表2)。培养结束时两种林分土壤由Glu引起的CO2累积排放量(9.6—13.49 g C/m2)显著大于所施加的葡萄糖含碳量(6.4 g C/m2),这可能来源于施加Glu所引起的土壤固有有机碳分解。随着土壤湿度的增加,两种林分土壤由Glu引起的CO2累积排放量显著增大 (P<0.001)(表2);土壤湿度及其与林分均显著地影响融化培养初期CO2排放速率(P<0.001)(表2)。结合未冻结实验结果[19],发现低湿度未施氮时冻结后两种林分土壤由Glu引起的CO2累积排放量(9.6—12.0 g CO2-C m-2)与未冻结土壤(9.5—11.2 g CO2-C m-2)无差异,而高湿度时则差异达显著水平 (P<0.05)(图4)。基于湿度和冻结交互作用影响Glu引起的CO2累积排放量(P<0.05)(表3),推论冻结对两种林分土壤由Glu引起的CO2累积排放量的影响应随土壤湿度增加而增大。Mørkved等[40]发现施加植物提取液(0.34 mg C/g干土和 28 μg N/g干土)对水分张力为10kPa的冻结土壤融化过程中CO2排放的刺激效果与未冻土壤无显著差异。Lukas等[25]发现施加玉米残渣(1.2 mg C/g干土和 42.5 μg N/g干土)促进冻土融化过程土壤(36%最大持水量)固有有机碳的分解,且这种激发效应显著强于未冻结处理。综上所述,外源碳对冻土融化微生物呼吸的激发效应与外源碳的种类及其剂量、土壤氮素有效性和湿度水平有关; 冻结过程及其与土壤湿度交互影响外源碳对土壤微生物呼吸的激发效应(P<0.05)(表3)。
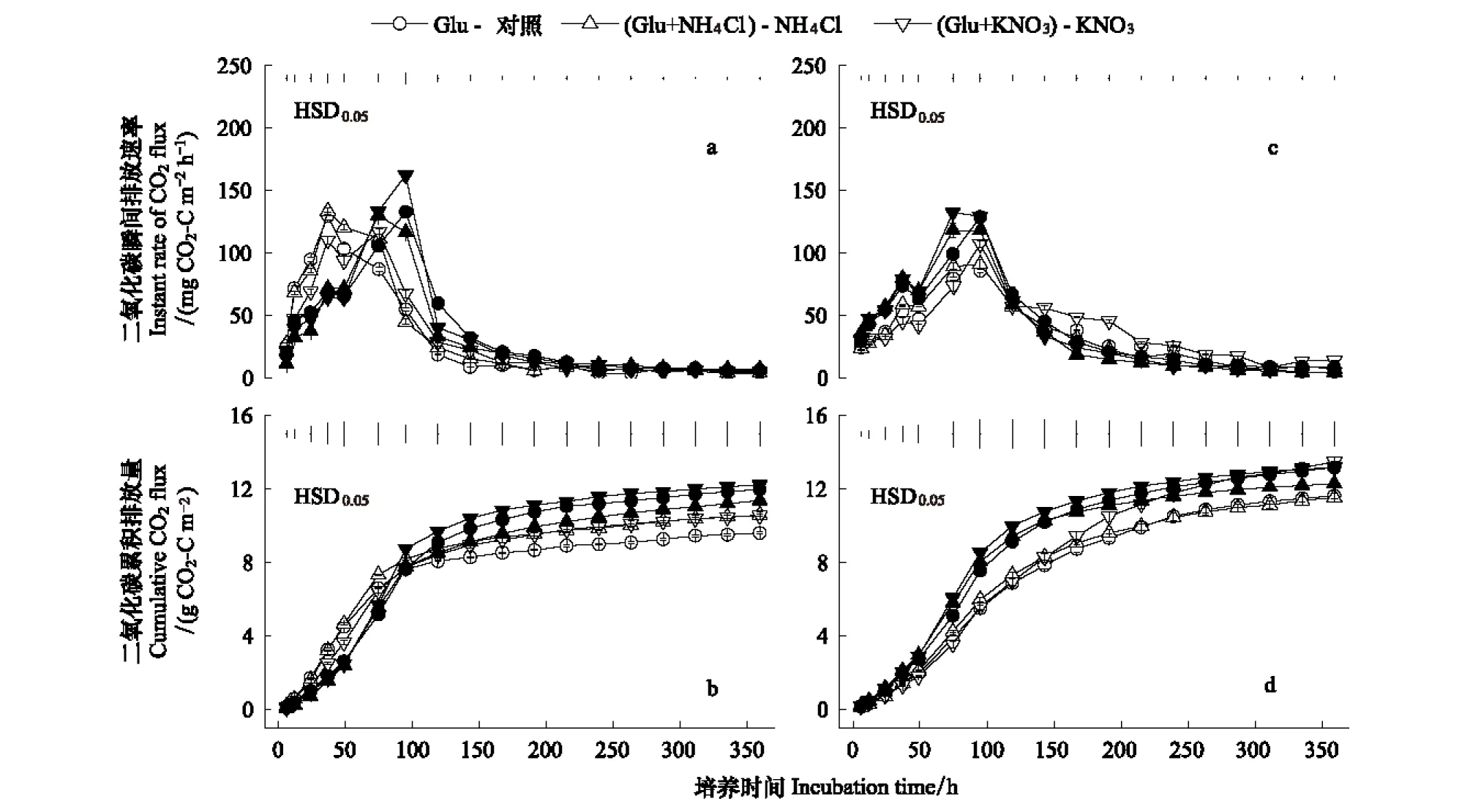
图3 不同湿度和外源氮添加条件下,两种林分土壤融化过程中由葡萄糖引起的CO2排放速率和累积排放量动态变化Fig.3 Dynamic of glucose-induced cumulative CO2 fluxes and instant rates of CO2 fluxes during thawing of frozen WBF and BKPF soils treated with and without NH4Cl or KNO3 addition under different moisture conditions空心图标表示次生白桦林土壤;实心图标表示阔叶红松混交林土壤;(a)和(b)表示低湿度;(c)和(d)表示高湿度;HSD0.05竖线表示每次采样各个处理的Honestly显著性差异(P=0.05)
与阔叶红松混交林土壤相比,次生白桦林土壤不施氮处理水浸提DOC(P<0.05)以及所有处理K2SO4浸提DOC和微生物碳含量均显著地增加(P<0.001)(表2),较大的活性碳含量可能导致了次生白桦林土壤融化过程CO2排放量较大(P<0.05)(表1)。方差分析显示土壤湿度及其与施氮交互作用显著地影响到由Glu引起的K2SO4浸提DOC增量(P<0.05),土壤湿度显著地影响到由Glu引起的土壤水浸提DOC增量(P<0.05)(表2)。单施KNO3将两种湿度次生白桦林土壤Glu引起的微生物碳含量显著地增至16.3—27.2 g C/m2,单施NH4Cl将低湿度阔叶红松混交林土壤Glu引起的微生物碳含量显著地增至14.5 g C/m2(P<0.001)(表2),两者均
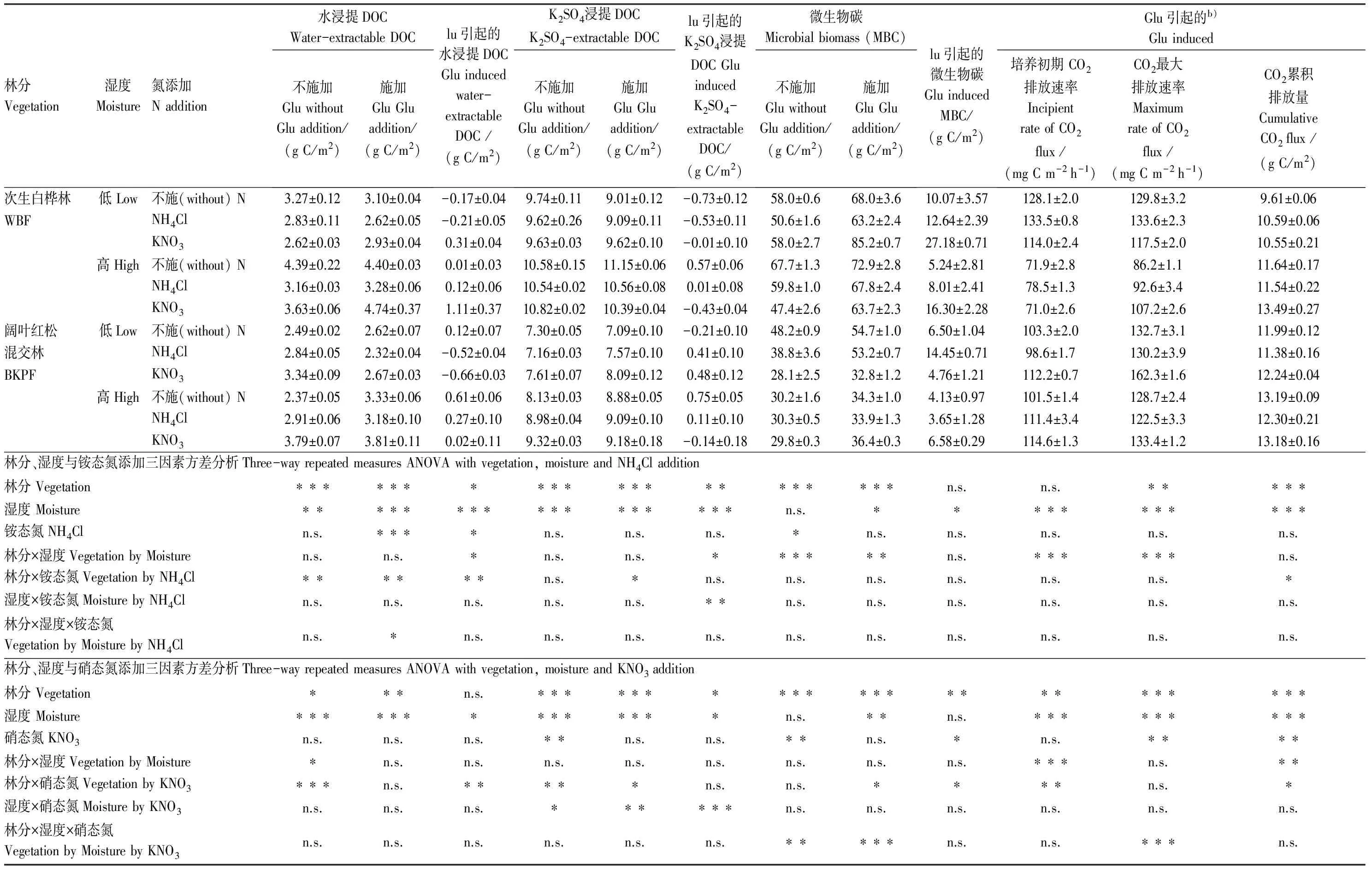
表2 林分、土壤湿度和施氮对由葡萄糖引起的土壤活性碳库及CO2排放量的影响及方差分析结果
*P<0.05, **P<0.01, ***P<0.001, n.s., 不显著; 由Glu引起的CO2排放速率和累积排放量计算方法见本文1.4计算与统计分析

表3 冻结、土壤湿度和施氮对由葡萄糖引起的土壤CO2排放量及微生物碳影响的方差分析结果
*P<0.05, **P<0.01, ***P<0.001, n.s., 不显著
显著大于所施Glu含碳量(6.4 g C/m2),这可能与Glu施加可刺激土壤融化过程中固有有机碳矿化,促进向微生物碳转换有关[25]。方差分析显示硝态氮添加、林分及其相互作用显著地影响到这种Glu引起的微生物碳增量(P<0.05)(表2)。低湿度未施氮冻结后两种林分土壤Glu引起的微生物碳(6.5—10.1 g C/m2)显著小于未冻结土壤(17.7—20.3 g C/m2)(P<0.05)(图4)。并且无论冻结与否,湿度的增加对土壤Glu引起的微生物碳均表现为抑制作用(图4)。单施NH4Cl促进冻结后土壤Glu引起的微生物碳,而对未冻结土壤主要表现为抑制作用(图4);方差分析显示铵态氮和硝态氮添加分别显著地影响到阔叶红松混交林和次生白桦林土壤Glu引起的微生物碳增量(P<0.01)(表3)。因此,土壤融化过程中葡萄糖对土壤微生物碳的激发效应与土壤湿度、外源氮的形态及林分类型有关(表3)。Lukas等[25]发现施加玉米残渣激发冻土融化过程中土壤固有有机碳向微生物碳转变,且这种激发效应显著大于未冻结土壤(P<0.05)。Blagodatskaya等[40]认为土壤有机碳激发效应所增加的CO2释放可能不仅仅与土壤微生物量周转有关,还可能受到土壤微生物群落的影响。研究表明[5,41],冻结过程显著地减少土壤微生物量及微生物碳/氮比,土壤微生物优势群落出现从真菌逐渐转向细菌[42]。因此,这种冻结显著影响葡萄糖对森林土壤微生物碳的激发效应可能与微生物群落结构的变化有关。

图4 氮添加、湿度增加(M)及其组合时未冻结和冻结后土壤Glu引起的微生物呼吸及微生物碳的增加或减少百分数Fig.4 Percentile increase or decrease in the glucose-induced soil microbial respiration and microbial biomass C in responses to NH4Cl or KNO3 addition and increased soil moisture (M) with and without freezing treatment图中各箭头上百分数范围的平均值是正值则箭头为实线,反之则为虚线; 平均值的绝对值越大箭头越粗;增加或减少百分数的计算方法见本文1.4计算与统计分析;未冻结土壤微生物呼吸及微生物碳数据参见文献[19]
2.4 森林土壤CO2累积排放量与土壤活性碳、氮含量的关系

表4 培养期间两种林分土壤CO2累积排放量与土壤活性碳、氮含量之间的回归分析结果
Table 4 Results of stepwise regression analysis for the cumulative CO2fluxes from WBF and BKPF soils against the soil labile C and N pools

Y(次生白桦林土壤CO2累积排放量)Y(CumulativeCO2fluxfromWBFsoil)/(gCO2-C/m2)变量Variable系数Coefficient标准误差Standarderror相对贡献率/%RelativecontributionR2b0Constant12.575.970.46∗∗∗X1,微生物碳MBC/(gCO2-C/m2)0.320.0849.4X2,微生物氮MBN/(gCO2-C/m2)-7.372.9426.7X3,K2SO4浸提DONK2SO4-extractableDON/(gCO2-C/m2)-0.820.3823.9Y(阔叶红松混交林土壤CO2累积排放量)Y(CumulativeCO2fluxfromBKPFsoil)/(gCO2-C/m2)变量Variable系数Coefficient标准误差Standarderror相对贡献率/%RelativecontributionR2b0Constant0.000.090.69∗∗∗X1,K2SO4浸提NH+4-NK2SO4-extractableNH+4-N/(gCO2-C/m2)-0.480.1032.2X2,K2SO4浸提DOCK2SO4-extractableDOC/(gCO2-C/m2)0.600.1040.3X3,K2SO4浸提NO-3-NK2SO4-extractableNO-3-N/(gCO2-C/m2)-0.410.1027.5
样本容量n=36; ***P<0.001;R2回归确定系数
3 结论
两种林分土壤融化初期存在CO2激发排放的现象,这种激发排放的强度和持续时间在外源碳添加后显著地增大,并受到林分类型和土壤湿度的影响。与阔叶红松混交林土壤相比,次生白桦林土壤较高的DOC及微生物碳含量可能导致其融化过程微生物呼吸增强。外源Glu引起的林地冻土融化过程中微生物呼吸碳排放量显著地大于所施Glu含碳量,这有力显示了施加Glu引起土壤固有有机碳的分解。湿度水平影响Glu对土壤微生物呼吸及微生物碳的刺激效应;外源氮影响Glu对土壤微生物呼吸及微生物碳的刺激效应,但随着湿度、林分和氮形态的不同存在差异。通过与未冻结实验结果[19]比较,发现土壤冻结过程显著地促进土壤微生物呼吸、削弱了外源氮对土壤微生物呼吸的抑制效果,并显著地改变了外源碳对土壤微生物碳和微生物呼吸的激发效应。无论冻结与否,温带森林土壤微生物呼吸和微生物量对葡萄糖施加的响应均与林分类型、湿度、外源氮供给及其形态存在显著的相关性。未来研究应进一步模拟野外实际情况,考虑外源物(如凋落物及其浸提物)的种类和剂量、冻融交替的频次和强度以及更多湿度梯度对中国高寒区森林土壤有机碳分解激发效应的影响及相关微生物机制。
[1] Durán J, Rodríguez A, Morse J L, Groffman P M. Winter climate change effects on soil C and N cycles in urban grasslands. Global Change Biology, 2013, 19(9): 2826- 2837.
[2] Goldberg S D, Muhr J, Borken W, Gebauer G. Fluxes of climate-relevant trace gases between a Norway spruce forest soil and atmosphere during repeated freeze-thaw cycles in mesocosms. Journal of Plant Nutrition and Soil Science, 2008, 171(5): 729- 739.
[3] Kim D G, Vargas R, Bond-Lamberty B, Turetsky M R. Effects of soil rewetting and thawing on soil gas fluxes: a review of current literature and suggestions for future research. Biogeosciences, 2012, 9(7): 2459- 2483.
[4] Schimel J P, Clein J S. Microbial response to freeze-thaw cycles in tundra and taiga soils. Soil Biology and Biochemistry, 1996, 28(8): 1061- 1066.
[5] 徐星凯, 段存涛, 吴浩浩, 李团胜, Cheng W G. 冻结强度和冻结时间对高寒区温带森林土壤微生物量、可浸提的碳和氮含量及N2O和CO2排放量的影响. 中国科学: 地球科学, 2015, 45(11): 1698- 1712.
[6] 秦璐, 吕光辉, 何学敏, 张雪妮, 张雪梅, 孙景鑫, 李尝君, 杨晓东. 艾比湖地区土壤呼吸对季节性冻土厚度变化的响应. 生态学报, 2013, 33(22): 7259- 7269.
[7] Grogan P, Michelsen A, Ambus P, Jonasson S. Freeze-thaw regime effects on carbon and nitrogen dynamics in sub-arctic heath tundra mesocosms. Soil Biology and Biochemistry, 2004, 36(4): 641- 654.
[8] Koponen H T, Flöjt L, Martikainen P J. Nitrous oxide emissions from agricultural soils at low temperatures: a laboratory microcosm study. Soil Biology and Biochemistry, 2004, 36(5): 757- 766.
[9] Larsen K S, Jonasson S, Michelsen A. Repeated freeze-thaw cycles and their effects on biological processes in two arctic ecosystem types. Applied Soil Ecology, 2002, 21(3): 187- 195.
[10] Groffman P M, Hardy J P, Driscoll C T, Fahey T J. Snow depth, soil freezing, and fluxes of carbon dioxide, nitrous oxide and methane in a northern hardwood forest. Global Change Biology, 2006, 12(9): 1748- 1760.
[11] Muhr J, Borken W, Matzner E. Effects of soil frost on soil respiration and its radiocarbon signature in a Norway spruce forest soil. Global Change Biology, 2009, 15(4): 782- 793.
[12] Brooks P D, McKnight D, Elder K. Carbon limitation of soil respiration under winter snowpacks: potential feedbacks between growing season and winter carbon fluxes. Global Change Biology, 2005, 11(2): 231- 238.
[13] Drotz S H, Sparrman T, Schleucher J, Nilsson M, Öquist M G.. Effects of soil organic matter composition on unfrozen water content and heterotrophic CO2production of frozen soils. Geochimica et Cosmochimica Acta, 2010, 74(8): 2281- 2290.
[14] Öquist M G, Laudon H. Winter soil frost conditions in boreal forests control growing season soil CO2concentration and its atmospheric exchange. Global Change Biology, 2008, 14(12): 2839- 2847.
[15] Stielstra C M, Lohse K A, Chorover J, McIntosh J C, Barron-Gafford G A, Perdrial J N, Litvak M, Barnard H R, Brooks P D. Climatic and landscape influences on soil moisture are primary determinants of soil carbon fluxes in seasonally snow-covered forest ecosystems. Biogeochemistry, 2015, 123(3): 447- 465.
[16] Lou Y S, Ren L X, Li Z P, Zhang T L, Inubushi K. Effect of rice residues on carbon dioxide and nitrous oxide emissions from a paddy soil of subtropical China. Water, Air, and Soil Pollution, 2007, 178(1/4): 157- 168.
[17] Lu W W, Ding W X, Zhang J H, Li Y, Luo J F, Bolan N, Xie Z B. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil: a negative priming effect. Soil Biology and Biochemistry, 2014, 76: 12- 21.
[18] Zou J W, Huang Y, Zong L G, Zheng X H, Wang Y S. Carbon dioxide, methane, and nitrous oxide emissions from a rice-wheat rotation as affected by crop residue incorporation and temperature. Advances in Atmospheric Sciences, 2004, 21(5): 691- 698.
[19] 吴浩浩, 徐星凯, 段存涛, 李团胜, Cheng W G. 植被类型、湿度和氮素供给对外源碳刺激森林土壤异养呼吸和微生物碳量的影响. 中国科学: 地球科学, 2015, 45(6): 820- 830.
[20] 王若梦, 董宽虎, 何念鹏, 朱剑兴, 代景忠, 施侃侃. 围封对内蒙古大针茅草地土壤碳矿化及其激发效应的影响. 生态学报, 2013, 33(12): 3622- 3629.
[21] Matzner E, Borken W. Do freeze-thaw events enhance C and N losses from soils of different ecosystems? A review. European Journal of Soil Science, 2008, 59(2): 274- 284.
[22] Lipson D A, Schmidt S K, Monson R K. Carbon availability and temperature control the post-snowmelt decline in alpine soil microbial biomass. Soil Biology and Biochemistry, 2000, 32(4): 441- 448.
[23] Schmidt S K, Lipson D A. Microbial growth under the snow: implications for nutrient and allelochemical availability in temperate soils. Plant and Soil, 2004, 259(1/2): 1- 7.
[24] Jacinthe P A, Lal R, Kimble J M. Carbon budget and seasonal carbon dioxide emission from a central Ohio Luvisol as influenced by wheat residue amendment. Soil and Tillage Research, 2002, 67(2): 147- 157.
[25] Lukas S, Potthoff M, Dyckmans J, Joergensen R G. Microbial use of15N-labelled maize residues affected by winter temperature scenarios. Soil Biology and Biochemistry, 2013, 65: 22- 32.
[26] Intergovernmental Panel on Climate Change (IPCC). Fifth Assessment Report (AR5), Working Group I: The physical Science Basis. Cambridge: Cambridge University Press, 2013: 475- 475.
[27] Wu X, Brüggemann N, Butterbach-Bahl K, Fu B J, Liu G H. Snow cover and soil moisture controls of freeze-thaw-related soil gas fluxes from a typical semi-arid grassland soil: a laboratory experiment. Biology and Fertility of Soils, 2014, 50(2): 295- 306.
[28] Teepe R, Vor A, Beese F, Ludwig B. Emissions of N2O from soils during cycles of freezing and thawing and the effects of soil water, texture and duration of freezing. European Journal of Soil Science, 2004, 55(2): 357- 365.
[29] 赵明月, 赵文武, 钟莉娜. 土地利用和环境因子对表层土壤有机碳影响的尺度效应——以陕北黄土丘陵沟壑区为例. 生态学报, 2014, 34(5): 1105- 1113.
[30] 孙玉军, 张俊, 韩爱惠, 王雪军, 王新杰. 兴安落叶松(Larixgmelini)幼中龄林的生物量与碳汇功能. 生态学报, 2007, 27(5): 1756- 1762.
[31] Xu X K, Han L, Wang Y S, Inubushi K. Influence of vegetation types and soil properties on microbial biomass carbon and metabolic quotients in temperate volcanic and tropical forest soils. Soil Science and Plant Nutrition, 2007, 53(4): 430- 440.
[32] 王旭, 周广胜, 蒋延玲, 贾丙瑞, 王风玉, 周莉. 山杨白桦混交次生林与原始阔叶红松林土壤呼吸作用比较. 植物生态学报, 2007, 31(3): 348- 354.
[33] Jenkinson D S. Determination of microbial biomass carbon and nitrogen in soil // Wilson J R, ed. Advances in Nitrogen Cycling in Agricultural Ecosystems. Wallingford: CAB International, 1988: 368- 386.
[34] Jenkinson D S, Brookes P C, Powlson D S. Measuring soil microbial biomass. Soil Biology and Biochemistry, 2004, 36(1): 5- 7.
[35] Wu J S, Joergensen R G, Pommerening B, Chaussod R, Brookes P C. Measurement of soil microbial biomass C by fumigation-extraction—an automated procedure. Soil Biology and Biochemistry, 1990, 22(8): 1167- 1169.
[36] Franzluebbers A J. Microbial activity in response to water-filled pore space of variably eroded southern Piedmont soils. Applied Soil Ecology, 1999, 11(1): 91- 101.
[37] Panikov N S, Dedysh S N. Cold season CH4and CO2emission from boreal peat bogs (West Siberia): winter fluxes and thaw activation dynamics. Global Biogeochemical Cycles, 2000, 14(4): 1071- 1080.
[38] 吴浩浩. 干湿交替及冻融过程对温带森林土壤温室气体净通量的影响[D]. 西安: 长安大学, 2014.
[39] Kurganova I N, Tipe P. The effect of freezing-thawing processes on soil respiration activity. Eurasian Soil Science, 2003, 36(9): 976- 985.
[40] Blagodatskaya E V, Blagodatsky S A, Anderson T H, Kuzyakov Y. Priming effects in chernozem induced by glucose and n in relation to microbial growth strategies. Applied Soil Ecology, 2007, 37(1/2): 95- 105.
[41] Mørkved P T, Dörsch P, Henriksen T M, Bakken L R. N2O emissions and product ratios of nitrification and denitrification as affected by freezing and thawing. Soil Biology and Biochemistry, 2006, 38(12): 3411- 3420.
[42] Högberg M N, Högberg P, Myrold D D. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three?. Oecologia, 2007, 150(4): 590- 601.
Changes in heterotrophic respiration and microbial biomass carbon of forest soils during thaw
WU Haohao1,2, XU Xingkai1,2,*, DUAN Cuntao1, LI Tuansheng3, CHENG Weiguo4
1StateKeyLaboratoryofAtmosphericBoundaryLayerPhysicsandAtmosphericChemistry,InstituteofAtmosphericPhysics,ChineseAcademyofSciences,Beijing100029,China2DepartmentofAtmosphericChemistryandEnvironmentalScience,CollegeofEarthScience,UniversityofChineseAcademyofSciences,Beijing100049,China3CollegeofEarthScienceandResources,Chang′anUniversity,Xi′an710054,China4FacultyofAgriculture,YamagataUniversity,Tsuruoka997- 8555,Japan
Packed soil core incubation experiment was made to study the effects of external carbon (C) (glucose, 6.4 g C/m2) addition on microbial respiration and microbial biomass C (MBC) in soils of a mature broadleaf and Korean pine mixed forest (BKPF) and an adjacent white birch forest (WBF) during thaw under different soil moisture levels (55% and 80% water-filled pore space) and nitrogen (N) supply (NH4Cl and KNO3, 4.5 g N/m2). The results showed that, without C and N addition, cumulative CO2flux from the WBF soil was significantly higher than that from the BKPF soil during the incubation period. With increasing soil moisture, the cumulative CO2flux and microbial metabolic quotient (qCO2) decreased in the WBF soil but increased in the BKPF soil without C and N addition(P< 0.05). The glucose-induced cumulative CO2fluxes from the two forest soils ranged from 9.61 to 13.49 g CO2-C/m2, which was greater than the dose of added C in the form of glucose. The glucose-induced MBC in the two forest soils ranged from 3.65 to 27.18 g C/m2, while glucose addition had little impact on soil dissolved organic C pool. Hence, the extra C released upon addition of glucose may result from the decomposition of soil native organic C. Without N addition and under the two soil moisture levels, the glucose-induced cumulative CO2flux from the BKPF soil was significantly higher than that from the WBF soil during thaw (P< 0.001). With increasing soil moisture, the glucose-induced cumulative CO2fluxes from the two forest soils were significantly increased (P< 0.001). The addition of KNO3alone significantly increased the glucose-induced cumulative CO2flux (P< 0.01) and the glucose-induced MBC (P< 0.001) in the WBF soil under two soil moisture levels (P< 0.001). Addition of NH4Cl alone significantly increased the glucose-induced MBC in the BKPF soil with low moisture level. Based on the results from the previously reported non-freezing experiments and the results of the present study, it can be concluded that freezing treatment significantly affects the stimulating effects of glucose on soil microbial respiration and MBC under temperate forests. Regardless of whether freezing occurred or not, the responses of soil microbial respiration and MBC to the addition of extraneous C as glucose in temperate forests depend on vegetation type, soil moisture, and the amount and type of N added.
microbial respiration; microbial biomass carbon; glucose; nitrogen supply; dissolved organic carbon; stimulating effect; thawing of frozen soil
国家自然科学基金(41175133, 21228701, 41275166, 41321064, 41575154)
2015- 11- 16; 网络出版日期:2016- 10- 29
10.5846/stxb201511162320
*通讯作者Corresponding author.E-mail: xingkai_xu@mail.iap.ac.cn
吴浩浩,徐星凯,段存涛,李团胜,CHENG WeiGuo.森林土壤融化期异养呼吸和微生物碳变化特征.生态学报,2017,37(8):2729- 2742.
Wu H H, Xu X K, Duan C T, Li T S, Cheng W G.Changes in heterotrophic respiration and microbial biomass carbon of forest soils during thaw.Acta Ecologica Sinica,2017,37(8):2729- 2742.
