飞秒激光对拟南芥种子萌发及幼苗生长的影响*
2017-06-25韩亚萍马斯晗
袁 野,韩亚萍,马斯晗
(东北林业大学)
0 引言
自1960年激光问世以来,受到了卫星通信、医疗、植物学等领域的青睐.1966年匈牙利科学家Mester首次发现弱激光具有生物效应[1],因此激光在生物学各方面的研究得到了广泛关注和探索,如激光微生物突变株诱变修复、细胞损伤及修复、提高酶的活性以及增强植物的抗氧化性等[2-5].其中在植物生理生化和诱变育种领域,常用的激光器为He-Ne激光器、CO2激光器、红宝石激光器等[6],按激光脉冲宽度可分为纳秒、皮秒、飞秒激光器等.飞秒激光器的瞬时功率高、穿透性强、脉冲宽度超短,单脉冲作用时间与生物化学反应时间相同[7],能在生物大分子间发生干涉衍射[8].拟南芥因植株个体小、生长周期短、基因组小等特点,已被广泛用于激光生物学研究.该文利用飞秒激光辐照拟南芥种子,统计其种子萌发率,测量幼苗根长、鲜重,叶绿素、可溶性糖、过氧化氢酶、丙二醛的含量[9-11].筛选出飞秒激光辐照拟南芥的最佳实验条件,为深入研究飞秒激光对拟南芥生长发育的作用机理提供参考.
1 材料与方法
1.1 材料
供试材料为哥伦比亚野生型拟南芥种子.
1.2 方法
1.2.1 处理设置
该研究选用钛宝石飞秒激光器,其参数为:波长800nm、频率1 kHz、扩束后光斑直径5 mm.用清水浸泡拟南芥种子3 h,随后避光存入4℃冰箱进行春化.实验采用不同辐照条件的飞秒激光照射拟南芥种子正反两面,共设置对照组(CK)和实验组共26组,每组辐照40粒种子,各组辐照条件见表1.
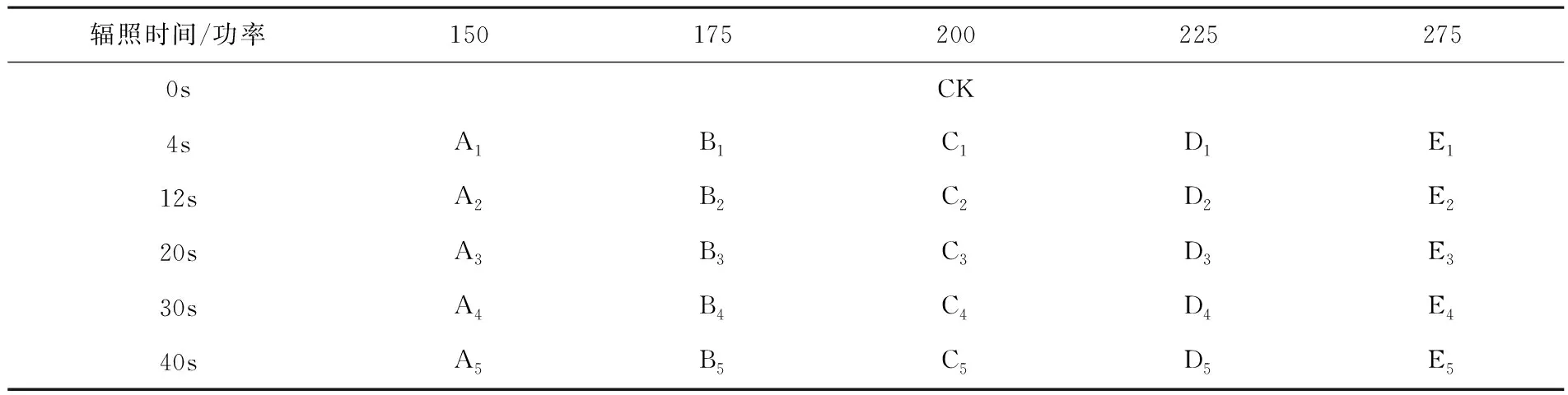
表1 各实验组的设置情况 mW
1.2.2 种子的培养
将处理后的各组种子用1%次氯酸钠溶液浸泡灭菌2 min,随后用无菌水进行冲洗,并将其点播在MS培养基上[12].在温度(21~23℃)、湿度(60%~70%)、光照强度(5000~6000lx)的光照培养箱中培养拟南芥种子,其光照周期为16h光照和8h黑暗.待生长8 d后,每组随机选取20棵幼苗,移栽至黑土∶蛭石=1∶1的营养土中栽培,保持土壤湿润.
1.3 指标的测定
1.3.1 萌发和生长指标
从MS培养基放入光照培养箱的第2 d开始统计发芽率,统计周期为24 h,连续统计7 d,以种子露白为萌发标准[13].发芽率公式如下:
发芽率(Gr)=(前7天种子萌发数/点播种子总数)×100%
(1)
拟南芥种子经8 d的MS培养后,每组随机选取20株幼苗进行根长、鲜重的测量.
1.3.2 生理生化指标
培养5周后测定叶绿素、可溶性糖、过氧化氢酶的含量,经5天的旱处理后测量丙二醛含量,具体测量方法如下:
叶绿素含量的测定采用乙醇法[14].将0.05g叶片、石英砂、95%乙醇放入研钵中研磨至组织变白,过滤定容后得到叶绿素提取液,利用紫外分光光度计测量波长为470nm、649nm、665nm的吸光度,计算叶绿素a、叶绿素b、总叶绿素的含量,如公式(2)~(5):
ca=13.95A665nm-6.88A649nm
(2)
cb=24.96A649nm-7.32A665nm
(3)
cT=ca+cb
(4)
叶绿素含量(mg/g)=
(5)
可溶性糖含量的测定采用恩酮比色法[14].将0.05g叶片放入80%乙醇中沸水浴加热30min,经活性炭褪色后离心过滤后得到提取液.在提取液中加入蒽酮试剂10min后测量625nm处的吸光度,通过标准蔗糖浓曲线测得蔗糖浓度,含量计算如公式(6):
(6)
过氧化氢酶活性的测定采用紫外吸收法[14].将0.05g叶片和pH为7.8的磷酸缓冲液放入研钵中研磨成浆,经离心过滤后提取粗酶液.在粗酶液中加入0.3mL的0.1mol/L过氧化氢,每分钟测一次240nm下吸光度,共测4次,酶活性计算如公式(7):
(7)
丙二醛含量的测定采用硫代巴比妥酸法[15].将0.05g叶片加入石英砂和pH为7.8的磷酸缓冲液研磨成浆,经离心过滤后的上清液为丙二醛提取液.在提取液中加入2mL的5%硫代巴比妥酸的5%三氯乙酸沸水浴加热10min,测量450nm、532nm、600nm波长下的吸光度,丙二醛含量计算如公式(8)、(9):
cMDA=6.45(A532nm-A600nm)-0.56Anm
(8)

(9)
1.4 数据分析
所有数据重复测量三次,取平均值,使用Excel 2007与Origin 9.0进行数据运算与图表的绘制.
2 结果与分析
2.1 飞秒激光对拟南芥种子萌发的影响
由图1可知,蓝绿色区域表示促进种子的萌发,橘红色区域表示抑制种子的萌发.绿色区域内的实验组为C4(200 mW,30s)、D3(225 mW,20s),平均发芽率高达96.3%,与CK组相比提高了11.3%,此区域为促进种子萌发的最佳实验条件.蓝色区域内的实验组平均发芽率为90.7%,与CK组相比提高了5.7%,此区域的飞秒激光能刺激种子的萌发.橘色区域内的实验组为E3(275mW,20s)、E4(275mW,30s),平均发芽率为72.5%,与CK组相比下降了7.5%,此区域开始抑制种子萌发.红色区域内的实验组为E5(275 mW,40s),此时发芽率为57.5%,与CK组相比下降了27.5%,此区域对种子萌发起到了明显的抑制作用.综上所述,试验条件除E5(275 mW,40s)外的飞秒激光对拟南芥种子萌发均起促进作用.

图1 飞秒激光作用下拟南芥种子发芽率的变化
2.2 飞秒激光对拟南芥根长的影响
由图2可知,纵坐标为实验组与CK组根长的差值,不同颜色表示不同的差值范围.蓝绿色区域表示起促根部生长,橘红色区域表示抑制根部生长.绿色区域内的实验组为B1(175 mW,4s)、B2(175 mW,12s)、C1(200 mW,4s)、D1(225 mW,4s),平均根长为22.61mm,与CK组(20.22mm)相比提高了11.8%,此区域为促进根部发育的最佳实验条件范围.蓝色区域实验条件集中在辐照功率(150~275 mW)、辐照时间(4~12s)的范围,平均根长为21.54mm,与CK组相比提高了6.5%,此区域根长的促进作用减弱.橘色区域内的实验条件集中于辐照功率(150~275 mW)、辐照时间(20~30s),平均根长为19.51mm,与CK组相比下降了3.6%,此区域表现为抑制作用.红色区域内的实验条件为辐照功率(150~275 mW)、辐照时间(30~40s),平均根长为15.51mm,与CK组相比下降了23.3%,此区域严重影响根部发育.综上所述,辐照功率150~275 mW、辐照时间4~12 s的飞秒激光辐照能促进根部发育,辐照时间变长时促进作用减弱,辐照时间达到20s后抑制作用越来越明显.
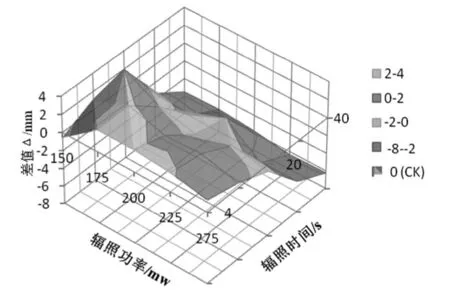
图2 飞秒激光作用下拟南芥根长的变化
2.3 飞秒激光对拟南芥鲜重的影响
由图3可知,蓝绿色区域表示促进幼苗生长,橘红色区域表示抑制幼苗生长.绿色区域内的实验组别为B2(175 mW,12s)、C2(200 mW,12s)、D1(225 mW,4s)、E1(275 mW,4s),平均鲜重为1.434mg,与CK组相比提高了59.3%,此区域为促进幼苗生长的最佳实验条件范围.蓝色区域实验条件集中在辐照功率(150~275 mW)、辐照时间(4~20s)的范围,平均鲜重为1.125 mg,与CK组相比提高了25%,此区域促进幼苗生长的作用减弱.橘色区域内的实验条件为辐照功率(150~200 mW)、辐照时间(30~40 s),平均鲜重为0.652 mg,与CK组相比下降了27.6%,此区域表现为抑制作用.红色区域内的实验条件为辐照功率(225~275 mW)、辐照时间(30~40 s),平均鲜重为0.373 mg,与CK组相比下降了58.6%,此区域严重影响幼苗生长.综上所述,辐照功率150~275 mW、辐照时间4~20 s的飞秒激光辐照能提高幼苗的鲜重,辐照时间达到30s后抑制作用明显.

图3 飞秒激光作用下拟南芥鲜重的变化
2.4 飞秒激光对拟南芥叶绿素含量的影响
叶绿素是一种光合色素,它可以反映出叶片的生长发育情况.由图4可知,在辐照功率175 mW的条件下,叶绿素含量随时间的增加呈现先增加后减少的趋势,其叶绿素含量平均值为1.24mg/g,与CK组(1.11mg/g)相比提高了11.7%,其中B2~B4的实验组促进作用明显.在辐照功率150、200、225 mW的条件下,叶绿素含量随时间的增加呈现先减少后增加的趋势,其叶绿素含量平均值依次为1.078、0.957、1.048mg/g,与CK组相比分别下降了2.73%、13.7%、5.39%,此时表现为较弱的抑制作用.在辐照功率275 mW的条件下,叶绿素含量随时间的增加而未发生明显改变,其叶绿素含量平均值为0.741 mg/g,与CK组相比降低了33.1%,此时体现为完全抑制作用.综上所述,辐照功率175 mW、辐照时间12~30 s的飞秒激光能显著提高叶绿素含量,最佳实验组为B3(175 mW,20 s).
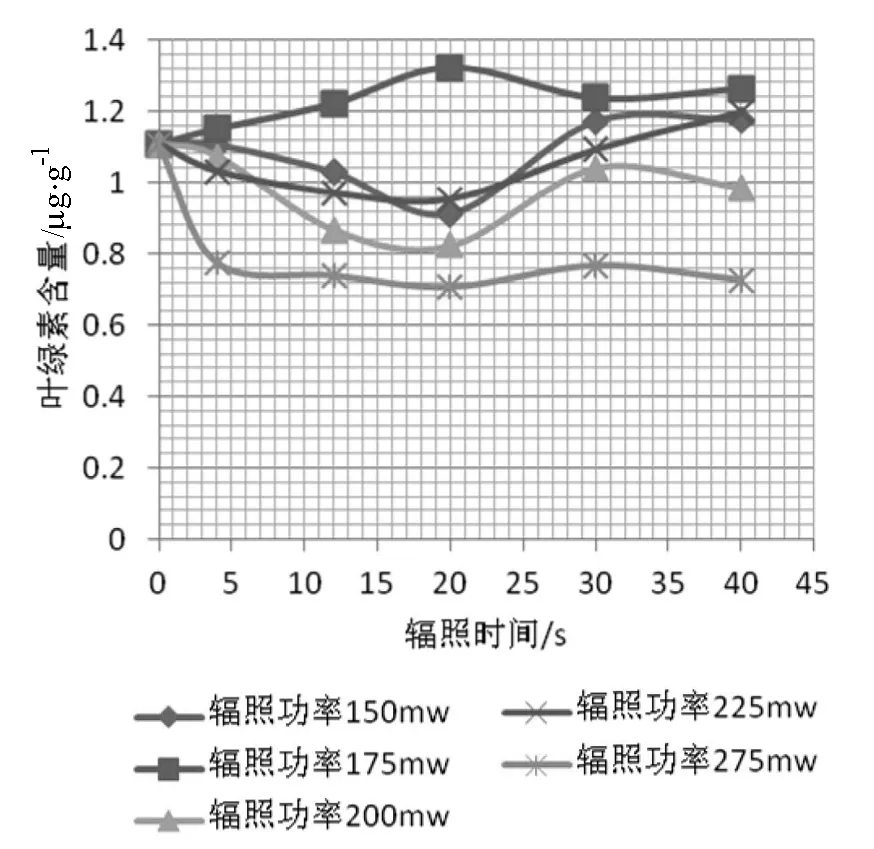
图4 飞秒激光作用下芥叶绿素含量的变化
2.5 飞秒激光对拟南芥可溶性糖含量的影响
可溶性糖是植物代谢的主要产物之一,主要影响了植物的生长发育和抗逆性.由图5可知,当辐照功率(150~225 mW)一定,辐照时间为0~40 s时,可溶性糖含量随辐照时间的增加均呈现先增加后减少的趋势.各辐照功率(150~225 mW)下的可溶性糖含量平均值依次为12.06、13.34、12.47、13.15 μg/g,与CK组相比分别上升了13.2、25.1%、16.9%、23.4%.当辐照功率150~ 225 mW、辐照时间12~20 s时,可溶性糖含量均值为14.38 μg/g,与CK组相比上升了34.9%,此区域的实验条件的促进作用最明显.在辐照功率275 mW、辐照时间0~40s的条件下,随辐照时间的增加可溶性糖含量先减少后增加,此时其平均值为9.9 μg/g,与CK组(10.66μg/g)相比下降了13.9%,抑制作用明显.综上所述,辐照功率150~225 mW、辐照时间12~20 s的飞秒激光能显著提高可溶性糖含量,最佳实验组为B3(175 mW,20s).

图5 飞秒激光作用下拟南芥叶片可溶性糖含量的变化
2.6 飞秒激光对拟南芥过氧化氢酶活性的影响
过氧化氢酶能清除植物体内H2O2,具有一定的保护效应.由图6可知,在辐照功率150~275 mW时,过氧化氢酶活随辐照时间的增加均表现为先增加后减少再增加的趋势,并且最佳辐照时间为12s.在辐照功率(150~275 mW)下,酶活均值依次为18.3、17.0、12.8、12.4、15.5U/(g·min),即辐照功率150~175 mW的飞秒激光能提高过氧化氢酶活性.在辐照功率150~175 mW、辐照时间4~12 s时,其活性均值为20.0U/(g·min),与CK组(16.5U/(g.min))相比提高了21.2%.虽然实验B2(175 mW,12s)为过氧化氢酶活性最高的实验组,但从辐照功率的总体趋势上看A2(150 mW,12 s)应为最佳实验组.综上所述,辐照功率150~175 mW、辐照时间4~12 s的飞秒激光能显著提高过氧化氢酶活性,其中最佳实验组为A2(150 mW,12 s).

图6 飞秒激光作用下拟南芥叶片 过氧化氢酶活性的变化
2.7 飞秒激光对拟南芥丙二醛含量的影响
丙二醛是植物膜脂过氧化反应的产物,能够反映出植物受伤害的程度.由图7可知,当辐照功率为150 mW、辐照时间4~40 s时,随时间的增加丙二醛含量先减少后无明显变化,且各组丙二醛含量均低于CK组(0.041μg/g),平均值为0.034μg/g,与CK组相比下降了18.6%,此功率的飞秒激光能提高膜脂的抗氧化能力.当辐照功率175~275 mW、辐照时间4~40 s时,辐照时间越长丙二醛含量越高.其中功率150、175 mW的各组丙二醛含量均低于CK组,此时其含量平均值依次为0.037、0.04μg/g,与CK组相比分别下降了18.5%和9.7%.综上所述,辐照功率150~175 mW、辐照时间4~40 s的飞秒激光能对拟南芥叶片起到保护作用,最佳辐照组为B4(175 mW,4s).

图7 飞秒激光作用下拟南芥叶片丙二醛含量的变化
3 讨论
该实验研究表明,辐照功率150~275 mW、辐照时间4~20 s的飞秒激光能提高种子发芽率、幼苗根长及鲜重,促进了拟南芥种子的生长与分化.辐照功率175 mW、辐照时间12~30 s的飞秒激光能显著提高叶绿素含量,提高了幼苗对光能的利用率,利于ATP和有机物的积累.辐照功率175~225 mW、辐照时间12~20 s的飞秒激光促进了可溶性糖的合成,增强了对渗透压的调控,提高了植物抗逆性.辐照功率150~175 mW、辐照时间4~12 s的飞秒激光能提高过氧化氢酶的活性,提升了清除过氧化氢的能力,增强了自身的保护作用.经干旱处理后,辐照功率150~175 mW、辐照时间4~40s的飞秒激光能降低丙二醛含量,防止叶片内自由基诱发膜脂过氧化,对细胞膜起保护作用.综上所述,在辐照功率175 mW、辐照时间12s的条件下,飞秒激光不仅能提高拟南芥种子的萌发及幼苗的生长,还能提高植物的光合作用与抗逆性.
激光生物效应可分为热效应、光效应、电磁效应和压力效应[16].热效应是指生物分子吸收红外线后使其温度升高的效应.而飞秒激光的单脉冲时间极短,激光沉积时间短于能量转移时间,所以排除了激光生物热效应的影响.光效应是指生物的分子吸收光子后激发的光化学反应[17-18].生物组织中的碳链和肤链分子键的维持能量为3.4 MeV[19],波长800nm的飞秒激光器光子能量为1.55MeV,若双光子吸收的能量为3.1MeV仍然不能使生物分子发生光化学效应,所以排除了激光生物光效应的影响.电磁效应表现为激光的电磁场与生物组织的相互作用[20],而电场强度与激光的功率密度相关,最佳条件的飞秒激光功率密度为9 mW/mm2,无法干扰生物分子自身的库伦场,形成不了激光生物电磁效应.压力效应是光压作用生物分子产生的效应.当大量光子长时间作用时,飞秒激光会在生物分子内部形成一个稳定的光压.光压计算公式为P=I(1+R)/c(式中I为光强,R为能量反射率,c为光速),光压与激光强度有关,光子作用时间与辐照时间相关,激光生物机械效应同时受二者共同作用,而且辐照功率存在最佳值,随着辐照时间的增加存在积累效应,当超过一定的辐照剂量时产生抑制作用.此理论与该文各项指标的实验结果不谋而合.
综上可知,辐照条件为功率175 mW、时间12 s的飞秒激光能促进拟南芥种子的萌发和幼苗的生长,飞秒激光对拟南芥的促进作用与光压有关,并且存在积累效应.
参 考 文 献
[1] Mester E.The use of the laser beam in therapy[J].Orvosi Hetilap,1966,107(22):1012-1016.
[2] 张岩,胡军,郭长虹,等.植物谷胱甘肽-S-转移酶的分子生物学研究进展[J].哈尔滨师范大学自然科学学报 , 2007,23 (4) :76-79.
[3] 姜晓燕,高丽美,李永峰,等.He-Ne激光对增强UV-B辐射拟南芥抗氧化系统的损伤修复[J].光子学报,2011,40(5):712-717.
[4] Wu M, Grahn E, Eriksson L A. Strid Computational Evidence for the Role of Arabidopsis thaliana UVR8 as UV-B Photoreceptor and Identification of Its Chromophore Amino Acids[J]. Journal of chemical information and modeling, 2011, 51(6):1287-1295.
[5] Kaiserli E, Jenkins G I. UV-B promotes rapid nuclear translocation of the Arabidopsis UV-B-specific signaling component UVR8 and activates its function in the nucleus[J]. The Plant Cell Online, 2007, 19(8):2662-2673.
[6] 冯光文,成浩,徐辉,等.激光诱变技术在生物育种中的应用[J].激光与光电子学进展,2007,44(5):56-61.
[7] 李海伟,陈云琳,黄笛,等.飞秒激光诱变微生物技术及其机理的研究进展[J].化工进展,2011,30(4):824-829.
[8] 王亚伟,刘莹,卜敏,等.飞秒激光与生物组织作用原理及其应用[J].激光与红外,2008,38(1)-10.
[9] 刘樱,刘玫,关旸.东北龙胆与莕菜种子至种苗发育过程的研究[J].哈尔滨师范大学自然科学学报,2002,18(5):73-76.
[10]李晓阳 陈慧泽 韩榕,等.He-Ne激光处理对拟南芥种子萌发和幼苗生长特性的影响[J].西北植物学报,2012,32(1):131-135.
[12] 侍福梅,王超.紫外线-B辐射引起拟南芥内源H2O2增加及细胞死亡[J].西北农业学报,2009,18(3):231-233.
[13] 谢阳姣,何志鹏 ,林伟,等.汉桃树种子发芽影响因素研究[J].种子,2012,31(2):108-110.
[14] 蔡永萍.植物生理学实验指导[M].北京:中国农业大学出版社,2014.
[15] 李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[16] 陈怀军,吴俊林.激光处理植物种子产生的效应概述[M].现代生物医学进展,2008,8(3):587-589.
[17] 康锡惠,刘梅清.光化学原理与应用[M].天津大学出版社,1995.
[18] Kreslavski VD, Shmarev AN, Lyubimov VY,et al.Response of photosynthetic apparatus in Arabidopsis thaliana L. mutant deficient in phytochrome A and B to UV-B[J]. Photosynthetica , 2017:1-9.
[19] 李正佳.激光生物医学工程基础[M].北京:国防工业出版社,2007.
[20] 魏静霞.生物电磁效应及其在睡眠障碍治疗中的应用[D].河北科技大学,2013.
