冷藏期间苹果果实能量和NADP-苹果酸酶及基因表达的变化
2017-06-23易美君郁志芳
孔 静,易美君,许 昕,姜 丽,郁志芳
(南京农业大学食品科技学院,江苏南京 210095)
冷藏期间苹果果实能量和NADP-苹果酸酶及基因表达的变化
孔 静,易美君,许 昕,姜 丽,郁志芳*
(南京农业大学食品科技学院,江苏南京 210095)
为研究冷藏期间苹果果实能量水平和NADP-苹果酸酶(NADP-ME)及基因表达的变化情况,本研究以‘长富2’苹果果实为实验材料,定期测定果实硬度、可溶性固形物等品质指标和能量相关物质三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、磷酸腺苷(AMP)含量和能荷变化及NADP-ME、琥珀酸脱氢酶(SDH)活性。结果显示,冷藏期间,‘长富2’果实ATP含量贮藏前60 d下降,而后恢复到贮藏初期水平,ADP和AMP贮藏前60 d稍有降低后,随时间延长显著增加;NADP-ME和琥珀酸脱氢酶(SDH)活性均随贮藏时间延长逐渐降低;辅酶Ⅱ(NADP+)和还原型辅酶Ⅱ(NADPH)含量在贮藏前120 d先增加后下降,与能荷变化相似;MdcyME1-MdcyME3基因表达虽在时间上有一定差异,但表现出相似的先增加后下降的趋势。冷藏期间苹果果实能量水平和利用效率发生了改变,且能量水平与NADP-ME活性及其基因表达在统计学上存在相关性。
苹果,机械冷藏,能量代谢,酶活,基因表达
苹果(MalusdomesticaBorkh)属于蔷薇科苹果属,果实酸甜可口,富含矿物质和维生素,是人们最常食用的水果之一。苹果较水蜜桃等耐贮藏,但仍受采后迅速成熟、呼吸跃变等因素的制约。冷藏是目前果品保鲜中采用较广泛且有效的技术手段之一。低温能抑制果实的各种代谢活动,延缓果实后熟软化,达到保鲜的目的[1-2]。
苹果的成熟衰老是个复杂的过程,伴随着一系列生理生化反应,如乙烯的生成、叶绿素和细胞壁的降解等,从而引起果实在质地、风味等方面的改变,这些反应过程伴随着能量水平的改变。能量水平与果实成熟衰老密切相关,而国内外对苹果成熟衰老的诸多研究主要集中在品质、生理生化和调节控制方面,其中专注于能量水平的研究相对缺乏。能量在细胞生命活动中起枢纽作用,细胞需要足够的能量来维持正常的代谢进程,保持生长、生物合成等重要的生理功能。研究发现ATP合成与膜脂降解之间存在相关性,能量代谢对细胞膜完整性起着重要的调节作用[3];能量亏损会促进活性氧积累,破坏细胞膜完整性,从而导致果实衰老[4],因此维持能量供应便能保证细胞膜完整性,进而可延缓果实衰老。
苹果酸是苹果中主要的有机酸,NADP-苹果酸酶(NADP-ME)是调控苹果酸代谢的关键酶,可催化苹果酸进行氧化脱羧反应。Liu等[5]研究了1-MCP处理对苹果中有机酸代谢及NADP-ME活性的调控作用,证明NADP-ME有降解苹果酸的作用。目前,NADP-ME活性的变化及基因表达情况是关注的重点。
本研究以‘长富2’果实为试材,分析了冷藏期间果实能量水平和NADP-ME活性及其基因表达的变化情况,探索果实能量水平与果实成熟衰老的关系,从能量变化和分子层面为进一步研究延缓果实衰老技术提供理论依据。
1 材料与方法
1.1 材料与仪器
‘长富2’苹果(MalusdomesticaBorkh.,cv. Changfu 2) 于2015年11月15日采收自江苏省徐州市丰县师寨果园,采摘后立即运至大沙河果园冷库在0~2 ℃预冷,挑选个体大小一致、无机械损伤、病虫害的果实,套网袋装入瓦楞纸箱内,于17日运回实验室进行实验处理。果实随机分为四组(每组90个果实),每个苹果套网袋放于瓦楞纸箱内,纸箱置于冷库中。贮藏(1~4 ℃)条件下,分别于0、60、120、180 d随机从各组取平行样品3个,每个平行30个果实,进行能量水平和NADP-ME基因表达相关指标的测定。果实去皮后取适量果肉,用液氮冷冻后存于-80 ℃待用。2,4-二硝基苯肼、三氯乙酸、高氯酸、磷酸钾、异抗坏血酸、氢氧化钾 分析纯;甲醇、磷酸 色谱纯;ATP、ADP、AMP标品 上海源叶生物科技有限公司。
FHM-5 Fruits Hardness Tester Japan;PAL-1 Pocket Refractometer Japan;Agilent HPLC Series 1200 安捷伦科技有限公司;TGL16M台式高速冷冻离心机 长沙维尔康湘鹰离心机有限公司;HH-6数显恒温水浴锅 国华电器有限公司;KQ-300DB数控超声波清洗器 昆山市超声仪器有限公司;Alpha-1860A紫外可见分光光度计 上海谱元仪器有限公司;Bio-Rad CFX96 Real-Time PCR System USA。
1.2 测定方法
1.2.1 硬度和可溶性固形物含量的测定 用Fruits Hardness Tester(FHM-5,Japan)测定去皮果实硬度,下压距离为5 mm,探头直径为5 mm,下压速度为1 mm/s,重复取果测定10次,记录数据,取平均值。用Pocket Refractometer PAL-1(Japan)测定果实可溶性固形物含量,重复取果测定10次,取平均值。
1.2.2 丙酮酸和苹果酸含量的测定 丙酮酸测定采用2,4-二硝基苯肼法。取2 g果肉,研磨后加入25 mL 8%三氯乙酸(TCA),静置30 min后取10 mL研磨液8000 r/min离心15 min。试管中依次加入1 mL上清液,2 mL 8% TCA,1 mL 0.1%的2,4-二硝基苯肼溶液,5 mL 1.5 mol/L的NaOH,摇匀显色。在520 nm波长下比色,记录吸光度。苹果酸测定参考Zhang等采用HPLC法[6]。取2 g果肉,用8 mL超纯水研磨成匀浆后转入到10 mL离心管中,80 ℃水浴超声1 h,冷却后8000 r/min离心15 min,取5 mL上清液过滤到10 mL的容量瓶中,残渣加入5 mL超纯水再提取,再取5 mL上清液过滤,用超纯水定容至刻度。用0.22 μm滤膜过滤待测。色谱条件为Kromasil C18反相柱(ODS,250 mm×4.6 mm),检测波长为214 nm,流动相为甲醇和0.1%磷酸水(v∶v=2∶98),流速为1 mL/min,柱温30 ℃。苹果酸含量以mg/g表示。
1.2.3 NADP+和NADPH含量的测定 NADP+和NADPH含量均采用试剂盒(建成生物技术有限公司)测定。
1.2.4 三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、磷酸腺苷(AMP)和能荷(EC)的测定 参考Liu等[7]略作修改。取2 g果肉,研磨后加入6 mL 0.6 mol/L高氯酸冰浴1 min,8000 r/min、4 ℃离心10 min。上清液用1 mol/L KOH中和至pH6.5~6.8。冰浴30 min后8000 r/min、4 ℃离心20 min,取上清液定容至7 mL,用0.22 μm滤膜过滤待测。采用HPLC外标法测定。所用仪器为Hitachi HPLC D-2000。色谱条件为C18柱(250 mm×4.6 mm),检测波长254 nm,流动相为甲醇(A)和0.1 mol/L磷酸钾缓冲液(pH7.0)(B)。线性梯度洗脱,时间为10 min,流速1 mL/min,柱温20 ℃,流动相A在第0、7、9、10 min所占比例分别是0、20%、25%、0,进样量20 μL。用ATP、ADP、AMP标品配制不同浓度ATP、ADP、AMP溶液并作标准曲线,ATP、ADP、AMP保留时间分别为7.11、8.21、9.55 min。
EC=([ATP]+0.5[ADP])/([ATP]+[ADP]+[AMP])。
1.2.5 NADP-苹果酸酶(NADP-ME)和琥珀酸脱氢酶(SDH)酶活性的测定 参考郭润姿等[8],史娟等[9]的方法测定NADP-ME活性。取2 g研磨好的样品,加入6 mL 预冷的研磨缓冲液(0.2 mol/L Tris-HCl,pH 8.2,0.6 mol/L蔗糖,10 mmol/L异抗坏血酸),在4 ℃ 4000×g下离心 20 min,取上清液5 mL用提取缓冲液(0.2 mol/L Tris-HCl,pH 8.2,10 mmol/L异抗坏血酸,0.1% Triton X-100)定容到10 mL,取其中6 mL加入等体积的提取缓冲液,混匀待测。反应体系为3 mL(0.8 mol/L Tris-HCl,4 mmol/L MnSO4,3.4 mol/L NADP,4 mmol/L苹果酸及待测液),加入反应底物(苹果酸)后立即用紫外可见分光光度计测定吸光度变化,记录3 min,以每分钟吸光度变化0.01为一个酶活单位U。SDH活性用SDH试剂盒(建成生物技术有限公司)测定。
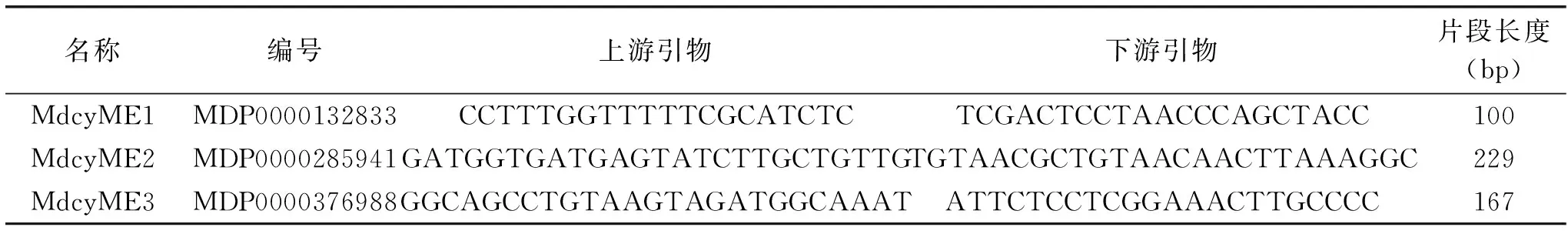
表1 ‘长富2’苹果果实NADP-ME基因荧光定量PCR引物序列Table 1 Primer sequence of NADP-ME genes for RT-qPCR in ‘Changfu 2’ fruit
1.2.6 苹果果实总RNA提取及Real-time荧光定量PCR检测 苹果果实总RNA用多糖多酚植物总RNA提取试剂盒(TIANGEN,China)提取,用紫外分光光度计检测RNA浓度、A260/A280,并进行0.8%琼脂糖凝胶电泳,检测RNA质量和完整性。RNA质量稳定后用PrimeSciptTM RT Master Mix试剂盒(TaKaRa,Japan)去除DNA杂质并合成cDNA。在苹果基因组数据库(https://www.rosaceae.org/search/features)中搜索并筛选得到MDP0000132833、MDP0000285941、MDP0000376988三个cDNA序列。参考董庆龙等[10]并结合premier 5.0软件设计引物(表1),选TUB为内参基因。荧光定量PCR包括95 ℃预变性30 s,95 ℃变性3 s和60 ℃复性延伸1 min组成的40个循环。所用仪器为Real-Time PCR System(Bio-Rad CFX96,USA),所有PCR反应均设3次平行管重复。PCR反应总体系(20.0 μL)为:cDNA模板1.0 μL,SYBR®Premix Ex TaqTM(2×)10.0 μL,上、下游引物各0.8 μL,水7.4 μL。用2-ΔΔCT法对结果进行数据分析。
1.3 数据统计分析
采用Excel及SPSS软件进行数据统计分析,结果用平均值±标准差(SE)表示。
2 结果与分析
2.1 硬度和可溶性固形物含量
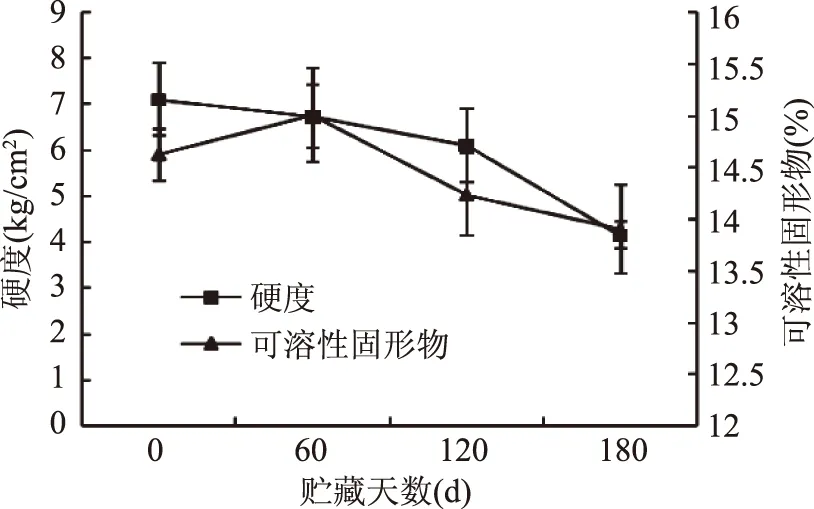
图1 冷藏期间‘长富2’苹果果实硬度和可溶性固形物含量的变化Fig.1 Change of firmness and TSS content in ‘Changfu 2’ apple fruit during storage
硬度和可溶性固形物是果实成熟衰老过程中表现果实品质的重要指标。图1显示,‘长富2’果实在整个冷藏期间呈现较高的硬度,并且随贮藏时间的增加呈下降趋势,由贮藏初期的7 kg/cm2(0 d)降至4 kg/cm2(180 d)。硬度在冷藏前120 d下降较为缓慢,后期急剧下降,由此推测果实在120 d后进入急剧衰老期。果实可溶性固形物含量则呈先上升后下降的趋势,由14.6%(0 d)增加至15%(60 d),随后下降至13.9%(180 d),这可能由于果实成熟初期淀粉降解导致还原糖含量上升,而后期还原糖被消耗有关。
2.2 丙酮酸和苹果酸含量
图2显示,冷藏期间‘长富2’果实丙酮酸含量在前60 d保持基本不变,而后快速增加,贮藏180 d时达到贮藏初期的3.9倍。王翠华等[11]研究证明菌体在能荷下降时丙酮酸大量合成,由此推测贮藏后期丙酮酸含量急剧增加与后期能量代谢加快,能量亏损有关。苹果酸作为三羧酸循环产能过程中重要的中间物质,其含量与能量水平的变化密切相关。苹果酸含量在冷藏期间呈下降趋势,贮藏前120 d表现尤其显著,至贮藏结束时苹果酸含量下降了41.6%。苹果酸的减少与其作为呼吸底物被消耗有关,进而可影响果实风味变化。
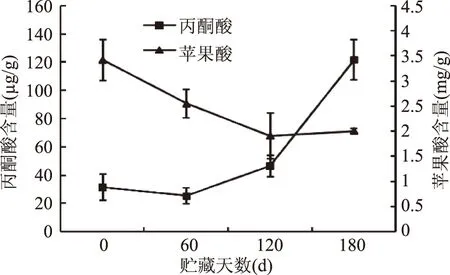
图2 冷藏期间‘长富2’苹果果实丙酮酸和苹果酸含量的变化Fig.2 Change of pyruvate and malate content in ‘Changfu 2’ apple fruit during storage
2.3 NADP+和NADPH含量
NADP+和NADPH可传递电子,参与生物体内的氧化还原反应,对生物体内各种代谢活动起调节作用[12]。NADPH可参与清除破坏膜结构的自由基[12],保持细胞膜完整性以延缓果实衰老。图3显示,机械冷藏期间‘长富2’果实NADP+和NADPH含量均呈先上升后下降趋势,变化表现出同步和一致性。NADP+和NADPH含量最高值均出现在120 d,最高值分别可达19 nmol/g组织和31 nmol/g组织,比0 d时分别增加了450%和219%。贮藏120 d后果实NADP+和NADPH含量减少,这可能是因为贮藏后期果实代谢减慢,品质下降。
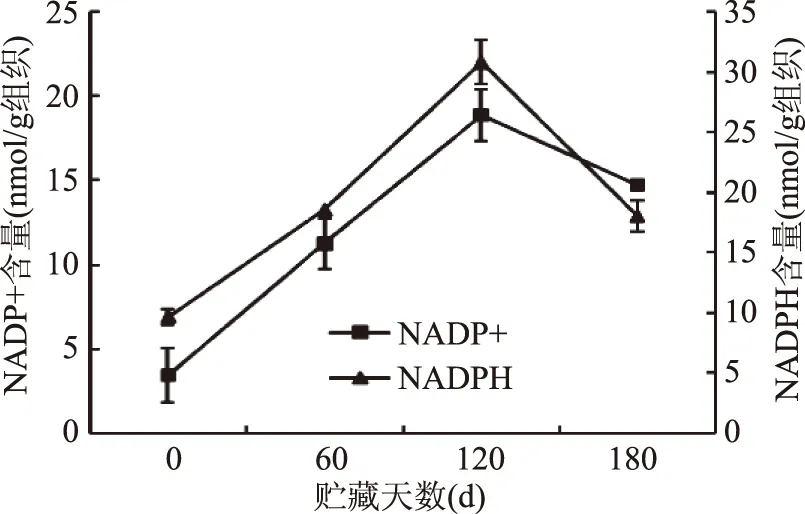
图3 冷藏期间‘长富2’苹果果实NADP+和NADPH含量的变化Fig.3 Change of NADP+ and NADPH content in ‘Changfu 2’ apple fruit during storage
2.4 ATP、ADP、AMP含量和能荷的变化
腺苷酸(ATP、ADP、AMP)是生物体重要的供能系统,与许多生物反应相偶联,能量亏损会造成果实代谢功能紊乱,导致不可逆转损伤[13-14]。图4显示,冷藏期间‘长富2’果实ATP含量在贮藏前60 d下降而后至120 d恢复到贮藏初期水平随后又有所下降,呈现波动性变化。冷藏前期低温减弱呼吸作用,降低整个代谢速率,导致ATP生成量少,中后期果实进一步成熟衰老,对ATP的需求促进了其积累,含量上升。与此对比,果实ADP、AMP含量在贮藏前60 d内先有一定幅度的下降而后显著上升。贮藏前期新陈代谢旺盛,需要ADP、AMP生成ATP,贮藏后期果实进入衰老期,能量亏损,ATP降解形成ADP、AMP。果实能荷在冷藏前120 d一直保持在较高水平,120 d后急剧下降,果实的衰老裂变与能量水平密切相关,且能荷表示细胞中腺苷酸系统的能量状态[12],因此能荷的这种变化可能与冷藏后期果实能量亏损,机体衰老有关。
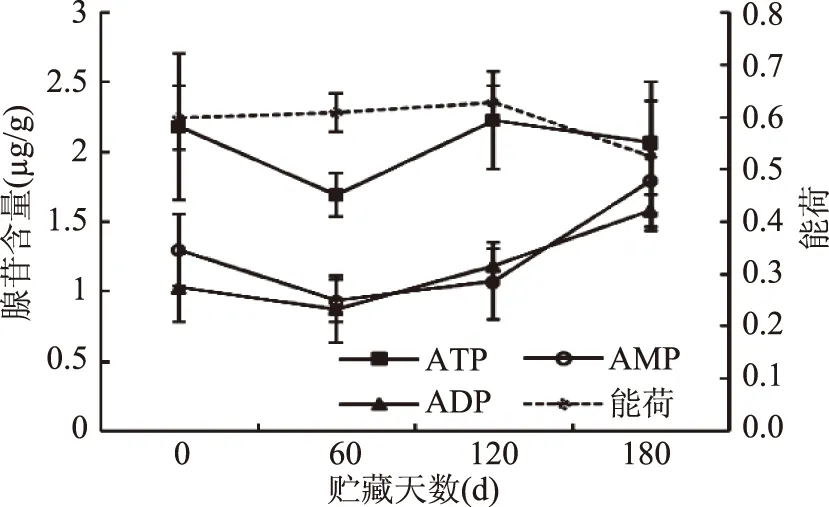
图4 冷藏期间‘长富2’苹果果实ATP、ADP、AMP含量和能荷的变化Fig.4 Change of ATP,ADP and AMP content and energy charge in ‘Changfu 2’ apple fruit during storage
2.5 NADP-ME和SDH活性
图5显示,冷藏期间‘长富2’果实NADP-ME和SDH活性均呈显著下降变化。NADP-ME活性在冷藏前120 d下降较缓慢,120 d后迅速下降,与苹果酸含量出现相反的变化,表明NADP-ME起着降解苹果酸的作用,且与能荷在冷藏前120 d保持较高水平,120 d后迅速下降变化相似。线粒体是细胞能量代谢和物质转化的中枢,是ATP产生的重要场所[4],而SDH是线粒体内呼吸代谢关键酶,其活性下降会造成线粒体结构和功能破坏,影响能量生成。贮藏结束时,与0 d相比,NADP-ME酶活下降了3000 U,琥珀酸脱氢酶(SDH)下降了3500 (U/mg prot)之多,如此大的酶活变化提示‘长富2’果实有机酸代谢速率和能量水平发生了显著变化。另外,需要注意的是‘长富2’苹果果实中NADP-ME和SDH两种酶活性呈同步性快速下降,提示果实成熟期间能量代谢速率发生了显著变化。
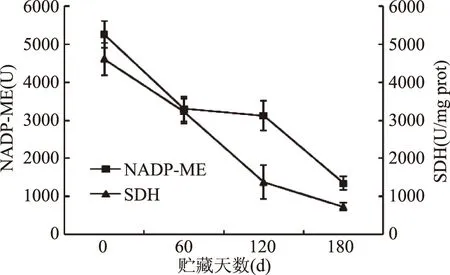
图5 冷藏期间‘长富2’苹果果实NADP-苹果酸酶(NADP-ME)和琥珀酸脱氢酶(SDH)活性的变化Fig.5 Changes of activities of NADP-ME and SDH in ‘Changfu 2’ apple fruit during storage
2.6 MdcyME基因表达
高等植物中编码NADP-ME的基因不是唯一的,而是由多个基因组成的小基因家族编码[10]。图6显示,冷藏期间MdcyME2和MdcyME3的相对表达量均呈先上升后下降的趋势,且均在贮藏60 d达到最大表达量,表现出同步性,而MdcyME1表达量呈整体上升趋势。MdcyME1相对表达量在贮藏60 d时可达0 d的1.8倍,且在贮藏后期也有1.46倍以上的表达量,而MdcyME2相对表达量在贮藏60 d时达到0 d的1.3倍,在贮藏后期降至0.5倍以下,基本不表达。MdcyME3在整个贮藏前4个月内表达量较高,可达0 d的3倍左右,但贮藏后期迅速下降,低至0.28倍,波动性较大。冷藏后期,NADP-ME活性持续下降,与MdcyME2和MdcyME3变化一致。以上结果表明MdcyME1-MdcyME3对NADP-ME的合成起重要作用,并不是合成NADP-ME的关键基因,且其表达具有阶段性。
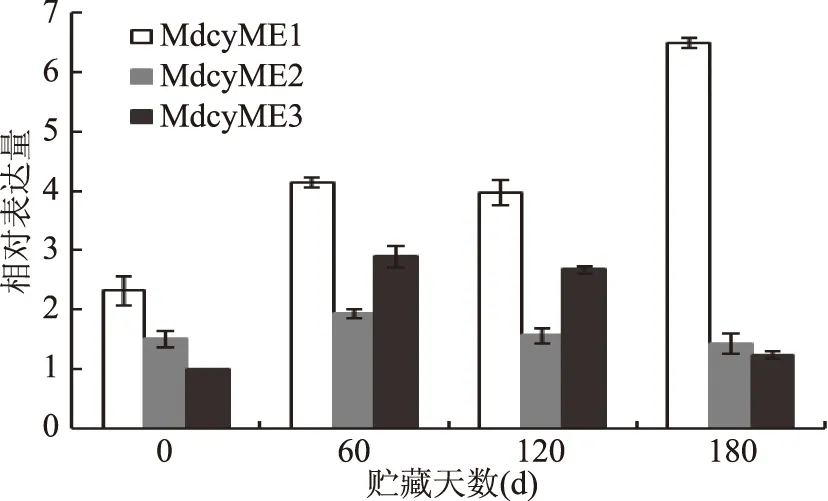
图6 冷藏期间‘长富2’苹果果实中MdcyME基因表达的变化Fig.6 Change of gene expression of MdcyME in ‘Changfu 2’ apple fruit during storage
2.7 苹果果实能量水平与NADP-ME活性及其基因表达的相关性分析
对能量水平相关指标和NADP-ME活性及基因表达作相关性分析(表2)。ADP、AMP与NADP-ME活性呈显著负相关,能荷与NADP-ME活性呈极显著正相关,表明能量水平与NADP-ME相关;而ATP、NADP+、NADPH与NADP-ME活性无明显相关关系,这可能与NADP-ME并不直接参与能量代谢有关,其具体机理还有待研究。ATP与MdcyME1呈显著负相关,NADP+、NADPH与MdcyME1则呈显著正相关关系;ADP、能荷与MdcyME2呈显著正相关,AMP则与MdcyME2呈显著负相关;ADP、AMP与MdcyME3呈显著负相关,而能荷、NADPH与MdcyME3则呈极显著正相关。以上结果表明能量水平(ATP、ADP和AMP)与NADP-ME活性及基因表达在统计学上存在相关性,其具体代谢相关性还有待深入研究。
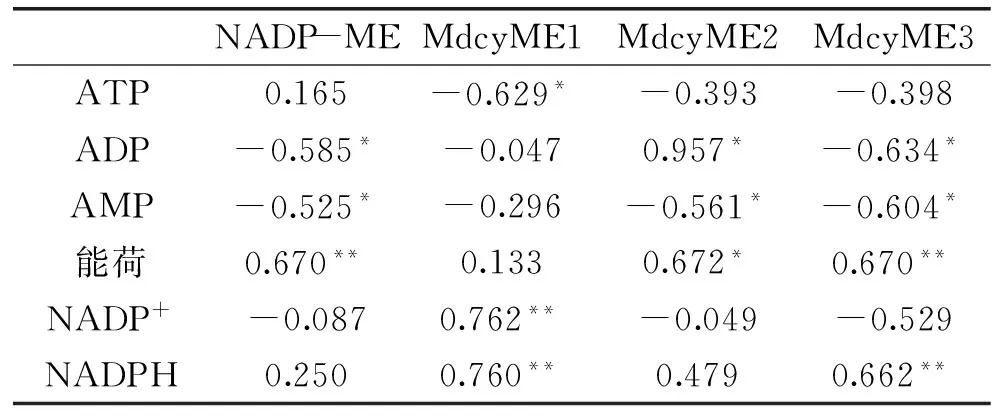
表2 苹果果实能量水平相关指标与NADP-ME活性及其基因表达的相关系数Table 2 Correlation analysis between indexes associated with energy level and activities and gene expression of NADP-ME in apple fruit
注:*表示在0.05水平上显著相关,**表示在0.01水平上极显著相关。
3 讨论与结论
果实成熟衰老期间能量水平发生明显变化。本研究中,苹果果实冷藏后期能荷急剧下降,果实能量亏损,品质下降,表明果实成熟衰老与能量状况相关。ATP含量冷藏前期下降后期上升,与冷藏期间荔枝果实ATP含量持续下降[15]存在差异,这可能与果实种类、贮藏时间长短等不同有关。苹果整个180 d冷藏期间,ATP、ADP、AMP、苹果酸和NADP(H)的含量变化表明果实能量水平降低,这可能与果实硬度和可溶性固形物含量下降,果实品质降低有关。研究表明,能量对维持细胞膜完整性具有非常重要的作用,能量亏损会导致细胞膜系统损伤[16],从而导致果实衰老[4],因此维持能量供应便能保证细胞膜完整性,进而可延缓果实衰老。由此可从维持果实能量水平方面研究果实保鲜的方法。
NADP-ME是与能量和碳水化合物代谢相关的蛋白质[17],对保持细胞渗透势、pH等有重要作用。本研究中,苹果果实NADP-ME活性在冷藏前期下降缓慢后期迅速下降,而能荷在冷藏前期保持较高水平而后期亦迅速下降,二者存在一定的相关性,表明前期较高的能量水平可能能够延缓NADP-ME活性的下降,至于其具体代谢相关性和影响机理还有待研究。另外,NADP-ME降解苹果酸的同时产生NADPH,使得NADPH不断积累,以清除破坏膜结构的自由基,从而对延缓果实成熟衰老有一定作用。本研究中,苹果果实NADP-ME和SDH活性呈同步的快速下降,表明苹果果实成熟期间能量代谢速率发生了明显变化,这可能是因为果实贮藏期间线粒体结构遭到了破坏[18],影响了能量生成效率。由此可为从提高NADP-ME和SDH活性方面探索延缓果实成熟衰老的方法提供理论依据。MdcyME1-MdcyME3在合成NADP-ME过程中起着重要作用,低温可诱导NADP-ME基因表达,产生新NADP-ME维持膜的流动性,以保证细胞各项代谢活动正常进行[19]。MdcyME2和MdcyME3表达量呈先上升后下降趋势,这可能是由于其贮藏前期受到低温诱导而后期果实进入衰老期,并且这与苹果果实能荷变化相似,由此推测苹果果实较高的能量水平可能有利于NADP-ME的基因表达,其具体影响机理还有待研究。
本研究结果显示,6个月的冷藏期间,‘长富2’果实苹果酸持续减少、丙酮酸后期大量累积,贮藏中后期ADP和AMP增加而后期能荷急剧下降,NADP+和NADPH含量呈先上升后下降趋势,NADP-ME和SDH两种酶的活性亦同步快速降低,提示果实贮藏期间能量水平和利用效率发生变化,且与NADP-ME活性和其基因表达在统计学上存在一定的相关性,推测前期较高的能量水平可延缓NADP-ME活性的下降和保持NADP-ME的基因表达,有利于保持果实品质。
[1]Wei J,Qi X,Guan J,et al. Effect of cold storage and 1-MCP treatment on postharvest changes of fruit quality and cell wall metabolism in sweet cherry[J]. Journal of Food,Agriculture & Environment,2011,9(3&4):118-122.
[2]李琛,刘颖,翁桢,等. 贮运环境对葡萄品质的影响[J]. 现代食品科技,2013,29(2):230-235.
[3]Rawyler A,Pavelic D,Gianinazzi C,et al. Membrane lipid integrity relies on a threshold of ATP production rate in potato cell cultures submitted to anoxia[J]. Plant Physiology,1999,120(1):293-300.
[4]Yi C,Qu H,Jiang Y,et al. ATP-induced changes in energy status and membrane integrity of harvested litchi fruit and its relation to pathogen resistance[J]. Journal of Phytopathology,2008,156(6):365-371.
[5]Liu R,Wang Y,Qin G,et al. Molecular basis of 1-methylcyclopropene regulating organic acid metabolism in apple fruit during storage[J]. Postharvest Biology and Technology,2016,117:57-63.
[6]Zhang Y,Li P,Cheng L. Developmental changes of carbohydrates,organic acids,amino acids,and phenolic compounds in ‘Honeycrisp’apple flesh[J]. Food Chemistry,2010,123(4):1013-1018.
[7]Liu H,Jiang Y,Luo Y,et al. A simple and rapid determination of ATP,ADP and AMP concentrations in pericarp tissue of litchi fruit by high performance liquid chromatography[J]. FoodTechnology and Biotechnology,2006,44(4):531-534.
[8]郭润姿. 不同处理对采后黄冠梨果实有机酸代谢酶及其基因表达的影响[D]. 天津:天津大学,2012.
[9]史娟,李方方,马宏,等. 不同中间砧对苹果果实苹果酸代谢关键酶活性及其相关基因表达的影响[J]. 园艺学报,2016(1):132-140.
[10]董庆龙,王海荣,安淼,等. 苹果NADP依赖的苹果酸酶基因克隆,序列和表达分析[J]. 中国农业科学,2013,46(9):1857-1866.
[11]王翠华,李友元,陈长华,等. Torulopsis glabrata 620在丙酮酸生物合成中的能荷变化和氧化-还原态趋势[J]. 华东理工大学学报:自然科学版,2006,32(5):552-555.
[12]李辉,林毅雄,林河通,等. 1-MCP延缓采后‘油木奈’果实衰老及其与能量代谢的关系[J]. 现代食品科技,2015(4):121-127.
[13]阳小成,王伯初. 机械振荡对猕猴桃愈伤组织ATP含量的影响[J]. 生物技术通讯,2003(5):393-395.
[14]Jiang Y,Jiang Y,Qu H,et al. Energy aspects in ripening and senescence of harvested horticultural crops[J]. Stewart Postharvest Review,2007,3(2):1-5.
[15]Liu H,Song L,You Y,et al. Cold storage duration affects litchi fruit quality,membrane permeability,enzyme activities and energy charge during shelf time at ambient temperature[J]. Postharvest Biology and Technology,2011,60(1):24-30.
[16]陈莲,陈梦茵,林河通,等. 解偶联剂DNP处理对采后龙眼果实果皮褐变和活性氧代谢的影响[J]. 中国农业科学,2009,42(11):4019-4026.
[17]Shi Y,Jiang L,Zhang L,et al. Dynamic changes in proteins during apple(Malus x domestica)fruit ripening and storage[J]. Horticulture Research,2014,1(6):1-21.
[18]阚娟,王红梅,金昌海,等. 桃果实成熟过程中活性氧和线粒体呼吸代谢相关酶的变化[J]. 食品科学,2009(8):275-279.
[19]刘增辉,邵宏波,初立业,等. 干旱,盐,温度对植物体NADP-苹果酸酶的影响与机理[J]. 生态学报,2009,30(2):3334-3339.
Change of energy level and gene expression of NADP-dependent malic enzyme in apple fruit during refrigerated storage
KONG Jing,YI Mei-jun,XU Xin,JIANG Li,YU Zhi-fang*
(College of Food & Technology,Nanjing Agricultural University,Nanjing 210095,China)
In order to investigate the change of energy level and gene expression of NADP-dependent malic enzyme during storage,‘Changfu 2’ apple fruits were taken as experimental material. Fruit firmness,total soluble solid(TSS),the activity of NADP-dependent malic enzyme(NADP-ME)and SDH,contents of ATP,ADP,AMP and energy charge were determined during storage. The results showed that the ATP content in apple fruit during storage period declined for the first 60 days thereafter recovering to storage beginning level,while the ADP and AMP content in fruit declined slightly for the first 60 days thereafter increased significantly. Both activities of NADP-ME and SDH declined gradually during whole storage period. The content of NADP+and NADPH in apple fruit performed similar trend with the energy charge that all increased obviously for the first 120 days then declined in the last 60 days. Although there was some difference on the time course,the gene expression of MdcyME1-MdcyME3 performed similar trend that they all increased during the early storage and then declined. These results demonstrated the energy levels and efficiency in apple fruits changed during storage and energy level has relevance with the activities and gene expression of NADP-ME.
apple;refrigerated storage;energy metabolism;enzyme activity;gene expression
2016-12-02
孔静(1991-),女,硕士,研究方向:采后生物学,E-mail:kongjingfly@163.com。
*通讯作者:郁志芳(1960-),男,博士,教授,研究方向:采后生物学,E-mail:yuzhifang@njau.edu.cn。
江苏省农业科技自主创新资金项目(CX(15)1022);江苏省高效园艺作物遗传改良重点实验室(2015022)。
TS255.1
A
1002-0306(2017)11-0329-06
10.13386/j.issn1002-0306.2017.11.055
