不同鲜食葡萄抗寒特性的实验研究
2017-06-23古丽孜叶·哈力克
古丽孜叶·哈力克
摘 要 根据“不同鲜食葡萄抗寒特性研究”的项目数据以及实验过程,对吐鲁番地区主栽的各种鲜食葡萄的抗寒特性进行了细致的研究。通过人工低温胁迫的方法,扦插苗根系在不同低温胁迫12 h后,测定低温对不同葡萄品种根系的相对电导率,以及其组织含水量、可溶性糖含量、脯氨酸含量及丙二醛含量等抗寒相关指标的变化,旨在分析比较低温胁迫下根系相关抗寒生理指标的变化规律,进一步了解这些调节物质与抗寒性的关系,从而发掘它们与低温胁迫抗寒相关性,更好地提高葡萄生产质量。
关键词 鲜食葡萄;抗寒特性;实验研究
中图分类号:S663.1 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2017.06.066
新疆地区的鲜食葡萄栽培在我国占据重要地位,探究葡萄的抗寒特性有助于调节其生长周期,确保葡萄及时上市,实现旺季、淡季的不间断供给,从而取得更高的生产效益。本文主要以吐鲁番地区主栽的各种鲜食葡萄为研究对象,通过人工低温胁迫的方法,测定低温对不同葡萄品种根系的影响作用,以及各种抗寒指标的相对变化规律,希望通过各种抗寒生理指标初步筛选出抗寒的鲜食葡萄品种,从而为葡萄生产的防寒防冻措施提供一定的理论基础和现实指导。
1 不同鲜食葡萄抗寒特性
1.1 实验选材与处理方法
本次实验主要选取新疆地区著名的葡萄品种进行具体研究,主要选取火焰无核、夏黑、巨峰、新郁和SO4五个品种的根系,用五个葡萄皮重扦插苗根系为试验材料。2016年11月,葡萄苗落叶后挖取一年生扦插苗,去除残叶,修剪枝条留相同长度,避免物质由枝条回流到根系的差异影响测量值。将葡萄苗拿到实验室,自来水冲洗,去除根系上泥土,将每份试材分成3份,用洗干净的潮湿纱布分别包好待处理。试验处理温度为-2、-4、-6、-8、-10 ℃和-12 ℃,从0 ℃开始降温,以2 ℃/h降温速度,降温至不同处理温度后持续12 h,取出后放在4 ℃的冷藏冰箱中解冻,然后测定其相关生理生化指标。
1.2 实验方法及设计
本次实验共用6种主要的分析方法,主要包括葡萄根系组织含水量的测定、电解质渗出率测定、用蒽酮显色法对可溶性糖含量的测定、硫代巴比妥酸显色法对丙二醛含量的测定、茚三酮显色法对游离脯氨酸含量的测定,最后,通过隶属函数法对各个相关变量进行综合分析。
1.2.1 葡萄根系组织含水量的测定
(1)总含水量的测定。葡萄根系中水的总质量分数为:
水的總质量分数/%=(W2-W3)/(W2-W1)×100%其中,W1为所取称量瓶的质量,g;W2为称取葡萄枝条/根系1 g的质量,g;W3为将葡萄枝条放入105 ℃烘箱内10 杀死植物组织,再于90 ℃下烘干至恒重时的质量,g。
(2)自由水含量的测定。葡萄根系中自由水的质量分数为:
自由水的质量分数/%=(W3-W2)×(W1-W2)/[W2(W2-W1)]×100%
其中,W1为所取称量瓶的质量,g;W2为称取葡萄枝条/根系0.5g的质量,g;W3为称量瓶中加入65%的蔗糖溶液5 mL的质量,g。
束缚水的质量分数=总质量分数-自由水的质量分数。
1.2.2 电解质渗出率测定计算
电解质外渗率=(S1-LCK)/(S2-LCK)×100%
其中,S1、S2为电导率,LCK去离子水电导率。
1.2.3 用蒽酮显色法对可溶性糖含量的测定
可溶性糖含量(%)=[C×(V/a)×n]/(W×106)×100%
式中,C为标准方程求的糖含量,?g;a为吸取样品液的体积;V为提取液量,mL;n为稀释倍数;W为样品鲜重。
1.2.4 硫代巴比妥酸显色法对丙二醛含量的测定
丙二醛的含量(μmol/g FW)=6.452×(A532-A600)-0.559×A450×V1/(V2×FW)
式中,V1为提取液总体积,mL;FW为样品鲜重,g;V2为测定用提取液体积,mL。
1.2.5 茚三酮显色法对游离脯氨酸含量的测定
脯氨酸含量(μg/g)=(C×V1/V2)/FW
式中,C为由标准曲线上查得的游离脯氨酸的含量,μg;V1为提取液总体积,mL;V2为测定时加样量,mL;FW为样品重,g。
1.2.6 隶属函数法
对各生理指标进行抗寒性综合评价与抗寒性呈正相关的指标计算:
Tij=(Xij-Xjmin)/(Xjmax- Xj min);
与抗寒性呈负相关的指标隶属函数值计算:
Tij=1-(Xij-Xj min)/(Xj max-Xj min)。
其中,Tij表示i葡萄砧木品种j生理生化指标的隶属函数值;Xij表示i葡萄砧木品种j生理生化指标的测定值;
Xj max和Xj min分别为5种葡萄砧木品种在各处理温度梯度中j生理生化指标的最大值和最小值。对各项理化指标隶属函数值的算术平均值进行比较,综合评价排名次序即各葡萄砧木品种抗寒的强弱能力。
2 实验内容与结果分析
2.1 各葡萄品种根系的含水量
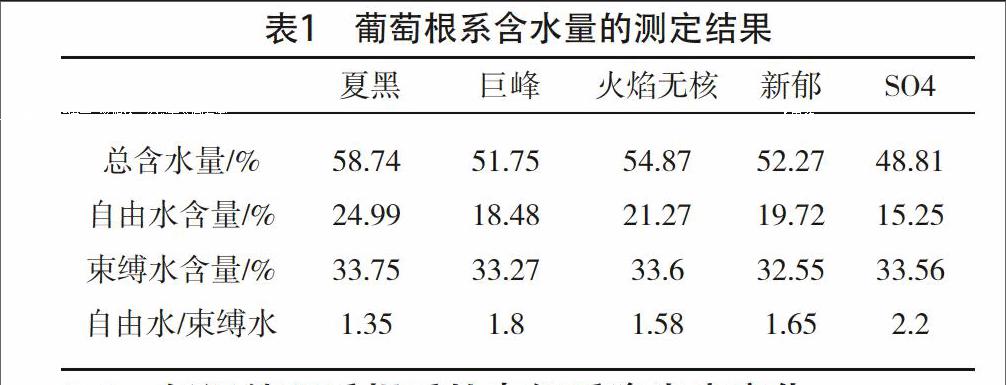
通过表1分析可知,供试葡萄扦插苗根系组织含水量均存在一定的差异。5份供试葡萄根系的总含水量由高到低的顺序均是夏黑>火焰无核>新郁>巨峰>SO4;自由水的含量差异较大,高低顺序与总含水量相同,自由水含水量最高品种夏黑比最低品种SO4高1.64倍。各葡萄品种根系中束缚水的含量差异不大,在30%~33.7%。5个葡萄品种根系束缚水/自由水比值品种间有明显差异,由高到低的顺序与总含水量相反,SO4>巨峰>新郁>火焰无核>夏黑。
2.2 低温处理后根系的电解质渗出率变化
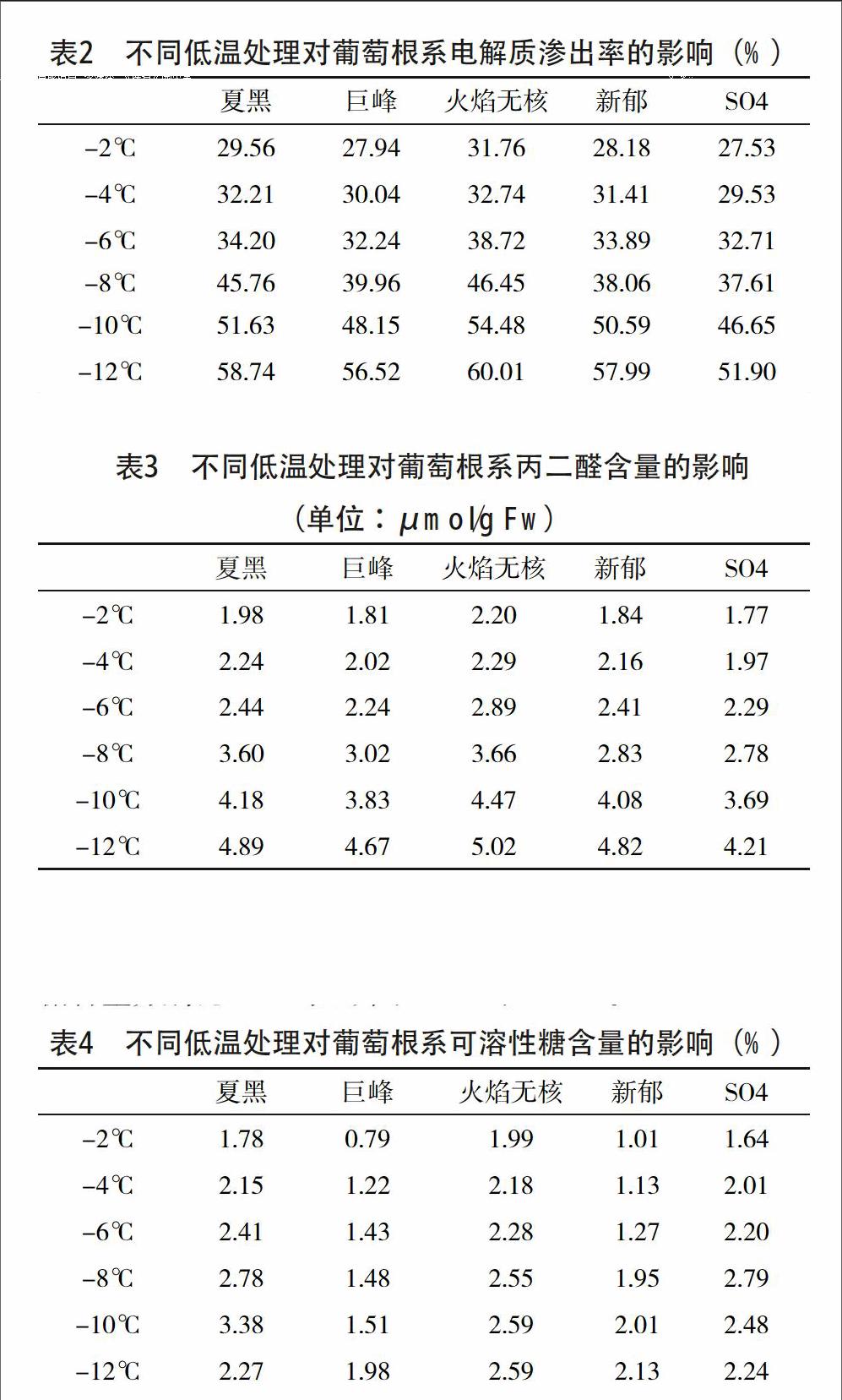
通过分析表2可知,地下部分根系的细胞电解质渗出率的变化同地上部分枝条相似,所有参试品种的电解质渗出率都随温度下降而上升,即处理温度开始下降时(在-2~-8 ℃低温处理后)渗出率开始缓慢上升,但处理之间的差异没有达到显著水平;随着温度继续下降(-10 ℃、-12 ℃),电解质渗出率迅速增加。在-10℃低温处理后,火焰无核和夏黑的电解质渗出率分别上升为54.48%、51.63%,幅度很大,而且超过50%。在处理温度降到-12 ℃时,各品种根系的电解质渗出率急剧增加均超过50%。
2.3 低温处理后各葡萄品种根系丙二醛含量的变化
由表3可以看出,各葡萄品种根系低温处理后,低温胁迫增强了所有参试品种根系的膜脂过氧化作用,使它们丙二醛含量增加,且各自上升过程中的增加幅度不同。
2.4 低温处理后根系的渗透调节物质含量变化
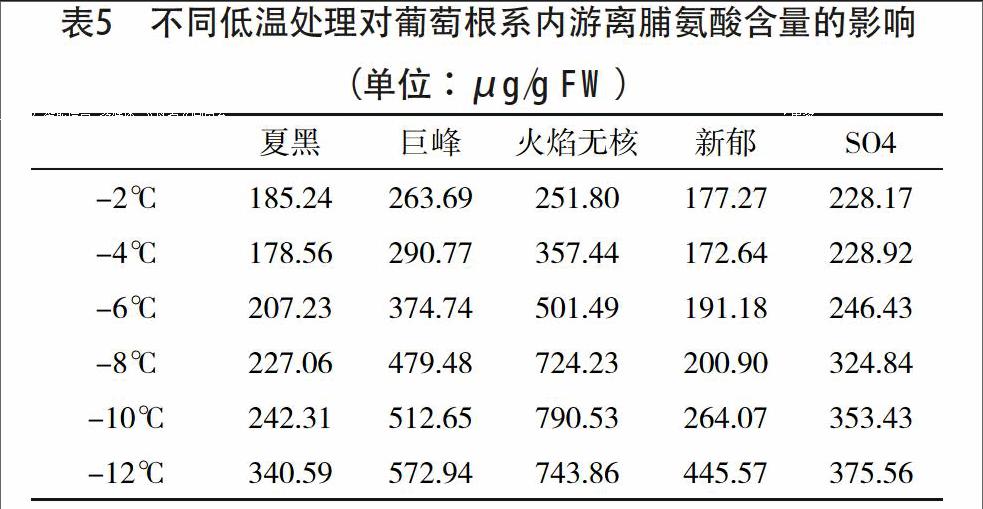
通过表4可以看出,各葡萄品种根系经低温处理后可溶性糖的含量有不同程度的增大,但它们在各自上升过程中的增加幅度和达到峰值的不同。随着处理温度的下降,SO4和夏黑根系中可溶性糖含量先上升后下降,分别在-6 ℃、-8 ℃和-10 ℃时,其根系的可溶性糖含量急剧升高达到峰值,分别比-2 ℃时上升了41.1%和47.2%,再后开始下降;巨峰和新郁的根系可溶性糖含量,随着处理温度的下降逐渐升高,在-12℃处理后其根系的可溶性糖含量分别比-2 ℃时上升了60.2%和52.4%。
2.5 低温处理后各葡萄品种根系内游离脯氨酸含量的变化
通过表5分析可知,参试5个葡萄品种根系内游离脯氨酸含量随处理温度的降低也呈上升趋势。各品种根系内脯氨酸含量增幅明显不同,其中夏黑和新郁的根系内游离脯氨酸含量,从-2~-10 ℃随处理温度降低缓慢升高,但处理之间差别没有达到显著水平;随处理温度降低火焰无核根系内脯氨酸含量增幅较明显,在-12 ℃处理后其根系内脯氨酸含量分别比-2 ℃时上升了66.2%。
3 抗寒性相关因素分析
3.1 葡萄各组织含水量与抗寒性的关系
植物组织中的水分主要以自由水和束缚水两种状态存在,自由水不与原生质体紧密结合,可以自由移动,束缚水则相反[1]。束缚水是细胞內亲水性大分子物质结合的水,对保证原生质体胶体稳定具重要作用。自由水和束缚水的相对含量可作为植物组织代谢活性和抗性强弱的重要指标。束缚水/自由水的值与抗寒性强弱有明显的相关性,比值越大的抗寒力越强。
3.2 葡萄质膜的膜透性与抗寒性的关系
实验研究显示,葡萄受低温胁迫后,细胞电解质的渗出率发生变化,细胞内相应的酶系统和代谢过程遭到破坏,引发和加剧了膜脂过氧化作用,膜脂过氧化产物丙二醛增多,并且扩散到其他部位,破坏体内多种反应的正常进行,膜脂过氧化的结果,使膜结构和功能受到损伤,使电解质渗出率增加和细胞代谢失调,严重时导致细胞死亡。将植物组织浸入无离子水中,水的电导值将因电解质的外渗而加大,伤害愈重,外渗愈多,电导值的增加也越大。在本次研究中,葡萄根系的电解质渗出率会随处理温度的变化而变化,不同葡萄品种经不同低温处理后,其电解质渗出率随处理温度的降低呈上升趋势。
本试验结果表明,抗寒性强的葡萄品种的电解质渗出率和丙二醛含量的值小,随处理温度的降低增加的幅度小;抗寒性弱的品种电解质渗出率和丙二醛含量的值大,随处理温度的降低增加的增加幅度大。通过电解质渗出率和丙二醛含量隶属度值得出葡萄根系抗寒性的强弱顺序依次为SO4>巨峰>新郁>夏黑>火焰无核(表6)。可溶性糖、可溶性蛋白、脯氨酸是植物体内的几种重要渗透调节物质,在植物抗寒生理中,它们可以提高细胞液浓度,降低冰点,可以缓和细胞质过度脱水,保持细胞不致遇冷凝固,从而提高植物抗寒性。
3.3 可溶性糖与抗寒性的关系
本试验对各种葡萄品种枝条中可溶性糖含量的变化研究结果表明,组织内的可溶性糖含量与其抗寒性密切相关,无论抗寒性强或弱的葡萄品种可溶性糖含量均随温度下降而增加,它们在各自上升过程中的增加幅度因品种抗寒性不同而有所差异。供试葡萄扦插苗根系的可溶性糖含量随着低温胁迫加剧自身的可溶性糖含量明显増高,而且增长量差异均显著。本研究表明,低温处理后,根系的可溶性糖含量与抗寒指标的隶属度相关性较小,因而供试葡萄根系抗寒性的强弱与可溶性糖含量并无显著相关关系。
通过对各项指标的测定结果分析,得出葡萄根系抗寒性的强弱顺序依次为SO4>夏黑>新郁>巨峰>火焰无核。
4 结语
葡萄抗寒性是一个非常复杂的生化过程,除受遗传因素决定外还受自身的生长趋势、枝条成熟度、冻害、病害等因素的影响,植物的抗寒性是由多种作用累加的结果[2]。因此,对各种鲜食葡萄进行抗寒性的鉴定,不能片面地根据单一指标进行判定,而需要对抗寒性相关的多项指标进行综合分析,本研究通过对多项指标的理化分析,科学地得到了供试葡萄抗寒性的综合影响因素。
参考文献
[1]王琴.不同栽培模式下的鲜食葡萄生物学特性研究[D].杨凌:西北农林科技大学,2013.
[2]阿力木·阿不力孜,再吐娜·买买提,沙吾提·阿布拉江,等.不同栽培模式下鲜食葡萄的生物学特性探析[J].中国林业产业,2017(1):284.
(责任编辑:赵中正)
