不同酶法辅助提取紫山药皮薯蓣皂苷及其抗氧化活性研究
2017-06-22王彦平杨庆莹孙瑞琳陈月英
王彦平,杨庆莹,孙瑞琳,古 洋,陈月英
(河南农业职业学院食品工程学院,河南郑州 451450)
不同酶法辅助提取紫山药皮薯蓣皂苷及其抗氧化活性研究
王彦平,杨庆莹,孙瑞琳,古 洋,陈月英*
(河南农业职业学院食品工程学院,河南郑州 451450)
以紫山药皮为实验材料,对比分析了纤维素酶和果胶酶对紫山药皮薯蓣皂苷的提取效果,并在单因素实验结果基础上采用正交实验对纤维素酶提取紫山药皮薯蓣皂苷的工艺进行优化。结果表明,最佳提取工艺为加酶量2.0%、料液比1∶10 g/mL、提取时间60 min、酶解温度40 ℃,此条件下紫山药皮薯蓣皂苷的平均得率为(8.77±0.89) mg/100 g。体外抗氧化实验中,紫山药皮薯蓣皂苷表现出明显的抗氧化能力,对DPPH自由基(DPPH·)和羟基自由基(·OH)的半数抑制率浓度IC50分别为0.276 mg/mL和0.430 mg/mL,清除能力略弱于维生素C。
紫山药皮,薯蓣皂苷,酶法辅提,抗氧化
紫山药(DioscoreaalataL.)是薯蓣科(Dioscoreae)山药属(DioscoreaL.)一年生或多年生蔓生植物,又名紫莳药、参薯等,可食用也可作为药材入药,产于广西、江西、云南、福建、河南等地[1]。紫山药味甜质脆,富含淀粉、膳食纤维、氨基酸、黏性多糖、花青素、薯蓣皂苷元和尿囊素等多种营养功能成分[2]。其中薯蓣皂苷元具有脱敏、抗炎、降脂、抗氧化、抗肿瘤、保肝、抗病毒等作用,具有很高的保健价值[3-6]。薯蓣皂苷元(diosgenin)作为一种重要的天然甾体皂苷元,来源广泛,是合成黄体酮、可的松、强的松、双烯醇酮醋酸酯、性激素、催产素等甾体激素的重要原料[7]。研究表明,紫山药中薯蓣皂苷元含量较高,且紫山药皮中的薯蓣皂苷元含量比肉中含量要高[8],可作为提取薯蓣皂苷元的优质原材料。
薯蓣皂苷(diosgen)由薯蓣皂苷元和糖基组成,与纤维素结合存在于细胞壁中,由于植物细胞壁较坚韧,因而传统的提取法仅能提取部分的皂苷。酶辅助提取方法是近年来用于植物功能性成分提取的一项生物工程技术,而国内外将酶工程技术用于紫山药皮薯蓣皂苷提取的研究未见报道。衰老是人体内自由基不断产生与积累的结果,自由基能使人体细胞中细胞膜氧化、蛋白质变性,导致体内抗氧化酶活性降低,抗氧化能力下降,从而诱发衰老、动脉硬化甚至肿瘤[9]。研究表明,山药薯蓣皂苷元具有良好的抗氧化性[10]。薯蓣皂苷元通过其抗氧化功能起到心肌保护、抗高血脂、治疗口腔癌的作用[11-14]。紫山药皮是紫山药开发利用的副产物,本研究比较研究纤维素酶和果胶酶对紫山药皮薯蓣皂苷的提取效果,并采用正交实验对复合酶法提取紫山药皮薯蓣皂苷的提取工艺进行优化,为紫山药的综合开发利用和提高附加值提供科学依据。
1 材料与方法
1.1 材料与仪器
紫山药 为河南温县产紫山药,将紫山药皮洗净后剪成约1 cm×1 cm的碎片,置于60 ℃恒温箱烘24 h,称恒重、粉碎,过50目筛后,在二氧化硅干燥器内常温保存备用;纤维素酶(10000 U/g)、果胶酶(10000 U/g) 索莱宝公司;薯蓣皂苷标准品 中国药品生物制品检定所;香草醛、冰醋酸、高氯酸、无水乙醇、醋酸钠等 均为分析纯,国药集团。
BS224S分析天平 德国赛多利斯公司;UV power紫外可见光分光光度计 北京莱伯泰科仪器股份有限公司;HH-2数显恒温水浴锅、202-3AB电热恒温鼓风干燥箱 上海乔跃电子科技有限公司;PHS-3C 精密pH计 上海雷磁仪器厂;RE2000旋转蒸发仪 上海亚荣生化仪器厂;D5-R2离心机 湖南湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 薯蓣皂苷标准曲线的绘制 准确称取干燥至恒重的薯蓣皂苷标准品5.0 mg,用无水甲醇溶解,定容至50 mL,摇匀得0.1 mg/mL的薯蓣皂苷标准溶液。分别移取0、0.5、1.0、1.5、2.0、2.5 mL的0.1 mg/mL薯蓣皂苷标准溶液置于具塞试管中,并置于70 ℃水浴使其溶剂挥干。再分别加入0.2 mL 5%香草醛冰醋酸溶液和0.8 mL高氯酸,混匀封塞,置于60 ℃水浴中显色15 min,取出后立即置冰水中冷却5 min,再各加5 mL冰醋酸,混匀,静置10 min。用紫外分光光度计在544 nm处测定其吸光度。以薯蓣皂苷质量浓度(mg/mL)为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.2 紫山药皮粉预处理 准确称取紫山药皮粉20 g置索氏抽提器中,用乙醚90 ℃回流脱脂,待紫山药粉中乙醚挥发完后,加入85%乙醇90 ℃回流提取,以去除可溶性糖;将挥发完乙醇后紫山药粉60 ℃恒温箱干燥、恒重,得紫山药皮预处理粉。
1.2.3 薯蓣皂苷的提取工艺流程 将紫山药预处理粉与水混合后加醋酸钠-醋酸缓冲液调节pH至一定值,然后加入一定量的酶在一定温度下酶解一定时间,90 ℃酶灭活10 min后4000 r/min离心15 min,弃上清液取滤渣,将滤渣用80%的乙醇回流提取6 h后4800 r/min离心15 min,取上清液,用旋转蒸发仪低温减压回收溶剂后得粗薯蓣皂苷粉末。对照组直接将紫山药预处理粉用80%的乙醇回流提取6 h后4800 r/min离心15 min,取上清液,用旋转蒸发仪低温减压回收溶剂后得粗薯蓣皂苷粉末。
1.2.4 薯蓣皂苷含量测定 将1.2.3步骤所得粗薯蓣皂苷粉末在60 ℃下干燥至恒重,精确称取粗薯蓣皂苷粉末50 mg,用无水甲醇定容至100 mL做薯蓣皂苷储备液。取储备液1 mL于具塞试管中,置70 ℃水浴使其溶剂挥干。然后按照1.2.1方法处理,测定其吸光度。
薯蓣皂苷得率(mg/100 g)=薯蓣皂苷质量(mg)/紫山药粉质量(g)×100
1.2.5 紫山药皮薯蓣皂苷提取的单因素实验
1.2.5.1 不同酶及加酶量对薯蓣皂苷得率的影响 纤维素酶和果胶酶两种酶的加酶量(以紫山药皮粉干重计酶量)分别为0.5%、1%、1.5%、2.0%、2.5%、3.0%,在料液比1∶20、pH5.0、温度40 ℃条件下酶解40 min,按1.2.4的方法处理并测定544 nm处吸光度,并计算薯蓣皂苷得率,选择其最佳酶及加酶量。
1.2.5.2 酶解时间对薯蓣皂苷得率的影响 酶解时间分别为15、30、45、60、75、90 min,在纤维素酶的加酶量均为1.5%、料液比1∶20、pH5.0、温度40 ℃的条件下酶解,按1.2.4的方法处理并测定544 nm处吸光度,并计算薯蓣皂苷得率,选择其最佳酶解时间。
1.2.5.3 酶解温度对薯蓣皂苷得率的影响 酶解温度分别为25、30、35、40、45、50、55 ℃,在纤维素酶的加酶量均为1.5%、料液比1∶20、pH5.0的条件下酶解40 min,按1.2.4的方法处理并测定544 nm处吸光度,并计算薯蓣皂苷得率,选择其最佳酶解温度。
1.2.5.4 料液比对薯蓣皂苷得率的影响 料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25,在pH5.0、纤维素酶的加酶量1.5%、温度40 ℃条件下酶解40 min,按1.2.4的方法处理并测定544 nm处吸光度,并计算薯蓣皂苷得率,选择其最佳料液比。
1.2.5.5 pH对薯蓣皂苷得率的影响 pH分别为3.5、4.0、4.5、5.0、5.5、6.0,在纤维素酶的加酶量1.5%、料液比1∶20、温度40 ℃条件下提取40 min,按1.2.4的方法处理并测定544 nm处吸光度,并计算薯蓣皂苷得率,选择其最佳pH。
1.2.6 纤维素酶对紫山药皮薯蓣皂苷提取的正交实验 在单因素实验基础上,设计出4因素3水平L9(34)的正交实验,见表1。按照1.2.3的方法提取紫山药皮薯蓣皂苷,并计算薯蓣皂苷得率,以确定纤维素酶法提取紫山药皮薯蓣皂苷的最佳工艺条件。
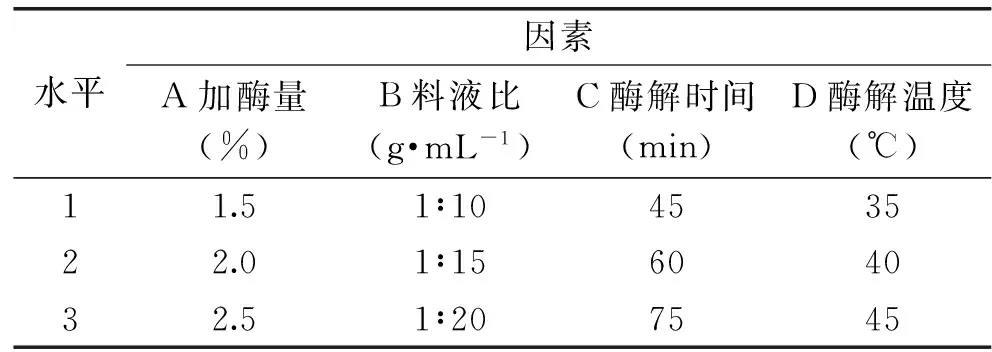
表1 正交实验因素水平表Table 1 Factors and levels table of orthogonal experiment
1.2.7 紫山药皮薯蓣皂苷体外抗氧化活性的测定 按照正交实验获得的最佳工艺条件得紫山药皮薯蓣皂苷提取液后,按照1.2.3的方法制备粗薯蓣皂苷粉末,按照1.2.4的方法测定洗脱液吸光度,并计算紫山药皮薯蓣皂苷质量浓度,按照不同要求,配制不同浓度的薯蓣皂苷甲醇溶液,分别进行DPPH·清除率的测定、·OH清除率的测定,体外抗氧化实验参照文献[15]的方法。
1.3 数据处理
采用Excel 2007软件对数据进行处理,所有实验数据均为3次重复实验的平均值。
2 结果与分析
2.1 薯蓣皂苷标准曲线
如图1所示,其线性回归方程为:y=2.236x+0.0063,R2=0.9991。
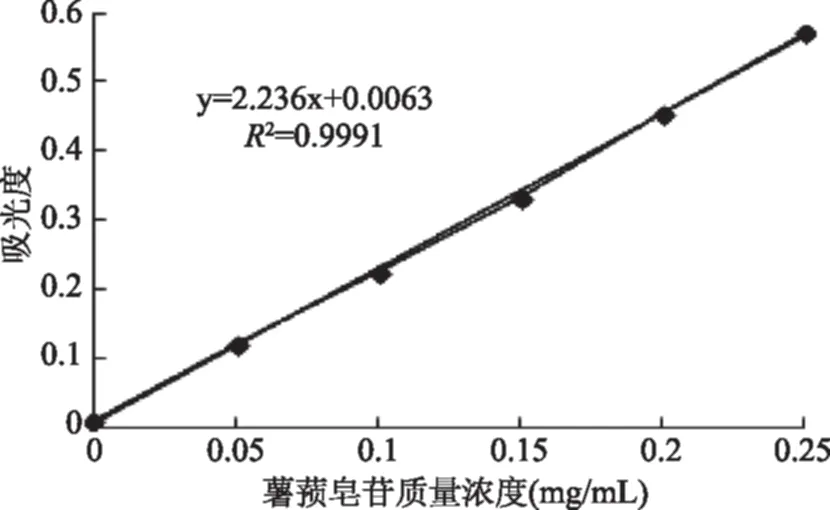
图1 薯蓣皂苷标准曲线Fig.1 The standard curve of dioscin
2.2 紫山药皮薯蓣皂苷提取单因素实验
2.2.1 酶及加酶量的选择 由图2可知,在一定的加酶量范围内,紫山药皮薯蓣皂苷得率随着加酶量的增加而升高,这主要是由于加酶量较少时,酶解进行不完全,随着加酶量的增加,酶解程度逐渐增高,薯蓣皂苷得率随之增高。当加酶量到一定量后,薯蓣皂苷得率趋于稳定,表明紫山药细胞壁酶解完全。得率最高时纤维素酶加酶量比果胶酶少,且纤维素酶的得率比果胶酶高。故选择纤维素酶辅助提取紫山药皮薯蓣皂苷,并选择纤维素酶添加量为1.5%~2.5%进行优化实验。
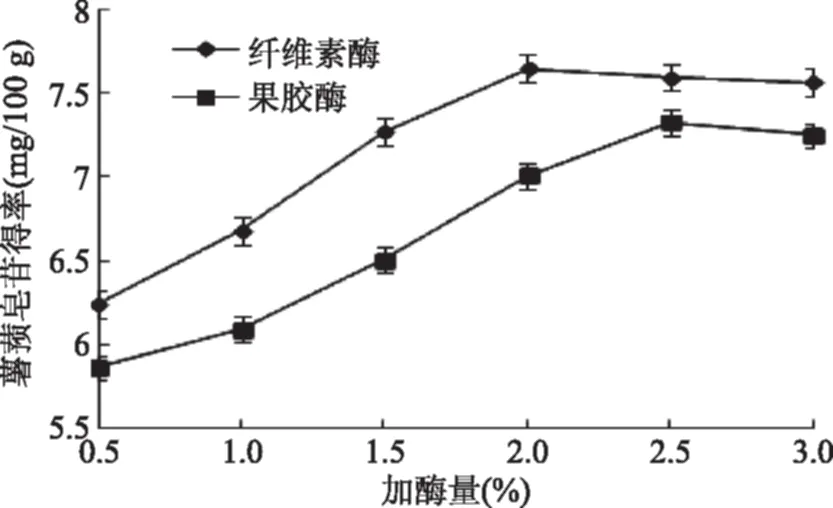
图2 不同酶和加酶量对薯蓣皂苷得率的影响Fig.2 Effect of different enzyme and enzyme amount on dioscin yield
2.2.2 酶解时间对薯蓣皂苷得率的影响 由图3可知,酶解时间低于60 min时,紫山药皮薯蓣皂苷得率随着时间延长呈现升高趋势,60~90 min范围时趋向平稳,说明酶解60 min时紫山药细胞壁基本酶解完全。故选择纤维素酶酶解时间为45~75 min进行优化实验。
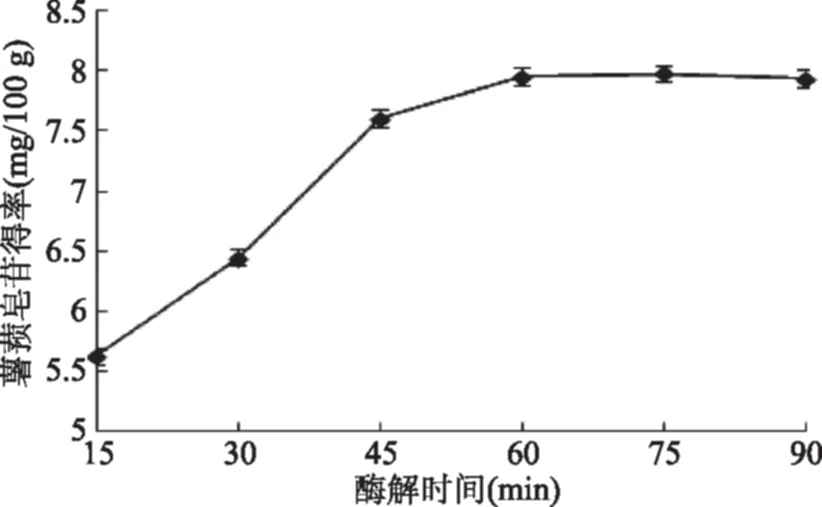
图3 酶解时间对薯蓣皂苷得率的影响Fig.3 Effect of enzymolysis time on dioscin yield
2.2.3 酶解温度对紫山药皮薯蓣皂苷得率的影响 由图4可知,在一定的酶解温度范围内,薯蓣皂苷得率随着温度的升高而增大,这主要是因为酶的活性受到温度的影响,纤维素酶的活性分别在40 ℃达到最高值,温度继续升高,酶的活性降低,薯蓣皂苷得率也随之降低。故选择酶解温度为35~45 ℃进行优化实验。
图4 酶解温度对薯蓣皂苷得率的影响Fig.4 Effect of enzymolysis temperature on dioscin yield
2.2.4 料液比对薯蓣皂苷元得率的影响 由图5可知,相同条件下,紫山药皮薯蓣皂苷得率随着料液比的减小而升高。当料液比由1∶5 g/mL增加到1∶15 g/mL时,薯蓣皂苷得率不断升高,当料液比大于1∶15 g/mL时,薯蓣皂苷得率呈下降趋势。一定范围内,提取剂剂量越大,薯蓣皂苷浸出率越高;但当提取剂过多时可能由于酶浓度下降,薯蓣皂苷得率反而下降[16]。故选择料液比为(1∶10~1∶20) g/mL进行优化实验。
图5 料液比对薯蓣皂苷得率的影响Fig.5 Effect of water-material ratio on dioscin yield
2.2.5 pH对薯蓣皂苷得率的影响 由图6可知,纤维素酶对紫山药皮薯蓣皂苷得率在pH为4.5时达到最大值,因此纤维素酶最适宜pH确定为4.5。
图6 pH对薯蓣皂苷得率的影响Fig.6 Effect of pH on dioscin yield
2.2 紫山药皮薯蓣皂苷提取的正交实验
紫山药皮薯蓣皂苷提取的正交实验结果(表2)分析表明,根据极差结果得出各因素对紫山药皮薯蓣皂苷提取效果重要性的顺序为RD>RA>RC>RB,即酶解温度>加酶量>酶解时间>料液比。最佳提取工艺为A2B1C2D2,即加酶量2.0%、料液比1∶10 g/mL、提取时间60 min、酶解温度40 ℃。对最佳提取工艺条件做验证实验,重复3次,此条件下紫山药皮薯蓣皂苷平均得率为(8.77±0.89) mg/100 g,高于正交实验中所有实验结果。
表2 紫山药皮薯蓣皂苷提取的正交实验结果Table 2 The results of orthogonal test of extraction of purple yam skin dioscin
2.3 紫山药皮薯蓣皂苷体外抗氧化活性
2.3.1 紫山药皮薯蓣皂苷对DPPH·的清除作用 由图7可知,在0.1~0.5 mg/mL浓度范围内,对DPPH·的清除能力随着紫山药皮薯蓣皂苷质量浓度的提高而增强,通过线性回归方程计算得到紫山药皮薯蓣皂苷的IC50=0.276 mg/mL,而维生素C的IC50=0.227 mg/mL,差异有统计学意义(p<0.05),这说明在相同浓度下,紫山药皮薯蓣皂苷对DPPH·的清除能力略弱于维生素C。

图7 紫山药皮薯蓣皂苷对DPPH·的清除作用Fig.7 The DPPH· removal effect of purple yam dioscin注:*与同浓度下维生素C比,差异显著(p<0.05);图8同。
2.3.2 紫山药皮薯蓣皂苷对·OH的清除作用 由图8可知,在·OH清除实验中,在0.1~0.5 mg/mL浓度范围内,薯蓣皂苷浓度与·OH清除率之间存在良好的量效关系,通过线性回归方程计算得到紫山药皮薯蓣皂苷的IC50=0.430 mg/mL,而维生素C的IC50=0.364 mg/mL,差异有统计学意义(p<0.05),这说明在相同浓度下,紫山药皮薯蓣皂苷对·OH的清除能力略弱于维生素C。

图8 紫山药皮薯蓣皂苷对·OH的清除作用Fig.8 The ·OH removal effect of purple yam dioscin
3 结论与讨论
徐皓等[17]、史会齐等[18]和周新勇等[19]均采用甲醇回流浸提工艺对紫山药薯蓣皂苷的提取,提取时间长且不具备绿色环保的特点。本研究采用酶法辅助提取薯蓣皂苷,主要包括酶促反应和溶剂回流两个过程。酶促反应阶段利用酶对紫山药皮细胞壁的分解和破坏,极大提高细胞壁的通透性,有利于细胞内薯蓣皂苷成分溶出;第二阶段通过溶剂回流,将紫山药皮细胞中薯蓣皂苷成分充分溶于溶剂中[20]。本实验对比分析了纤维素酶和果胶酶对紫山药皮薯蓣皂苷得率的影响,单因素实验结果显示,纤维素酶的提取效果明显优于果胶酶。因此纤维素酶对紫山药皮薯蓣皂苷的提取工艺进行优化,正交实验根据极差结果得出各因素对紫山药粗薯蓣皂苷提取效果重要性的顺序为酶解温度、加酶量、酶解时间、料液比。最佳提取工艺为加酶量2.0%、料液比1∶10 g/mL、提取时间60 min、酶解温度40 ℃。对最佳提取工艺条件做验证实验,重复3次,此条件下紫山药皮薯蓣皂苷的平均得率为(8.77±0.89) mg/100 g,高于正交实验中所有实验结果也高于对照组紫山药皮薯蓣皂苷平均得率为(6.92±0.16) mg/100 g,差异均有统计学意义(p<0.05)。说明此优化工艺参数可靠,能为紫山药的综合利用提供参考。
该研究分别对DPPH·和·OH清除率2个方面对紫山药皮薯蓣皂苷进行了体外抗氧化能力测定。通过体外抗氧化性实验,发现紫山药皮薯蓣皂苷对DPPH·和·OH的清除能力略弱于维生素C。紫山药皮薯蓣皂苷在实验浓度下,浓度对DPPH·和·OH的清除能力呈现良好的量效关系,即浓度越高抗氧化能力越强。综上所述,紫山药皮薯蓣皂苷具有较好的抗氧化活性,说明紫山药薯蓣皂苷具有良好的应用前景,为其在功能性食品和药品方面的开发利用提供一定的科学依据。
[1]阮思莲,贺永朝,叶翌东,等. 超声波辅助提取紫山药花青素的工艺优化[J]. 莆田学院学报,2015,22(2):48-52.
[2]王彦平,汤高奇,谢克英,等. 紫山药主要活性成分提取纯化技术研究进展[J]. 食品工业科技,2016,37(17):356-359.
[3]何焱,王继双,张鹏,等. 薯蓣皂苷元药理作用及其机制研究进展[J]. 中草药,2013,44(19):2759-2765.
[4]Miyoshi N,Nagasawa T,Mabuchi R,et al. Chemoprevention of azoxymethane/dextran sodium sulfate-induced mouse colon carcinogenesis by freezedried yam Sanyaku and its constituent diosgenin[J]. Cancer Prevention Research,2011,4(6):924-934.
[5]Liu K,Zhao W,Gao X,et al. Diosgenin ameliorates palmitate-induced endothelial dysfunction and insulin resistance via blocking IKKβand IRS-1 pathways[J]. Atherosclerosis,2012,223(2):350-358.
[6]Rajalingam K,Sugunadevi G,Arokia Vijayaanand M,et al. Anti-tumour and anti-oxidative potential of diosgenin against 7,12-dimethylbenz(a)anthracene induced experimental oral carcinogenesis[J]. Pathology and Oncology Research,2012,18(2):405-412.
[7]徐丽娜,卫永丽,彭金咏,等. 天然产物薯蓣皂苷的研究进展[J]. 中国中药杂志,2015,40(1):36-41.
[8]周新勇,宋曙辉,罗晖,等. 反相高效液相色谱法测定紫山药中薯蓣皂苷的含量[J]. 食品工业科技,2011,32(7):420-422.
[9]Schriner SE,Linford NJ,Martin GM,et al. Extension of murine life span by overexpression of catalase targeted to mitochondria[J]. Science,2005,308(5730):1909-1911.
[10]周丽,史新敏,任香梅,等. 淮山药叶乙醇提取物黄酮和皂苷含量及抗氧化抗肿瘤活性研究[J]. 食品科技,2015,40(8):204-207.
[11]何焱,王继双,张鹏,等. 薯蓣皂苷元药理作用及其机制研究进展[J]. 中草药,2013,44(19):2759-2765.
[12]Pari L,Monisha P,Mohamed J A. Beneficial role of diosgenin on oxidative stress in aorta of streptozotocin induced diabetic rats[J]. Eur J Pharmacol,2012,691(1/3):143-150.
[13]Salimeh A,Mohammadi M,Rashidi B. Preconditioning with diosgenin and treadmill exercise preserves the cardiac toxicity of isoproterenol in rats[J]. Journal of Physiology and Biochemistry,2013,69(2):255-265.
[14]Rajalingam K,Sugunadevi G,Arokia Vijayaanand M,et al. Anti-tumour and anti-oxidative potential of diosgenin against 7,12-dimethylbenz(a)anthracene induced experimental oral carcinogenesis[J]. Pathol Oncol Res,2012,18(2):405-412.
[15]陈月英,王彦平,孙瑞琳,等. 葡萄皮渣原花青素微波辅助提取工艺的优化及其抗氧化活性研究[J]. 北方园艺,2016,(11):123-126.
[16]霍艳荣,高钱欣,王振宇. 紫山药花色苷生物酶法提取工艺优化研究[J]. 安徽农业科学,2015,43(8):253-254,261.
[17]徐皓. HPLC法测定紫参薯中薯蓣皂苷元的含量[J]. 食品科技,2013,38(6):307-309.
[18]史会齐,李明静,宋爱新,等. 反相高效液相色谱法测定山药及其同属植物参薯中薯蓣皂苷元的含量[J]. 药物分析杂志,2004,24(5):465-467.
[19]周新勇,宋曙辉,罗晖,等. 反相高效液相色谱法测定紫山药中薯蓣皂苷的含量[J]. 食品工业科技,2011,32(7):420-422.
[20]张黎明,张露亿,杜连祥. 酶解法提取葫芦巴种子中薯蓣皂苷元的工艺研究[J]. 农业工程学报,2005,21(2):161-164.
Study on optimization of enzymatic extraction of dioscin from purple yam skin and its antioxidant activity
WANG Yan-ping,YANG Qing-ying,SUN Rui-lin,GU Yang,CHEN Yue-ying*
(Department of Food Engineering,Henan Vocational College of Agriculture,Zhengzhou 451450,China)
Taking purple yam skin as the experimental material,cellulase and pectinase were selected to comparatively analyze extraction effect of purple yam skin,and the optmium technology conditions of the cellulase extraction of purple yam skin dioscin were optimized by using the orthogonal experiment based on the results of single factor test. Results showed the optimum condition were as follows:cellulose amount 2.0%,material-solvent ratio 1∶10(g/mL),enzymolysis time 60 min,enzymolysis temperature 40 ℃. Under such conditions,the yield of dioscin was(8.77±0.89) mg/100 g. Dioscin from purple yam skin showed significant antioxidant capacity,and half inhibition concentrations(IC50)of DPPH· and that of ·OH were 0.276 mg/mL and 0.430 mg/mL respectively,the scavenging abilities were slightly weaker than vitamin C.
purple yam skin;dioscin;enzymatic extraction;antioxidant
2016-11-08
王彦平(1983-),女,硕士,讲师,研究方向:食品功能与营养因子,E-mail:14389487@qq.com。
*通讯作者:陈月英(1964-),女,硕士,教授,研究方向:功能性食品,E-mail:cyy932@qq.com。
郑州市普通科技攻关项目(153PKJGG424);2015年度河南省高等学校优秀教学团队建设;2014年度河南省高等学校“专业综合改革试点”项目。
TS209
A
1002-0306(2017)10-0200-05
10.13386/j.issn1002-0306.2017.10.030
