高考化学测试题
2017-06-22河北师范大学附属中学刘勤暖
■河北师范大学附属中学 刘勤暖
高考化学测试题
■河北师范大学附属中学 刘勤暖
相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Fe:56 Cu:64
一、选择题(每小题6分,共42分)
1.下列关于化学与生产、生活的认识不正确的是( )。
A.CO2、CH4、N2等均是造成温室效应的气体
B.使用清洁能源是防止酸雨发生的重要措施之一
C.节能减排符合低碳经济的要求
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
2.下列离子方程式书写正确的是( )。
A.少量NaHCO3溶液与过量Ba(OH)2溶液反应:BaCO3↓+H2O
B.碳酸钙溶于醋酸溶液:CaCO3+ 2H+આઆCa2++CO2↑+H2O
C.Fe3O4溶于过量的稀硝酸中:Fe3O4+ 8H+આઆ2Fe3++Fe2++4H2O
D.实验室用浓盐酸与MnO2制Cl2: MnO2+2H++2Cl-△આઆCl2↑+Mn2++H2O
3.NA代表阿伏加德罗常数,下列有关叙述正确的是( )。
A.常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA
B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.78gNa2O2中所含阴离子的数目是2NA
D.3.2gS在足量O2中燃烧,转移的电子数为0.6NA
4.下列叙述错误的是( )。
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合液中:
2c(H+)+c(CH3COOH)= c(CH3COO-)+2c(OH-)
B.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-ܪܩܒAgI(s)+Cl-能够发生
C.氯水中:c(Cl-)>c(H+)> c(OH-)>c(ClO-)
D.常温下NH4Cl和NH3·H2O的混合溶液中,若pH<7,则
5.E、F、G、M是原子序数依次增大的短周期主族元素,E、G在周期表中的相对位置如下。已知E元素最低负化合价的绝对值与其原子最外层电子数相等,F是地壳中含量最多的金属元素。下列说法错误的是( )。
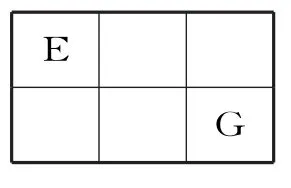
A.离子半径:G>M>F
B.G、M两元素的气态氢化物中,M的气态氢化物更稳定
C.E与G形成的二元化合物空间结构呈直线形D.E与氢组成的分子中只含有极性共价键
6.在下列各溶液中,一定能大量共存的离子组是( )。
B.水电离出来的c(H+)=10-13mol·L-1的溶液中:
C.所含溶质为Na2SO4的溶液中:K+、
D.室温下,pH=1的溶液中:Na+、Fe3+、
7.用下列有关实验装置进行的相应实验,能达到实验目的是( )。
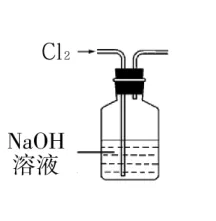
图1

图2

图3

图4
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干FeCl3饱和溶液制备FeCl3晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
二、非选择题
8.(16分)中学化学中常见的物质有如下所示的转化关系(反应条件略去)。X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸。

(1)写出下列物质的化学式:Y为____, A为____,C为____。
(2)D的电子式为____。
(3)我国生产B的工业中,常采用以下方式处理尾气A:
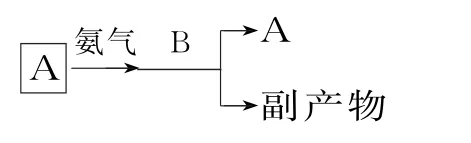
试从综合经济效益的角度分析,这样处理的目的是(答出其中两点即可):
a.__;
b.___。
(4)反应①的化学方程式:____。
反应②的化学方程式:____。
反应④的离子方程式:____。
9.(6分)在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应:Cu2O-2e-+2H+આઆ2Cu2++H2O是一个半反应式,下列五种物质FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI中的一种物质A能使上述半反应顺利发生。
(1)写出并配平该反应的离子方程式: ____。
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,还原产物为Mn2+(无色),反应的离子方程式为____;判断Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序是(用离子符号表示)____。
10.(16分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O的装置(如图5)和部分操作步骤如下。

图5
Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①Ⅰ中,圆底烧瓶中发生反应的化学方程式是____。
②Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是____。
“停止C中的反应”的操作是____。
③Ⅲ中,“过滤”用到的玻璃仪器是(填仪器名称)____。
④装置B中盛放的试剂是(填化学式)____溶液,其作用是____。
(2)依据反应2S2O2-3+I2આઆS4O2-6+ 2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1I2的标准溶液进行滴定,相关数据记录如表1所示。
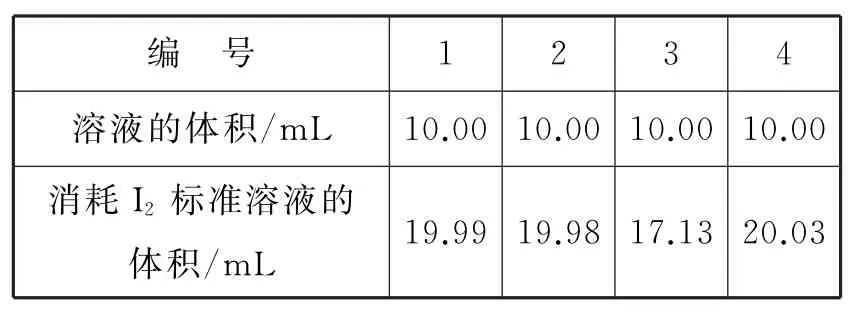
表1
① 判断达到滴定终点的现象是____。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数)____。
(Na2S2O3·5H2O的式量为248)
11.(20分)汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2CO2(g)+N2(g) ΔH=akJ·mol-1。
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如表2(CO2和N2的起始浓度均为0)。

表2
回答下列问题:
(1)上述条件下该反应能自发进行,则正反应是____反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率v(N2)= ____(保留三位有效数字),t1℃时该反应的平衡常数K=____。
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是____。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据表3设计的实验测得混合气体中NO的浓度随时间(t)变化的趋势如图6所示。

表3

图6
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为____。
(5)已知: N2(g)+O2(g)આઆ2NO(g) ΔH1= +180.5kJ·mol-1
2C(s)+O2(g)આઆ2CO(g) ΔH2= -221.0kJ·mol-1
C(s)+O2(g)આઆCO2(g) ΔH3= -393.5kJ·mol-1
则处理汽车尾气反应中的a=____。
(6)用活性炭还原法也可以处理氮氧化物,有关反应为C(s)+2NO(g)ܪܩܒCO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如表4。

表4
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5∶3∶3,则ΔH40(填“>”“=”或“<”)。
(参考答案在本期内找)
(责任编辑 谢启刚)
