标准溶液配制用碳酸锂纯物质中杂质含量的测定
2017-06-22李海平范晓芸
李海平 范晓芸
(钢研纳克检测技术有限公司,北京100081)
标准溶液配制用碳酸锂纯物质中杂质含量的测定
李海平 范晓芸
(钢研纳克检测技术有限公司,北京100081)
从高纯碳酸锂中杂质含量测定出发,研讨了标准溶液配制用原料的杂质测定方法,首先利用电感耦合等离子体质谱(ICP-MS)法对高纯碳酸锂进行半定量分析,再依据半定量分析结果选择ICP-MS、电感耦合等离子体原子发射光谱(ICP-AES)法、原子吸收光谱(AAS)法等方法对相应元素(杂质含量>0.001%)进行定量分析,通过扣除杂质含量得出高纯碳酸锂纯度大于99.991%。从而建立了一个准确、高效,覆盖元素种类多的高纯物质中杂质含量的分析方法
高纯碳酸锂;标准溶液;半定量分析;ICP-MS;ICP-AES;AAS
前言
标准溶液是具有特定量值,已知准确浓度的溶液,在分析化学中常被作为工作标准使用,随着仪器科学的迅猛发展,标准溶液越来越多地用于绘制仪器分析时的工作曲线。在分析化学工作者的日常工作中扮演着愈来愈重要的角色,而随着分析科学的不断进步,我们对标准溶液量值的准确性要求也越来越高,而标准溶液量值的准确性取决于高纯物质的纯度,高纯物质的纯度往往由测定其杂质来确定,所以标准溶液配制用高纯物质的杂质含量的测定显得尤为重要。锂标准溶液的配制用原料常采用高纯碳酸锂,其杂质的测定也有大量文献[1-6]报道,其作为高纯物质配制标准溶液比较典型。本文以其为例,先期采用ICP-MS法对其进行半定量分析大部分杂质元素,继而选择ICP-AES法、AAS法等方法对相应元素(杂质含量>0.001%)进行定量分析补充确认,从而建立了一个准确高效,覆盖了元素周期表中大多数元素的高纯物质中杂质分析方法。
1 实验部分
1.1 仪器及工作参数
XSERIRII1047c电感耦合等离子体质谱仪(美国赛默飞世尔科技有限公司)。仪器参数设置:入射功率1 300 W;等离子体流速15.0 L/min;载气流速0.80 L/min;辅助气流速0.90 L/min;采样深度155 mm;氧化物CeO+/Ce+<0.5%。
ICP-725ES电感耦合等离子体原子发射光谱仪(美国安捷伦科技有限公司)。仪器参数:功率1 300 W;等离子体流速19.5 L/min;辅助气流速2.25 L/min;雾化器流速0.85 L/min;观察高度8 mm。
S2AAsystem原子吸收光谱仪(美国赛默飞世尔科技有限公司):通带宽度0.5 nm、燃烧器高度9 mm、乙炔流量1.5 L/min。
1.2 试剂
Be、In、Bi、Rh、Se、Ca、Mg、Fe、Ti、V、K、Na标准储备溶液(1 000 μg/mL,钢铁研究总院);碳酸锂(99.99%,国药集团化学试剂有限公司);盐酸(优级纯,国药集团化学试剂公司)。
实验用水均为超纯水(电阻率为18.25 MΩ·cm)。
1.3 样品处理与测定
1.3.1 ICP-MS法半定量分析
逐级稀释Rh(1 000 μg/mL)标准储备溶液,配制成Rh(1.0 μg/mL)标准溶液,留作内标使用。
逐级稀释Be(1 000 μg/mL)、In(1 000 μg/mL)、Bi(1 000 μg/mL),配制成Be、In、Bi浓度为1.0 μg/mL的混合标准溶液。分别移取上述混合标准溶液0.25、0.50、2.50 mL于50 mL容量瓶中,分别加入1.0 mL Rh标准溶液(1.0 μg/mL) 作为内标,绘制浓度为0.0005%、0.001%、0.005%的工作曲线。
称取0.050 0 g碳酸锂三份,于100 mL烧杯中,加入2.5 mL HCl溶解,加入1.0 mL Rh标准溶液(1.0 μg/mL)作为内标,定容于50 mL容量瓶中。
随同试样做空白实验两份。
在ICP-MS仪上,选用半定量分析程序,采用标准加入法,依次进行测定。
1.3.2 ICP-MS法定量分析
逐级稀释Se(1 000 μg/mL)标准储备溶液,配制成Se(1.0 μg/mL)标准溶液,分别移取0.25、0.50、2.50、5.00 mL于50 mL容量瓶中,分别加入1.0 mL Rh标准溶液(1.0 μg/mL)作为内标,绘制浓度为0.0005%、0.001%、0.005%、0.01%的工作曲线。
其余同1.3.1。
在ICP-MS仪上,选用定量分析程序,采用全定量分析法,对碳酸锂中的Se进行定量分析。
1.3.3 ICP-AES法定量分析
逐级稀释Ca(1 000 μg/mL)、Mg(1 000 μg/mL)、Fe(1 000 μg/mL)标准储备溶液,配制成浓度分别为5.0 μg/mL的 Ca、Mg和Fe混合标准溶液,分别移取0.5、1.0、5.0、10.0 mL于50 mL容量瓶中,绘制浓度为0.0005%、0.0010%、0.0050%、0.010%的工作曲线。
逐级稀释Ti(1 000 μg/mL)、V(1 000 μg/mL) 标准储备溶液,配制成浓度分别为5.0 μg/mL的Ti和V混合标准溶液,分别移取0.5、1.0、5.0、10.0 mL于50mL容量瓶中,绘制浓度为0.0005%、0.001%、0.005%、0.01%的工作曲线。
称取0.500 0 g碳酸锂三份,于100 mL烧杯中,加入5.0 mL HCl溶解,定容于50 mL容量瓶中。
随同试样做空白实验两份。
在ICP-AES仪上,对碳酸锂中的Ca、Mg、Fe、Ti和V进行定量分析。
1.3.4 AAS法定量分析
逐级稀释K(1 000 μg/mL)和Na(1 000 μg/mL)标准储备溶液,配制成浓度分别为为5.0 μg/mL的K和Na混合标准溶液,分别移取0.5、1.0、5.0、10.0、20.0、50.0 mL于50 mL容量瓶中,绘制浓度为0.0005%、0.0010%、0.0050%、0.010%、0.020%、0.050%的工作曲线。
其余同1.3.3。
在AAS仪上,对碳酸锂中的K和Na进行定量分析。
2 结果与讨论
2.1 ICP-MS法半定量分析结果
实验中,质谱干扰主要有等离子体中的Ar、O、N、H、C等元素和试样中存在的Li、Cl等元素干扰测定,通过考虑其干扰程度和仪器灵敏度,将选择的待测元素的同位素和测定结果,列于表1,数据均为三次测定的平均值,同时,选用高纯铁003-5(日本钢铁联盟出品的CRM),采用此方法对其杂质元素进行测定(其中元素Mn质量数55,无同位素,检测受1H+54Fe干扰,因此不适合用ICP-MS法测定铁基样品中的Mn,另用ICP-AES法测定,结果与标准值一致。),结果见表2。半定量分析所选用的Be、In、Bi等标准的曲线方程相关系数大于0.999。
ICP-MS法的半定量分析高纯碳酸锂共采用了48种元素的测定结果,其中Be、Sc等41种元素的测定结果均小于0.0001%,以小于0.0001%采用;B、Al等7种元素测定结果大于0.0001%,以实测结果采用。
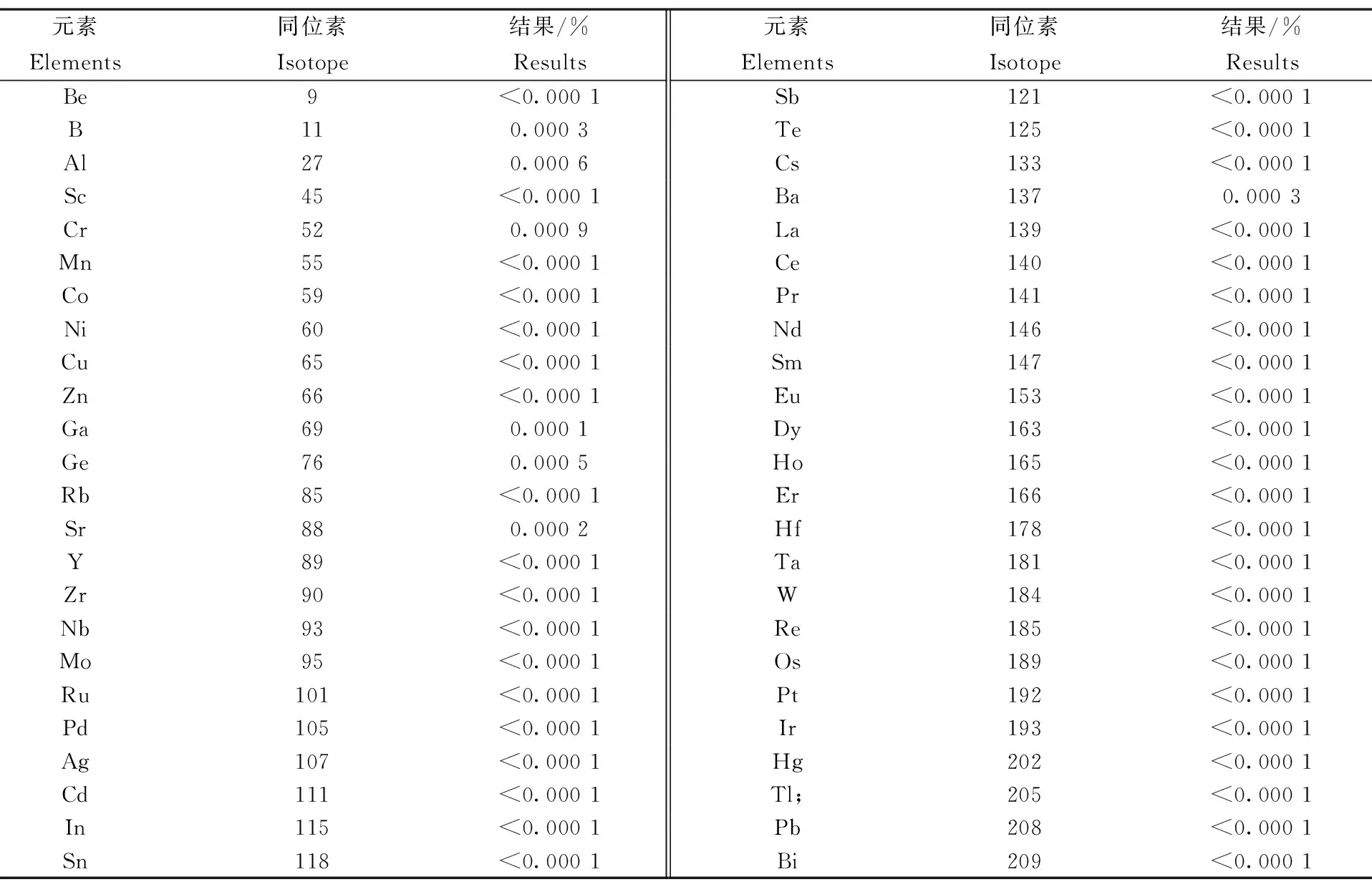
表1 ICP-MS法半定量分析结果
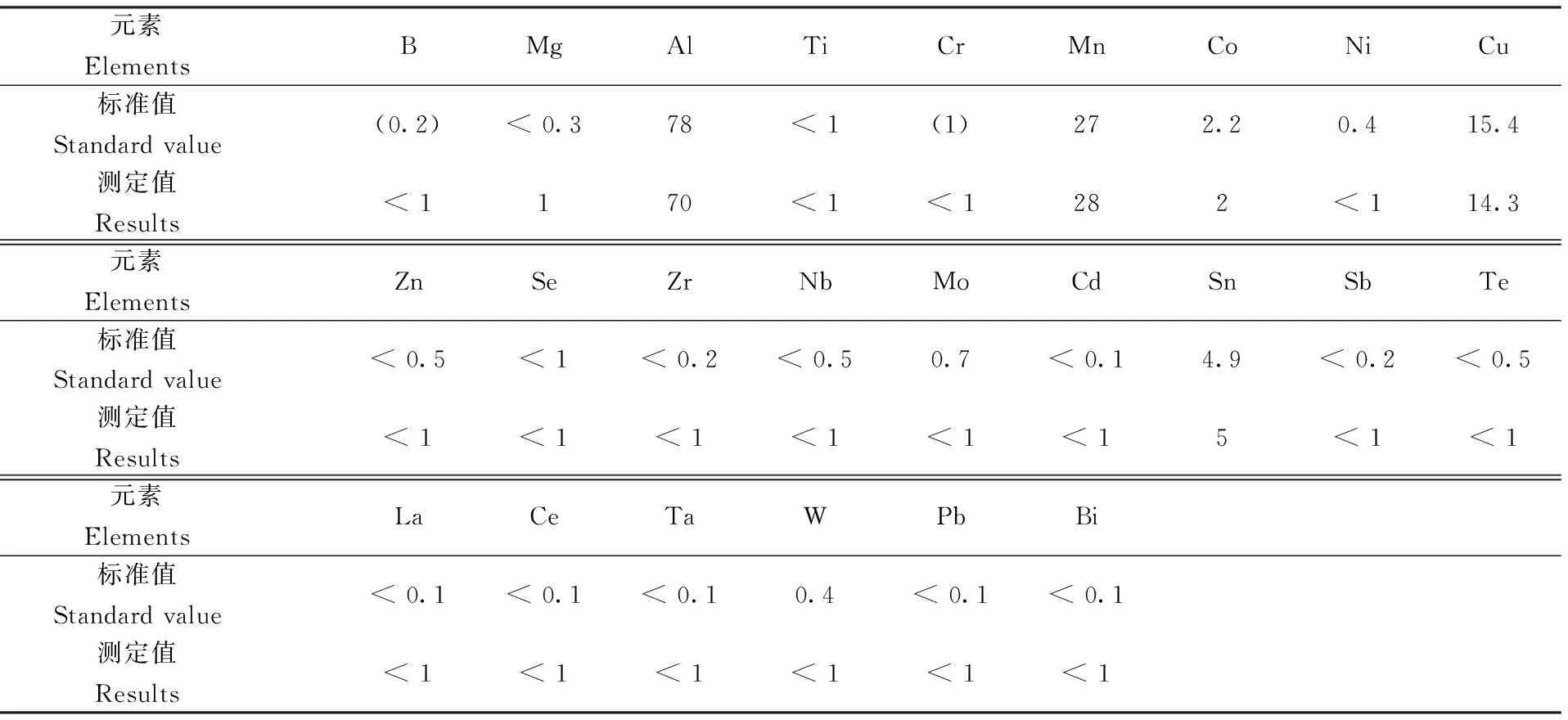
表2 日本高纯铁003-5测定结果汇总
从以上测定结果可以看出,采用此方法对原料中杂质元素进行测定结果准确可靠。
2.2 定量分析
ICP-MS法的半定量分析的准确度约为±30%。高纯碳酸锂经ICP-MS法的半定量分析后,对测试结果中大于0.001%的元素,分别采用ICP-MS、ICP-AES和AAS法等进行定量分析,并同时进行加标回收实验,以期得到准确的测定结果。
2.2.1 ICP-MS法定量分析结果
ICP-MS法的半定量分析高纯碳酸锂结果中Se各同位素的测定结果畸高,为进一步得到其准确的含量,采用定量的方法以Se为外标,Rh为内标,选择合适的同位素,进行分析。分析结果列于表3。 Se的含量为:0.0007%,线性相关系数>0.999。
表3 ICP-MS法定量分析结果

Table 3 Result of quantitative analysis by ICP-MS /%
2.2.2 ICP-AES法定量分析结果
ICP-MS法的半定量分析中Ti和V由于质谱干扰严重,未能得到准确的结果,Ca、Mg和Fe受制于整个分析系统的影响,也未能得到较好的分析结果,上述5种元素选用ICP-AES法进行测试,由于试样中杂质含量低,谱线干扰少,各元素均有多条谱线有较好的分析结果,选择代表性的结果列于表4。Ti、V和Fe的含量小于0.0001%,Ca:0.0003%;Mg:0.0002%。线性相关系数>0.999。
表4 ICP-AES法定量分析结果
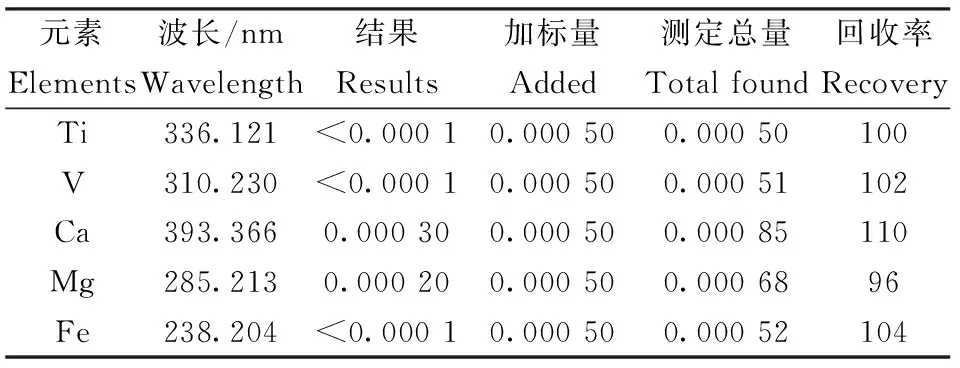
Table 4 Results of quantitative analysis by ICP-AES /%
2.2.3 AAS法定量分析结果
由于K、Na在高盐体系的基体中(Li2CO3),且受仪器背景和Ar气的影响,不适宜选用ICP-AES法测量,选用AAS法对其进行测试,结果列于表5。 K含量小于0.0001%,Na含量为0.0004%,线性相关系数>0.999。
表5 AAS法定量分析结果
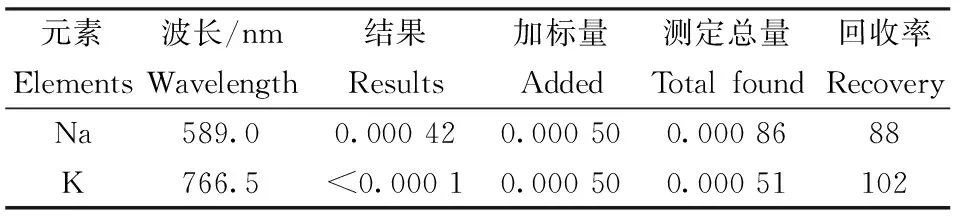
Table 5 Results of quantitative analysis by AAS /%
3 结论
经过ICP-MS法的半定量分析和定量分析(ICP-MS、ICP-AES和AAS法),完成对高纯碳酸锂中多达57种杂质元素的测试,杂质含量总和约为0.0090%(其中小于0.0001%的元素,以0.0001%计),碳酸锂含量大于99.991%,满足Li标准溶液的配制要求和广大分析工作者对Li标准溶液准确性的要求。
标准溶液配制用高纯物质的杂质含量往往较低,通过ICP-MS法的半定量分析确定大部分杂质元素含量,再选用合适的方法对特定杂质元素含量进行定量分析,从而快速高效地确定高纯物质的杂质含量,筛选出符合标准溶液配制用要求的高纯物质,保证标准溶液的特征值的准确度,可以满足分析工作者的需求。
[1] 赵青,王红,李晖,等.ICP-AES法同时测定高纯碳酸锂中11种杂质元素[J].西南民族大学学报自然科学版(JournalofSouthwestUniversityforNationalities:NatrualScienceEdition),2003,29(5):541-543.
[2] 靳芳,李吉生,杨宏生,等.ICP-MS测定碳酸锂中微量元素[J].光谱实验室(ChineseJournalofSpectroscopyLaboratory),2011,4(3):1710-1712.
[3] 陈先安.等离子体原子荧光光谱法测定碳酸锂中钠、钾、钙、镁、铜、铁、钻、镍、锰、锌、镉[J].分析化学(ChineseJournalofAnalyticalChemistry),1989,17(11):1011-1014.
[4] 陈黎明,丁飞.电感耦合等离子发射光谱法测定工业碳酸锂中杂质元素[J].分析实验室(ChineseJournalofAnalysisLaboratory),2008,27(增刊):71-72.
[5] 钟家跃,吴淑芳.电感耦合等离子体质谱(ICP-MS) 法测定高纯碳酸锂中杂质元素[J].江西化工(JiangxiChemicalIndustry),2004(3):154-155.
[6] 苏亚勤,章新泉,易永,等.电感耦合等离子体质谱法测定高纯碳酸锂中的杂质元素[J].江西化工(JiangxiChemicalIndustry),2004(12):145-147.
Determination of Impurity Elements in High Purity Li2CO3for Preparation of Li Standard Solution
LI Haiping, FAN Xiaoyun
(NCSTestingTechnologyCo.Ltd.,Beijing100081,China)
Based on the determination of impurity elements in high purity Li2CO3, a method for the determination of impurity elements in the raw materials for the preparation of standard solutions was studied. Firstly, the contents of most elements in high purity Li2CO3were measured by semi-quantitative analysis of ICP-MS. Then,according to these results, the corresponding elements(more than 0.001%) were quantitatively determined by ICP-MS、ICP-AES and AAS.The purity of high purity Li2CO3was determined above 99.991% by means of the deduction of the impurity element content.An accurate and efficient method, which covering multiple elements, for impurity content analysis of high pure substance has been established.
high purity Li2CO3;standard solution;semi-quantitative analysis;ICP-MS;ICP-AES;AAS
10.3969/j.issn.2095-1035.2017.02.010
2016-10-13
2016-12-25
李海平,男,高级工程师,主要从事标准物质的研究与应用。E-mail:lhp8609345@163.com
O657.31;TH744.11
A
2095-1035(2017)02-0038-04
本文引用格式:李海平,范晓芸. 标准溶液配制用碳酸锂纯物质中杂质含量的测定[J].中国无机分析化学,2017,7(2):38-41. LI Haiping, FAN Xiaoyun. Determination of Impurity Elements in High Purity Li2CO3for Preparation of Li Standard Solution [J].Chinese Journal of Inorganic Analytical Chemistry,2017,7(2):38-41.
