基于计时库仑技术的可再生型三磷酸腺苷适配体电化学传感器的研究
2017-06-21卢莹田燕王莉杨耀姚晓林
卢莹+田燕+王莉+杨耀+姚晓林


摘 要 构建了一种可再生型三磷酸腺苷(ATP)适配体计时库仑电化学传感器。将一条短链DNA通过AuS键自组装固定在电极表面, ATP的核酸适配体与该短链DNA杂交而结合在电极表面。带负电的DNA通过静电吸引结合电解液中的六氨合钌(RuHex)阳离子。当传感器和靶分子ATP孵育后,ATP与核酸适配体结合,使适配体链从电极表面解离,电极表面吸附的DNA量减少,结合RuHex的量随之降低。通过计时库仑技术检测RuHex响应信号降低的量 ,可以对ATP进行定量测定。此传感器的电化学响应信号与ATP浓度对数值呈线性关系,线性检测范围为0.001~100 μmol/L,检出限(S/N=3)为0.5 nmol/L。此传感器检测靶分子ATP后,可以通过简单的操作步骤再生,再生5次后的响应信号为初始信号的90%以上。采用此传感器检测大鼠脑透析液中ATP的含量为(19.2±3.7) nmol/L (n=3)。
关键词 核酸适配体; 计时库仑; 传感器; 三磷酸腺苷; 再生
1 引 言
生物传感技术在疾病预警与诊断、临床治疗等方面具有良好的应用价值[1~3]。许多生理和病理过程相关的生物活性分子在人体内含量低、易降解、难于被检测,因此开发和筛选选择性好、灵敏度高的识别元件一直是相关研究者关注的热点[4~6]。核酸适配体作为一种新型生物传感识别元件,被越来越多地应用于基础和应用研究[7~10]。核酸适配体是通过系统配体进化技术筛选得到的特定序列的DNA或RNA寡核苷酸链,与靶标之间具有高选择性和强亲和力,某些靶标分子与核酸适配体之间的选择性和亲和力甚至强于其天然配体[11~13]。與天然配体相比,核酸适配体具有制备成本低、稳定性好等优点。
三磷酸腺苷(ATP)在能量代谢、信号转导、神经发育等生命过程中起关键作用[14,15]。文献报道的检测ATP的方法包括荧光法[16]、化学发光法[17]、生物发光法[18]和电化学方法等[19]。ATP在生物体液中的浓度为109~108 mol/L,建立高选择性、高灵敏度的ATP检测方法对于科研工作者是一个具有挑战性的课题[20,21]。电化学方法具有灵敏度高、检测限低的优点,核酸适配体作为识别元件具有良好的选择性,而利用核酸适配体电化学传感器检测ATP已成为当前的热点研究课题之一[22~25]。
利用核酸适配体作为识别元件的电化学传感器通常采用标记电化学活性基团的DNA链作为标记探针,将核酸适配体对于靶标的识别过程转换为电化学响应信号[26~30]。与免标记的电化学传感器相比,标记探针型的核酸适配体电化学传感器的构建过程较为繁琐,制备成本也相对较高。六氨合钌(RuHex)作为一种电活性的分子,其自身带正电荷,如果将DNA链固定在电极表面,RuHex会通过静电吸附的方式结合在带负电荷的DNA骨架上[31]。通过检测吸附于电极表面的RuHex的响应信号可以实现针对固定在电极表面的DNA链的定量测定。基于以上原理,Shen等[32]将腺嘌呤核糖核苷酸(AMP)的核酸适配体与其互补链杂交形成的双链DNA固定在电极表面作为识别元件,构建了一种免标记型核酸适配体电化学传感器。AMP与电极表面的适配体结合,从而与其互补链解离,电极表面固定的DNA的总量随之减少,导致吸附在电极表面的RuHex的量减少,从而实现对AMP的定量测定,检测范围为1.0×107~1.0×103 mmol/L,检出限低于0.1 μmol/L。Jiao等[33]报道了一种检测凝血酶的核酸适配体计时库仑电化学传感器,采用纳米金作为信号放大元件,检测凝血酶的线性范围为0.1~18.5 nmol/L,检出限为30 pmol/L。Li等[34]构建了利用纳米金放大检测ATP的计时库仑型传感器,检测线性范围为1.0×109~1.0×105 mmol/L,检出限为0.2 nmol/L。 Qiu[35]和Du[36]等构建的计时库仑型核酸适配体传感器可以再生,再生处理后传感器至少可重复使用3次。
本研究将与ATP核酸适配体其中一段序列互补的短链DNA固定在电极表面,核酸适配体与短链DNA杂交结合,构建了一种计时库仑型ATP核酸适配体电化学传感器。在电解液中加入电化学活性分子RuHex,带负电荷的DNA通过静电作用吸附RuHex。当在体系中加入ATP时,ATP与核酸适配体结合形成特定的二级结构,从而与互补链解离,从电极表面脱落下来,电极表面的DNA的总量减少,吸附在电极表面的RuHex的总量也相应减少,计时库仑响应信号降低。根据传感器响应信号的降低实现对靶分子ATP的检测。检测后的电极表面与无标记的核酸适配体孵育,重新杂交,即可实现传感器表面的再生。本研究构建的传感器具有普适性,制备和再生方法简单。利用此传感器检测了大鼠脑透析液中ATP的浓度,与文献报道结果一致, 表明此传感器可用于实际生物样品中的检测。
2 实验部分
2.1 仪器与试剂
CHI660B电化学工作站(上海辰华仪器公司)。电化学测定采用三电极体系:DNA修饰的金电极(Φ=2 mm,)为工作电极,Ag/AgCl电极为参比电极,Pt丝为对电极。
DNA序列(见表1)由生工生物工程(上海)股份有限公司合成。三磷酸腺苷(ATP)、三磷酸胞苷(CTP)、三磷酸鸟苷(GTP)和三磷酸尿苷(UTP),购于上海源叶生物科技有限公司;三羟甲基氨基甲烷(Tris,美国Amresco公司);六氨合钌(RuHex,美国Sigma公司);3巯基丙酸(MPA,Acros公司(Geel, Belgium));大鼠脑透析液(北京梦和崇胜科技有限责任公司),脑透析液取自大鼠右腹侧海马脑区,透析探针膜长度为4 mm,人工脑脊液灌流流速为3 μL/min,灌流平衡90 min后,在低温的环境下开始收集透析液,收集到的脑透析液未经进一步处理。本研究所用试剂均为分析纯。实验用水为超纯水(MilliporeD 24UV纯水仪,法国Millipore公司)。
2.2 传感器的制备和再生
金电极依次用粒径为0.30和0.05 μm的Al2O3粉悬浊液抛光,然后依次用丙酮和超纯水各超声清洗5 min。清洗过的电极在0.5 mol/L H2SO4溶液中以0.5 V/s的扫速在0.2~1.6 V的电位范围内扫描,直至得到典型的清洁金电极特征循环伏安图。将50 μL CDNA溶液滴涂在电极表面,使巯基标记的CDNA通过自组装的方式固定在金电极表面。随后取50 μL 10 μmol/L ADNA滴涂在此电极表面,孵育2 h,使ADNA与CDNA杂交形成双链结构。将电极浸入0.1 mmol/L MPA溶液中10 min,再依次使用乙醇和超纯水充分清洗电极以除去电极表面残余的MPA及吸附不牢固的分子。
2.3 电化学测定
电化学检测在含有50 μmol/L RuHex的20 mmol/L TrisHCl的缓冲液中进行,计时库仑电化学检测脉冲宽度为600 mV,脉冲周期为250 ms;差示脉冲伏安检测的电位范围0.5~0 V,脉冲宽度为0.05 s。
3 结果与讨论
3.1 传感器的设计方案
本研究构建的ATP适配体计时库仑电化学传感器的传感机理见图1。首先将5′巯基标记的CDNA通过AuS键自组装的方式固定在电极表面,ATP适配体通过杂交的方式与CDNA结合, 从而固定在电极表面。由于DNA磷酸骨架带负电,当加入RuHex后,电极表面固定的DNA通过静电吸引结合RuHex,此时可以检测到RuHex的电化学响应信号。检测ATP时,ATP与适配体结合形成特定的二级结构,导致适配体DNA链与CDNA解离,从电极表面脱落下来。由于电极表面固定的DNA量减少,通过静电吸引作用吸附在电极表面的RuHex的量也随之减少,RuHex的响应信号也随之降低。通过检测RuHex信号的降低,可以实现对ATP分子的定量测定。检测结束后,将ATP适配体与电极表面固定的CDNA再次杂交, 即可实现传感器的再生。
3.2 核酸适配体传感器对于靶标的响应
RuHex和DNA寡核苷酸链可以在静电吸引的作用下形成RuHexDNA复合结构,在含有RuHex的电解液里,固定了DNA的金电极的差示脉冲伏安(DPV)扫描图有两个氧化峰[32],在0.15 V处的氧化峰归属于RuHex扩散控制峰,位于0.32 V 处的氧化峰是吸附在电极表面的RuHex的特征峰。DPV曲线如图2所示,与CDNA固定在金电极上扫描得到的DPV曲线相比, CDNA与ADNA杂交后的0.32 V处的氧化峰电流明显增大。采用此电极检测100 μmol/L ATP,扫描得到DPV曲线, 在0.32 V处的氧化峰电流明显降低,表明电极表面固定的DNA的量减少,进而导致吸附在电极表面的RuHex的量也相应减少。
3.3 电极制备条件的优化
考察了CDNA的浓度对于电极表面固定的CDNA的量以及杂交ADNA后检测1 mmol/L ATP的DPV响应信号的影响。电极表面固定DNA的密度可通过计时库仑技术测定[29]。选取修饰电极所用的CDNA浓度分别为0.5、1、5、10和50 μmol/L,电极表面固定的CDNA密度随修饰电极所用CDNA浓度的升高而增大。当该电极结合核酸适配体后,检测1 mmol/L ATP所得到的响应信号ΔQ也随之升高。ΔQ的计算方法见3.4节。当修饰电极用的CDNA浓度高于10 μmol/L时,电极表面固定的CDNA的密度以及后续检测ATP的响应信号的增加趋于平缓,表明电极表面固定的CDNA密度接近饱和。因此后续实验选择10 μmol/L CDNA修饰电极。
此外,选择了一条27个碱基的寡核苷酸鏈(RDNA)进行了对比实验,RDNA 3′端的12个碱基与CDNA的3′端的12个碱基互补,其余碱基均为T。传感器的计时库仑响应信号值与CDNA杂交ADNA基本相同,证明DNA的序列对于电极的初始信号没有影响。但该电极与1 mmol/L ATP孵育后,修饰电极的计时库仑响应信号无明显变化,证明RDNA不能识别ATP。
3.4 ATP的检测
图3A为采用计时库仑技术在dsDNA修饰的金电极上测得的Anson曲线。图中曲线由上至下所检测的ATP的浓度分别为0、1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L和100 μmol/L。而当检测ATP的浓度为1 mmol/L时,所得曲线与检测100 μmol/L ATP所得到的曲线几乎重合,证明此传感器检测100 μmol/L ATP时已达到检测上限。由于选用的第一个脉冲电势为0.55 V,此时电极表面的吸附物种以还原态形式存在,假设氧化态物种的扩散系数等于还原态物种的扩散系数D(cm2 s1),根据Cottrell公式可得:
其中, Qad为吸附态的RuHex发生氧化反应时的法拉第电量。在本实验条件下,其余参数均可视为常数。 F为法拉第常数,n为电子转移数,A为电极面积,C0O为氧化态RuHex的初始浓度,D为还原态RuHex的扩散系数,Qdl为电极表面形成双电层所需电量。由公式(1)可知,在公式中其它各参数均为常数的前提下,Qad与Q(t)值成正比。Qad值可以在Anson曲线上由t=0处的截距得到。由图3B可知,ATP浓度在1 nmol/L~100 μmol/L范围内的对数值与Anson曲线t=0处截距的增加值(ΔQ)成正比(ΔQ(μC)=0.085lgCATP (nmol/L) + 0.014, R=0.995)。传感器的检出限为0.5 nmol/L(S/N=3)。使用此传感器检测了大鼠脑透析液中ATP的含量,计算得大鼠脑透析液中ATP浓度为(19.2±3.7) nmol/L (n=3), 与文献[22]报道的结果相符。
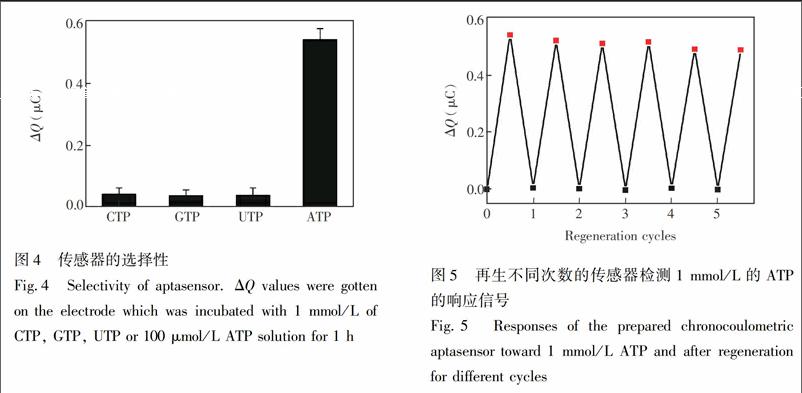
3.5 傳感器的选择性
考察了传感器对ATP 类似物CTP、GTP和UTP的响应。CTP、GTP和UTP浓度均为 1 mmol/L,ATP的浓度为100 μmol/L。图4结果表明,采用本传感器检测100 μmol/L ATP的响应信号ΔQ为检测1 mmol/L的CTP、GTP和UTP响应信号10倍以上,说明所构建的核酸适配体传感器检测ATP具有良好的选择性。
3.6 传感器的再生
将传感器CDNA固定在电极表面,核酸适配体通过杂交的方式与CDNA结合。在检测ATP样品后,核酸适配体从电极表面解离下来,因此传感器的再生仅需将检测后的传感器与10 μmol/L ADNA溶液在室温下温育2 h,使ADNA与电极表面固定的CDNA重新杂交即可实现。图5显示了此传感器及经过5次再生的传感器检测1 mmol/L ATP前后的电化学响应信号。经过5次再生后的电极对ATP的响应仍能达到电极初始响应的90%以上。证明此本传感器能够反复再生使用,可有效地降低检测成本。
4 结 论
构建了一种可再生的核酸适配体ATP计时库仑电化学传感器。将核酸适配体的互补链CDNA固定在电极表面,核酸适配体通过杂交的方式与CDNA结合。靶分子与核酸适配体结合,使其从电极表面解离,电极表面吸附的RuHex随之减少,因此计时库仑信号降低。本传感器设计方案具有普适、简单的特点,而且传感器易于再生。使用本传感器检测大鼠脑透析液中的ATP的含量结果与文献报道结果相符,表明本传感器可用于实际生物样品测定。
References
1 Newman R H, Fosbrink M D, Zhang J. Chem. Rev., 2011, 111(5): 3614-3666
2 Sassolas A, LecaBouvier B D, Blum L J. Chem. Rev., 2008, 108(1): 109-139
3 Zhang M N, Liu K, Gong K P, Su L, Chen Y, Mao L Q. Anal. Chem., 2005, 77(19): 6234-6242
4 Khan M, Park S Y. Anal. Chem., 2014, 86(3): 1493-1501
5 Liu G D, Mao X, Phillips J A, Xu H, Tan W H, Zeng L W. Anal. Chem., 2009, 81(24): 10013-10018
6 Hayat A, Haider W, Rolland M, Marty J L. Analyst, 2013, 138(10): 2951-2957
7 Famulok M, Hartig J S, Mayer G. Chem. Rev., 2007, 107(9): 3715-3743
8 Zayats M, Huang Y, Gill R, Ma C A, Willner I. J. Am. Chem. Soc., 2006, 128(42): 13666-13667
9 Lu Y, Zhu N N, Yu P, Mao L Q. Analyst, 2008, 133(9): 1256-1260
10 LI Xia, TAN Hui, LI YunLei, WU ZhaoYang, SHEN GuoLi, YU RuQin. Chinese J. Anal. Chem., 2014, 42(5): 629-635
李 霞, 谭 慧, 李云磊, 吴朝阳, 沈国励, 俞汝勤. 分析化学, 2014, 42(5): 629-635
11 Ellington A D, Szostak J W. Nature, 1990, 346(6287): 818-822
12 Tuerk C, Gold L. Science, 1990, 249(4968): 505-510
13 Shangguan D H, LiY, Tang Z W, Cao Z C, Chen H W, Mallikaratchy P, Sefah K, Yang C J, Tan W H. Proc. Natl. Acad. Sci. USA, 2006, 103(32): 11838-11843
14 Cook S P, Vulchanova L,Hargreaves K M, Elde R, McCleskey E W. Nature, 1997, 387(6632): 505-508
15 Gourine A V, Llaudet E, Dale N, Spyer K M. Nature, 2005, 436(7047): 108-111
16 Liu Z B, Chen S S, Liu B W, Wu J P, Zhou Y B, He L Y, Ding J S, Liu J W. Anal. Chem., 2014, 86(24): 12229-12235
17 Edwards J, Sprung R, Sprague R, Spence D. Analyst, 2001, 126(8): 1257-1260
18 Kamidate T, Yanashita K, Tani H, Ishida A, Notani M. Anal. Chem., 2006, 78(1): 337-342
19 Llaudet E, Hatz S, Droniou M, Dale N. Anal. Chem., 2005, 77(10): 3267-3273
20 Melani A, Turchi D, Vannucchi M G, Cipriani S, Gianfriddo M, Pedata F. Neurochem. Int., 2005, 47(6): 442-448
21 Lin Z Y, Luo F, Liu Q D, Chen L F, Qiu B, Cai Z W, Chen G N. Chem. Commun., 2011, 47(28): 8064-8066
22 Yu P, He X L, Zhang L, Mao L Q. Anal. Chem., 2015, 87(2): 1373-1380
23 Zuo X L, Song S P, Zhang J, Pan D, Wang L H, Fan C H. J. Am. Chem. Soc., 2007, 129(5): 1042-1043
24 Lu Y, Li X C, Zhang L M, Yu P, Su L, Mao L Q. Anal. Chem., 2008, 80(6): 1883-1890
25 JIANG LiYing, WANG FenFen, HU Jie, YUE BaoLei, YAN YanXia, CHEN QingHua. Chinese J. Anal. Chem., 2014, 42(5): 666-671
姜利英, 王芬芬, 胡 杰, 岳保磊, 閆艳霞, 陈青华. 分析化学 2014, 42(5): 666-671
26 Baker B R, Lai R Y, Wood M S, Doctor E H, Heeger A J, Plaxco K W. J. Am. Chem. Soc., 2006, 128(10): 3138-3139
27 YANG ShaoMing, DING SuYou, CHEN YanSheng, ZHANG XiaoRong, Zheng Yue, ZHENG LongZhen. Chinese J. Anal. Chem., 2016, 44(1): 110-116
杨绍明, 丁素游, 陈延胜, 张小荣, 郑 玥, 郑龙珍. 分析化学, 2016, 44(1): 110-116
28 YANG ShaoMing, ZHA WenLing, LI Hong, SUN Qing, LIU Bin, ZHENG LongZhen. Chem. J. Chinese Universities, 2013, 34(3): 551-555
杨绍明, 查文玲, 李 红, 孙 清, 刘 斌, 郑龙珍. 高等学校化学学报, 2013, 34(3): 551-555
29 Zuo X L, Song S P, Zhang J, Pan D, Wang L H, Fan C H. J. Am. Chem. Soc., 2007, 129(5): 1042-1043
30 Xiao Y, Lubin A A, Heeger A J, Plaxco K W. Angew. Chem. Int. Ed., 2005, 44(34): 5456-5459
31 Steel A B, Herne T M, Tarlov M J. Anal. Chem., 1998, 70(22): 4670-4677
32 Shen L, Chen Z, Li Y H, Jing P, Xie S B, He S L, He P L, Shao Y H. Chem. Commun., 2007, (21), 2169-2171
33 Jiao X X, Chen J R, Zhang X Y, Luo H Q, Li N B. Anal. Biochem., 2013, 441(2): 95-100
34 Li W, Nie Z, Xu X H, Shen Q P, Deng C Y, Chen J H, Yao S Z. Talanta, 2009, 78(3): 954-958
35 Qiu H J, Sun Y L, Huang X R, Qu Y B. Colloid. Surf. B, 2010, 79(1): 304-308
36 Du Y, Chen C G, Zhou M, Dong S J, Wang E K. Anal. Chem., 2011, 83(5): 1523-1529
