利用代谢组学研究大气细颗粒物的生殖毒性效应
2017-06-21王晓飞蒋守芳张维冰张凌怡刘颖杜
王晓飞+蒋守芳+张维冰+张凌怡+刘颖+杜晓妍+张洁+申河清
摘 要 大气细颗粒物(PM2.5)污染已成为严峻的环境问题,探究PM2.5的毒性效应和机理变得尤为重要。本研究利用基于液相色谱/质谱的代谢组学技术,分析经PM2.5悬混液气管滴注暴露后成年雄性大鼠睾丸代谢组的全局变化,采用偏最小二乘判别分析法和非参数检验进行统计分析。结果表明,PM2.5暴露组大鼠睾丸的油提和水提代谢指纹谱均可与对照组实现准确区分,表明PM2.5暴露对大鼠睾丸的整体代谢网络产生了显著影响,最终鉴定出56个差异代谢物。通路分析显示,PM2.5暴露会引起大鼠睾丸的氨基酸和核苷酸代谢紊乱、类固醇激素代谢失衡以及脂类代谢异常,而这些重要通路可能是PM2.5生殖毒性的关键分子事件。
关键词 代谢组学; 大气细颗粒物; 睾丸; 生殖毒性; 液相色谱质谱
1 引 言
随着城市化进程的推进和经济发展,以细颗粒物(PM2.5)为主要成分的空气污染已成为全国性的环境问题。PM2.5颗粒表面附着大量具有内分泌和代谢干扰效应的内分泌干扰物(Endocrine disrupting chemicals,EDCs),如重金属、多环芳烃、挥发性有机物等,而且固体颗粒本身也对机体的正常代谢存在显著影响。PM2.5进入呼吸道深部并沉积在末细支气管和肺泡中,其中化学组分和细颗粒物进入血液循环,可能通过干扰下丘脑垂体性腺轴的内分泌和代谢通路从而影响生殖健康。美国环保署2009年发布的《关于颗粒物的综合科学评估报告》指出暴露在浓度水平较高的空气污染物中,未来生育能力会受到影响。已有研究表明,大气颗粒物暴露引起生物体内炎症反应和氧化胁迫,导致小鼠睾丸P450scc基因表达和血清睾酮水平显著下降[1],影响激素分泌相关通路[2,3],并且大气颗粒物污染可通过诱导生殖细胞DNA损伤、异常甲基化和内分泌干扰影响动物生殖器官发育,干扰睾丸类固醇激素合成与分泌,抑制精子发生,降低精子质量[4~6]。此外,PM2.5还可干扰大鼠睾丸细胞周期进程及引起细胞脂质过氧化,进而对其生殖系统产生毒害[7,8]。虽然目前的很多报道证明了PM2.5暴露对雄性生殖的影响,但是这些研究大部分停留在效应层面,相关生殖毒性的分子机理尚不明确[9]。
鉴于PM2.5的组成非常复杂,阐明其毒性机制面临巨大的挑战,代谢组学技术为解决这一问题提供了强大的工具。代谢组学研究生物体低分子量代谢物的系统响应,有助于从复杂的分子变化中识别出关键事件,而无需对毒性成分不确定的细颗粒物做明确的毒理学假设[10]。与基于假设的传统毒理学不同,代谢组学基于高通量获取的大数据筛选暴露效应相关的标志物,某些标志物本身就是毒性机制中的关键分子,与其它标志物结合通过进一步的聚类分析可发现相关的重要毒性通路。目前,PM2.5暴露相关的代谢组学研究还较少,并且主要侧重肺部毒性效应的研究。 Chen等[11]利用脂质组学的方法研究了PM2.5对大鼠肺部脂质代谢的影响,发现一系列重要的脂类代谢物的合成和代谢通路发生了显著变化。本研究组也利用代谢组学技术探讨了PM2.5对A549肺上皮细胞的代谢网络的影响,大量的氨基酸代谢、TCA循环和能量代谢相关小分子代谢物的表达发生了显著变化[12]。
上述研究表明,代谢组学技术在揭示PM2.5毒性分子机理方面巨大的应用潜力。本研究针对PM2.5暴露组和对照组大鼠的睾丸代谢轮廓进行研究,应用统计分析方法筛选出差异性显著的代谢物并加以鉴定,结合相关代谢通路对PM2.5的睾丸毒性机理进行了研究。
2 实验部分
2.1 仪器与试剂
ACQUITY超高效液相色谱仪(美国Waters公司);Q Exactive质谱仪(美国Thermo公司);大气颗粒物采样仪(中国武汉天虹公司);石英纤维滤膜(英国Whatman公司)。甲醇和异丙醇(色谱纯,德国Merck公司);实验用水由MilliQ超纯水系统制备;甲酸(质谱纯,百灵威J&K公司)。
2.2 实验方法
2.2.1 PM2.5的收集和悬浮液制备 PM2.5的采样地点为唐山市中心的华北理工大学公共卫生学院二楼楼顶,采样时间为2014年11月至2015年5月(污染最严重时期),滤膜在40℃避光保存。
将滤膜剪碎后放入超纯水中,冰浴下超声30 min,取出滤膜后,经6层无菌纱布过滤,得到混悬液,上述提取过程重复一次,合并两次所得混悬液,真空冷冻干燥得到PM2.5颗粒物。准确称取PM2.5颗粒物,加入生理盐水超声下配制混悬液。PM2.5暴露前灭菌并超声振荡使混悬液均匀。
2.2.2 试验动物分组与染毒方法 SD成年雄性大鼠(体重为(200±20) g,2月龄)适应性饲养1周后,随机分成两组,分别为PM2.5混悬液处理组和对照组,每组6只。饲养条件为SPF级实验动物室,昼夜交替各为12 h,暴露期间大鼠可以自由摄取食物和水。暴露组采用气管滴注的方式进行染毒,每周染毒1次,連续染毒3个月,每周染毒容量为25 mg/kg。对照组采用生理盐水进行气管滴注。
2.2.3 睾丸组织的收集和代谢物提取 (1)睾丸组织样品收集 大鼠末次染毒24 h后,采用10%水合氯醛腹腔注射方法麻醉,快速分离睾丸,放入液氮急速冷冻后, 80℃保存。(2)水溶性和脂溶性代谢物提取步骤 \[13] 样品在4℃下解冻。称取100 mg解冻后的样品,加入1.5 mL甲醇水(1∶1, V/V, 20℃预冷),匀浆,离心10 min(4℃,16000 g),上清液即为水提代谢物,上清液真空冷冻干燥。再向沉淀物中加入1.6 mL二氯甲烷甲醇(3∶1, V/V, 20℃预冷),匀浆,离心10 min(4℃,16000 g),有机相即为油提代谢物,通风橱内挥干。 所有样品先用200 μL甲醇水(1∶1, V/V)复溶,离心除去不溶物后再进行检测。(3)质量控制(QC)样品的制备 每个大鼠睾丸组织称取等量混合均匀后,按照上述样品处理过程处理,所得代谢提取物作为质量控制样品。
2.2.4 睾丸代谢提取物的LCMS条件 (1) 水提代谢物分析 Waters公司ACQUITY HSS T3 色谱柱(100 mm×2.1 mm i.d., 1.7 μm,);流动相A为0.1%甲酸的水溶液; 流动相B为含有0.1%甲酸的甲醇。梯度洗脱:初始流动相为0.1% B,保持2 min,6 min时升至25% B,10 min时升至80% B,12 min时升至90% B,21 min时升至99.9% B并保持2 min,随后快速恢复初始0.1% B,并保持3 min。进样体积为5 μL;流速为400 μL/min;柱温40℃。(2)油提代谢物分析 Waters公司ACQUITY BEH C8 色谱柱(100 mm ×2.1 mm i.d., 1.7 μm);流动相C为0.1%甲酸溶液, 流动相D为含0.1%甲酸的甲醇异丙醇(85∶15, V/V)溶液。梯度洗脱:初始流动相为75% D,保持1 min,6 min时升至85% D并保持4 min,15 min时升至90% D并保持2 min,18 min时升至91% D并保持3 min,22 min时升至92% D并保持5 min,29 min时升至99.9% D并保持3 min,随后快速恢复初始75% D并保持3 min。进样体积为5 μL;流速为400 μL/min;柱温40℃。(3)电喷雾离子源(ESI) 分别采用正、负离子模式采集数据,Full MS分辨率70000,质谱扫描范围为m/z 100~1000。氮气作为载气,正离子模式和负离子模式的喷针电压分别设为3200和2800 V。对于水提代谢物:鞘气流量45 L/min;辅助气体积流量15 L/min;辅助气温度350℃;对于油提代谢物:鞘气流量40 L/min;辅助气体积流量10 L/min;辅助气温度320℃。每个样品进样两次,随机进样,以便能消除人为或者仪器造成的系统误差,QC样品每隔6个样品进一次样,Full MS/ddMS2模式用于获得标志物的二级结构信息,NCE设为30%。
2.2.5 数据处理及代谢物鉴定 LCMS采集的原始数据转换为mzXML格式,经XCMS软件处理后得到离子信息表,离子质荷比窗口设为10 ppm,保留时间窗口设为40 s。所得数据经过峰面积归一化并删除检出率小于80%的离子峰,处理后的数据导入SIMCAP(Version 11.0,Sweden),首先进行主成分分析考察方法稳定性(QC样品聚合情况),然后进行偏最小二乘判别分析(PLSDA),并通过SPSS软件 (Version 18.0) 和MetaboAnalyst 3.0进行相关统计学分析。差异代谢物的筛选标准为:VIP值(Variable importance in the projection)≥1; 变化倍数≥2(处理组vs对照组); p<0.05(处理组vs对照组)。将满足上述筛选条件的水提代谢物的精确分子量导入HMDB(http://www.hmdb.ca)数据库,质量偏差≤30 ppm,同时结合代谢物的二级质谱信息进行鉴定。对于满足上述筛选条件油提代谢物,将其二级质谱信息导入LipidSearchTM软件 (Thermo ScientificTM)进行鉴定,搜索及鉴定参数设置如下:Type,Product;ExpType,LC;Precursor Tol,30 ppm, Grade=A or B。
3 结果与讨论
3.1 代谢组学分析
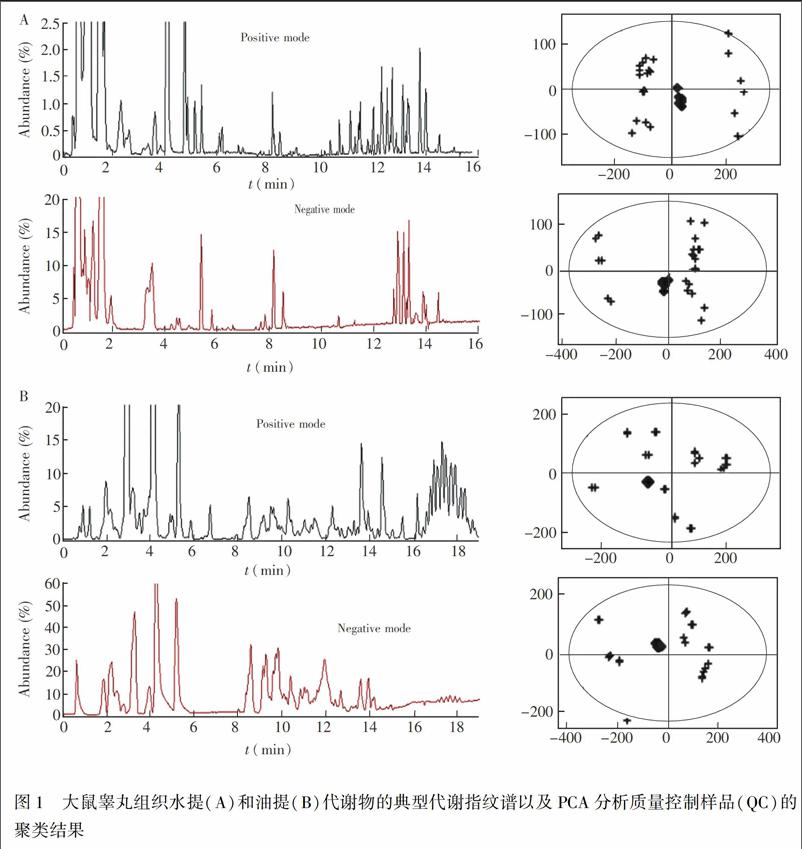
理想的代谢组学分析要求尽可能获得所有代谢物的信息。本研究分别在正、负离子模式下对大鼠睾丸组织的水提和油提代谢物进行分析,以获得综合全面的代谢物信息。图1为代谢物的代表性指纹谱。
样品分析过程利用QC样品检验方法的可靠性及LCMS的稳定性。采用PCA方法对样品和QC样品进行模式识别,如图1所示,QC样品有很好的聚合度,说明本方法重復性好,仪器性能稳定,数据可靠,满足代谢组学分析的要求。
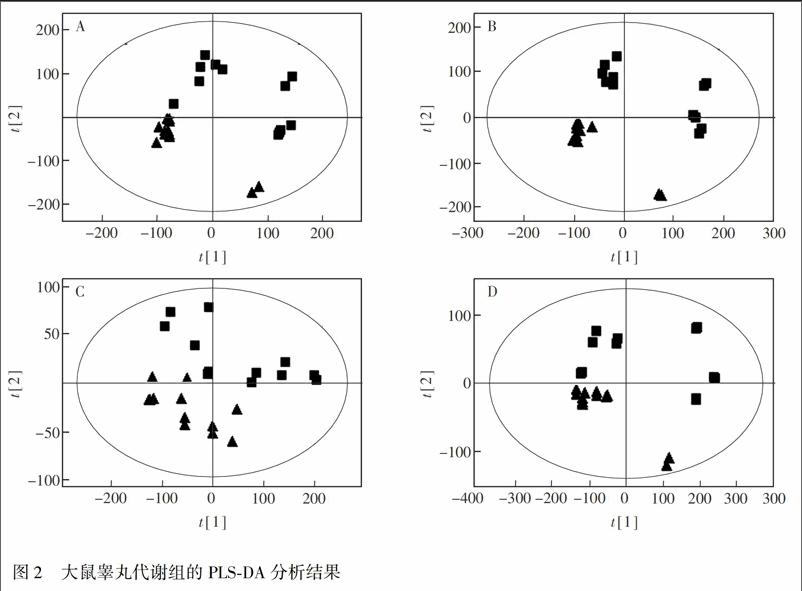
偏最小二乘法判别分析(PLSDA)是代谢组学中常用的数据分析方法,可以在不降低模型的预测能力的前提下,有效减少模型的复杂性, 增强模型的解释能力[14]。PLSDA分析(图2)表明,在两种代谢物提取方法和两种离子扫描模式下,PM2.5处理组均能够与对照组实现很好的聚类区分,说明PM2.5处理对大鼠睾丸的整体代谢产生了显著影响。
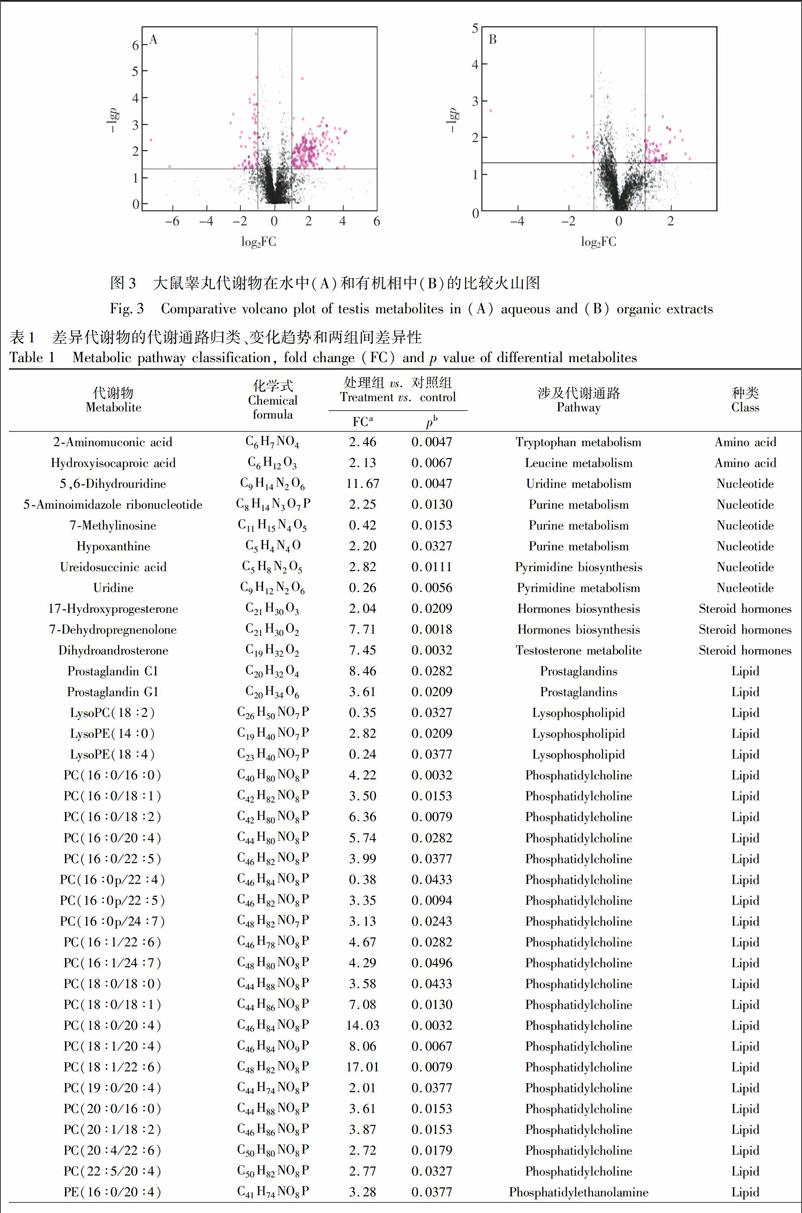
处理过的离子信息表导入MetaboAnalyst 3.0进行统计学分析(图3),不同提取方式下代谢物在两组间差异性,横坐标代表代谢物在两组间的变化倍数的log2,纵坐标代表代谢物在两组间ttests的p值的log10。由图3可见,PM2.5处理组与对照组大鼠的睾丸中存在大量显著性差异的代谢物。根据变量的重要性,结合变化倍数及变量在两组间的差异性,最终筛选出56个差异代谢物(表1),包括2个氨基酸代谢物、 6个核苷酸代谢物、 3个类固醇激素代谢物、 2个前列腺素、 3个溶血磷脂、 20个磷脂酰胆碱、7个磷脂酰乙醇胺、 5个鞘磷脂、2个甘油单酯、1个甘油二酯和5个甘油三酯。
3.2 PM2.5通过诱导氧化应激引起核苷酸代谢紊乱
目前普遍接受的PM2.5暴露的毒性机理包括以下方面:PM2.5进入人体后,会增加体内的氧化应激压力,导致DNA损伤[15,16]、细胞和器官的功能异常[17,18],同时造成炎症因子的释放[19,20],从而导致多种疾病的发生或者加重。氧化胁迫是PM2.5暴露所引起的体内主要反应[12],睾丸内氧化应激的增强会影响睾丸内精子的产生和成熟[21],并且核苷酸代谢紊乱被认为与氧化应激相关。6个与核苷酸代谢相关的代谢物在PM2.5处理组和对照组中产生了显著变化(4个上升,2个下降),说明PM2.5暴露引起了大鼠睾丸内核苷酸代谢的紊乱,这表明PM2.5很可能通过引起氧化应激增强来干扰核苷酸代谢,并对大鼠睾丸正常生理功能产生损害。
3.3 PM2.5可引起类固醇激素及多种脂类的代谢异常
类固醇激素在促进性腺发育与生殖控制方面起重要作用,PM2.5处理组大鼠睾丸中17羟孕酮(17Hydroxyprogesterone)、7双烯醇酮(7Dehydropregnenolone)和二氢雄甾酮(Dihydroandrosterone)这3个与类固醇激素相关代谢物的水平明显上升,这表明PM2.5可能会引起体内类固醇激素合成代谢的紊乱。睾酮是雄性生殖调节过程中最重要的激素,二氢雄甾酮作为睾酮的代谢物,其表达在PM2.5处理组中明显升高,表明PM2.5暴露加速了睾酮代谢,降低体内的睾酮水平,因此会影响雄性大鼠生殖功能。暴露后,45个脂类代谢物发生了显著变化,涉及到前列腺素(Prostaglandins)的生成与代谢、溶血磷脂(Lysophospholipid)代谢、磷脂酰胆碱(Phosphatidylcholine)代谢、磷脂酰乙醇胺(Phosphatidylethanolamine)代谢、鞘磷脂(Sphingomyelin)代谢和甘油三酯代谢(Monoacylglyceride, diglycerideand triglyceride)。睾丸组织的脂类代谢在维持正常的雄性生殖功能方面也起到了非常重要的作用[22,23],尤其是在细胞膜的流动性保持、精子运动能力和维持精子形态等方面[24]。前列腺素含量变化已被证明能够显著影响雄性生殖能力,包括影响睾丸的发育,精子的生成及活性[25]。磷脂酰胆碱、磷脂酰乙醇胺和鞘磷脂做为生物膜的主要成分,在维持精子细胞膜完整和功能正常方面起到了重要作用[26]。而且甘油三酯代谢与精子生成供能密切相关[27]。这表明PM2.5暴露会造成大鼠睾丸内脂类代谢紊乱,进而可能会影响到大鼠睾丸的正常生理功能、精子生成及精子形态的正常,从而损害大鼠的生殖功能。
3.4 PM2.5会干扰色氨酸和亮氨酸的合成和代谢通路
作为生物体内构成蛋白质分子的基本单位,氨基酸参与了蛋白质合成和能量代谢等多种生命活动。2氨基2,4己二烯二酸(2Aminomuconic acid)和2羟基异己酸(Hydroxyisocaproic acid)分别是色氨酸和亮氨酸的代谢产物。与对照组相比,PM2.5处理组大鼠睾丸中色氨酸和亮氨酸的代谢水平显著升高,这说明PM2.5暴露扰乱了睾丸中部分氨基酸的合成和代谢通路。
4 结 论
本研究利用代谢组学技术对PM2.5处理后大鼠睾丸组织的代谢指纹谱进行了比对分析,发现PM2.5暴露对大鼠睾丸的整体代谢组产生了显著影响,鉴定了56个差异显著的代谢物,代谢通路分析表明PM2.5暴露会导致氨基酸和核苷酸代谢紊乱、类固醇激素代谢失衡以及脂类代谢异常。这些重要通路是PM2.5生殖毒性的关键分子事件,在此基础上,综合利用常规毒理学方法和基因组学、蛋白质组学等系统生物学技术,深入研究这些分子事件上下游的响应机理,对于认识大气颗粒物的生殖毒性机制具有重要的意义。
References
1 Li C, Li X, Jigami J, Hasegawa C, Suzuki A K, Zhang Y, Fujitani Y, Nagaoka K, Watanabe G, Taya K. Inhal.Toxicol., 2012, 24(9): 599-608
2 Balasubramanian P, Sirivelu M P, Weiss K A, Wagner J G, Harkema J R, Morishita M, MohanKumar P, MohanKumar S. Neurotoxicology, 2013, 36: 106-111
3 Block M L, CalderónGarcidueas L. Trends Neurosci., 2009, 32(9): 506-516
4 Somers C M. Syst. Biol.Reprod. Med., 2011, 57(12): 63-71
5 Ono N, Oshio S, Niwam Y, Yoshida S, Tsukue N, Sugawara I, Takano H, Takeda K. Inhal.Toxicol., 2007, 9(3): 275-281
6 Yoshida S, Sagai M, Oshio S, Umeda T, Ihara T, Suqamata M, Suqawara I, Takeda K. Int. J. Androl., 1999, 22(5): 307-315
7 ZHANG Lin, NIU JingPing, XU Jia, XU DaQin. Asian J. Ecotoxicol., 2009, 4(2): 271-275
张 琳, 牛静萍, 徐 佳, 徐大琴. 生态毒理学报, 2009, 4(2): 271-275
8 LIU XiaoLi, LI Hong, MENG ZiQiang. China Environmental Science J., 2005, 25(2): 160-164
劉晓莉, 李 红, 孟紫强. 中国环境科学, 2005, 25(2): 160-164
9 WANG EnPeng, SUN Yan, YUE Hao, CHEN HuanWen, WANG Yang, CHEN ChangBao, LIU ShuYing. Chinese J. Anal. Chem., 2016, 44(9): 1410-1418
王恩鹏, 孙 岩, 越 皓, 陈焕文, 王 洋, 陈长宝, 刘淑莹. 分析化学, 2016, 44(9): 1410-1418
10 YAN Chao, CAO XiNing, SHEN LianJu, LIU DongYao, PENG JinPu, CHEN JinJun, ZHOU Yue, LONG ChunLan, LIN Tao, HE DaWei, LI XuLiang, WEI GuangHui. National Journal of Andrology, 2016, 22(2): 104-109
严 超, 曹希宁, 沈炼桔, 刘东尧, 彭金普, 陈进军, 周 玥, 龙春兰, 林 涛, 何大维, 李旭良, 魏光辉. 中华男科学杂志, 2016, 22(2): 104-109
11 Chen W L, Lin C Y, Yan Y H, Cheng K T, Cheng T J. Mol. Biosys., 2014, 10(12): 3163-3169
12 Huang Q, Zhang J, Luo L, Wang X F, Wang X X, Alamdar A, Peng S, Liu L, Tian M, Shen H. Toxicol. Res., 2015, 4(4): 939-947
13 Want E J, Masson P, Michopoulos F, Wilson I D, Theodoridis G, Plumb R S, Shockcor J, Loftus N, Holmes E, Nicholson J K. Nat. Protoc., 2012, 8(1): 17-32
14 Trygg J, Wold S. J. Chemometr., 2002, 16 (3): 119-128
15 Corsini E, Budello S, Marabini L. Arch. Toxicol., 2013, 87(12): 2187-2199
16 SaintGeorges F, Garon G, Escande F, Abbas I, Verdin A, Gosset P, Mulliez P, Shirali P. Toxicol. Lett., 2009, 187(3): 172-179
17 Deng X, Zhang F, Rui W, Long F, Wang L, Feng Z, Chen D, Ding W. Toxicol. in vitro, 2013, 27(6): 1762-1770
18 Li N, Sioutas C, Cho A, Schmitz D, Misra C, Sempf J, Wang M, Oberley T, Froines J, Nel A. Environ. Health. Persp., 2003, 111(4): 455
19 Dagher Z, Garon G, Gosset P, Ledoux F, Surpateanu G, Courcot D, Aboukais A, Puskaric E, Shirali P. J. Appl. Toxicol., 2005, 25(2): 166-175
20 Potnis P A, Mitkus R, Elnabawi A, Squibb K, Powell J L. Toxicol. Res., 2013, 2(4): 259-269
21 Shiraishi K, Naito K. J. Urology, 2007, 178(178): 1012-1017
22 Robinson B S, Johnson D W, Poulos A. J. Biot. Chem., 1992, 267(3): 1746-1751
23 Retterstl K, Haugen T B, Tran T N, Christophersen B O. Reproduction, 2001, 121(6): 881-887
24 Connor W E, Lin D S, Wolf D P, Alexander M. J. Lipid. Res., 1998, 39(7): 1404-1411
25 YE GanCai. Progress in Physiological Sciences, 1983, 14(1): 53-57
葉干才. 生理科学进展, 1983, 14(1): 53-57
26 HinkovskaGalcheva V, Petkova D, Koumanov K. Cryobiology, 1989, 26(1): 70-75
27 Aziz, M A, ELHAGGAR, S, Tawadrous, G A, Hamada, T, Shawky, M A, Amin, K S. Andrologia, 1983, 15(3): 259-263
