含硒磺基甜菜碱表面活性剂界面性能的氧化-还原响应行为
2017-06-21孔伟伟张永民刘雪锋
孔伟伟 郭 爽 张永民 刘雪锋
(江南大学化学与材料工程学院,食品胶体与生物技术教育部重点实验室,江苏 无锡 214122)
含硒磺基甜菜碱表面活性剂界面性能的氧化-还原响应行为
孔伟伟 郭 爽 张永民*刘雪锋*
(江南大学化学与材料工程学院,食品胶体与生物技术教育部重点实验室,江苏 无锡 214122)
硒,作为一种新的氧化-还原响应位点因其良好的生物相容性日益引起人们的关注,然而,对这种新型氧化-还原响应型表面活性剂的研究相对较少,尤其是其界面性能的智能调控。本文以含硒两性离子表面活性剂苄基十一烷基磺基甜菜碱(BSeUSB)为对象,研究了其分子结构、Krafft温度、表/界面张力及发泡和乳化性能的氧化-还原刺激响应行为。发现在极微量的H2O2(≤体系总质量的0.056%)氧化下,BSeUSB分子中疏水的―Se―C―键转变成了具有一定亲水能力的Se=O键,表面活性剂从单头单尾的还原态变成了类Bola型的氧化态,导致表面活性剂的Krafft温度由(23.5 ± 0.5) °C下降至0 °C以下,5.00 mmol·L-1时的表/界面张力分别从45.15、5.52 mN·m-1升高至61.63、18.38 mN·m-1。宏观上,还原态具有良好的发泡和乳化性能,而氧化态的发泡和乳化能力几乎消失。再次加入极少量还原剂Na2SO3(≤体系总质量的0.060%)后,分子的微观结构和溶液性能又可恢复到初始状态。总之,通过极微量H2O2和Na2SO3的交替加入,我们实现了该表面活性剂界面性能的智能调控。
氧化-还原响应;含硒表面活性剂;甜菜碱;界面性能;泡沫;乳液
1 引 言
工业应用中常常需要表面活性剂的表面活性定期的出现与消失。例如,起泡性有利于矿物的浮选,而在溶液浓缩与减压蒸馏过程中,泡沫的存在却会带来不必要的麻烦。再者,在石油工业中为了减少管道输送的能耗,通常需要将石油乳化降低其粘度;但是到达目的地后,又需要快速破乳实现油水分离1-3。无论是泡沫的产生与消失,还是乳液的形成与破坏,它们都与体系中表面活性剂分子的界面活性密不可分。传统的消泡或破乳的方法往往需要额外添加其它试剂(消泡剂或破乳剂)4,5或者输入一定的能量(升温、高速离心等)6,7才能实现。环境刺激响应型表面活性剂的出现为这一问题的解决提供了更好的选择。通过环境的微小刺激,即可实现对表面活性剂界面活性的宏观调控,从而达到发泡/消泡或乳化/破乳的智能“开”与“关”。
目前,有关环境响应型表面活性剂的报道已有很多,其触发方式主要集中于pH8、光9、磁10、CO211等。氧化-还原过程广泛存在于自然界的一切生命体中,与生命活动(新陈代谢)息息相关。当前已有报道的氧化-还原响应型表面活性剂通常含有二茂铁基团12或双硫键13。二茂铁基团在水溶液中化学稳定,并且由于二茂铁的氧化-还原电势相对较低,常以电化学法作为氧化-还原刺激手段,且其氧化态较易制得。含双硫键的表面活性剂则常通过加入含双硫键或含巯基类的有机物来实现氧化-还原响应。关于新型氧化-还原响应型表面活性剂的研究报道较少。
硒是一种人体必需的微量元素。近年来,由于硒在人体的重要作用14-16和独特的氧化-还原响应性能17-21,含硒化合物的研究日益引起人们的关注。清华大学许华平教授对含硒聚合物进行了大量而深入的研究,发现―Se―C― (244 kJ·mol-1)、―Se―Se― (172 kJ·mol-1)及―Se―N― (193 kJ·mol-1)相对于―S―S―键具有更低的键能,表现出对活性氧极为敏感的刺激响应行为20。受此启发,本小组成功设计合成了含―Se―C―键的两性离子表面活性剂,苄基硒十一烷基磺基甜菜碱(BSeUSB)22,研究了该类表面活性剂与传统的十二烷基硫酸钠共组装构筑粘弹性蠕虫状胶束及其氧化-还原响应行为,发现在微量H2O2的刺激下BSeUSB即可实现从传统单头单尾型到Bola型结构的转变,从而导致蠕虫状胶束的解聚。
表面活性分子结构的转变必然带来其水溶液界面性能的变化,而这正是实现发泡与消泡、乳化与破乳智能调控的关键所在。因此,本文将着重研究单一的含硒磺基甜菜碱甜菜碱表面活性剂水溶液界面性能的氧化-还原响应行为及响应机理。
2 实验部分
2.1 实验试剂
硒粉(≥ 99%),硼氢化钠(≥ 98%),苄基溴(≥99%),三溴化磷(≥ 99%),1,3-丙磺酸内酯(≥ 99%),33% (w)的二甲胺水溶液,30% (w)的H2O2,Na2SO3(≥ 99%),维生素C (VC,≥ 99%)等均为分析纯,购于上海化学试剂股份有限公司。溴代十一醇(≥99%)和谷胱甘肽(GSH,≥ 99%)购自Admas,直接使用。含硒表面活性剂苄基硒十一烷基磺基甜菜碱BSeUSB (图1)参照文献22合成提纯。水是通过对去离子水三次蒸馏所得(电阻率为18 MΩ·cm)。
2.2 表面活性剂氧化-还原前后的结构表征
称取15 mg BSeUSB溶于0.4 mL重水中,通过核磁共振仪(Avance III,德国Bruker公司)测得该物质的1H NMR。再加入等摩尔比的H2O2(30% (w),约1.04 mg),充分氧化后,测得其氧化后的产物BSeUSB-Ox的1H NMR。再加入等摩尔比的Na2SO3(约3.84 mg),还原0.5 h,测得还原后的产物BSeUSB-Re的1H NMR。配制1 mg·mL-1的BSeUSB的纯水溶液,通过液质联用仪(Maldi Synapt MS,美国Waters公司)对不同氧化时间和H2O2用量下的氧化产物进行质谱(ESI-MS)表征。
2.3 Krafft温度的测量
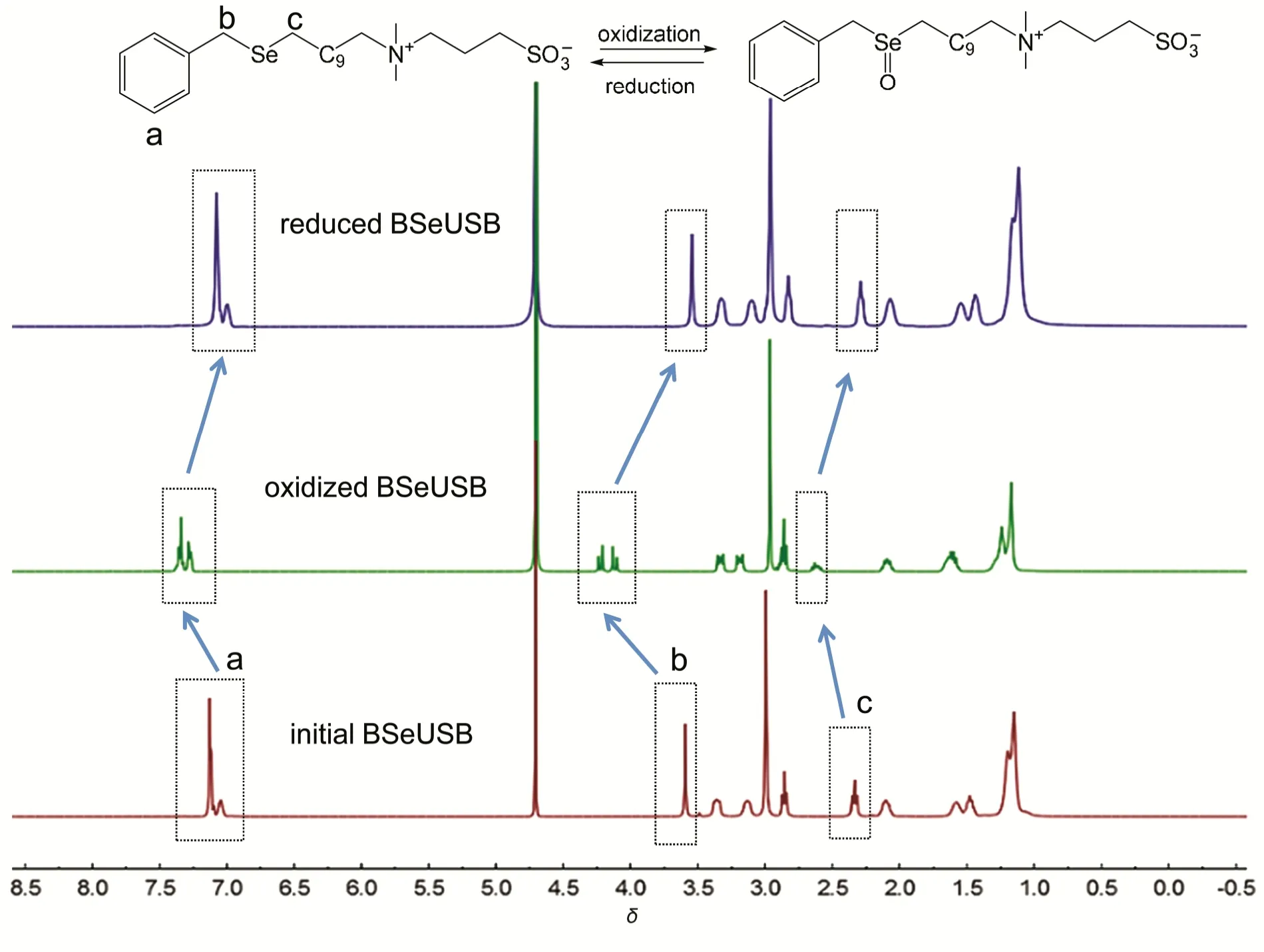
图1 BSeUSB氧化-还原响应前后的核磁氢谱(D2O作为溶剂)Fig.1 Evidences of1H NMR spectra using D2O as the solvent for the redox response of BSeUSB
配制浓度为1% (w)的BSeUSB水溶液于15 mL试管内,插入温度计和搅拌铜丝,然后将样品置于冰盐浴中,以0.5 °C·min-1的速率缓慢升温,观察到溶液由浑浊突然变为澄清时,此时的温度记为Krafft温度(Tk)。样品平行测量三次,相对误差应低于0.5%。
2.4 表面张力的测量
表面活性剂水溶液的表面张力是在(25.0 ± 0.1) °C下,利用滴体积法得到。毛细玻璃管的外径为0.58 mm。滴体积法测定的表面张力通常是指平衡时的稳态表面张力,达到稳态平衡必须经过一定的老化时间,直至悬挂液滴的体积不再变化。对于BSeUSB-Ox表面张力的测量,是先用H2O2氧化一个高浓度的BSeUSB水溶液,然后定容,通过稀释得到一系列浓度的BSeUSB-Ox水溶液。
2.5 界面张力的测量
表面活性剂水溶液与正庚烷的油水界面张力,通过旋转滴界面张力仪(SVT20N,德国Dataphysics公司)在(25.0 ± 0.1) °C下测量所得。
2.6 起泡性的测定
用于测定泡沫氧化-还原可逆响应性的表面活性剂水溶液浓度均为5.00 mmol·L-1。BSeUSB溶液的起泡性和泡沫的稳定性通过30 s的手动震荡并拍照记录进行测定。通过向4 mL 5.00 mmol·L-1BSeUSB水溶液中加入等摩尔H2O2(相当于体系总质量的0.056%)氧化12 h,可制得5.00 mmol·L-1BSeUSB-Ox水溶液。再继续加入等摩尔Na2SO3(相当于体系总质量的0.060%)并还原3 min即可制得BSeUSB-Re的水溶液。
2.7 乳化性的测定
用于测定乳液氧化-还原可逆响应性的表面活性剂水溶液浓度均为5.00 mmol·L-1。表面活性剂的乳化性能及乳液的稳定性通过涡旋振荡(JHX3H,北京京辉凯业科技有限公司)30 s并拍照记录进行测定。将5.00 mmol·L-1BSeUSB水溶液和正庚烷以1 : 1的体积比混合,涡旋振荡30 s后制得8 mL初乳液。继续加入等摩尔H2O2(相当于体系总质量的0.028%)并氧化48 h即可制得BSeUSB-Ox/正庚烷乳液。之后再加入等摩尔Na2SO3(相当于体系总质量的0.030%)并还原3min可得BSeUSB-Re/正庚烷乳液。
3 结果与讨论
3.11H NMR和ESI-MS表征
表面活性剂的宏观性能(起泡或消泡,乳化或破乳)和微观性能(界面吸附,界面张力等)通常是由表面活性剂在溶液中的分子结构决定。在先前的研究中我们发现,含硒表面活性剂在加入一定量的H2O2氧化后,其分子结构中的疏水性硒醚(Se―C)会被氧化成具有一定亲水能力的硒亚砜(Se=O)20-22。通过1H NMR对比(图1)发现,相比最初的BSeUSB氢谱,氧化后有三处氢信号出现了明显偏移,分别是Ph―CH2―Se― (a)、Ph―CH2―Se― (b)和Ph―CH2―Se―CH2(c)。其中Ph―CH2―Se― (a)的信号在氧化后明显地向低场偏移,且苯环中的五个氢质子信号的分布规律从4 : 1变成3 : 2,这预示着苯环从一个低极性环境迁移到了一个相对极性较强的环境中3,23,24;Ph―CH2―Se― (b)的信号在氧化后也明显的向低场偏移,且分裂成两组对称的峰。这通常被视作Se原子氧化成Se=O的证据20-22。Se=O的形成为疏水尾链提供了氢键作用位点,使得疏水尾链的极性增强。这与苯环上氢质子信号发生的变化是相吻合的。加入Na2SO3还原后,所有的氢信号又回到原先的位置,这意味着BSeUSB中的硒可以在Se―C和Se=O之间可逆转换,即BSeUSB可以随着H2O2和Na2SO3的交替加入在还原态(BSeUSB)和氧化态(BSeUSB-Ox)间可逆转变(图1)。
进一步通过质谱表征可以发现,还原态时BSeUSB的分子离子峰为492.1 (MH+为492.1,MNa+为514.1,图2(A))。加入等摩尔H2O2氧化6 h后,绝大多数分子离子峰迁移至508.3 (MH+,图2(B)),比还原态的质荷比恰好多了16,而这正是一个氧原子的相对质量,证明硒醚被氧化成了硒亚砜,但仍然有一小部分BSeUSB没有被氧化。氧化12 h后,谱图中仅有硒亚砜一组分子离子峰508.3 (MH+,图2(C)),说明硒醚已全部氧化成硒亚砜。继续延长氧化时间,质谱中并无新的分子离子峰出现(图2(D)),即延长氧化时间并不会导致氧化产物的增多或改变。另一方面,将H2O2的用量增大至2倍或5倍氧化12 h后,质谱图中依然仅有硒亚砜一组分子离子峰508.3 (MH+,图2(E, F)),表明BSeUSB分子中的硒仅可以被氧化成硒亚砜,而不会出现硒砜。

图2 不同氧化条件(氧化时间和H2O2用量)下所得氧化产物的质谱Fig.2 ESI-MS spectra of the oxidized products of BSeUSB under different conditions including time and the dosage of H2O2
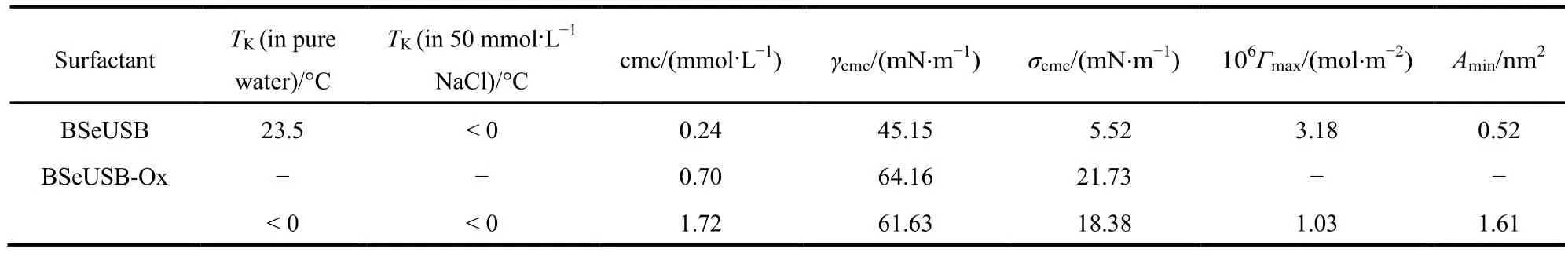
表1 25 °C下含硒磺基甜菜碱表面活性剂的表/界面性质Table 1 Values of physicochemical properties parameters of Se-containing surfactant solution at 25 °C
3.2 Krafft温度(TK)
TK温度是表征表面活性剂溶解性质的一个重要参数。在磺基甜菜碱应用过程中,其高的TK温度往往是一个不可回避的问题。通过目视法测得BSeUSB在纯水中的TK为(23.5 ± 0.5) °C (表1),这导致其在气温较低时经常从溶液中结晶析出,影响实际应用;而氧化态BSeUSB-Ox在纯水中的TK小于0 °C (表1),说明疏水的硒醚被氧化成硒亚砜后,分子的亲水性增强。
由于BSeUSB的TK接近于常温25 °C,使得在25 °C下测量的表/界面张力和起泡性与乳化性可能会出现较大误差。在溶液中加入适量的NaCl后,BSeUSB与BSeUSB-Ox的TK点均可降至0 °C以下。这是因为磺基甜菜碱表面活性剂的高TK通常与其亲水基形成电中性的内盐结构是密不可分,无机盐的加入可以有效破坏这种内盐结构,从而降低TK。本文中表面活性剂水溶液如果没有明确说明均是指50 mmol·L-1的NaCl水溶液。
3.3 表/界面张力
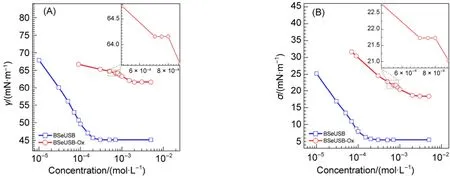
图3 BSeUSB和BSeUSB-Ox溶液的(A)表面张力和(B)正庚烷与溶液的油水界面张力随浓度变化的曲线Fig.3 Surface/interfacial tension of BSeUSB and BSeUSB-Ox solution plotted versus the surfactant concentrations of (A) surface tension and (B) interfacial tension between n-heptane and solution
图3 (A)为BSeUSB和BSeUSB-Ox水溶液的表面张力随浓度变化曲线,随着表面活性剂浓度增加,溶液的表面张力快速下降,在某一浓度之后趋向于平衡,意味着表面活性剂在界面吸附达到饱和,溶液的表面张力达到最低,此浓度即为临界胶束浓度(cmc)。
仔细对比还原态(BSeUSB)和氧化态(BSeUSB-Ox)的表面张力曲线可以发现,在低浓度下BSeUSB溶液的表面张力快速下降,超过0.24 mmol·L-1(cmc)后表面张力几乎不再发生变化,维持在45.15 mN·m-1,表现出一种典型的表面张力—浓度曲线行为。然而对于BSeUSB-Ox溶液,表面张力在低浓度下缓慢下降;当浓度达到0.69 mmol·L-1后,溶液表面张力曲线出现了一个较小的平台,保持为64.16 mN·m-1,记为第一个cmc值;浓度超过0.81 mmol·L-1之后又重新开始下降,直到浓度达到1.72 mmol·L-1,表面张力几乎不再变化,保持在61.63 mN·m-1,记为第二个cmc值。这种双拐点现象通常被认为是Bola型表面活性剂的典型特征25。
Bola型表面活性剂指的是一条疏水链两端连接各连接一个亲水头基的一类表面活性剂。我们猜想出现两个平台的原因是BSeUSB分子中疏水的硒醚被氧化为了亲水性的硒亚砜,从而使其表现出类似Bola型表面活性剂的行为。通过分析表面活性剂在表面的吸附以及每个分子占据的表面面积可以证实这一猜想。表面活性剂的表面吸附量(Г)和表面张力曲线的斜率有关,可通过Gibbs吸附公式26得出:

γ为溶液的表面张力,R为气体常数,T表示绝对温度。表面活性剂的饱和吸附量Гm可以通过szyszkowski公式27得到:
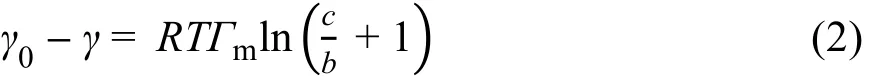
其中γ0表示纯水的表面张力,b为常数。每个分子占据的最小截面积可以从饱和吸附量计算得到:

其中NA为阿伏伽德罗常数。
如表1所示,通过以上公式得出BSeUSB的Гm和Amin分别为3.18 × 10-6mol·m-2和0.52 nm2,而BSeUSB-Ox的Гm和Amin则分别为1.03 × 10-6mol·m-2和1.61 nm2。也就是BSeUSB-Ox在气/液界面上的吸附量只有BSeUSB在气/液界面上吸附量的1/3左右,故单个BSeUSB-Ox分子在气/液界面上所占据的最小截面积达到了单个BSeUSB分子的3倍。这说明还原态(BSeUSB)和氧化态(BSeUSB-Ox)在气/液界面上的排列方式是截然不同的。还原态时,BSeUSB是一种典型的单头单尾型表面活性剂。当其在气/液界面上吸附饱和时,最佳的排列方式为亲水头基伸向水,疏水尾链伸向空气的垂直排列,此时每个分子所占据的截面积最小。氧化态时,BSeUSB-Ox分子中除了原先的亲水基团之外,疏水尾端的硒亚砜键可作为另一个亲水基团。因此,当BSeUSB-Ox在气/液界面上吸附饱和时,不仅磺基甜菜碱基团会伸向水里,疏水尾端的硒亚砜基团由于氢键作用也会努力伸向水中,而苄基和碳氢链则会逃离水环境,从而导致中间的疏水碳链发生向空气一侧的弯曲,形成一种类似“U”型的排列,而这正是Bola型表面活性剂在气/液界面上吸附时经常采用的构型25。所以,相对于BSeUSB,每个BSeUSB-Ox分子在气/液界面上所占据的最小截面积显著增大。
此外,从图3(A)可以看出,BSeUSB-Ox降低水溶液表面张力的最大幅度仅为BSeUSB的1/3左右,且表面张力随浓度的下降极为缓慢。在浓度均高于cmc时,BSeUSB可使其水溶液达到更低的表面张力。如5.00 mmol·L-1BSeUSB水溶液的表面张力为45.15 mN·m-1,而相同浓度下BSeUSB-Ox水溶液的表面张力为61.63 mN·m-1,升高了16.48 mN·m-1。如此之高的平衡表面张力使得BSeUSB-Ox更像一种活性物质而非传统意义上的表面活性剂,并且导致在形成单位界面积时,BSeUSB-Ox体系比BSeUCB体系需要更多的能量输入。换言之,在相同能量输入的情况下,BSeUSB-Ox形成的界面更小。氧化后BSeUSB-Ox的cmc为1.72 mmol·L-1,相当于氧化前的7倍多,这也从另一个方面说明氧化后分子的亲水性增强了。
图3(B)为BSeUSB和BSeUSB-Ox水溶液与正庚烷之间的油水界面张力曲线。由图可知随着浓度的增大,油/水界面张力先是快速下降;达到某一临界浓度后,油/水界面张力趋于平衡不再变化。无论是BSeUSB还是BSeUSB-Ox,油/水界面张力曲线的转折点与表面张力曲线上的转折点几乎完全吻合。在浓度分别达到各自的cmc后,它们与正庚烷的油/水界面张力均趋于平衡,分别维持在5.52 mN·m-1(BSeUSB)和18.38 mN·m-1(BSeUSB-Ox)。BSeUSB-Ox更高的平衡油/水界面张力意味着在制备相同的油/水界面积时氧化态需要更高的能量输入。此外,氧化态时油/水界面张力曲线像表面张力曲线一样,在cmc前(0.7 mmol·L-1)也出现了一个小的平台。这也再次印证了Bola型结构的存在。
更为有趣的是,当向BSeUSB-Ox溶液中添加等摩尔的还原剂Na2SO3后,溶液的表/界面张力又可以精准的恢复到初始大小,并不会像含硒羧基甜菜碱表面活性剂因为氧化-还原反应产生的无机盐Na2SO4而发生小幅下降28,即含硒磺基甜菜碱表面活性剂水溶液的表/界面张力不受无机盐的影响,这也正是磺基甜菜碱的优异特性之一。即使循环添加H2O2和Na2SO3,使表面活性剂在还原态和氧化态间可逆改变10个循环,溶液的表/界面张力依然可以准确返回相应的初始值附近(图4),说明溶液的表/界面活性可以随着氧化剂H2O2和还原剂Na2SO3的反复加入在“低”和“高”间可逆循环而不用担心无机盐的影响。
3.4 发泡性与乳化性能
泡沫和乳液均具有较大的界面面积和较高的界面能,因而都是热力学不稳定体系。表面活性剂可以在界面形成吸附膜,通过降低界面张力和产生静电作用或空间阻力来稳定泡沫和乳液29。因而,可以通过测定表面活性剂溶液起泡沫和乳化性的变化进一步验证氧化态与还原态之间表/界面张力的改变。
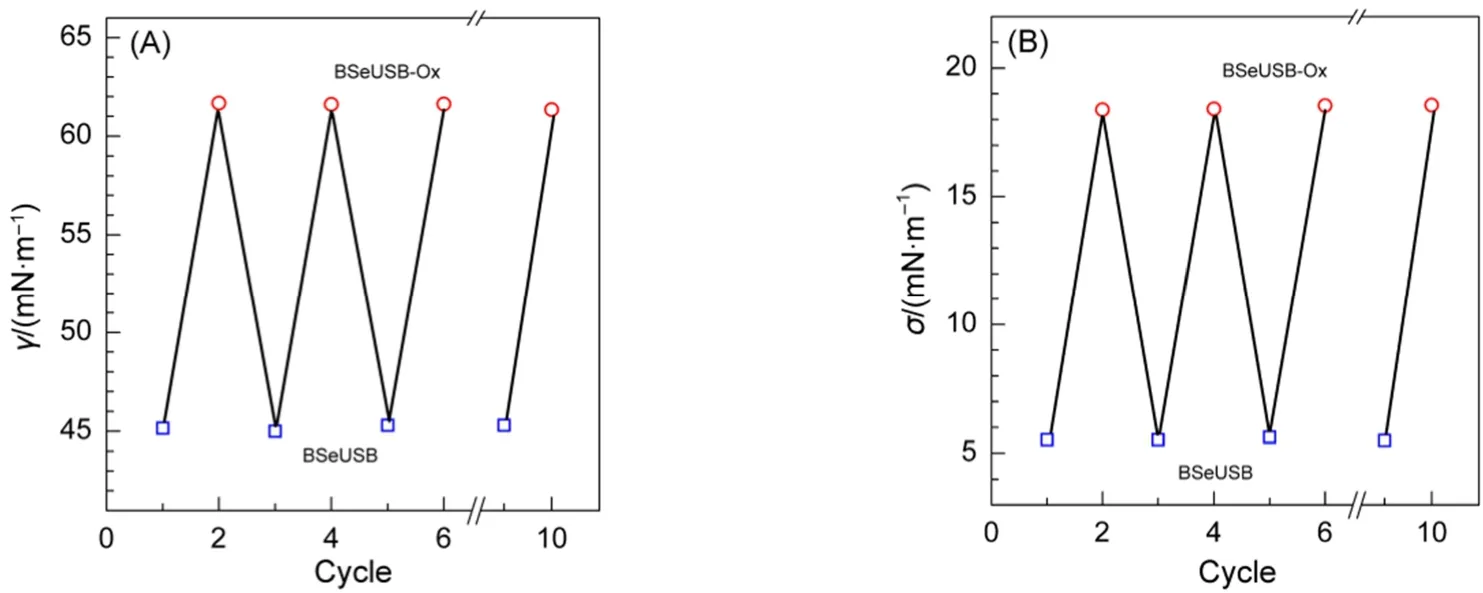
图4 交替加入H2O2(关)和Na2SO3(开)后表面张力(A)与界面张力(B)的变化Fig.4 Variation of surface tension (A) and interfacial tension (B) with alternately addition of H2O2(filled) and Na2SO3(open)
图5展示了25 °C下5.00 mmol·L-1BSeUSB水溶液的泡沫性能的变化。经过手摇振荡30 s后,BSeUSB溶液即可产生丰富而细腻泡沫,体积约8.5 mL (图5(A)),说明还原态(BSeUSB)具有优良的发泡性能。然而,加入等摩尔H2O2(相当于体系总质量的0.056%)氧化12 h后,再次手摇振荡30 s,仅能产生一种“瞬时”泡沫(图5(B)),且只能维持短短5 s。这充分体现了氧化态BSeUSB-Ox高的平衡表面张力所导致的高界面自由能及随之而来的泡沫不稳定性;同时也反映了BSeUSB-Ox在气/液界面上以弯曲构型排列形成的吸附膜是较为松散的。此时,如果向溶液中加入等摩尔Na2SO3(相当于体系总质量的0.060%),3 min后,发泡性能即可得到恢复(图5(C))。继续交替加入H2O2和Na2SO3(图5(D, E)),又能实现发泡性能的“关”与“开”。简言之,BSeUSB溶液的发泡性能可以通过H2O2和Na2SO3的氧化-还原反应实现可逆调控。除Na2SO3外,加入等摩尔量GSH或VC也能使BSeUSB-Ox恢复起泡性(图5(F, G))。

图5 25 °C时BSeUSB的溶液(5.00 mmol·L-1)通过手摇振荡30 s后立即拍照的泡沫图Fig.5 Photographs of foams based on 5.00 mmol·L-1BSeUSB solution that were taken right now after shaken by hand for 30 s at 25 °C

图6 BSeUSB溶液(5.00 mmol·L-1)与正庚烷经涡流震荡制备的乳液照片Fig.6 Photographs of n-heptane-in-water emulsions stabilized by 5.00 mmol·L-1BSeUSB alone
泡沫的氧化-还原响应性意味着溶液气/液界面性能的可逆变化,而液/液界面性能的氧化-还原响应行为可以通过乳化性能的变化体现。如图6所示,以正庚烷为油相,5.00 mmol·L-1BSeUSB溶液为水相,等体积混合后经涡流震荡30 s即可制得乳液(图6(A)),通过目视分散法确定该乳液为O/W型。由于乳液的热力学不稳定性,随着时间的延长,下层不断有水析出,且析水速度逐渐放缓,但最终体系将完成油水分层,即破乳。然而,单一BSeUSB稳定的乳液在静置10 min后,乳液体积依然高达80% (图6(B));甚至静置一周后乳液体积依然可以达到50%以上。向新鲜制备的乳液中加入等摩尔H2O2(相当于体系总质量的0.028%), 静置48 h后乳液彻底破乳。此时,再次涡旋震荡30 s,仅仅可以获得一种“瞬时”乳液,不到10 s就完成了破乳(图6(C))。如果继续添加等摩尔Na2SO3(相当于体系总质量的0.030%),3 min后再次涡流震荡30 s,相对稳定的乳液再次重现(图6(D))。若用等摩尔量VC或GSH代替Na2SO3,同样只需要短短几分钟,就可重新赋予溶液强的乳化能力(图6(E, F))。
通过上述实验不难发现,随着氧化剂和还原剂的交替加入,表面活性剂在氧化态(BSeUSB-Ox)和还原态(BSeUSB)间的可逆转变,溶液的气/液(泡沫)和液/液(乳液)界面性能随之发生了显著改变。这主要归因于以下两个原因。首先,BSeUSB和BSeUSB-Ox降低气/液和液/液界面张力的能力不同,当将气体分散到液相中,或者将油分散到水中形成大量微小气泡或液滴时,高的表/界面张力意味着更高的能量输入29,也就意味着更差的稳定性。其次,根据相似相容原理两亲分子在界面上通常采取亲水头伸向水相,疏水尾链伸向气相或油相的方式排列。BSeUSB是一种典型的单头单尾型结构,当其在界面上吸附饱和时分子之间排列较为紧密,所形成的吸附膜更加牢固,故泡沫或乳液的稳定性相对较好。然而,BSeUSB-Ox分子中由于疏水端硒亚砜键的存在,导致其亲水性显著增强,表现出类Bola型表面活性剂的特征,其在界面上吸附时更多的采取一种近似“U”型构型排列,分子之间的排列较为松散,所形成的吸附膜非常不牢固30,故泡沫或乳液的稳定性极差。
4 结 论
通过苄基硒十一烷基丙基磺基甜菜碱表面活性剂的1H NMR、ESI-MS、表面张力和界面张力在H2O2添加前后的变化对比,明确了由于硒原子的氧化-还原响应特性,使得含硒表面活性剂可在单头单尾(还原态)与Bola型(氧化态)结构间的转变。这种分子结构的转变不仅导致了表面活性剂Krafft温度的变化,而且使得表面活性剂溶液的表/界面活性可在“高”与“低”间开关,进而可将其用于泡沫、乳液等分散体系的调控。这一研究将为新型氧化-还原响应型表面活性剂的发展和界面性能的智能调控奠定一定的基础。
(1) Liu, Y. X.; Jessop, P. G.; Cunningham, M.; Eckert, C. A.; Liotta, C. L. Science 2006, 313, 958. doi: 10.1126/science.1128142
(2) Zhang, Y.; Zhang, Y.; Wang, C.; Liu, X.; Fang, Y.; Feng, Y. Green Chem. 2016, 18 (2), 392. doi: 10.1039/C5GC01411E
(3) Zhang, Y.; Kong, W.; An, P.; He, S.; Liu, X. Langmuir 2016, 32 (10), 2311. doi: 10.1021/acs.langmuir.5b04459
(4) Wu, J.; Xu, Y.; Dabros. T.; Hamza, H. Energy Fuels 2003, 17 (6), 1554. doi: 10.1021/ef030113e
(5) Feng, X.; Mussone, P.; Gao, S.; Wang, S.; Wu, S.Y.; Masliyah, J. H.; Xu, Z. Langmuir 2010, 26 (5), 3050. doi: 10.1021/la9029563
(6) Lin, C.; He, G.; Dong, C.; Liu, H.; Xiao, G.; Liu, Y. Langmuir 2008, 24 (10), 5291. doi: 10.1021/la704079s
(7) Krebs, T.; Schroën, C. G. P. H.; Boom, R. M. Chem. Eng. Sci. 2012, 71, 118. doi: 10.1016/j.ces.2011.10.057
(8) Zhang, Y.; Han, Y.; Chu, Z.; He, S.; Zhang, J.; Feng, Y. J. Colloid Interface Sci. 2013, 394, 319. doi: 10.1016/j.jcis.2012.11.032
(9) Takahashi, Y.; Koizumi, N.; Kondo, Y. Langmuir 2016, 32 (3), 683. doi: 10.1021/acs.langmuir.5b03912
(10) Brown, P.; Butts, C. P.; Cheng, J.; Eastoe, J.; Russell, C. A.; Smith, G. N. Soft Matter 2012, 8 (29), 7545. doi: 10.1039/C2SM26077H
(11) Zhang, Y.; Feng, Y.; Wang, J.; He, S.; Guo, Z.; Chu, Z.; Dreiss, C. A. Chem. Commun. 2013, 49 (43), 4902. doi: 10.1039/C3CC41059E
(12) Tsuchiya, K.; Orihara, Y.; Kondo, Y.; Yoshino, N.; Ohkubo, T.; Sakai, H.; Abe, M. J. Am. Chem. Soc. 2004, 126 (39), 12282. doi: 10.1021/ja0467162
(13) Fan, H.; Han, F.; Liu, Z.; Qin, L.; Li, Z.; Liang, D.; Ke, F.; Huang, J.; Fu, H. J. Colloid Interface Sci. 2008, 321 (1), 227. doi: 10.1016/j.jcis.2008.01.039
(14) Xu, H. B. Biological Trace Elements-Selenium; Huazhong Institute of Technology Press: Wuhan, 1984; p 104. [徐辉碧. 生物微量元素—硒. 华中工学院出版社: 武汉, 1984: 104.]
(15) Combs, G. F., Jr. West. J. Med. 1990, 153 (2), 192.
(16) Ip, C.; Hayes, C.; Budnick, R. M.; Ganther, H. E. Cancer Res. 1991, 51 (2), 595.
(17) Zhang, Y.; Yang, C.; Guo, S.; Chen, H.; Liu, X. Chem. Commun. 2016, 52 (86), 12717. doi: 10.1039/C6CC06699B
(18) Tan, X.; Yu, Y.; Liu, K.; Xu, H.; Liu, D.; Wang, Z.; Zhang, X. Langmuir 2012, 28 (25), 9601. doi: 10.1021/la301703t
(19) Wang, L.; Cao, W.; Yi, Y.; Xu, H. Langmuir 2014, 30 (19), 5628. doi: 10.1021/la501054z
(20) Xu, H.; Cao, W.; Zhang, X. Acc. Chem. Res. 2013, 46 (7), 1647. doi: 10.1021/ar4000339
(21) Wang, Y.; Xu, H.; Ma, N.; Wang, Z.; Zhang, X.; Liu, J.; Shen, J. Langmuir 2006, 22 (13), 5552. doi: 10.1021/la060711w
(22) Zhang, Y.; Kong, W.; Wang, C.; An, P.; Fang, Y.; Feng, Y.; Qin, Z.; Liu, X. Soft Matter 2015, 11 (38), 7469. doi: 10.1039/C5SM01515D
(23) Vermather, M.; Stiles, P.; Bachofer, S. J.; Simonis, U. Langmuir 2002, 18 (4), 1030. doi: 10.1021/la0109765
(24) Lin, Y.; Qiao, Y.; Yan, Y.; Huang, J. Soft Matter 2009, 5 (16), 3047. doi: 10.1039/B906960G
(25) Sköld, R. O.; Tunius, M. A. R. J. Colloid Interface Sci. 1992, 152 (1), 183. doi: 10.1016/0021-9797(92)90018-H
(26) Gallardo, B. S.; Hwa, M. J.; Abbott, N. L. Langmuir 1995, 11 (11), 4209. doi: 10.1021/la00011a008
(27) Szymanowski, J.; Szewczyk, H.; Hetper, J. Tenside Deterg. 1981, 18, 333.
(28) Kong, W.; Guo, S.; Wu, S.; Liu, X.; Zhang, Y. Langmuir 2016, 32 (38), 9846. doi: 10.1021/acs.langmuir.6b02616
(29) Brown, P.; Butts, C. P.; Eastoe, J. Soft Matter 2013, 9 (8), 2365. doi: 10.1039/C3SM27716J
(30) Rosen, M. J.; Kunjappu, J. T. Surfactants and Interfacial Phenomena, 4th ed.; John Wiley & Son: Hoboken, NJ, 2012.
Redox-Responsive Interfacial Properties of Se-Containing Sulfobetaine Surfactant
KONG Wei-Wei GUO Shuang ZHANG Yong-Min*LIU Xue-Feng*
(Key Laboratory of Food Colloids and Biotechnology, Ministry of Education, School of Chemical & Material Engineering, Jiangnan University, Wuxi 214122, Jiangsu Province, P. R. China)
The use of Se atom as the redox-responsive group has aroused considerable attention because of its good biocompatibility. However, only a few efforts have been devoted to Se-containing surfactants, especially for smart control of interfacial properties. This paper focuses on the redox-responsive behaviors, such as molecular structure, Krafft temperature, surface/interfacial tension, foaming, and emulsification of the Se-containing zwitterionic surfactant, 3-(11-benzylselanyl-undecyl)-dimethyl ammonium propane sulfonate (BSeUSB). After oxidization with a trace of H2O2(≤ 0.056% of total mass), the reduced form BSeUSB with one hydrophilic head and one hydrophobic tail-transformed to the Bola-type oxidized form BSeUSB-Ox due to the presence of a new hydrophilic group (selenoxide). Therefore, Krafft temperature decreased from (23.5 ± 0.5) °C to less than 0 °C. The surface/interfacial tension values at 5.00 mmol·L-1increased from 45.15, 5.52 mN·m-1to 61.63, 18.38 mN·m-1, respectively. Macroscopically, BSeUSB has good foaming and emulsification properties, while foaming aemulsification abilities of BSeUSB-Ox were almost non-existent. Interestingly, the initial molecular structure and the solution properties of BSeUSB were regained after reduction with a trace of Na2SO3(≤ 0.060% of total mass). Thus, by the addition of trace amounts of H2O2and Na2SO3alternately, we have achieved smart control of the interfacial properties of the surfactant.
Redox-responsive; Se-containing surfactant; Betaine; Interfacial property; Foam; Emulsion
December 27, 2016; Revised: February 22, 2017; Published online: February 22, 2017.
O648
10.3866/PKU.WHXB201702222
*Corresponding authors. ZHANG Yong-Min, Email: zhangym@jiangnan.edu.cn. LIU Xue-Feng, Email: xfliu@jiangnan.edu.cn.
The project was supported by the National Natural Science Foundation of China (21503094, 21673103), MOE & SAFEA for the 111 Project (B13025), Fundamental Research Funds for the Central Universities, China (JUSRP 51507), Natural Science Foundation of Jiangsu Province, China (BK20150128) and Qinglan Project of Jiangsu Province, China.
国家自然科学基金(21503094, 21673103),111引智计划“功能分子、聚集体及器件创制创新引智基地(B13025)”, 江苏省自然科学基金(BK20150128)及江苏省青蓝工程资助
© Editorial office of Acta Physico-Chimica Sinica
