累积光密度法研究山药淀粉的糖/水热糊化机制*
2017-06-21李倩高群玉
李倩 高群玉
(1. 华南理工大学 食品科学与工程学院, 广东 广州 510640;2. 广东省农业科学院 蚕业与农产品加工研究所, 广东 广州 510610)
累积光密度法研究山药淀粉的糖/水热糊化机制*
李倩1,2高群玉1†
(1. 华南理工大学 食品科学与工程学院, 广东 广州 510640;2. 广东省农业科学院 蚕业与农产品加工研究所, 广东 广州 510610)
采用数字图像分析方法——累积光密度(IOD)法,结合晶变响应峰模型(MRDCC)研究了山药淀粉的糊化特性,并应用X射线衍射法讨论淀粉的结晶结构,同时考察不同浓度/种类小分子糖对淀粉糊化过程的影响.结果表明:山药淀粉呈现C型结构,MRDCC显示双峰,分别对应B型和A型同质晶体的糊化;不同浓度蔗糖以及不同种类单糖、二糖、三糖和四糖对山药淀粉糊化过程的影响不同;糖类的糊化抑制作用与其动态水合数有很好的相关性,糖分子的赤道羟基个数越大,对淀粉的糊化抑制作用越强;除此之外,糖与水分子的结合能力还与糖分子的大小以及它们的三维结构有关.四糖的理想模型为通过氢键形成螺旋结构,削弱其水合能力,因此线性结构的棉籽糖比水苏糖的糊化抑制作用更强.
山药淀粉;糊化;糖;数字图像分析;累积光密度法
淀粉是植物中含量丰富的可再生资源,以储能性碳水化合物的形式存在于大部分绿色植物中,是一种不溶于冷水的颗粒.当其在水体系中加热时,淀粉晶型逐渐消失,结构被破坏,淀粉聚合链分散到溶液中.这个热处理过程所导致的淀粉颗粒破坏并从有序变为无序的相变过程称为糊化[1].淀粉相变过程会在一个很宽的温度范围内发生,且不同来源淀粉的相变过程有着极大差别.因此糊化性质成为淀粉的一个非常重要的理化特性.
国际上对淀粉晶型的研究一直是热点之一,相关的结构机理剖析也已日趋成熟并被广大学者所认可.按照双螺旋结构在淀粉颗粒中的排布密度不同,可将淀粉结晶结构区分为A型和B型,且A型结构密度大于B型[2].众多研究表明,A型和B型结构共存于淀粉的C型结构晶体中,因这两种结构在C型淀粉中的排布具有差异,必然会给这类淀粉带来独特的性质.
糖类通常对淀粉的糊化过程及其流变性质均有显著影响.糊化温度和糊化焓均会因糖的加入而发生改变,且糊化和老化的速度和程度也随之增加或减小[3- 6].为了探讨糖对淀粉糊化过程的影响机理,许多研究手段被应用在相关研究当中.例如,差示扫描量热仪(DSC)[6- 9]、流变仪[10]、光学显微镜[3, 5]、X射线衍射法[6, 9]、核磁共振仪[11]、快速黏度分析仪[12]等.这些方法通过不同的参数和角度来表征糖对淀粉糊化过程的影响.尽管糖对淀粉糊化过程影响的机理被众多学者所讨论,但至今并未形成统一并可解释所有测量结果的理论.
数字图像分析(IOD)法作为一种全新的测量方法,可以表征部分糊化的淀粉颗粒,同时它能有效避免因对淀粉样品进行预、后处理而产生的系统误差,并可在线监控淀粉糊化的真实过程.这一方法较传统基于偏光显微镜的其他测量方法,如数颗粒法、面积法具有突出优势[13].对糊化过程的监控更加敏感而准确,甚至可以监测预糊化阶段淀粉的微弱膨胀过程[14].
本实验结合热台偏光显微镜和数字图像分析方法,并引入积分光密度的新方法和晶变响应峰模型(MRDCC),研究了山药淀粉的结晶结构以及糖对山药淀粉糊化过程的影响.
1 材料与方法
1.1 材料与试剂
山药淀粉为实验室自提.怀山药块茎(1 000 g)经洗涤,去皮修剪,除掉缺陷部分.加1倍体积蒸馏水用九阳榨汁机高速搅拌2 min.用200目筛过滤,滤渣用蒸馏水洗涤两遍,滤液静置2 h.然后倾去上清液,加入新的蒸馏水重悬浮沉降的淀粉层,如此重复8次后用布什漏斗过滤回收淀粉颗粒,并在45 ℃下干燥24 h,收集得怀山药淀粉,测得水分含量为12.56%.
D-核糖、D-木糖和D-半乳糖(分析纯),美国Sigma 化学有限公司产品;D-果糖、D-葡萄糖和蔗糖(分析纯),上海博奥生物科技有限公司产品;海藻糖、棉籽糖和水苏糖(分析纯),上海源聚生物技术有限公司产品.
1.2 仪器与设备
EVO 18型扫描电子显微镜,德国Zeiss公司产品;D/Max2200VPC型X射线衍射仪,日本理学公司产品;Micro Publisher 3.3 RTV数码相机偏光显微镜,日本Olympus公司产品;DSC8000型差示扫描量热仪,美国PerkinElmer公司产品;THMSE600型热台,LINRAM公司产品.
1.3 实验方法
1.3.1 扫描电镜观察
将样品烘干至恒重,取少许固定于金属样品台上,真空条件下喷金后在扫描电子显微镜下观察,并拍摄淀粉颗粒形貌照片.
1.3.2 X射线衍射分析
用X射线衍射仪获得山药淀粉的X射线衍射图谱.将样品放在干燥器中平衡水分24 h以上,之后放入带有凹槽的玻璃板上,填满凹槽并压实,保证样品与整个玻璃板保持水平,放入X射线衍射仪中采用步进扫描法进行扫描.操作条件如下:起始角2θ=4°;终止角2θ=35°;步长为0.05°;扫描速度为5°/min;积分时间为2 s;靶型为Cu;管流为26 mA;管压为44 kV;发散和散射狭缝为1.0 mm,接收狭缝为 0.1 mm[15].
1.3.3 样品的制备
在25 ℃下用蒸馏水配置3%的淀粉乳,使得淀粉干基/水质量比为3∶97.配置质量分数为5%、10%、15%和20%的蔗糖溶液及15%的核糖、木糖、果糖、葡萄糖、麦芽糖、海藻糖、棉籽糖和水苏糖溶液.用以上所得溶液制备3%的淀粉-糖溶液(淀粉干基/水质量比为3∶97).取适量淀粉溶液或淀粉-糖溶液平衡10 min,用道康宁732玻璃胶密封于两片圆形玻璃片之中,使得淀粉颗粒在玻璃片内均匀分散且可布满整个视野.再放入热台显微镜中观察其热糊化过程,每个样品重复3次.
1.3.4 偏光图片的采集
本实验所用热台偏光显微镜配备有数码相机,可以真实在线记录淀粉偏光颗粒在糊化过程中的变化.设置与热台连接的温度控制仪,先以5 ℃/s 快速升温至50 ℃,然后以2 ℃/s缓慢升温,监测温度范围为50~98 ℃.每隔2 ℃记录一张数码照片,完全糊化后,即图像中淀粉偏光颗粒完全消失时停止记录.因此,根据每个样品糊化快慢不同,所收集的实验照片数也不尽相同.通过视频监视器连接照相机输出颗粒双十字的在线图像,图片保存为TIFF格式,分辨率为2 048×1 536像素,放大倍数为200[20].
1.3.5 数字图像的分析
IOD 法是一种新型测定淀粉糊化度(DG)的方法.用Image-pro plus 5.0 软件测定每张图片的IOD值[14].将拍摄的数字图片输入该软件,获得图片的IOD值.基于IOD法计算糊化度(DG1),公式为:
C=A-B
(1)
DGI=(1-C/C0)×100%
(2)
式中:A为原始IOD值,即糊化过程中每张数字图片计算得出的IOD值;B为背景IOD值,即当所有偏光十字颗粒消失糊化完全时图片的IOD值;C为不同温度点的真实IOD值;C0为初始真实IOD值(淀粉颗粒双折射光未发生任何改变),在本实验中,50 ℃时数字图片的IOD值设为初始IOD值.
1.3.6 晶变响应峰模型
晶变响应峰模型(MRDCC)是能表征淀粉糊化速度的新模型.模型曲线最高点所对应的温度定义为峰值温度Tp.同质结晶结构的糊化过程MRDCC在理想条件下应呈现正态分布.然而,因淀粉晶型的不同,其MRDCC往往呈现多峰曲线,反应了淀粉的多晶性和晶型的多样性[16].
晶变响应值(RDCC):表征在某一温度范围内糊化度的变化,即糊化速度,本实验中Δt为2℃.
绘制方法:某一温度点(如50,52,54,… ,98 ℃)的晶变响应值是该点的糊化度DGI减去前一温度点的糊化度.以温度为横坐标,RDCC为纵坐标,输入Curve Expert软件,选择张力样条函数将散点拟合,得到晶变响应峰模型.计算公式如下:
(3)
式中,Pt是某一温度点(t)的RDCC值,DGt是某一温度点的IOD法计算得出的糊化度.本实验中,在50~98 ℃的温度范围内,某一温度点的RDCC值,如70 ℃,是该温度下的糊化度减去前一温度点(68 ℃)的糊化度所得差值的一半.
1.3.7 统计学分析
每个样品平行试验3次,结果用EXCEL软件计算.MRDCC曲线由CurveExpertPro拟合得到,而其他曲线由OriginPro8绘制.
2 结果与分析
2.1 山药淀粉的颗粒形貌和结晶结构
怀山药淀粉的扫描电镜图片如图1所示,怀山药淀粉呈现圆饼型、椭球型或广椭球形.颗粒大小均一,表面光滑,未见明显的裂痕和破损.X射线衍射图谱(见图2)在5.7°、11.4°、15.1°、17.1°、22.5°和23.8°处显示6个特征峰,因此鉴定为C型结晶淀粉.


图1 怀山药淀粉的不同倍数扫描电镜图片
Fig.1SEMimagesofChineseyamstarchwithdifferentamplificationfactors
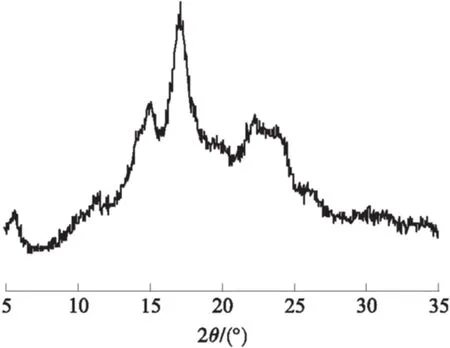
图2 怀山药淀粉的X射线衍射图谱
图3为山药淀粉在水中糊化的偏光图片.可以观察到,在64 ℃下,偏光图片十字光强对比原始颗粒照片(50 ℃),仍未有肉眼可见改变,处于预糊化阶段;在68 ℃下,图片中偏光强度以及颗粒十字区域面积明显减弱,处于部分糊化阶段;而在84 ℃下,偏光十字完全消失,淀粉颗粒处于完全糊化阶段.
2.2 不同浓度蔗糖对山药淀粉糊化过程的影响及机理探讨
图4为山药淀粉在不同浓度的蔗糖溶液中的糊化度-温度关系.定义糊化度(DGI值)到达10%时(即光密度损失10%)的温度设为起始温度ts;将DGI值到达95%时(即光密度损失了95%)的温度设为终止温度tc.随着蔗糖质量分数的增加(0~20%),ts和tc依次增加.随着蔗糖浓度的增加,山药淀粉的糊化曲线向右平移,并且同一温度点处山药淀粉的糊化度降低.表明增加蔗糖的浓度能有效地抑制淀粉的糊化. 举例说明如下: 与蔗糖的质量




图3 怀山药淀粉在水中糊化过程不同温度点的偏光照片
Fig.3 Polarized light micrographs of Chinese yam starch at different temperatures in a gelatinization process in water
分数0、5%、10%、15%、20%相对应的ts(糊化度为10%)分别为62.8、 63.9、66.5、68.6和69.8 ℃.当糊化度到达50%时,与不同蔗糖浓度相对应的温度分别为67.7、68.1、70.9、72.6和 73.1 ℃.蔗糖浓度越高,起始糊化温度越高,要求达到同样的糊化度所需要的温度也越高,意味着糊化更加困难.当温度达到68 ℃时,与蔗糖质量分数0、5%、10%、15%和20%对应的糊化度分别为56.1%、48.2%、39.9%、18.3%和11.2%.在相同的温度点下,糊化度随蔗糖浓度增加相继下降,所以可以得出淀粉糊化过程被蔗糖抑制的这一结论.
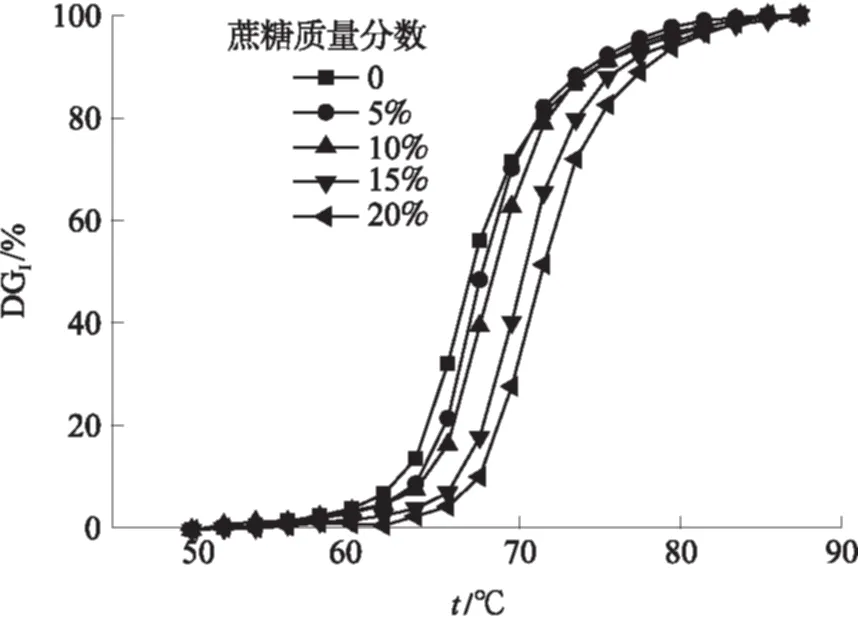
图4 不同蔗糖浓度下山药淀粉的温度-糊化度关系
Fig.4 Relationship between temperature and DGIof Chinese yam starch at different sucrose concentration
蔗糖能够延迟淀粉糊化的开始和结束,这一结果与Maaurf等[17]的研究结果相一致.这种糊化抑制作用的原因是小分子的蔗糖能够渗透在山药淀粉颗粒的内部,蔗糖分子所含的羟基会与山药淀粉颗粒相互作用,从而减缓淀粉颗粒的膨胀作用.除此之外,蔗糖的存在会减少水分的含量和水分活度,从而在一定程度上降低淀粉分子和水分子之间的相互作用,最终影响了淀粉糊化的进程[7].另有一些研究发现[8],小分子碳水化合物对水中带氢键结构的聚合链有稳定作用,因而能够延迟链的重新排序.
图5是山药淀粉在不同浓度的蔗糖溶液中的晶变响应峰.在纯水中,MRDCC图谱中并非显示单一峰曲线,而是在主峰右侧有一个很大的平台峰,显示了山药淀粉的多阶段糊化过程.与豌豆淀粉类似,图谱中的两个峰分别与C型结构山药淀粉中的B型和A型同质晶体的糊化相对应[14],且两个峰值温度点(tp1和tp2)分别对应B峰和A峰,tp1为67.5 ℃,tp2为79.9 ℃.与B-A结晶糊化临界温度点(72 ℃)相对应的DG1为80%,因此可以得出以下结论:B型同质晶体结构约占山药淀粉颗粒结构的80%.该结果与按照Davydova等[18]的方法所得结果略有差异(70%).A型结构仅占山药淀粉结构的大约20%,而且其糊化崩解过程受B型同质晶体糊化的影响,因此,很难将其糊化温度范围从整个糊化过程中单独出来加以讨论.由于蔗糖的加入,对A型和B型晶体的影响程度不同,最终表现为两种结构糊化的主峰相互靠拢.因此,表征A型结构糊化的平台峰并不明显,无法单独讨论.在0%、5%、10%、15%和20%的蔗糖溶液中,与C型山药淀粉中B型结晶结构糊化过程对应的tp1分别为67.5、68.2、 71.5、73.9和74.7 ℃.
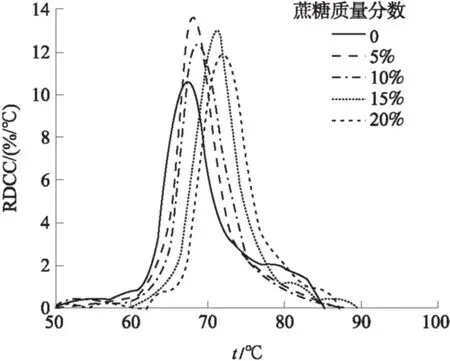
图5 山药淀粉在不同浓度蔗糖中加热糊化的MRDCC
Fig.5 The MRDCC of Chinese yam starch heated at different sucrose concentration
蔗糖的添加会改变水的结构和破坏水分子的稳定性.与水中相比,在蔗糖溶液里淀粉颗粒的膨胀和糊化需要更高的温度和更多的能量.山药淀粉在溶液体系的糊化过程中呈现类似拉链模型的有序结构,而蔗糖对这种结构有稳定作用.这一结果同样被蔗糖浓度对马铃薯和橡子淀粉的糊化影响所证实[6, 14].拉链模型环数随糖浓度的增加而增加,因形成拉链模型,可自由转动的淀粉链随之减少,也就是说流苏模型的自由淀粉链会减少[7].
2.3 不同单糖对山药淀粉糊化过程的影响及机理探讨
从图6可以看出,与纯水相比,加入的3种单糖都对山药淀粉糊化有抑制作用.且其抑制作用的大小关系为:半乳糖>葡萄糖>果糖>木糖=核糖.与水、核糖、木糖、果糖、葡萄糖和半乳糖相对应的ts分别为62.8、64.2、64.2、65.2、65.6和66.7 ℃.当糊化度达到50%时,与之相对应的温度分别是67.7、68.0、68.0、70.2、70.5 和71.4 ℃.从图7可知,与水、核糖、木糖、果糖、葡萄糖和半乳糖分别对应的tp1分别为67.5、68.4、68.4、69.7、71.2和71.3 ℃.葡萄糖和果糖等己糖远远比木糖和核糖等戊糖对山药淀粉糊化的抑制效果要强,这个结果和许多学者的研究结果相一致[19].众多学者的研究表明,葡萄糖在水中的结构为鳞石英结构[20],同时,糖分子上的赤道羟基可以有效地与水分子作用,增强水分子结构的稳定性[21].影响的效果与糖分子的动态水合数(nDHN)有关,葡萄糖结构nDHN=18.6;果糖中nDHN=16.5;而核糖中的nDHN=10.6[20, 22].nDHN是表示溶质的水合特性的重要物理量;且它与平均赤道羟基数n(e-OH)构成良好的线性关系.
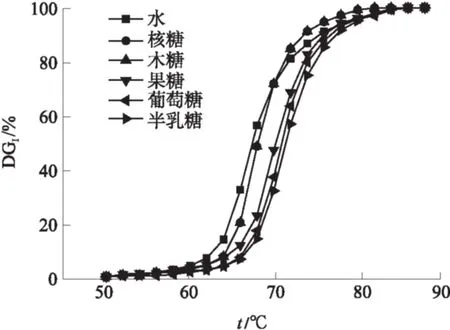
图6 山药淀粉在不同单糖溶液影响下的温度-糊化度关系
Fig.6 Relationship between temperature and DG1of Chinese yam starch under the effects of different monosaccharide
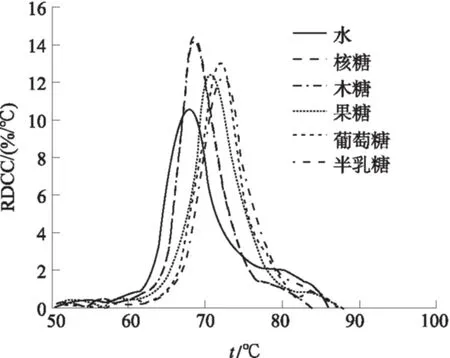
图7 山药淀粉在不同单糖溶液中的MRDCC
Fig.7 The MRDCC of Chinese yam starch heated with different monosaccharide
2.4 不同二糖对山药淀粉糊化过程的影响及机理探讨
图8示出了山药淀粉在不同的二糖溶液中的温度-糊化度关系.所有二糖都具有抑制山药淀粉糊化的作用.抑制作用的大小关系为:海藻糖 ≌ 蔗糖>麦芽糖.与水、蔗糖、麦芽糖、海藻糖对应的ts分别为62.8、66.5、63.5和66.5 ℃;当糊化度达到50%时,与之相应的温度分别是67.7、70.9、69.5和71.2 ℃.从图9可知与它们相对应的的糊化峰值温度tp1分别为67.5、71.5、70.0和71.3 ℃.麦芽糖对淀粉颗粒的保护作用比蔗糖和海藻糖要弱,这一结果与Katsuta等[19]的研究结果相反.在他们的研究结果中,麦芽糖是所有二糖中对淀粉糊化抑制作用最强的.本实验中,麦芽糖的nDHN值为27.1、蔗糖的nDHN值为25.2、海藻糖的nDHN值为25.4.抑制作用与nDHN不完全一致.该研究结果与Savage等[23]的研究结果相同,在淀粉-水-糖体系中,麦芽糖对淀粉热膨胀糊化过程的影响与单糖类似.原因在于,糖对淀粉-水体系中糊化过程的抑制作用大小,除了与糖分子结构赤道羟基个数有关外, 还与糖分子本身的大小以及它们的三维结构有关.糖分子体积越小就越容易与水分子结合.而麦芽糖的分子大小和三维结构相比蔗糖分子更大,与其他种类二糖的抑制作用相比,麦芽糖更接近单糖对淀粉的抑制效果.
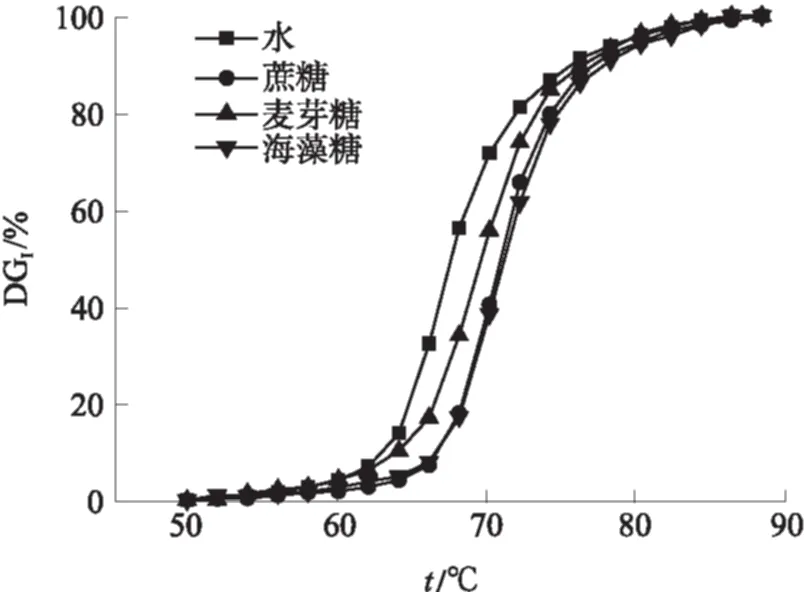
图8 山药淀粉在不同二糖溶液影响下的温度-糊化度关系
Fig.8 Relationship between temperature and DGIof Chinese yam starch under the effects of different disaccharides

图9 山药淀粉在不同二糖溶液中的MRDCC
Fig.9 The MRDCC of Chinese yam starch heated with different disaccharides
2.5 不同低聚糖对山药淀粉糊化过程的影响及机理探讨
图10示出了4种低聚糖在山药淀粉糊化过程的保护作用.当糊化度达到10%时,与水、葡萄糖、蔗糖、棉籽糖和水苏糖对应的ts分别是62.8、65.6、66.5、71.9和68.3 ℃;当糊化度达到50%时,与之对应的温度分别为67.7、70.5、70.9、76.4和73.7 ℃.由此可知,四糖和三糖相比起二糖能更有效地抑制山药淀粉的糊化,且二糖对于淀粉糊化的保护作用强于单糖.这一结果与Katsuta等[19,24]和Kohyama等[7]的研究结果相一致.
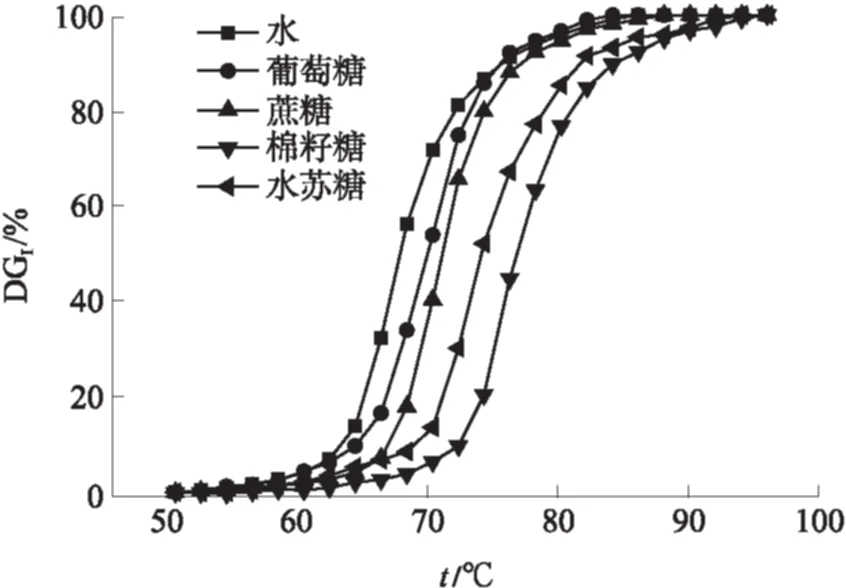
图10 山药淀粉在不同低聚糖溶液影响下的温度-糊化度关系
Fig.10 Relationship between temperature and DGIof Chinese yam starch under the effects of different oligosaccharides
从图11可以看出加入棉籽糖后的淀粉峰值糊化温度(tp1)(76.1 ℃)大于水苏糖的(73.8 ℃).在相同浓度下,棉籽糖对山药淀粉的糊化抑制作用大于水苏糖,这可以解释为:nDHN的增加对糊化抑制效果的增强作用小于分子大小/三维结构的增加对抑制效果的削弱作用.作为一种四糖,水苏糖对淀粉颗粒在糊化过程中的保护作用小于三糖(棉籽糖).这一结果也被Katsuta等[24]的研究结果所证实.他们在研究不同糖对淀粉糊化过程的影响时发现,麦芽四糖与麦芽三糖相比,具有特殊的构象,不利于水分子结构的稳定.当糖苷键的数量≥4时,这种糖类的理想结构是螺旋链的结构.通过氢键形成的螺旋结构削弱了具有更高聚合度(DP)低聚糖的水合能力,从而降低水分子的鳞石英镶嵌结构的构建.与水苏糖不同,棉籽糖是典型的线性结构低聚糖,对水分子结构具有很好的稳定性,因而能比蔗糖和葡萄糖更加有效地抑制山药淀粉的糊化.根据笔者的实验结果,水苏糖对淀粉糊化的抑制效果弱于棉籽糖.这意味着螺旋结构低聚糖对淀粉基质的稳定作用要小于线性结构的低聚糖.也就是说,在分析糖类对淀粉糊化的影响时,糖分子的聚合度是一个重要的影响因素.
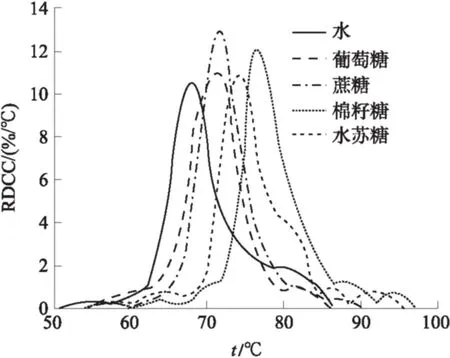
图11 山药淀粉在不同低聚糖溶液中的MRDCC
Fig.11 The MRDCC of Chinese yam starch heated with different oligosaccharides
3 结论
应用IOD法结合MRDCC研究山药淀粉的糊化特性.结果发现C型山药淀粉的MRDCC显示双峰曲线,分别对应了结晶结构中B型和A型同质晶体的糊化过程.本实验中所有小分子糖对山药淀粉的糊化过程均有抑制作用,但影响不同.随着蔗糖质量分数的增加(0~20%),山药淀粉的糊化温度也增加;三糖和四糖的淀粉糊化抑制作用比二糖更强,而二糖对淀粉结构的保护作用强于单糖.糖对淀粉糊化的抑制能力与nDHN值(动态水合数)有一定的线性关系.研究还发现一些二糖,例如麦芽糖的抑制糊化能力与单糖相似,糖与水分子的结合能力除了与nDHN值相关外也取决于糖分子的大小和它们的三维结构.由于通过氢键形成了螺旋结构,四糖对水分子结构的稳定作用有所削弱,水苏糖对淀粉糊化的抑制能力弱于棉籽糖.而其他线性低聚糖的抑制糊化作用为:三糖>二糖>单糖.
[1] JENKINS P J,DONALD A M. Gelatinisation of starch: a combined SAXS/WAXS/DSC and SANS study [J].Carbohydrate Research,1998,308(1/2):133- 147.
[2] WANG T T Y,HEDLEY C L.Starch:as simple as A,B,C? [J].Journal of Experimental Botany,1998,49(320):481- 502.
[3] GONERA A,CORNILLON P.Gelatinization of starch/gum/sugar systems studied by using DSC,NMR,and CSLM [J].Starch- Stärke,2002,54(11):508- 516.
[4] WOOTTON M,BAMUNUARACHCHI A.Application of differential scanning calorimetry to starch gelatinization.iii.effect of sucrose and sodium chloride [J].Starch- Stärke,1980,32(4):126- 129.
[5] RUMPOLD B A,KNORR D.Effect of salts and sugars on pressure-induced gelatinisation of wheat,tapioca,and potato starches [J].Starch-Stärke,2005,57(8):370- 377.
[6] HOOVER R,SENANAYAKE N.Effect of sugars on the thermal and retrogradation properties of oat starches [J].Journal of Food Biochemistry,1996,20(6):65- 83.
[7] KOHYAMA K,NISHINARI K.Effect of soluble sugars on gelatinization and retrogradation of sweet potato starch [J].Journal of Agricultural and Food Chemistry,1991,39(8):1406- 1410.
[8] PROKOPOWICH D J,BILIADERIS C G.A comparative study of the effect of sugars on the thermal and mechanical properties of concentrated waxy maize,wheat,potato and pea starch gels [J].Food Chemistry,1995,52(3):255- 262.
[9] PERRY P A,DONALD A M.The effect of sugars on the gelatinisation of starch [J].Carbohydrate Polymers,2002,49(2):155- 165.
[10] AHMED J.Rheometric non- isothermal gelatinization kinetics of mung bean starch slurry:effect of salt and sugar- part 1 [J].Journal of Food Engineering,2012,109(2):321- 328.
[11] LEACH H W,MCCOWEN L,SCHOCH T J.Structure of the starch granule.I.swelling and solubility patterns of various starches [J].Cereal Chemistry,1959,36:534- 544.
[12] TORLEY P J,VAN DER MOLEN F.Gelatinization of starch in mixed sugar systems [J].LWT- Food Science and Technology,2005,38(7):762- 771.
[13] 高群玉,谢钦.淀粉糊化过程的数字图像分析技术动态监测 [J].华南理工大学学报(自然科学版),2011,39(12):105- 109. GAO Qun- yu,Xie Qin.Dynamic monitoring of gelatiniztion process of starch based on digital image analysis technique [J].Journal of South China University of Technology(Natural Science Edition),2011,39(12):105- 109.
[14] LI Q,XIE Q,YU S,et al.New approach to study starch gelatinization applying a combination of hot- stage light microscopy and differential scanning calorimetry [J].Journal of Agricultural and Food Chemistry,2013,61(6):1212- 1218.
[15] SHI M,YUN C,YU S,et al.Preparation and properties of RS III from waxy maize starch with pullulanase [J].Food Hydrocolloids,2013,33(1):19- 25.
[16] LI Q,ZHANG L,YE Y,et al.Effect of salts on the gelatinization process of Chinese yam (Dioscoreaopposita) starch with digital image analysis method [J].Food Hydrocolloids,2015,51:468- 475.
[17] MAAURF A G,CHE MAN Y B,ASBI B A,et al.Gelatinisation of sago starch in the presence of sucrose and sodium chloride as assessed by differential scanning calorimetry [J].Carbohydrate Polymers,2001,45(4): 335- 345.
[18] DAVYDOVA N I,LEONT'EV S P,GENIN Y V,et al.Some physico- chemical properties of smooth pea starches [J].Carbohydrate Polymers,1995,27(2):109- 115.
[19] KATSUTA K,NISHIMURA A,MIURA M.Effects of saccharides on stabilities of rice starch gels.1.mono-and disaccharides [J].Food Hydrocolloids,1992,6(4):387- 398.
[20] UEDAIRA H,UEDAIRA H.Sugar-water interaction from diffusion measurements [J].Journal of Solution Chemistry,1985,14(1):27- 34.
[21] HYANG Aee L,NAM HIE K,NISHINARI K.DSC and rheological studies of the effects of sucrose on the gelatinization and retrogradation of acorn starch [J].Thermochimica Acta,1998,322(1):39- 46.
[22] UEDAIRA H,ISHIMURA M,TSUDA S,et al.Hydration of oligosaccharides [J].Bulletin of the Chemical Society of Japan,1990,63(12):3376- 3379.
[23] SAVAGE H L,OSMAN E M.Effects of certain sugars and sugar alcohols on the swelling of cornstarch granules [J].Cereal Chemistry,1978.
[24] KATSUTA K,NISHIMURA A,MIURA M.Effects of saccharides on stabilities of rice starch gels.2.oligosaccharides [J].Food Hydrocolloids,1992,6(4):399- 408.
Investigation into Sugar/Water Hot Gelatinization Mechanism of Chinese Yam Starch by Means of Integral Optical Density Method
LIQian1,2GAOQun-yu1
(1.School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,Guangdong,China;2.Sercultural & Agri-Food Research Institute,Guangdong Academy of Agricultural Sciences,Guangzhou 510610,Guangdong,China)
Firstly,an image analysis method,namely integral optical density (IOD) method,was combined with the model of response difference of crystallite change (MRDCC) to analyze the gelatinization property of Chinese yam starch.Then,XRD was adopted to discuss the crystalline structure of the starch.Finally,the effects of concentration and sugars variety on the gelatinization process were analyzed.The results demonstrate that (1) Chinese yam starch is in a C-type structure; (2) MRDCC shows double peaks that correspond to the gelatinization process of types B and A paramorph; (3) different sucrose concentrations as well as various monosaccharide,disaccharide,trisaccharide and tetrasccharide have different effects on the gelatinization process; (4) the inhibition effect due to sugar shows good correlation with dynamic hydration number,concretely,the more the equatorial hydroxyl number (e-(OH)) of sugar molecules,the stronger the inhibition effect; (5) sugar-water hydration effect is also related to the size and three-dimension structure of sugar molecules; and (6) a helical structure bonded through hydrogen bond is ideal for tetrasccharide because this structure weakens the hydratability,which means that the gelatinization inhibitiion effect of stachyose is smaller than that of raffinose.
Chinese yam starch; gelatinization; sugar; digital image analysis; integral optical density method
2016- 04- 22
国家自然科学基金重点项目(31230057);东莞市产学研合作项目(201450911106); Foundation item: Supported by the Key Program of National Natural Science Foundation of China(31230057)
李倩(1989-),女,博士,主要从事淀粉改性及碳水化合物功能材料研究. E-mail:liqian.hubei@163.com
†通信作者: 高群玉(1965-),女, 博士, 教授, 主要从事淀粉改性及碳水化合物功能材料研究. E-mail:qygao@scut.edu.cn
1000- 565X(2017)03- 0117- 08
TS 236
10.3969/j.issn.1000-565X.2017.03.017
