半夏叶柄愈伤组织诱导与分化最适培养基筛选
2017-06-19温琳惠国强杨海鹏宋红霞梁艺孙毅刘小红张红梅
温琳,惠国强,杨海鹏,宋红霞,梁艺,孙毅,刘小红,张红梅,4
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院玉米研究所,山西忻州034000;3.山西省农业科学院生物技术研究中心,山西太原030031;4.农业部黄土高原作物基因资源和种质创制重点实验室,山西太原030031;5.西华师范大学生命科学学院,四川南充637002)
半夏叶柄愈伤组织诱导与分化最适培养基筛选
温琳1,惠国强2,杨海鹏2,宋红霞1,梁艺2,孙毅3,4,刘小红5,张红梅2,4
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院玉米研究所,山西忻州034000;3.山西省农业科学院生物技术研究中心,山西太原030031;4.农业部黄土高原作物基因资源和种质创制重点实验室,山西太原030031;5.西华师范大学生命科学学院,四川南充637002)
以半夏(Pinellia ternata(Thunb.)Breit)叶柄为外植体,研究不同培养基配方对诱导脱分化、愈伤组织增殖及分化的影响。结果表明,适合半夏叶柄诱导脱分化的最佳培养基是MS+1.0 mg/L2,4-D+0.2 mg/L6-BA;最适愈伤组织增殖培养基是MS+1.0 mg/L2,4-D+0.2 mg/L6-BA;最适分化培养基是MS+0.5 mg/L 6-BA+0.2 mg/L NAA。
半夏;叶柄;组织培养;愈伤组织
半夏(Pinellia ternata(Thunb.)Breit),别名三叶半夏、三兴草,属天南星科,主要产于四川、云南、贵州、江南等地。半夏是多年生宿根小草本植物,块茎入药,具有燥湿化痰、和胃止呕,主治痰湿水饮、呕吐、咳喘等病症[1-2]。半夏已有2 000多年的用药历史,始载于《神农本草经》,其良好的应用价值备受国内外的关注,社会需求量较大[3]。但是近年来,由于土地开发、放牧、环境污染及野生资源过度采挖等原因,我国大部分地区的半夏栖息地遭到不同程度的破坏,导致野生半夏资源日益减少[4-8]。
半夏组培苗具有生长速度快、繁殖系数高、不带病毒等特点,所以,利用组织培养再生苗或者用于提取有效成分已成为半夏生产发展的趋势[9-12]。徐秀梅等[13]通过对半夏叶片和叶柄的诱导,得到半夏丛生芽诱导最适培养基为MS+2 mg/L 6-BA+0.1 mg/LNAA。万美亮等[14]采用叶片、叶柄得到一次成苗的最适培养基为MS+0.2 mg/L2,4-D+1 mg/L KT。夏海武等[15]在半夏出苗期、生长旺盛期、珠芽成熟期、倒苗期分别取叶片、叶柄、块茎接种,结果发现,材料的采集时间与再生愈伤组织的数量有密切的关系,出苗期和生长旺盛期材料分生能力较强,而珠芽成熟期和倒苗期材料分生能力逐渐减弱。半夏块茎的诱导率较高,最高可达94%,且块茎的诱导率与采集时间关系不大。
本试验选用半夏叶柄进行诱导脱分化、愈伤组织增殖和分化的最适培养基的研究,旨在为工厂化、规模化生产脱毒种苗奠定基础,提供技术支持[16-20]。
1 材料和方法
1.1 材料
供试材料选自陵川县栽培的半夏珠芽及种子。
1.2 方法
1.2.1 无菌苗的获得分别取半夏的珠芽、种子,先用流水洗去表面的灰尘及泥土等,再用洗涤剂漂洗。珠芽清洗干净后需要剥去外层皮,清水洗净,避免伤到生长点;种子剥去种皮,清水洗净,流水下冲洗30 min。珠芽和种子处理好后进行第1轮消毒,75%酒精处理30 s,无菌水冲洗3~4次,然后将珠芽、种子各分成4份,每份都用0.1%HgCl2进行第2轮消毒,消毒时间依次是4,8,10,12 min共4个处理,第2轮消毒处理后都经无菌水冲洗3~4次,转至未添加任何激素的MS培养基中,珠芽每瓶放置1个,每个处理接种50瓶,种子每瓶放置5个,每处理接种10瓶。接种后置于25℃,光强2 000 lx的培养室内进行无菌苗培养,30 d后统计珠芽和种子的染菌率和成活率。
1.2.2 半夏叶柄的脱分化以MS为基本培养基,分别添加不同浓度的2,4-D和6-BA,共9个处理组(表1)。切取长势良好的半夏无菌苗叶柄接种于9种培养基中,每瓶接种3个,每个处理接种10瓶,重复3次,接种后置于培养室内进行暗培养,培养温度25℃。培养30 d后观察统计半夏愈伤组织诱导率及生长情况。

表1 半夏愈伤组织诱导培养基不同激素配比mg/L
1.2.3 半夏愈伤组织增殖选取长势一致的半夏愈伤组织分别接种到以下3种培养基上,Ⅰ号:MS+1.0mg/L2,4-D+0.2mg/L6-BA;Ⅱ号:MS+1.5mg/L 6-BA+0.2 mg/L IAA;Ⅲ号:MS+0.5 mg/L 2,4-D+0.2 mg/LNAA;每个培养瓶接4块愈伤组织,每种培养基接20瓶。培养温度25℃,光照强度2 000 lx,30 d后观察统计愈伤组织生长情况。
1.2.4 半夏愈伤组织分化分化培养基为MS添加不同浓度的6-BA和NAA。6-BA和NAA浓度设计为9个处理,如表2所示。选取生长状态相同的增殖愈伤组织接种到分化培养基上,每瓶接种4块,每个处理接种10瓶,每个处理重复3次。接种后暗培养5 d,然后转入光培养,培养温度25℃,光照强度2 000 lx,光照为16 h/d。每10 d观察出苗数(叶柄高于5 mm为1苗)。
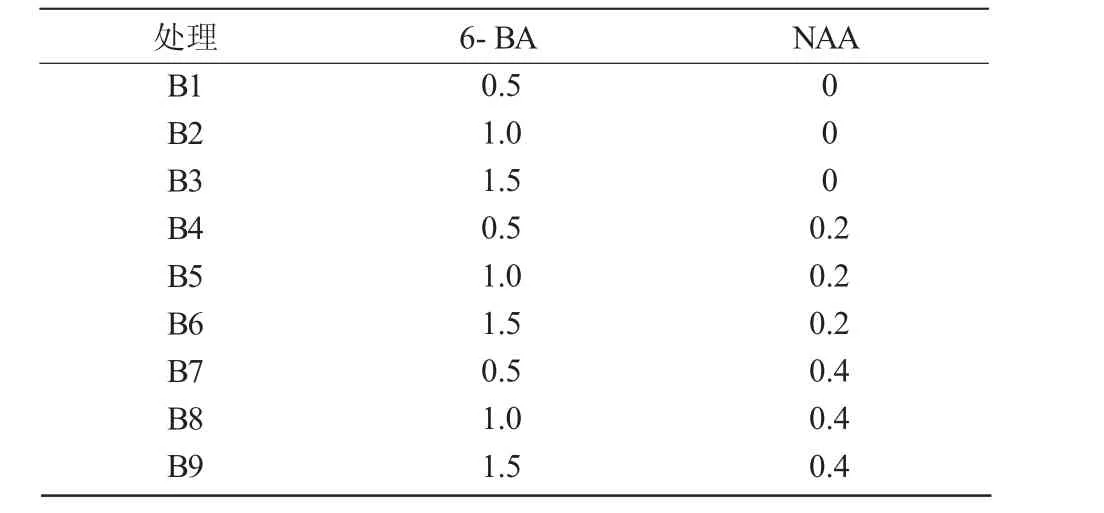
表2 半夏愈伤组织分化培养基不同激素配比mg/L
2 结果与分析
2.1 灭菌时间对珠芽和种子的影响
以半夏珠芽、种子获得无菌苗时,灭菌时间对灭菌效果和成活率的影响如图1所示。试验结果表明,用0.1%的升汞消毒,消毒时间越长灭菌效果越好,但外植体的成活率随之降低;种子消毒8 min就可获得理想的灭菌效果,污染率是0,而成活率可达81.8%,珠芽消毒时间达到10 min才可获得较理想的灭菌效果,污染率仅4.3%,而成活率可高达91.5%。试验结果表明,珠芽与种子相比,种子灭菌较为容易。珠芽灭菌困难主要由于其接触土壤,自身携带生物细菌、真菌或者霉菌较多,且珠芽外表皮质地略硬,较难清洁干净,因此,灭菌较困难。种子最外有佛焰苞包被,又具有易分离的种皮包裹,生存环境相对纯净,因此,灭菌较容易。
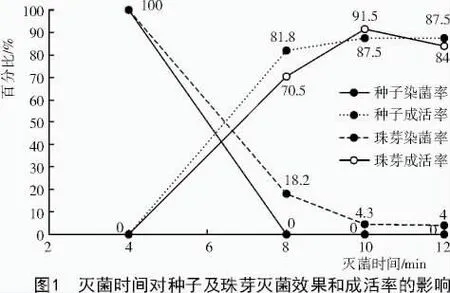
试验表明,用0.1%的升汞消毒,消毒时间8~12 min,种子的存活率差异较小,但珠芽随灭菌时间的延长,成活率呈下降趋势。这个现象可能是珠芽生长点的包被层较薄,生长点易遭到伤害使其无法生长。种子生长点包被的相对较厚,不易受到伤害。但珠芽得到的无菌苗比由种子获得的无菌苗健壮,表现为叶柄粗,叶子大,颜色深,根系粗且长,这可能与半夏珠芽本身含营养物质较多有关。
在自然环境中,半夏的发芽率只有20%左右,采用本试验的方法,可将发芽率提高到87.5%,这对于提高杂交选育半夏优良品种的效率是个突破。
2.2 半夏叶柄的脱分化
外植体叶柄接种到培养基上20 d时,叶柄两端上翘或弯曲,并且膨大,出现大量黄绿色疏松愈伤组织,随着时间延长,愈伤组织不断增大,此外还有白色疏松状的愈伤组织,质地疏松无器官分化,分散性好,但数量较少。表3显示,除T1外,其他培养基皆可诱导得到愈伤组织,其中,T5的愈伤诱导率最高。

表3 不同激素组合对半夏愈伤组织发生的影响
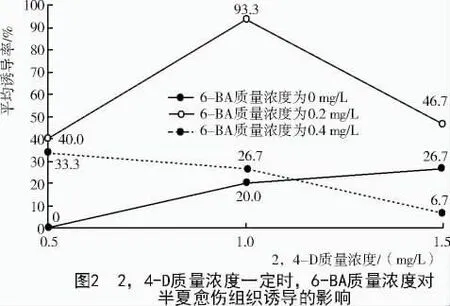
从图2可以看出,不添加6-BA时,愈伤组织诱导率随2,4-D质量浓度的增加而增大;6-BA质量浓度是0.4 mg/L时,愈伤组织诱导率随2,4-D质量浓度的增加而降低;6-BA质量浓度是0.2 mg/L时,3种2,4-D质量浓度的愈伤组织诱导率均较高,但以2,4-D质量浓度是1.0 mg/L时愈伤组织诱导率最高,为93.3%。所以,诱导愈伤组织的最佳培养基是MS+1.0 mg/L2,4-D+0.2 mg/L6-BA。
2.3 半夏愈伤组织的增殖
愈伤组织在3种培养基上的增殖情况如图3所示,Ⅰ号培养基上愈伤组织可大量增殖,无明显分化现象,适合做增殖培养基;Ⅱ号培养基上愈伤组织增殖很少,出现少量分化的苗;Ⅲ号培养基上愈伤组织分化明显,分化苗周围伴随颗粒状愈伤生长。因此,Ⅰ号培养基MS+1.0mg/L2,4-D+0.2mg/L 6-BA适合用作增殖培养基,Ⅱ号培养基适合用作1次成苗培养基,Ⅲ号培养基适合用作分化培养基。

2.4 半夏愈伤组织的分化
9种分化培养基均可分化出苗(表4、图4),但分化出苗数量和质量在不同培养基上有差异。由图4可知,培养基中不添加NAA时,6-BA对分化率的影响呈正效应,随6-BA质量浓度的增高分化率也增高。但加入NAA后,在NAA质量浓度一定的情况下,分化率随6-BA质量浓度的增高呈下降趋势。说明NAA和6-BA之间存在互作,根据表4,图4,5分析得出,分化最佳培养基为MS+0.5 mg/L 6-BA+0.2 mg/LNAA。
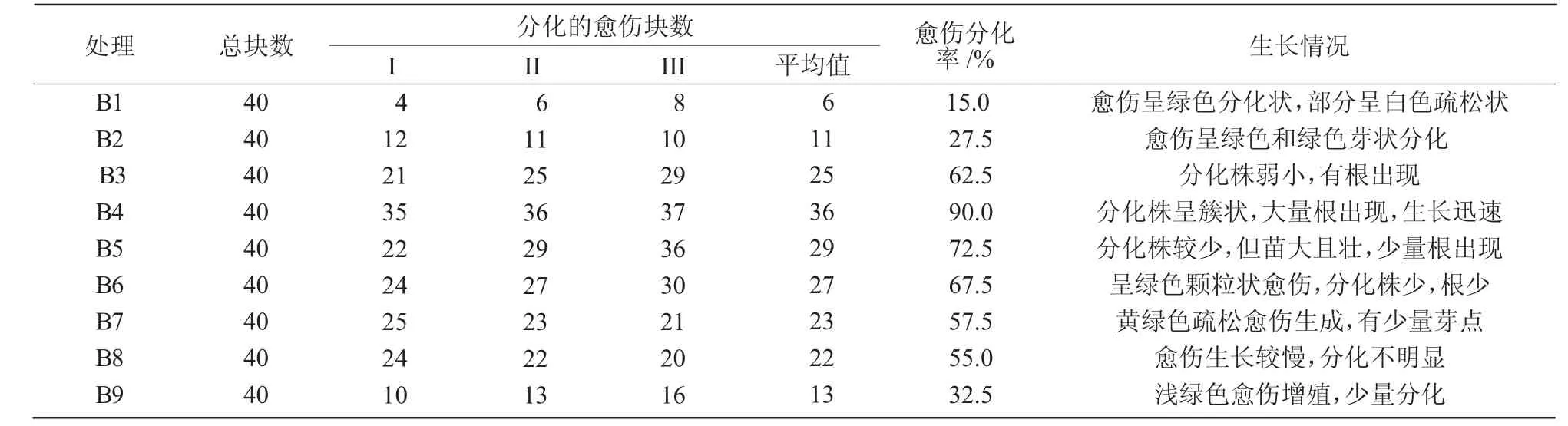
表4 不同激素组合对半夏愈伤组织分化的影响


3 讨论
半夏种子数量较多,活力较强,易于灭菌,因此,种子是培养基初步筛选的较好材料[4]。在影响半夏出芽的外界因素中,外植体的年龄对植株再生有重要影响,无菌苗苗龄低,接种过程中容易造成机械损伤,使伤口褐化,导致外植体死亡,出芽率下降;苗龄过高,易形成倒苗,叶片和叶柄老化甚至枯萎,不能用作外植体;生长旺盛期和珠芽成熟期的半夏材料,其外植体的分化率都较高[21]。将种子接种在MS培养基时,87.5%以上的种子可以萌发成幼苗,前人的研究结果在自然状态下半夏种子的发芽率只有20%,因此,本研究获得的结果为通过杂交选育半夏优良品种奠定了良好的基础。
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典(一部)[M].广州:广东科技出版社,1995:9.
[2]李玉先,刘晓东,朱照静.半夏药理作用的研究述要[J].辽宁中医学院学报,2004(6):459-460.
[3]曹瑞霞.半夏再生体系的建立及其次生代谢的调控[D].重庆:西南大学,2013.
[4]陈集双,贾明良.半夏生物资源与细胞工程[M].北京:科学出版社,2013:35.
[5]张利霞,孟彦斌.半夏无菌组织培养体系建立中存在的问题和解决方法[J].安徽农业科学,2015,43(17):82-83.
[6]ZHU Y F,MAO C N.Optimization of inducing conditions for loose callus of pinellia ternata[J].Agricultural Science&Technology,2011(8):1116-1117,1124.
[7]罗成科,彭正松.半夏疏松愈伤组织诱导的研究[J].西华师范大学学报(自然科学版),2005(1):37-39,43.
[8]殷红莲.半夏的组织培养和人工种子研究及其指纹图谱初探[D].重庆:重庆大学,2006.
[9]林秋月,曾万勇,李天佩,等.半夏愈伤组织诱导与分化最适培养基筛选[J].湖北农业科学,2014(13):3183-3186.
[10]杨凯,王荔,杨艳琼,等.不同激素浓度配比对半夏组培一次性成苗的影响[J].云南农业大学学报,2005(5):615-619.
[11]潘卫仓,刘菊英.半夏愈伤组织的诱导及植株的再生研究[J].北方园艺,2009(11):221-223.
[12]王艺霖,屈文国,李昆志.旱半夏组织培养技术的优化研究[J].江西农业学报,2012(3):26-29.
[13]徐秀梅,吕道锡,孙敏,等.半夏丛生芽诱导及快速繁殖[J].中药材,2005(12):1052-1053.
[14]万美亮,陈宏康,詹亚华,等.半夏组织培养与快速繁殖研究[J].中国中药杂志,1995(9):526-529,574.
[15]夏海武,赵月玲,战克勤,等.半夏组织培养研究[J].中国中药杂志,1994(12):720-721,761.
[16]武宗信,郝建平,王晓立,等.半夏快速繁殖研究[J].山西大学学报(自然科学版),2005(3):315-317.
[17]齐莉娜.半夏脱毒组培苗繁育和规范化栽培技术研究[D].杨凌:西北农林科技大学,2015.
[18]解晓红,李江辉,陈丽,等.半夏脱毒技术研究及应用[J].中药材,2011(7):1014-1017.
[19]江艳华.半夏规范化种植关键技术及组培快繁体系建立的研究[D].北京:北京协和医学院,2013.
[20]薛建平,朱艳芳,张爱民,等.半夏试管块茎直接再生技术的研究[J].作物学报,2004(10):1060-1064.
[21]和凤美,朱永平.半夏愈伤组织诱导和分化再生植株的研究[J].现代农业科技,2010(4):136-137,141.
Screening of Optimal Medium for Callus Inducing and Differentiation of Petiole ofPinellia ternata(Thunb.)Breit
WENLin1,HUI Guoqiang2,YANGHaipeng2,SONGHongxia1,LIANGYi2,SUNYi3,4,LIUXiaohong5,ZHANGHongmei2,4
(1.College ofBiological Engineering,Shanxi University,Taiyuan 030006,China;2.Institute ofMaize,Shanxi AcademyofAgricultural Sciences,Xinzhou 034000,China;3.Research Center ofBiotechnology,Shanxi Academyof Agricultural Sciences,Taiyuan 030031,China;4.KeyLaboratoryofCrop Gene Resources and GermplasmEnhancement on Loess Plateau,MinistyofAgriculture,Taiyuan 030031,China;5.College ofLife Science,China West Normal University,Nanchong637002,China)
Petioles of Pinellia ternata(Thunb.)Breit were used to investigate the effects of several mediums on the induced dedifferentiation ratio,callus proliferation ratioofpetioles of Pinellia ternata(Thunb.)Breit.The results showed that the optimal medium for petioles dedifferentiation,callus proliferation and differentiation were MS+1.0 mg/L 2,4-D+0.2 mg/L 6-BA,MS+1.0 mg/L 2, 4-D+0.2 mg/L6-BA,MS+0.5 mg/L6-BA+0.2 mg/LNAA.
Pinellia ternata(Thunb.)Breit;petiole;tissue culture;callus
S567.23+9
:A
:1002-2481(2017)06-0905-05
10.3969/j.issn.1002-2481.2017.06.11
2017-01-19
国家转基因生物新品种培育重大专项(2016ZX08003-001)
温琳(1992-),女,山西介休人,在读硕士,研究方向:作物遗传与育种。张红梅为通信作者。
