在线固相萃取—HPLC测定4种虫草类药材中虫草素和2′—脱氧腺苷
2017-06-19田野王传喜钱正明李周周妙霞孙万
田野+王传喜+钱正明+李周+周妙霞+孙万阳+姚新生+李文佳+高昊
[摘要] 该文建立一种同时测定4种虫草类药材(冬虫夏草、蛹虫草、虫草菌丝体和蝉花)中虫草素(3′-脱氧腺苷)和2′-脱氧腺苷含量的在线固相萃取-高效液相色谱分析方法。供试品经ZORBAX SB-AQ(4.6 mm×12.5 mm,5 μm)色谱柱富集,水-甲醇(91∶9)洗脱;ZORBAX SB-AQ(4.6 mm×150 mm,5 μm)色谱柱分离,流动相为0.1%甲酸水溶液-甲醇(91∶9),检测波长260 nm,柱温40 ℃,流速1.0 mL·min-1,分别对4种虫草类药材中虫草素和2′-脱氧腺苷含量进行检测。结果表明冬虫夏草、虫草菌丝体和蝉花样品中仅检测到2′-脱氧腺苷,蛹虫草样品中仅检测到虫草素,早期报道的在冬虫夏草中检测到的虫草素色谱峰可能是其同分异构体2′-脱氧腺苷色谱峰或以2′-脱氧腺苷为主的与虫草素的共洗脱色谱峰。该方法重复性好,准确度高,分析时间短,可用于虫草类药材中虫草素和2′-脱氧腺苷的分析。
[关键词] 固相萃取; 高效液相; 虫草素(3′-脱氧腺苷); 2′-脱氧腺苷
[Abstract] An online SPE-HPLC method for simultaneous determination of cordycepin (3′-deoxyadenosine) and 2′-deoxyadenosine in Cordyceps genus (C. sinensis,C. militaris,Hirsutella sinensis and C. sobolifera) was developed. The samples were enriched on a ZORBAX SB-AQ (4.6 mm×12.5 mm,5 μm) column with isocratic elution by 9% methanol solution. The separation of analytes was performed on a ZORBAX SB-AQ (4.6 mm×150 mm,5 μm) column with gradient elution by 0.1% formic acid solution and methanol (91∶9). The flow rate was 1.0 mL·min-1. Column temperature was 40 ℃ and detection wavelength was 260 nm. This method has been applied for analysis of different Cordyceps genus. The 2′-deoxyadenosine was detected in C. sinensis,Hirsutella sinensis and C. sobolifera. The cordycepin was detected in C. militaris. In summary,the cordycepin chromatographic peak from C. sinensis in some past reports may be the 2′-deoxyadenosine chromatographic peak or the mixture peak of 2′-deoxyadenosine and cordycepin in which 2′-deoxyadenosine content was higher than cordycepin. The developed method is suitable for analysis of cordycepin and 2′-deoxyadenosine in Cordyceps genus.
[Key words] SPE; HPLC; cordycepin (3′-deoxyadenosine); 2′-deoxyadenosine
冬蟲夏草是麦角菌科真菌冬虫夏草菌Cordyceps sinensis(BerK.)Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的复合体,具有补肺益肾,止血化痰的功效[1]。现代药理学研究表明,冬虫夏草具有抗肿瘤、免疫调节、保护肝脏、保护肾脏、保护心血管、延缓衰老等功效[2-5]。蛹虫草为蛹草真菌C. militaris以虫蛹为寄主或在人工培养基上形成的子实体,虫草菌丝体为中华被毛孢真菌Hirsutella sinensis通过液体发酵技术生产的菌丝体,蝉花为蝉花真菌C. sobolifera寄生于蝉类若虫形成的菌虫复合体[6]。
虫草素(3′-脱氧腺苷)具有抗肿瘤、抗菌、抗病毒、免疫调节、清除自由基等多种药理作用[7-8],有观点认为其是冬虫夏草的主要活性成分,也有研究认为冬虫夏草中虫草素不存在或含量极微,而含有的是2′-脱氧腺苷[9-10]。虫草素与其同分异构体2′-脱氧腺苷结构相近,液相分离困难,容易造成错误指认。前期实验结果表明虫草素在蛹虫草中含量相对较高,但在冬虫夏草中含量很低,定量困难,精确指认不易[11]。因此有必要开发一种能够有效分离虫草素和2′-脱氧腺苷,并准确定量的分析方法,对虫草类药材中存在的虫草素或2′-脱氧腺苷进行定性和定量分析。虫草素和2′-脱氧腺苷在虫草类药材的含量通常较低,本研究通过固相萃取法对虫草类药材中的虫草素和2′-脱氧腺苷进行富集,进而实现定量分析。
固相萃取(solid phase extraction,SPE)是色谱分析中极其重要的一种样品前处理方法,主要目的是把痕量被测组分进行浓缩、富集、净化和介质转移(把被测组分从样品基体中转移到溶剂或气体中)[12],具有节省时间,溶剂用量少和不易乳化等优点[13]。自20世纪70年代后期商品化产品问世以来,SPE技术发展迅速,目前已被广泛应用于中药材中的微量物质分析[14-15]。在线SPE以柱切换系统为核心,通过程序控制多通道切换实现样品前处理与分离分析的偶联,能够自动化实现从生物样品前处理到数据分析的全部过程[16-17]。
本研究采用在线SPE-HPLC联用技术建立了同时测定虫草素和2′-脱氧腺苷的分析方法,并成功运用于冬虫夏草、蛹虫草、虫草菌丝体和蝉花的分析。
1 材料
冬虫夏草样本20份,蛹虫草样本4份,虫草菌丝体样本4份,蝉花样本4份,实验样本经广东东阳光药业有限公司国家中医药管理局重点研究室钱正明博士鉴定,分别是冬虫夏草C. sinensis、蛹虫草C. militaris、虫草菌丝体Hirsutella sinensis和蝉花C. sobolifera,见表1。
Agilent1260高效液相色谱仪,配有2个二元泵、自动进样器、柱温箱、六通阀、VWD紫外检测器(美国Agilent公司),KQL-100B1超声仪(昆山市超声仪器有限公司),Votex-Genie 2涡旋仪(美国Scientific industries公司),XS205 1/10万天平(瑞士Mettler-Toledo公司),5424离心机(德国Eppenfdorf公司)。
对照品虫草素(上海融禾医药有限公司,批号150306)、2′-脱氧腺苷(百灵威科技有限公司,批号151008),纯度均大于98%。甲酸(色谱纯,阿拉丁公司)、磷酸(色谱纯,成都科龙化工试剂厂)、甲醇(色谱纯,美国spectrum公司)、超纯水(美国Millipore公司)。
2 方法
2.1 色谱条件
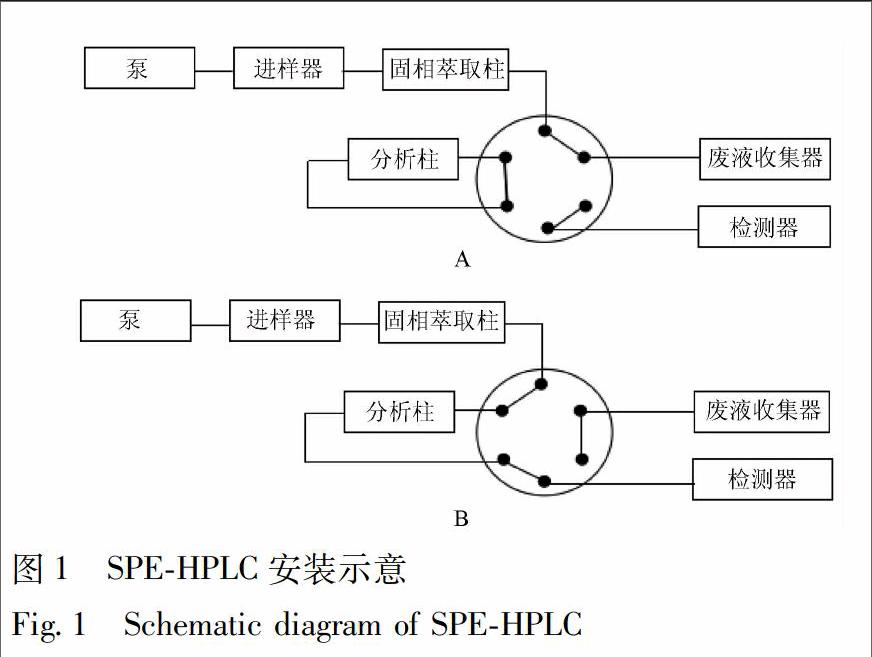
固相萃取柱为ZORBAX SB-AQ(4.6 mm×12.5 mm,5 μm);分析柱为ZORBAX SB-AQ(4.6 mm×150 mm,5 μm);流速为1 mL·min-1,柱温为40 ℃,检测波长为260 nm;仪器安装见图1,首先,六通阀切换至固相萃取柱与废液收集器联用位置见图1A,进样体积为40 μL,使待测组分质量浓度达到检测限,在线固相萃取流动相为水-甲醇(91∶9),等度洗脱3 min,除去杂质;六通阀切换至固相萃取柱、分析柱和检测器联用位置见图1B,流动相为0.1%甲酸水-甲醇,梯度洗脱3~5 min,水-甲醇(91∶9)~0.1%甲酸水-甲醇(91∶9);5~17 min,0.1%甲酸水-甲醇(91∶9)。
2.2 对照品贮备液的配制
精密称取虫草素对照品20.14 mg,置于100 mL量瓶中,用超纯水溶解并定容至刻度,摇匀,得质量浓度为201.4 mg·L-1的虫草素对照品溶液;精密称取2′-脱氧腺苷对照品19.85 mg,置于100 mL量瓶中,用超纯水溶解并定容至刻度,摇匀,得浓度为198.5 mg·L-1的2′-脱氧腺苷对照品溶液;精密量取两对照品溶液1 mL,置于100 mL量瓶中,用超纯水定容至刻度,摇匀,得混合对照品溶液。
2.3 供试品溶液的制备
取样品粉碎成细粉,过6号筛。取2.5 g样品粉末,精密称定,置于100 mL量瓶中,加入超纯水80 mL,密塞,放置1 h,时时振摇,超声处理(功率500 W,频率40 kHz)30 min,放冷,超纯水定容至刻度,摇匀,滤过,取续滤液,过0.22 μm水系滤膜,即得供试品溶液。
3 结果与分析
3.1 方法学考察
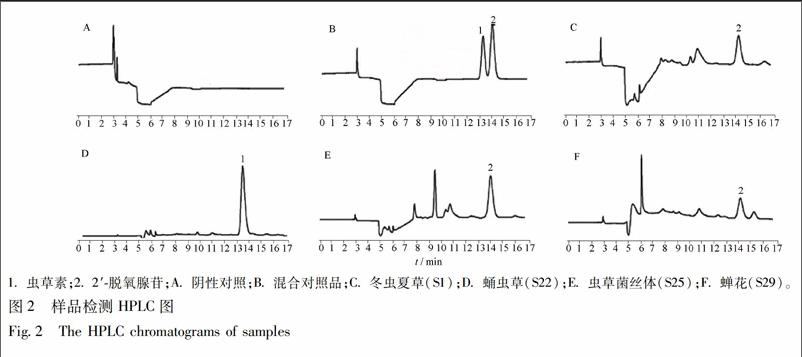
3.1.1 专属性试验 本试验色谱条件下的专属性,结果见图2,在对应虫草素和2′-脱氧腺苷色谱峰的保留时间处,阴性对照液的色谱图中不存在色谱峰,冬虫夏草、虫草菌丝体和蝉花供试品在2′-脱氧腺苷色谱峰的保留时间处有色谱峰,蛹虫草在虫草素色谱峰的保留时间处有色谱峰,证明虫草素和2′-脱氧腺苷的色谱峰没有受到干扰,方法的专属性符合要求。
3.1.2 标准曲线、定量限和检测限 取混合对照品溶液,用超纯水稀释配成系列浓度梯度,按2.1项下色谱条件测定,记录色谱图。以溶液浓度(X)为横坐标,峰面积(Y)为纵坐标,用最小二乘法进行回归计算,求得回归方程和相关系数。取混合对照品溶液,用超纯水逐级稀释,进样分析,信噪比(S/N)约为10时的相应浓度确定最低定量限,S/N约为3时的相应浓度确定最低检测限,见表2。结果表明,虫草素和2′-脱氧腺苷在相应的线性范围内线性关系良好。
3.1.3 精密度试验 精密吸取混合对照品溶液40 μL,重复进样6次,记录峰面积,测得虫草素和2′-脱氧腺苷的日内精密度(RSD)分别为0.10%和0.20%。精密吸取混合对照品溶液40 μL,每天进样2次,连续进样3 d,记录峰面积,测得虫草素和2′-脱氧腺苷的日间精密度(RSD)分别为0.20%,0.30%。表明该方法精密度良好。
3.1.4 重复性试验 精密称取同一批冬虫夏草(S1)药材6份,按2.3项下制备供试品溶液,测定样本中虫草素和2′-脱氧腺苷的含量,并计算RSD。样品中未检测到虫草素,2′-脱氧腺苷RSD为2.9%,表明该方法重复性良好。
3.1.5 稳定性试验 取重复性试验供试品1份,分別放置0,1,2,4,8,12 h后,测定虫草素和2′-脱氧腺苷的含量,计算RSD,样品中未检测到虫草素,2′-脱氧腺苷RSD为2.9%,表明供试品溶液在12 h内稳定。
3.1.6 加样回收试验 精密称取蛹虫草(S22)药材6份,准确加入虫草素对照品,另精密称取冬虫夏草(S1)药材6份,准确加入2′-脱氧腺苷对照品。按2.3项下方法制备供试品溶液,按2.1项下色谱条件测定,计算虫草素和2′-脱氧腺苷的平均回收率及RSD。虫草素和2′-脱氧腺苷的平均回收率分别为100.6%,100.4%,RSD分别为2.9%,3.2%,结果见表3。
3.2 含量测定
取虫草类药材(冬虫夏草、蛹虫草、虫草菌丝体和蝉花样本),按2.3项下方法制备供试品溶液,按2.1项下色谱条件进行分析检测,见图2,结果见表4。
4 讨论
本研究采用固相萃取-高效液相色谱联用方法同时对4种虫草类药材中的虫草素和2′-脱氧腺苷进行定量分析,为了获得满意的分离度、较短的分析时间、较好的灵敏度和准确的含量测定结果,试验分别对供试品提取条件和色谱条件进行了考察。
4.1 提取条件优化
本试验分别采用超纯水和80%甲醇水溶液为提取溶剂,制备供试品溶液,按照2.1项下色谱条件分析。结果表明,采用超纯水制备的供试品溶液能够检测到2′-脱氧腺苷,80%甲醇水溶液制备的供试品溶液2′-脱氧腺苷色谱峰未达检测限,可能原因是2′-脱氧腺苷的水溶性强于醇溶性,文献报道中虫草素具有相似的性质[18],因此选择超纯水作为制备供试品的提取溶剂。
取冬虫夏草(S1),分别采用超纯水超声提取法(如2.3项下方法)和超纯水加热回流提取法(回流提取30 min),制备供试品溶液,按照2.1项下色谱条件分析。结果表明,加热回流提取法制备供试品中2′-脱氧腺苷平均含量为0.032 mg·g-1,与超声提取法制备供试品中测得的2′-脱氧腺苷含量(0.034 mg·g-1)相近,且均未检测到虫草素色谱峰。考虑到操作的简便性,确定超纯水超声提取法为供试品溶液的制备方法。
4.2 色谱条件的优化
4.2.1 预分离条件的优化 在前期研究基础上[19],选择能够耐受高比例水相的ZORBAX SB-AQ(4.6 mm ×12.5 mm,5 μm)色谱柱作为固相萃取柱。固相萃取柱后端连接紫外检测器,分别以水-甲醇系统和0.1%甲酸水-甲醇系统为洗脱剂进行洗脱,流速1 mL·min-1,检测波长260 nm。结果表明,当以0.1%甲酸水-甲醇(91∶9)系统作为洗脱剂时,混合对照品保留时间小于1 min,不足以和杂质有效分离;当以水-甲醇(91∶9)系统作为洗脱剂时,混合对照品在3.5 min时被洗脱,见图3A,而蛹虫草供试品中杂质在3 min内被充分洗脱,见图3B。因此选择水-甲醇(91∶9)系统作为固相萃取柱的洗脱溶剂,冲洗3 min,使样品中的大量杂质不经分析柱直接进入废液收集装置,从而保护色谱柱。当杂质被完全洗脱时,六通阀切换至分析流路位置,见图1B,进行定量分析。
4.2.2 色谱分离条件的优化 本试验选择ZORBAX SB-AQ(4.6 mm ×150 mm,5 μm)色谱柱作为分析柱,分别比较了水-甲醇系统和0.1%甲酸水-甲醇系统对虫草素和2′-脱氧腺苷的分离效果,结果显示水-甲醇系统能够对虫草素和2′-脱氧腺苷实现分离,但出峰时间大于40 min,见图4A;采用0.1%甲酸水-甲醇系统(91∶9)洗脱时,虫草素和2′-脱氧腺苷分离效果较好(分离度为1.60),且二者在10 min实现基线分离,显著减少了分析时间,见图4B,因此选择0.1%甲酸水-甲醇系统(91∶9)作为分析柱洗脱溶剂。
4.3 含量测定结果分析
本研究采用SPE-HPLC对冬虫夏草、蛹虫草、虫草菌丝体和蝉花样本中虫草素和2′-脱氧腺苷进行定量分析。结果表明虫草素在蛹虫草样品中质量分数较高(0.799~1.893 mg·g-1),在冬虫夏草、虫草菌丝体和蝉花样品中含量均低于定量限,不能用常规紫外检测器进行定量。在本实验色谱条件下,2′-脱氧腺苷在冬虫夏草(0.017~0.046 mg·g-1)、虫草菌丝体(0.041~0.052 mg·g-1)和蝉花(0.036~0.051 mg·g-1)中被检出,在蛹虫草中未见明显色谱峰。本研究组前期报道[19]的色谱条件不能对虫草素和2′-脱氧腺苷有效分离,可能存在共洗脱现象,在冬虫夏草中检测到的微量虫草素,可能是把2′-脱氧腺苷色谱峰或虫草素与2′-脱氧腺苷共洗脱色谱峰错误指认为虫草素色谱峰。本文通过固相萃取技术对虫草类药材中微量的虫草素和2′-脱氧腺苷进行富集,并通过优化色谱条件将二者分离,并准确定量。
5 結论
本研究建立了一种同时测定虫草类药材中虫草素和2′-脱氧腺苷含量的固相萃取-高效液相色谱分析方法,使得二者在15 min实现基线分离并准确定量,极大缩短分析时间,适用于虫草类药材的分析。我们前期研究中所建立的分析方法不能对虫草素和2′-脱氧腺苷有效分离而可能产生共洗脱现象,因此本文通过固相萃取和高效液相色谱联用方法对虫草类药材中的虫草素和2′-脱氧腺苷分离并定量分析。结果显示,在本文所述检测条件下,冬虫夏草、虫草菌丝体和蝉花样品中仅检测到2′-脱氧腺苷,蛹虫草样品中仅检测到虫草素;在冬虫夏草样品中未检测到虫草素,早期报道的在冬虫夏草中检测到的虫草素色谱峰可能是其同分异构体2′-脱氧腺苷色谱峰或以2′-脱氧腺苷为主的与虫草素的共洗脱色谱峰。
[参考文献]
[1] 中国药典. 一部[S]. 2015:115.
[2] Zhou X,Gong Z,Su Y,et al. Cordyceps fungi: natural products, pharmacological functions and developmental products[J]. J Pharm Pharmacol, 2009, 61(3): 279.
[3] 王玉华, 叶加, 李长龄, 等. 冬虫夏草提取物延缓衰老实验研究[J]. 中国中药杂志, 2004, 29(8): 60.
[4] 陈小秋, 刘宝玲, 赵中振, 等. 冬虫夏草与其混淆品的性状及显微鉴别研究[J]. 中国中药杂志, 2011, 36(9): 1141.
[5] 司南, 彭博, 赵海誉, 等. 不同基原虫草的成分比较及其对人胚胎成纤维细胞抗纤维化作用的初步研究[J]. 中国中药杂志, 2016, 41(14): 2669.
[6] 钱正明, 李文庆, 王传喜, 等. 高效液相色谱定量分析比较4种虫草药材的核苷类成分[J]. 中国中药杂志, 2016, 41(13): 2493.
[7] Tuli H S, Sandhu S S, Sharma A K. Pharmacological and therapeutic potential of Cordyceps, with special reference to cordycepin[J]. Biotechniques, 2013, 4(1):1.
[8] Tuli H S, Kashyap D, Sharma A K. Cordycepin: a Cordyceps, metabolite with promising therapeutic potential[M]. New York City: Springer International Publishing, 2016.
[9] 楊涛, 董彩虹. 虫草素的研究开发现状与思考[J]. 菌物学报, 2011, 30(2): 180.
[10] 高晓霞, 周伟平, 谢明容, 等. 西藏冬虫夏草水提液HPLC指纹图谱研究及核苷类成分测定[J]. 广东药学院学报, 2014, 30(1): 44.
[11] 钱正明, 孙培培, 李文庆, 等. 冬虫夏草高效液相特征图谱分析[J]. 世界科学技术——中医药现代化, 2014, 16(2): 279.
[12] 傅若农. 近年国内固相萃取——色谱分析的进展[J]. 分析试验室, 2007(2): 100.
[13] 孙海红, 钱叶苗, 宋相丽, 等. 固相萃取技术的应用与研究新进展[J]. 现代化工, 2011, 31(S2): 21.
[14] 张加余, 乔延江, 高晓燕, 等. 清火栀麦片中化学成分的SPE-HPLC-ESI-MSn快速识别与鉴定[J]. 中国中药杂志, 2013, 38(2): 186.
[15] 孟健, 王淑芬, 韩飞, 等. SPE-HPLC测定注射用红景天(冻干)中红景天苷和酪醇的含量[J]. 中国中药杂志, 2006, 31(2): 119.
[16] Oscar J P, Carlos G, Juan V. Efficient approach for the reliable quantification and confirmation of antibiotics in water using on-line solid-phase extraction liquid chromatography/tandem mass spectrometry[J]. J Chromatogr A, 2006, 1103(1): 83.
[17] Yazen A, Karthik S, David W. Development and application of a new on-line SPE system combined with LC-MS/MS detection for high throughput direct analysis of pharmaceutical compounds in plasma[J]. J Chromatogr A, 2005, 1080(2): 99.
[18] 李祥玲, 胡劲松, 陈作红. HPLC测定人工蛹虫草及其培养基中虫草素和腺苷含量[J]. 湖南师范大学:自然科学学报, 2010, 33(2): 107.
[19] 钱正明, 周妙霞, 孙敏甜, 等. 冬虫夏草不同部位核苷类成分比较分析[J]. 世界科学技术——中医药现代化, 2014, 16(11): 2390.
[责任编辑 丁广治]
