UPLC—Q—TOF/MSE结合诊断离子过滤方法快速分析大黄中酚类成分
2017-06-19王晴卢志威刘月红王美玲付爽张清
王晴+卢志威+刘月红+王美玲+付爽+张清清+赵慧真+张志新+谢紫烨+黄政海+于红红+周文卷+高晓燕

[摘要] 采用超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF/MSE)结合诊断离子过滤方法对掌叶大黄中的酚类成分进行快速分析鉴定。首先,负离子模式下对酚类代表性单体没食子酸、(+)-儿茶素、(-)-表儿茶素、(-)-表儿茶素-3-O-没食子酸酯和原花青素B2进行分析,综合文献报道,总结质谱裂解途径,确定诊断离子;然后,应用诊断离子过滤快速筛选掌叶大黄提取液中的酚类成分,结合保留时间、质谱碎片信息、裂解行为和精确质量数(计算分子式)对化合物进行结构鉴定。在掌叶大黄中共鉴定了63个酚类成分(36个简单酚酸类化合物、8个类黄酮类化合物和19个鞣质类化合物),其中包括6个潜在的新化合物。诊断离子过滤方法可对大黄中酚类成分进行快速分析,并完善了中药大黄的药效物质基础。
[关键词] 超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF/MSE); 诊断离子; 掌叶大黄; 酚类
[Abstract] Diagnostic ions filter method was used to rapidly detect and identify the phenolic compounds in Rheum palmatum based on ultra performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF/MSE). The representative authentic standards of phenolic compounds, including gallic acid, (+)-catechin, (-)-epicatechin, (-)-epicatechin-3-O-gallate and procyanidin B2, were subjected to analysis by UPLC-Q-TOF/MSE system with negative ion mode. Fragmentation patterns of each standard were summarized based on assigned fragment ions. The prominent product ions were selected as diagnostic ions. Subsequently, diagnostic ions filter was employed to rapidly recognize analogous skeletons. Combined with retention time, accurate mass, characteristic fragments and previous literature data, the structures of the filtered compounds were identified or tentatively characterized. A total 63 phenolic compounds (36 phenolic acid derivatives, 8 flavonoid derivatives and 19 tennis derivatives) in R. palmatum were identified, including 6 potential new compounds. The method of diagnostic ions filter could rapidly detect and identify phenolic compounds in R. palmatum This study provides a method for rapid detection of phenolic compounds in R. palmatum and is expected to complete the material basis of rhubarb.
[Key words] liquid chromatography coupled with quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF/MSE); diagnostic ions; Rheum palmatum; phenolic compounds
大黃为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄R. tanguticum Maxim.ex Balf.或药用大黄R. offcihale Baill.的干燥根和根茎[1]。大黄具有泻下攻积,清热泻火,凉血解毒,逐瘀通经,利湿退黄之功效。大黄所含化合物类型多样,结构典型,特点明确,除了被认为是主要致泻成分的蒽醌类和蒽酮类成分被报道较多外,其他类成分鲜有研究。根据本课题组前期对唐古特大黄的化学成分的充分研究发现,大黄中含有大量酚类成分[2],根据结构可分为简单酚酸类、类黄酮类和鞣质类成分[3],它们在结构上具有一定的相似性。大黄中的简单酚酸类衍生物通常是以没食子酸、对羟基苯甲酸或对羟基苯烯酸为结构单元的苷类成分;类黄酮类成分主要为黄烷-3-醇,另外还有少数槲皮素类、山柰酚类和橙皮素类衍生物;鞣质类成分为没食子酸和/或黄烷-3-醇互相聚合而成的聚合物,如原花青素类成分[4-5]。
诊断离子过滤方法[6-9]是利用高分辨质谱提供的离子精确质量信息、基于同类化学成分的质谱裂解特点提出的中药化学成分快速筛查手段,非常适合结构类似物的搜索。不同于以往查阅文献建立化学数据库方法,诊断离子过滤克服了难以发现潜在新化合物的局限性,从化合物质谱裂解碎片信息入手推断化合物的整体结构。
本研究针对大黄中酚类成分结构单元固定、质谱裂解规律明显的特点,采用诊断离子过滤方法对掌叶大黄中的酚类化合物进行挖掘分析。该方法包括3步:①对代表性酚类成分的标准物质进行UPLC-Q-TOF/MSE检测,获得高分辨质谱数据,同时结合相关文献,总结质谱裂解规律,确定了酚类成分的诊断离子;②根据诊断离子快速识别酚类化合物的结构类型;③结合保留时间、质谱碎片信息、裂解行为、精确相对分子质量(计算分子式)和在线数据库(ChemSpider,PubChem,SciFinder)对化合物进行进一步的结构鉴定。本研究对大黄中除蒽醌类和蒽酮类成分外的酚类成分进行分析,为大黄药效物质基础研究提供了参考。
1 材料
Waters-ACQUITYTM I-Class SYNAPT G2-Si MS超高效液相色谱-四级杆飞行时间质谱联用仪(美国Waters公司产品,配有电喷雾离子源(ESI)及MassLynx 4.1工作站),UNIFITM 1.7软件系统(美国Waters公司产品)。
掌叶大黄药材(野生),由北京大学中医药现代研究中心提供,经屠鹏飞教授鉴定为蓼科植物掌叶大黄R. palmatum的干燥根及根茎。没食子酸、(+)-儿茶素、(-)-表儿茶素、(-)-表儿茶素-3-O-没食子酸酯、原花青素B2对照品:购自成都普瑞法科技开发有限公司。甲醇(HPLC级)、乙腈(LC-MS级)、甲酸(LC-MS级):赛默飞世尔科技(美国)有限公司;色谱用水为屈臣氏蒸馏水。
2 方法
2.1 样品制备
将大黄药材粉碎,粉末过20目筛。准确称取大黄药材粉末2.5 g,置具塞锥形瓶中,加入70%甲醇25 mL,摇匀,称重,超声30 min,取出放冷,再次称重,70%甲醇补足失重,摇匀,过滤,取续滤液,12 000 r·min-1离心10 min,取上清液。甲醇稀释5倍,取2 μL进样分析。另分别称取各对照品1.5 mg置于25 mL量瓶中,用质谱级甲醇定容,4 ℃储存待用。
2.2 色谱条件
色谱柱Waters ACQUITYTM BEH C18 (2.1 mm×100 mm,1.7 μm),流动相0.1%甲酸水溶液(A)和乙腈(B),柱温40 ℃,样品室温度4 ℃,流速0.2 mL·min-1,进样量2 μL。洗脱程序0~2 min,2% B; 2~3 min,2%~20% B; 3~4 min,20% B; 4~5 min,20%~23% B; 5~6 min,23%~30% B; 6~8 min,30% B; 8~9.5 min,30%~50% B; 9.5~12 min,50%~100% B; 12~13 min,100% B; 13~13.5 min,100%~2% B; 13.5~15 min,2% B。
2.3 质谱条件
电喷雾电离离子源(ESI),负离子模式扫描;扫描范围m/z 100~1 200;毛细管电压和锥孔电压分别为3 kV,40 V;离子源温度100 ℃;锥孔气流速50 L·h-1;去溶剂气温度400 ℃;去溶剂气流速800 L·h-1;Lockmass溶液为亮氨酸-脑啡肽溶液,采集不校正。低能量扫描trap电压为6 V,高能量扫描trap电压为10~65 V。数据采集模式为continuum模式。
3 结果与讨论
3.1 大黄中酚类成分质谱裂解规律
根据已有报道发现,大黄中酚类成分的基本结构主要包括没食子酸、对香豆酸、阿魏酸、对羟基苯丙酸、儿茶素/表儿茶素和原花青素类,少数槲皮素(图1)。本研究对负离子模式下酚类代表性单体没食子酸、(+)-儿茶素、(-)-表儿茶素、(-)-表儿茶素-3-O-没食子酸酯和原花青素B2进行分析,根据实测碎片信息并结合参考文献总结质谱裂解规律,确定了它们的诊断离子(表1),并将裂解过程中的其他产物离子作为辅助诊断信息。
大黄中的简单酚酸类成分基本结构主要是没食子酸、对香豆酸、阿魏酸、对羟基苯丙酸,它们自身的质谱裂解行为较为简单,主要为取代基羧基和羟基的丢失,表现为脱羧基 (-44)和脱水(-18),如没食子酸(图2)。简单酚酸类成分以葡萄糖苷形式存在,并常常与其他成分的羟基结合为酯键形成酚酸衍生物,在负离子扫描模式下的质谱裂解过程通常表现出基本结构整体丢失、酯键断裂丢失取代基或产生去质子化的简单酚酸基本母核。
大黄中最主要的类黄酮类成分是黄烷-3-醇,代表性物质为儿茶素和表儿茶素,槲皮素类衍生物[10]也有报道。它们以游离和葡萄糖苷2种形式存在。通过对儿茶素和表儿茶素对照品进行分析,总结了它们的质谱裂解规律(图3)。儿茶素/表儿茶素的质谱裂解过程分别发生在A环、B环和C环:首先,C环的1,4键断裂(1,4A-)、1,3键断裂(1,3A-)、1,2键断裂(1,2A-)会产生A环碎片;其次,儿茶素/表儿茶素失去1分子H2O后,会相继发生B环丢失、丢失C2H2O(B环)或丢失C3O2(A环);此外,儿茶素/表儿茶素还可不经过失水直接产生[M-H-2C2H2O]-和[M-H-C6H6O2]-(丢失B环)产物离子;儿茶素/表儿茶素经A环失去CO2后,产生丢H2O,C2H2O或C3H6O碎片的产物离子。
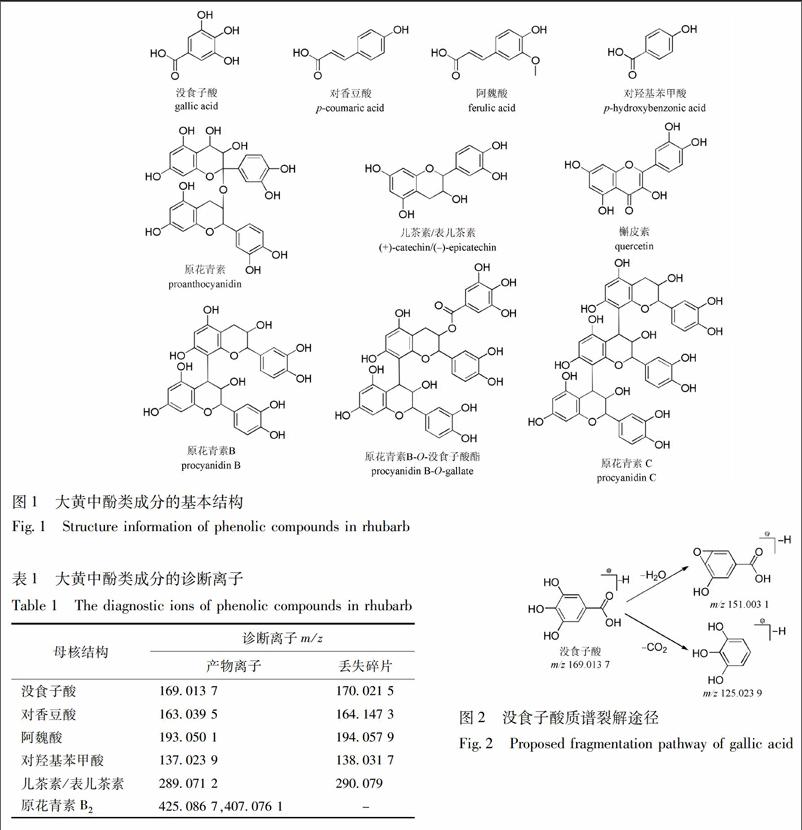
大黄中的鞣质类成分主要分为多个没食子酸通过酯键相连而成的可水解鞣质、儿茶素/表儿茶素經碳碳双键聚合而成的聚合鞣质和聚合鞣质与水解鞣质结合形成的复合鞣质3类。通过对代表性成分原花青素B2(图4)分析并总结相关文献发现,它们的质谱裂解规律与其结构单元相似,主要是没食子酸基团丢失、儿茶素/表儿茶素B环RDA裂解(1,3A-)和黄烷醇间的C-C键断裂产生儿茶素/表儿茶素及相关碎片[11-13]。
3.2 酚类成分鉴定
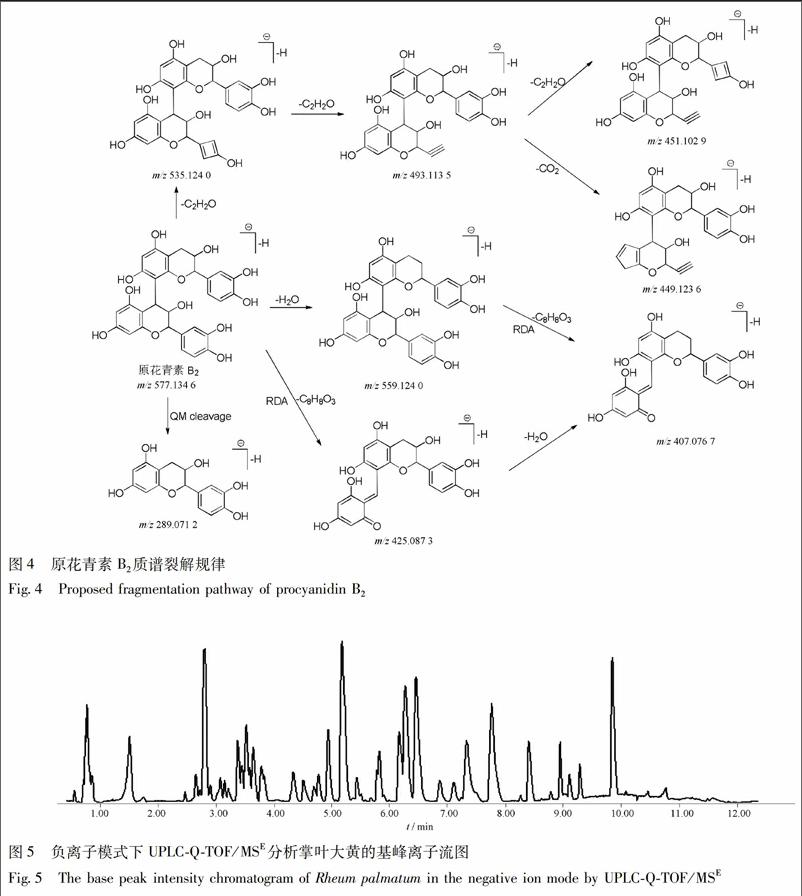
为了获得最佳的检测条件,对UPLC-Q-TOF/MSE的液相洗脱程序和质谱检测参数进行了优化。结果发现,与正离子扫描模式相比,负离子扫描模式下的大黄提取液的色谱图显示的色谱峰个数更多、峰强度更大,质谱图中目标成分质谱碎片更丰富,因此最终选择负离子扫描模式对样品进行检测。
利用已确定的实验条件对掌叶大黄提取液进行
UPLC-Q-TOF/MSE分析(图5)。利用总结的诊断离子,对掌叶大黄药材中的酚类成分进行快速筛选,根据一级和多级质谱碎片信息、精确分子质量及计算的元素组成,结合同属植物化学成分的文献研究,对潜在酚类成分进行结构鉴定。同时,ChemSpider,PubChem,SciFinder在线数据库用于确认潜在的新化合物。共在大黄药材中鉴定出63个酚类成分(表2)。
3.2.1 简单酚酸类 采用诊断离子方法共检出简单酚酸类成分19个(表2)。从表1可见,大黄中酚酸类成分多数是对香豆酸(p-coumaric acid)、阿魏酸(ferulic acid)、对羟基苯甲酸(p-hydroxybenzonic acid)与没食子酸(gallic acid)脱水缩合形成的酯,其他成分的母核为没食子酸;以上均以葡萄糖苷形式存在。
化合物6,8和12产生相同的母离子[M-H]- m/z 331.06 (C13H16O10),并产生m/z 169.01,125.02没食子酸的特征碎片离子。因此推测三者均为没食子酸-O-葡萄糖苷。化合物1较化合物6多162.052 9 (C6H10O5),并同样产生m/z 331.066 9,169.013 6碎片离子;其他碎片离子(m/z 151.002 9[M-H-Glc-H2O]-,125.023 8[M-H-Glc-CO2]-)也顯示该化合物具有没食子酸结构。因此,化合物1被鉴定为没食子酸-O-二葡萄糖苷,化合物4,5,7,9为它的同分异构体。
从化合物24的二级质谱图可见,碎片离子m/z 163.002 9由母离子m/z 325.092 4通过丢失1分子葡萄糖产生,判断该化合物为对香豆酸-O-葡萄糖苷,碎片离子m/z 119.033 9由香豆酸丢失-CO2产生。化合物34的母离子[M-H]-为m/z 477.103 3 (C22H22O12),并具有对香豆酸母核中性丢失行为(m/z 313.055 5[M-H-C9H8O3]-)和没食子酸特征碎片离子m/z 169.013 7,因此推测该化合物为对香豆酸-O-没食子酰-葡萄糖苷;由碎片m/z 331.069 1[M-H-C9H6O2]-和m/z 315.054 2[M-H-C6H10O5]-推测对香豆酸和葡萄糖分别连接在没食子酸的羟基(-OH)上。由相似的质谱碎片信息推测化合物39和44同为对香豆酸-O-没食子酰-葡萄糖苷。化合物45的母离子[M-H]-为m/z 629.114 1,由碎片离子m/z 467.070 6[M-H-Glc]-,465.067 1[M-H-Glc-C9H6O2]-,459.090 9[M-H-Glc-C7H6O5]-等推测该化合物结构为1分子对香豆酸、1分子没食子酸和1分子葡萄糖分别通过酯键与1分子没食子酸相连(对香豆酸-O-二没食子酰-葡萄糖苷),化合物48为它的同分异构体。
化合物29的母离子为m/z 355.102 2[M-H]-(C16H20O9),经中丢失葡萄糖产生阿魏酸诊断离子m/z 193.050 3,碎片m/z 179.070 7[M-H-Glc-CH2]-,149.912 4[M-H-Glc-CO2]-和m/z 134.036 2[M-H-Glc-CH3]-均为阿魏酸的特征离子,因此,推测该化合物为阿魏酸-O-葡萄糖苷。
化合物37所显示的质谱裂解行为显示具有葡萄糖(C6H10O5)丢失(m/z 345.077 4)、阿魏酸母核(C10H10O4)丢失(m/z 313.055 5)、阿魏酸取代基(C10H8O3)丢失(m/z 331.068 7)的产物碎片和没食子酸的特征离子(m/z 169.013 8,151.003 0,125.023 9),因此将该化合物鉴定为阿魏酸-O-没食子酰-葡萄糖苷。同理,推测化合物42和46为化合物37的同分异构体,并于在线数据库中未检索到匹配结果,因此推测为潜在的新化合物。
化合物33的母离子为m/z 451.087 2[M-H]- (C20H20O12),281.044 2[M-H-C7H6O5]-,289.071 0[M-H-Glc]-,143.049 9[M-H-C7H6O5-C7H6O3]-推测该结构具有葡萄糖、对羟基苯甲酸和没食子酸结构单元,m/z 151.003 4推测为没食子酸丢失1分子H2O所产生。因此,推测该化合物为对羟基苯甲酸-O-没食子酰-葡萄糖苷。
此外,对香豆酸、阿魏酸、对羟基苯甲酸和没食子酸也常常单独或互相结合作为其他酚类成分的取代基,因此,使用诊断离子过滤方法并结合精确分子质量、碎片离子信息鉴定得到17个简单酚酸衍生物(化合物35,36,43,49,51~63),其中,化合物35,61,62在在线数据库中未检索到匹配结构,因此推断其为潜在的新化合物。以化合物36为例说明化合物鉴定过程。化合物36的母离子为m/z 671.176 1[M-H]- (C36H32O13),碎片离子m/z 169.013 8[C7H6O5-H]-,151.003 0[C7H6O5-H-H2O]-,125.023 9[C7H6O5-H-CO2]-显示具有没食子酸结构;碎片离子m/z 389.065 6[C14H12O3+Glc-H-CO2]-,361.071 6[C14H12O3+Glc-H-CO2]-,227.034 4[C14H12O3-H]-,183.028 1[C14H12O3-H-CO2]-显示具有白藜芦醇-O-葡萄糖苷结构;碎片离子m/z 389.065 6由母离子丢失没食子酰基和C9H6O(推测为肉桂酰基)而得;碎片离子m/z 509.120 7由白藜芦醇结构丢失CO2、没食子酸结构丢失H2O产生;根据以上分析,将化合物36鉴定为白藜芦醇-O-肉桂酰-没食子酰-葡萄糖苷。
3.2.2 类黄酮 提取诊断离子m/z 289.07并辅助鉴定信息,共检出儿茶素/表儿茶素类成分7个,此外,经没食子酸类诊断离子推断得到1个槲皮素衍生物(表2)。
化合物22保留时间为3.01 min,母离子为m/z 289.071 7[M-H]-(C15H14O6),经与对照品比对相同确定为(+)-儿茶素;其碎片离子m/z 245.081 3[M-H-CO2]-,227.070 4[M-H-CO2-H2O]-,203.070 7[M-H-CO2-C2H2O]-,187.039 3[M-H-CO2-C3H6O]-推测均由A环失去CO2后所产生,碎片离子m/z 229.049 4[M-H-H2O-C2H2O]-和161.059 8[M-H-H2O-C6H6O2]-由母核丟失1分子H2O后所产生,m/z 205.049 9由母核丢失2分子C2H2O产生,m/z 179.034 3由母核丢失B环(C6H6O2)产生,m/z 137.023 8由C环1,4键断裂产生。同理,经与对照品比对,化合物16确定为儿茶素的同分异构体(-)-表儿茶素。化合物3,14和17的母离子均为m/z 451.12[M-H]- (C21H24O11),并具有儿茶素/表儿茶素准分子离子峰m/z 289.070 8,推测由中性丢失葡萄糖基产生,因此,鉴定三者为儿茶素/表儿茶素的葡萄糖苷。
化合物41保留时间为3.76 min,母离子为m/z 441.082 3[M-H]- (C22H18O10),除产生儿茶素/表儿茶素特征碎片外,还产生碎片m/z 169.013 8,125.023 9,提示存在没食子酸结构。经与对照品比对,将其确定为(-)-表儿茶素-3-O-没食子酸酯。化合物21母离子为m/z 603.134 4[M-H]- (C28H28O15),较化合物41正好相差162.052 1,碎片离子m/z 451.036 8提示该化合物可能发生没食子酸(C7H6O5)中性丢失,m/z 289.071 7,245.081 3,227.070 4等碎片离子提示具有儿茶素/表儿茶素结构单元,因此,将化合物21鉴定为儿茶素-O-没食子酰-葡萄糖苷/表儿茶素-O-没食子酰-葡萄糖苷。
化合物26母离子为m/z 615.098 7[M-H]- (C28H24O16),碎片离子m/z 169.013 9显示具有没食子酸结构单元,由母离子丢失没食子酰基产生的碎片离子m/z 463.094 9[M-H-C7H4O4]-的计算分子式为C21H20O12,推测为槲皮素-O-葡萄糖苷结构。因此,化合物26暂时鉴定为槲皮素-O-没食子酰-葡萄糖苷。
3.2.3 鞣质类 大黄中的可水解鞣质同样由没食子酸诊断离子m/z 169.013 7过滤所得。化合物2母离子为m/z 483.077 1[M-H]- (C20H20O14),经丢失葡萄糖基产生碎片离子m/z 321.041 7[M-H-Glc]-,继续丢失没食子酰基产生没食子酸准分子离子峰m/z 169.013 6[M-H-Glc-C7H4O4]-,其他碎片离子m/z 465.085 2[M-H-H2O]-,439.085 1[M-H-CO2]-,151.002 9[M-H-Glc-C7H4O4-H2O]-,125.023 8[M-H-Glc-C7H4O4-H2O-CO2]-均由没食子酸结构产生。因此,将化合物2鉴定为di-O-galloyl-glucose。同理,将化合物13和18鉴定为没食子酸-O-没食子酰-葡萄糖苷,化合物25鉴定为没食子酸-O-二没食子酰-葡萄糖苷。
通过提取原花青素类成分的共有碎片结构m/z 425.086 7,407.076 1,结合精确相对分子质量、碎片信息,共鉴定出15个原花青素类成分。化合物11的母离子为m/z 593.128 7[M-H]-,计算分子式为C30H26O13,推测可能为原花青素或其同分异构体,碎片信息归属如下:因丢失H2O产生碎片离子m/z 575.120 3[M-H-H2O]-,随后连续丢失C2H2O或CO2碎片产生m/z 407.076 3[M-H-H2O-4C2H2O]-,405.102 6[M-H-H2O-CO2-3C2H2O]-;由RDA裂解产生碎片离子m/z 421.019 6[M-H-H2O-C7H6O4]-。化合物15,30与化合物15具有相同的母离子和相似的质谱裂解行为,因此也将其鉴定为原花青素或其同分异构体。经与对照品比对,将化合物23确定为原花青素B2。根据相似的质谱裂解行为,将化合物19和31推断为原花青素二聚体,因无法判断手性碳构型,因此二者均暂时鉴定为原花青素B或其同分异构体,将化合物10,20和28暂时鉴定为原花青素C或其同分异构体。此外,化合物27,32,38,40,47和50除了显示原花青素二聚体的特征碎片外,还出现C7H6O5中性丢失行为,推测具有没食子酸结构,因此结合精确分子量及计算分子式将它们鉴定为原花青素B-O-没食子酸酯或原花青素B-O-二没食子酸酯。
4 讨论
本文采用诊断离子过滤方法对UPLC-Q-TOF/MSE检测的掌叶大黄提取液中的酚类化合物进行挖掘。代表性酚类成分的标准物质的实测高分辨质谱数据结合相关文献报道,确定了酚类成分的诊断离子和辅助诊断信息,确保化合物结构单元的准确性;同时,结合保留时间、质谱碎片信息、裂解行为和精确质量数(计算分子式)对化合物进行结构鉴定;ChemSpider,PubChem,SciFinder在线数据用于确认潜在的新化合物。本研究共鉴定了63个酚类成分,包括36个简单酚酸类化合物,8个类黄酮类化合物和19个鞣质类化合物,其中有6个为潜在的新化合物。本研究对大黄中除蒽醌类和蒽酮类成分外的酚类成分进行分析,有助于大黄化学成分研究的全面性,为中药大黄药效物质研究提供物质参考。
[参考文献]
[1] 中国药典.一部[S]. 2015.
[2] Zhang L, Liu H, Qin L, et al. Global chemical profiling based quality evaluation approach of rhubarb using ultra performance liquid chromatography with tandem quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2015, 38(3):511.
[3] Smith P M. 植物化学分类学[M].上海:上海科技出版社,1980: 49.
[4] Ye M, Han J, Chen H B, et al. Analysis of phenolic compounds in rhubarbs using liquid chromatography coupled with electrospray ionization mass spectrometry[J]. J Am Soc Mass Spectr, 2007, 18: 82.
[5] Jin W, Wang Y F, Ge R L, et al. Simultaneous analysis of multiple bioactive constituents in Rheum tanguticum Maxim. ex Balf. by high-performance liquid chromatography coupled to tandem mass spectrometry[J]. Rapid Commun Sp, 2007, 21: 2351.
[6] Sun X, Zhang Y, Chen S, et al. Characterization and identification of the chemical constituents in the root of Lindera reflexa Hemsl. using ultra-high performance liquid chromatography coupled with linear trap quadrupole orbitrap mass spectrometry[J]. J Pharmaceut Biomed, 2016, 126:34.
[7] Zhang H, Zheng D, Li H H, et al. Diagnostic filtering to screen polycyclic polyprenylated acylphloroglucinols from Garcinia oblongifolia by ultrahigh performance liquid chromatography coupled with ion mobility quadrupole time-of-flight mass spectrometry[J]. Anal Chim Acta, 2016, 912:85.
[8] Zheng C N, Hao H P, Wang X, et al. Diagnostic fragment-ion-based extension strategy for rapid screening and identification of serial components of homologous families contained in traditional Chinese medicine prescription using high-resolution LC-ESIIT-TOF/MS: Shengmai injection as an example[J]. J Mass Spectrom, 2009, 44: 230.
[9] Zhang J Y, Zhang Q, Li N, et al. Diagnostic fragment-ion-based and extension strategy coupled to DFIs intensity analysis for identification of chlorogenic acids isomers in Flos Lonicerae Japonicae by HPLC-ESI-MSn[J]. Talanta, 2013, 104: 1.
[10] Krafczyk N, Ktke M, Lehnert N, et al. Phenolic composition of rhubarb[J]. Eur Food Res Technol, 2008, 228(2):187.
[11] 任其龍, 魏冠红, 金米聪,等. 反相高效液相色谱-电喷雾质谱法鉴定葡萄籽低聚原花青素[J]. 食品与发酵工业, 2006, 32(3):79.。
[12] Gu L, Kelm M A, Hammerstone J F, et al. Screening of foods containing proanthocyanidins and their structural characterization using LC-MS/MS and thiolytic degradation[J]. J Agr Food Chem, 2003, 51(25):7513.
[13] Lv Q, Luo F, Zhao X, et al. Identification of proanthocyanidins from litchi (Litchi chinensis Sonn.) pulp by LC-ESI-Q-TOF-MS and their antioxidant activity[J]. PLoS ONE, 2015, 10(3):e0120480.
[责任编辑 丁广治]
