苎麻实时定量 PCR体系的建立
2017-06-19马鑫谭松林邢虎成廖少波
马鑫,谭松林,邢虎成,2,3*,廖少波
(1.湖南农业大学苎麻研究所,长沙 410128;2.湖南省种质资源创新与资源利用重点实验室,长沙 410128;3.湖南农业大学草业研究所,长沙 410128)
苎麻实时定量 PCR体系的建立
马鑫1,谭松林1,邢虎成1,2,3*,廖少波1
(1.湖南农业大学苎麻研究所,长沙 410128;2.湖南省种质资源创新与资源利用重点实验室,长沙 410128;3.湖南农业大学草业研究所,长沙 410128)
荧光定量 PCR技术目前应用比较广泛,但是 RNA质量、反转录效率、扩增效率和内参基因的选择等都会影响实时荧光定量 PCR技术的准确性。研究以 3个苎麻品种为材料,采用 actin作为内参基因,利用 2个苎麻基因进行实时定量 PCR体系的建立。结果表明,采用试剂盒法提取的 RNA可以满足 RT-qPCR技术的要求,扩增曲线和熔解曲线都符合实验要求,actin基因可以作为内参进行苎麻相对定量分析研究。相对定量分析表明,研究建立的 RT-qPCR方法可以应用于基因表达水平的研究。该研究为实时定量 PCR在苎麻中的应用提供了参考。
苎麻;实时定量 PCR;RNA
荧光定量 PCR技术(也叫 RT-qPCR技术)的概念是在 1992年提出的[1]。1995年,美国 PE(Perkin Elmer)公司开发了 TaqMan荧光探针定量技术,提高了检测的特异性和灵敏度,使荧光定量 PCR 实 现 了 “实时”(real-time)[2]。1996年又 推 出了首 台荧光 定量 PCR检 测系 统,自 此real-time PCR技术才得以真正的推广和应用[3]。实时荧光定量 PCR与传统的定量技术(如半定量 PCR)相比,具有重复性好、特异灵敏、定量准确、操作简便,以及对样品污染小和自动化程度高等优点。该技术现已在基础科学研究、转基因产品和食品安全检测、医学诊断、药物研发、海关检验检疫等科研和实践领域得到广泛应用[2,3-8]。
实时荧光定量分析包括绝对定量和相对定量。相对定量不是测定样品的绝对拷贝数,而是通过比较样品之间同一目的基因的相对表达量,来分析样品之间目的基因的表达差异。该技术在基因表达差异分析方面具有巨大优势。而 RNA质量、反转录效率、扩增效率和内参基因的选择等都会影响实时荧光定量 PCR技术的准确性[9]。
苎麻(Boehmeria nivea(L.)Gaud)是起源于中国的多年生草本植物,主要以收获纤维为目的来栽培,还可以用于造纸,做饲料,生产工业酒精,以及入药等[10]。苎麻含有大量的多糖、色素、酚类等物质,RNA提取难度较大,目前已报道的方法有 CTAB法[11],Trizol试剂法[12],RNAplant试剂法[13],这些方法耗时、人力成本较高,且前期准备工作复杂,实验难度大,初学者很难掌握。现如今植物 RNA的提取也越来越商业化,有些公司开始推出一些试剂盒,能够较为简单方便的提取植物体内 的 RNA[14]。本 研 究 通 过 试 剂 盒 法 对 苎 麻 不 同 品 种 不 同 部 位 进 行 RNA 的 提 取,并 就real-time PCR体系的建立进行探索,以期为苎麻实时荧光定量 PCR技术的应用提供参考。
1 材料与方法
1.1 材料
苎麻材料为弯子苎麻、园青 5号、大叶绿 MS1的茎尖、叶、皮和骨。所有苎麻材料均于 2016年5月取自湖南农业大学耘园试验基地。所取材料经自来水和蒸馏水洗净后,将茎尖、叶、皮和骨分离后用液氮迅速冷冻,保藏于 -80℃超低温冰箱,用作 RNA提取的材料。
植物 RNA提 取 试 剂 盒 (Transgen),cDNA合成 试剂 盒 (Transgen),荧 光 定 量 PCR试剂 盒(Transgen),其他生化试剂均购自全式金(Transgen)生化试剂公司。引物由生工生物工程(上海)有限公司合成,real-time PCR使用的引物见下表 1。
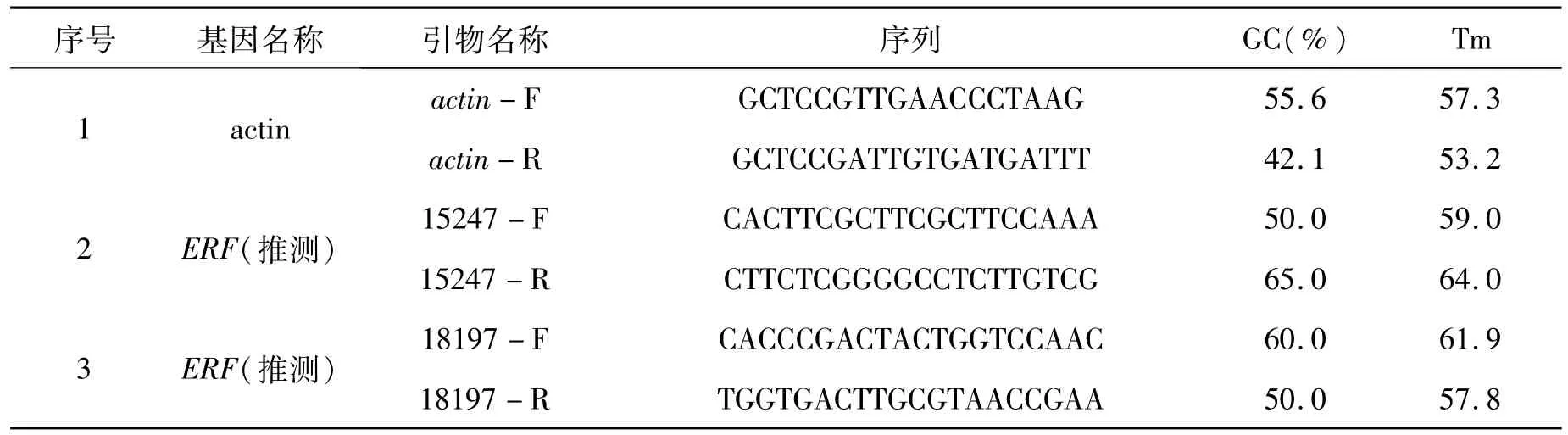
表1 引物列表Tab.1 The primers used in this paper
1.2 RNA提取
将相应质量(见样品要求)植物组织在液氮中迅速研磨成粉末,按照植物 RNA提取试剂盒(Transgen)说明书的要求提取 RNA,提取的 RNA置于 -80℃保存。
1.3 RNA纯度、产率和完整性检测
取 1 uLRNA样品,微量分光光度计(NANO 100,中国)测其230、260、280 nm下的吸光度值,并计算 A260/A280和 A260/A230比值及浓度。根据检测的浓度值,按照每克植物材料提取的 RNA总量算出其产率。
取所得的 RNA约 2μL,加 2μL无 RNAase的水和 1μL 6×loading buffer后于 1.2%的琼脂糖胶、l×TBE电泳缓冲液中电泳检测总 RNA的完整性。电压为 6 V/cm,电泳 15~20 min后,凝胶成像仪照相分析(Kodak GL2002,美国)观察和拍照。
1.4 反转录及 real-time PCR体系的建立
分别取 3个不同苎麻种质的各组织 RNA 1 ug,按照 cDNA合成试剂盒(TransgenAT311货号)上的说明书操作进行反转录。反应体系为 20μL,反转录完成后再加无菌水稀释 8倍成 160μL。
实时荧光定量 PCR采用 ABI7500荧光定量 PCR仪,试剂采用 Transgen公司的荧光定量 PCR试剂盒。按照说明书进行操作,参照基因为苎麻 actin基因序列。首先对引物的特异性进行普通PCR验证,PCR体系按照 EASY Taq酶(Transgen公司)说明书的要求设置,扩增程序为 95℃预变性 3 min,38个循环的程序为 95℃变性 30 s,62℃退火 30 s,72℃延伸 30 s。然后用验证后的引物在上进行 Realtime PCR,体系为 20μL,扩增程序 95℃预变性 3 min,40个循环的程序为 95℃变性30 s,62℃退火 30 s,72℃延伸 30 s。
1.5 数据处理
数据采用 excel进行统计和分析。熔解曲线、扩增曲线由 ABI 7500分析软件制作。相对表达量的计算以 actin为内参基因,计算 Ct值(Ct代表目标扩增产物达到设定阈值所经历的循环数),参照魏敏[15]计算方法,得到 RQ值(表达量变化倍数)。即通过计算△Ct(△Ct=Ct目的基因 -Ct内参),然后获得△△Ct(△△Ct=△Ct(实验组)-△Ct(对照组),再计算 RQ值(RQ=2-△△Ct),用 Ct3次重复的平均值作为该基因在该处理组的表达量,并计算 RQ的误差。
2 结果与分析
2.1 RNA提取率
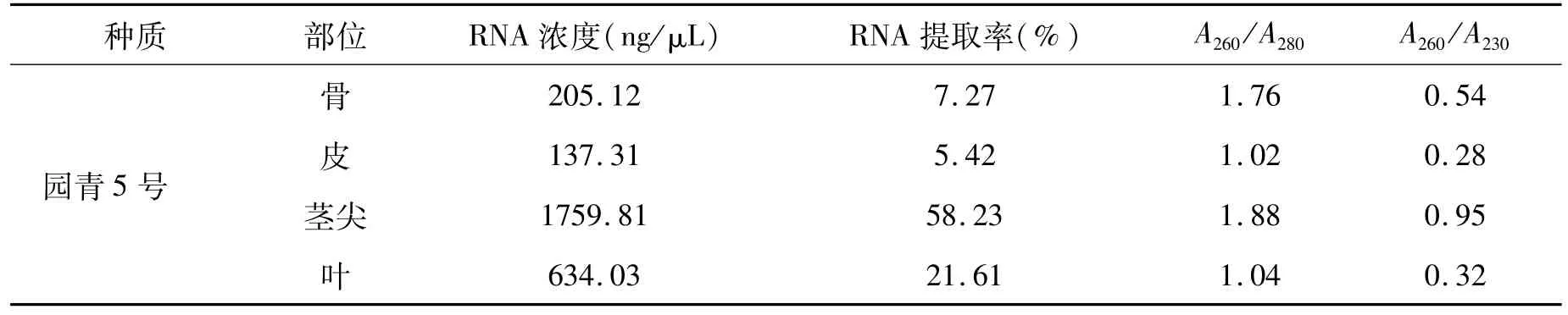
由表 2可以看出,本试验提取出的苎麻 RNA浓度最大值为1759.81 ng/μL,最小值为137.31 ng/μL,提取出的 RNA质量最大的为 79191.36 ng,质量最小的为 5492.4 ng,而提取率最大为 58.23%,最小值为 5.42%。从图 1可以看出,提取出的 RNA的量与取样量有直接的关系,但是苎麻部位不同取样量之间也有差距。例如骨的取样,在 0.1~0.13 g时取样越多,提取出的 RNA浓度越高,但是到了 0.14 g与 0.17 g时又会降低,在取最大值 0.2 g时,浓度达到最高。皮则和骨有差异,在 0.1~0.14 g时,随着取样量的增加提取的 RNA浓度也变大,而在取样量达到最大值0.15 g时,提取的 RNA浓度又降到最低。叶在 0.1~0.11 g和 0.13~0.14 g时浓度较高,且呈递增顺序,而在 0.12 g和 0.15 g时提取出的 RNA浓度较低。茎尖取样量在 0.14 g时提取出的苎麻总 RNA达到最大值,取样量在 0.11 g时提取出的苎麻总 RNA较多,而取样量在 0.12~0.13 g和0.17 g时浓度最少也超过了 400 ng/μL。由图 1可以看出,苎麻取样量并不是越多越好,除骨以外,皮、叶、茎尖随着取样量的增加,在到达一个峰值后,提取出的苎麻总 RNA会随着取样量的增加而降低。
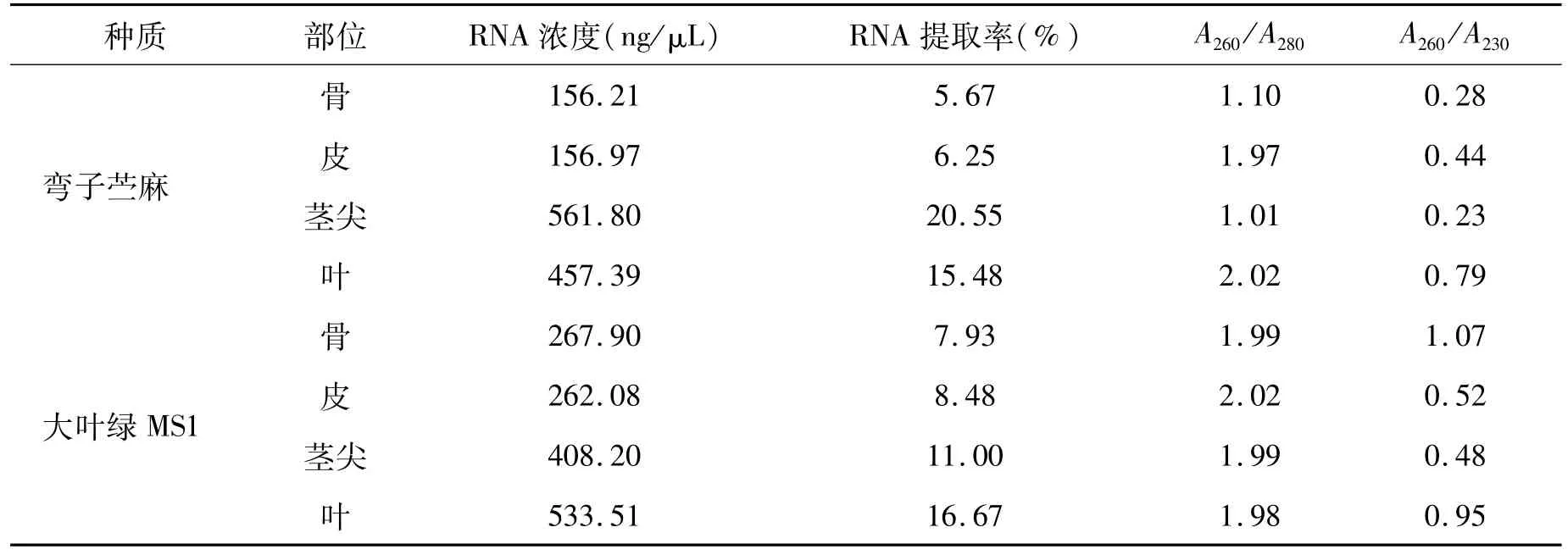
表2 苎麻不同品种不同部位提取出的 RNA浓度、质量和提取率Tab.2 RNA concentration,quality and extraction rate from different parts of ramie
种质 部位 RNA浓度(ng/μL) RNA提取率(%) A260/A280 A260/A230骨园青5号634.03 21.61 1.04 0.32 205.12 7.27 1.76 0.54皮137.31 5.42 1.02 0.28茎尖 1759.81 58.23 1.88 0.95叶
由图 1和表 2可以看出,苎麻不同部位的 RNA提取率以茎尖最大,达到 29.9%;其次是叶,提取率为 17.9%;最后是皮和骨,提取率较低。皮的提取率为 6.7%,骨的提取率为 7.0%。苎麻提取出的总 RNA的平均质量与提取率相同,都是以茎尖最多。从以上数据可以看出,提取出的苎麻总 RNA的数量与苎麻的部位有关,像茎尖和叶等 RNA含量较高的部位提取出的苎麻 RNA量也较高,而骨和皮等 RNA含量较低的部位提取出的 RNA量也较低。
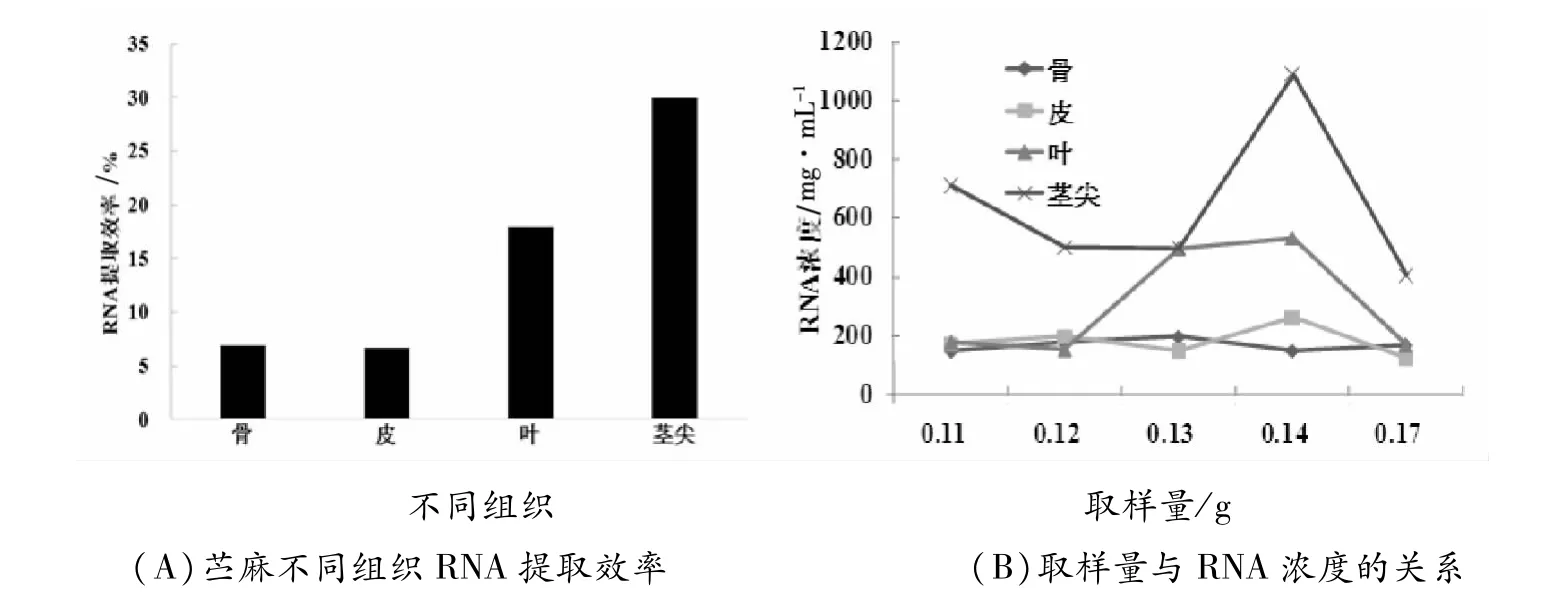
图1 苎麻不同组织 RNA提取效率及取样量与 RNA浓度的关系Fig.1 Relationship between RNA extraction efficiency and sampling amount and RNA concentration in different tissues of ramie
2.2 RNA的纯度和完整性
由表 2可知,12个组织材料中只有 7个组织 RNA提取纯度较好,A260/A280都大于 1.8,其他提取的组织有蛋白质或酚污染。对比 A260/A230的值可以知道,所有样品的 RNA均有盐或异硫氰酸胍的污染,使得 A260/A230的值都小于 1.5。因此该方法提取的苎麻虽总 RNA提取率高,但纯度不够,不仅不能将所有苎麻内的蛋白质完全分离,而且提取过程中用到的异硫氰酸胍也有残留。取 1μL RNA进行琼脂糖凝胶电泳分析,RNA都能够正常的跑出条带,28S rRNA的亮度是18S rRNA的两倍,完整性较好。
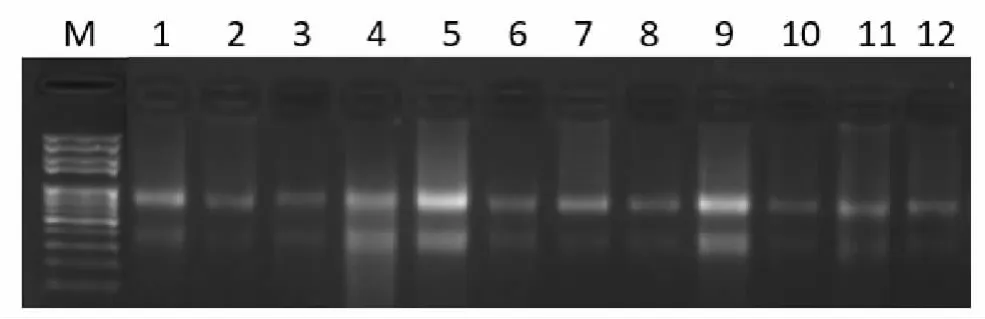
图2 苎麻 RNA琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of ramie RNA
2.3 实时定量 PCR扩增曲线和熔解曲线分析
实时荧光定量 PCR技术整个反应过程可分为荧光背景信号、荧光信号指数扩增和平台期3个阶段。由图 3可知,3对引物 RT-qPCR扩增曲线都存在背景信号阶段,此时 PCR扩增产生的荧光信号弱,无法检测产物量的变化,在图上表现为高低起伏的杂乱线。而进入平台期后,扩增产生的荧光信号稳定,不再增加,在图上表现为平行于 X轴的线;在荧光背景信号和平台期之间的是荧光信号指数扩增阶段,扩增产物量的指数与模板数呈线性关系,在图 3中表现为指数曲线。因此 3对引物在3个苎麻品种的不同器官组织中都进行了有效的扩增。
为了检测扩增产物的特异性,避免 qPCR扩增过程中非特异性扩增产物和引物二聚体产生的荧光信号造成假阳性结果,本文对扩增产物进行熔解曲线分析。由图 4可知,18197、15247和 actin基因在不同苎麻品种的不同器官中的扩增产物熔解曲线较一致,无非特异性扩增产生,说明设计的引物符合试验要求,扩增体系、退火温度及循环程序都适合。按照本试验的研究方法可以对苎麻的基因进行 RT-qPCR分析。
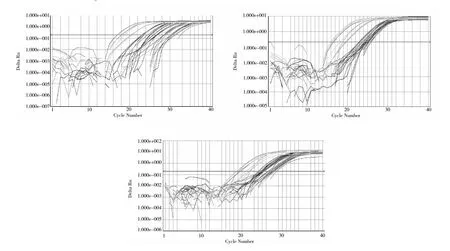
图3 3对引物 RT-qPCR扩增曲线图Fig.3 RT-qPCR amplification curve of 3 pairs of primers
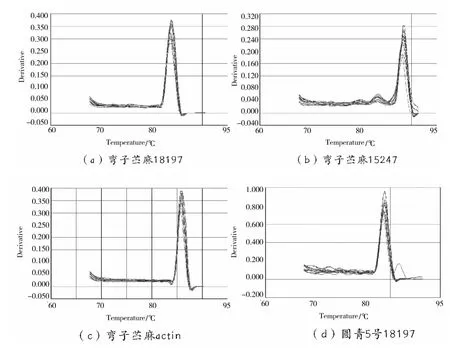
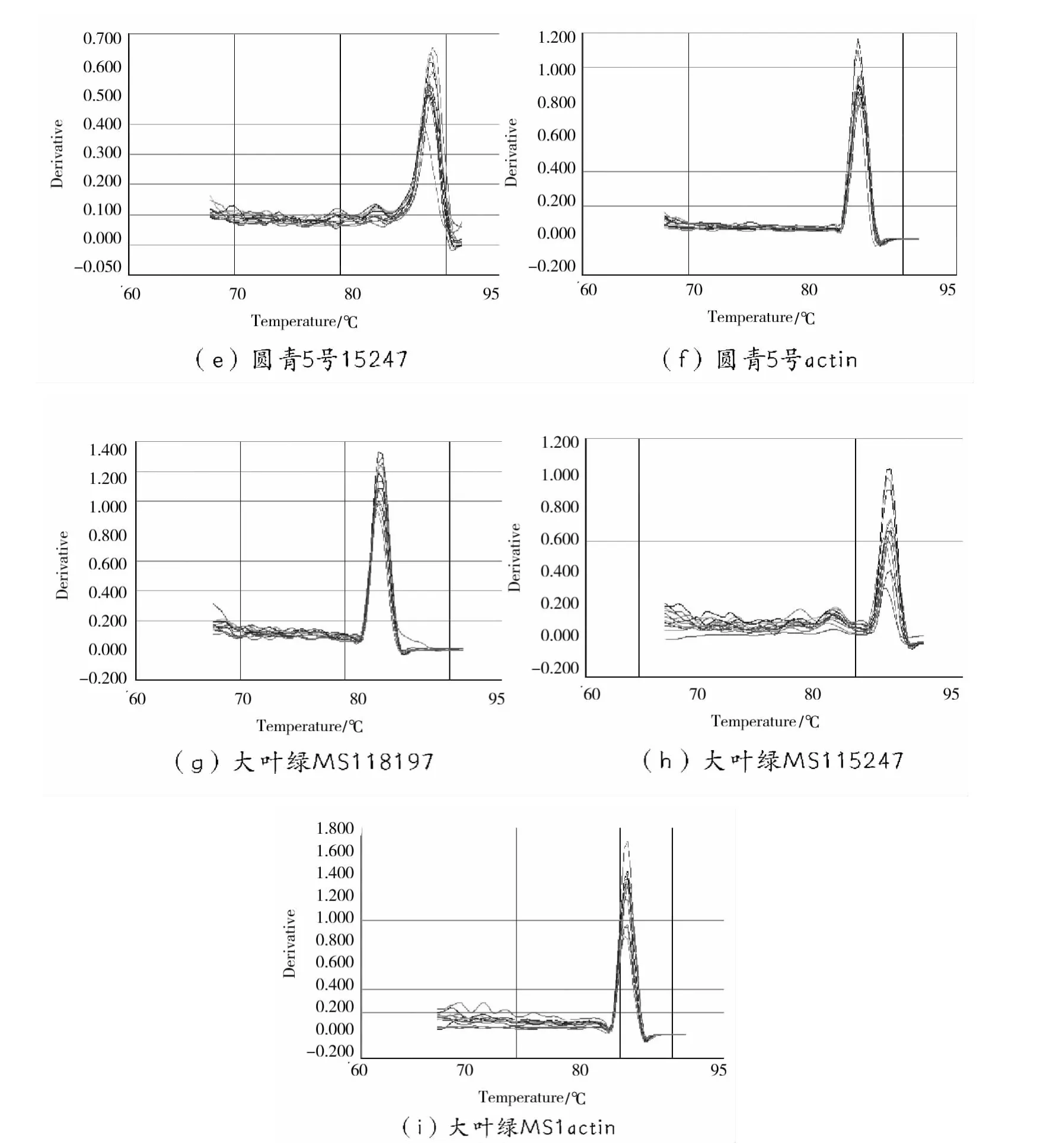
图4 3个基因扩增产物熔解曲线图Fig.4 Dissolution curve of 3 gene amplification products
2.4 实时定量 PCR相对表达量分析
理想的内参基因应具备下列特性:在所有组织和细胞类型中表达,在所有的环境和试验条件下稳定表达,具有与目标基因相似的稳定表达水平[17]。本研究利用苎麻肌动蛋白(ACTIN)基因作为内参,该基因在苎麻麻骨,麻皮,叶片和茎尖等不同部位都可以表达。从表 3来看,该基因在不同品种的不同器官间标准误较小(0.20~0.520),变异率也较小(1.099~2.427);在同一品种不同器官间的表达也表现为较小的标准误(0.10~0.52)和变异率(0.514~2.447)。因此 ACTIN基因可以作为内参进行苎麻 RT-qPCR相对定量分析研究。
采用表达量变化倍数(RQ值)对 18197和 15247两个基因在 3个苎麻品种不同器官间的表达情况进行分析。以弯子苎麻麻骨的表达作为对照,及设定两个基因在弯子苎麻麻骨中的表达量都是 1。由图 5可知,18197和 15247两个基因在苎麻不同品种不同器官间的表达量不同,在茎尖的表达量最高,而在其他部位的表达则较少,另外 15427基因的表达水平要高于 18197基因。因此本研究建立的 RT-qPCR方法可以进行基因表达水平的研究。
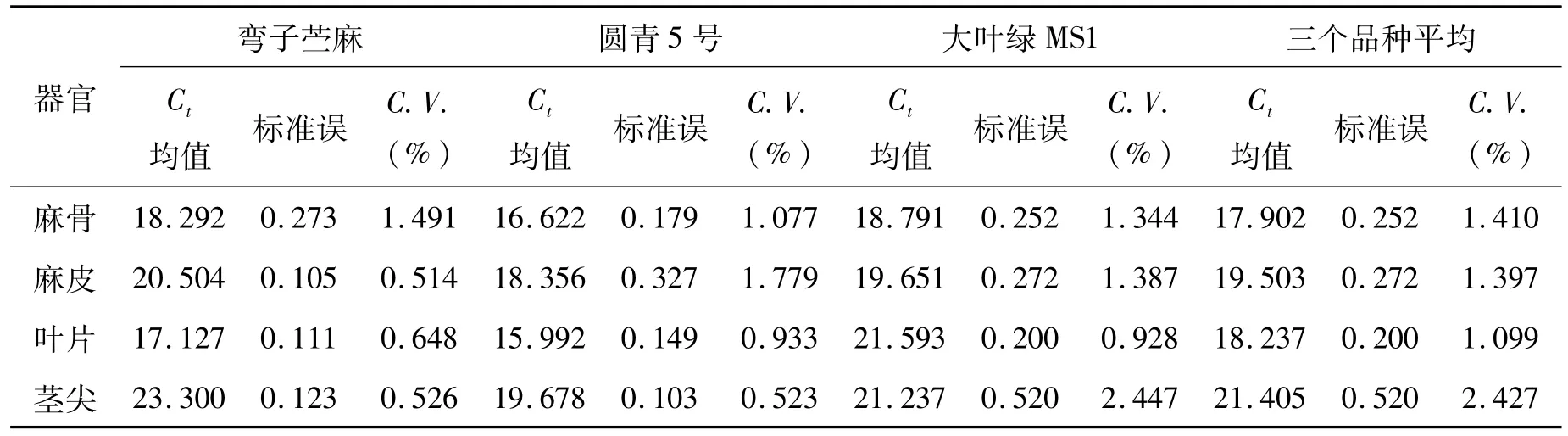
表3 内参基因 ACTIN在不同品种不同器官中的表达稳定性Tab.3 The expression stability of reference gene ACTIN in different organs in different varieties
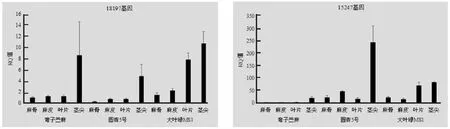
图5 2个基因在 3种苎麻不同器官中 RT-qPCR表达图Fig.5 RT-qPCR expression of2 genes in different organs of3 ramie varieties
3 结论与讨论
3.1 结论
本研究对苎麻不同品种不同部位进行 RNA的提取,发现 RNA的提取量与取样量和部位有直接的关系。苎麻不同部位的提取率以茎尖最大,达 29.9%;其次是叶,提取率为 17.90%。电泳分析表明提取的RNA完整性较好。扩增曲线分析表明2对引物在3个苎麻品种的不同器官组织中都进行了有效的扩增。熔解曲线分析表明 18197、15247和 actin基因在不同苎麻品种的不同器官中的扩增产物熔解曲线较一致,无非特异性扩增产生。对内参基因 actin Ct值分析表明,该基因在不同品种和器官间标准误、变异率较小,可以作为内参进行苎麻相对定量分析研究。对 18197和15247两个基因在苎麻不同品种不同器官间的表达量进行分析,发现两个基因在茎尖的表达量最高,而在其他部位的表达则较少。
3.2 讨论
RNA质量是进行植物分子生物学某些方面研究的必要保证。程超华[11]报道了采用 CTAB发提取苎麻野生近缘种悬铃叶苎麻花序 RNA的方法,RNA提取前所有器具和耗材都需要用 0.1%的DEPC水处理 15 h以上后再高温灭菌,RNAplant[13],pBIOZOL[16-21],Trizol[12,22]和 Invitrogen公司的Plant RNA Reagent和 ConcertTM PlantRNA Reagent[25,27]试剂提取 RNA都需要采用同样的办法处理。而本试验中采用试剂盒法提取,所有耗材均采用试剂盒提供的无核酸酶的离心管,不仅避免了使用有毒的 DEPC,又节约了时间。目前报道可以成功提取苎麻的 RNA的试剂盒有 Promega公司 SVTotal RNA Isolation System试剂盒[23,24],OMEGA公司 Plant RNA Kit[26],Ambiogen公司的植物RNA提取试剂盒[28],这些试剂盒均为进口,与本研究使用的试剂盒相比成本较高。因此本研究使用试剂盒法,既可以节约人力和时间成本,价格又较低,对于需要提取多个材料进行荧光定量 PCR分析经济又方便。从提取所需样品量和提取的浓度来看,CTAB法提取 0.4~0.5 g悬铃叶苎麻叶片的 RNA得率在 13% ~15%,而使用本试验提取的苎麻只需 0.1 g材料,获得的 RNA浓度大于100 ng/uL,得率最低的为 5.42%,基本上可以满足实时定量 PCR实验对 RNA浓度的要求,这与其他人[16-28]的报道结果相似。
苎麻实时定量 PCR技术体系已有很多报道[16-25],目前反转录 cDNA体系大都是 20~50 uL体系,如果检测基因多,则 cDNA模板量不足,本实验经过摸索发现,cDNA模板稀释 8倍的扩增结果与不稀释没有显著性差别,因此实验选择模板 cDNA稀释 8倍进行荧光定量 PCR分析。
荧光定量 PCR检测灵敏度很高,引物的优劣对实验影响较大,一般要求引物无非特异扩增,无引物二聚体。本实验采用 NCBI网站提供的 primer-BLAST进行特异引物设计,一般引物的长度都控制在 100~300 bp[24,25],因为产物越长,越容易出现假阳性,同时使得 Ct值出现较晚。但是对于有多个同源序列的基因检测,如何避免引物形成稳定的二聚体或发夹结构,错配及避免基因组的扩增是需要考虑的,在本试验中,引物设计时考虑了引物的长度在 18~25 bp,Tm值在 60℃左右、GC含量 40% ~60%,跨两个外显子等要求,所有引物扩增片段长度都在 300~500 bp,Tm值都大于 55℃,经过熔解曲线分析表明,本试验设计的引物可以进行荧光定量 PCR分析,这为荧光定量 PCR引物的设计提供了参考。
荧光定量 PCR分析方法有绝对定量分析法和相对定量分析法,马雄风等[25]和刘建新等[27]都对绝对定量法进行了研究,以 cDNA和相应引物进行普通 PCR扩增,然后将 PCR产物进行10倍梯度稀释用于制备标准曲线,并获得拟合方程用于后期目的基因定量分析。本研究采用的相对定量方法与他人报道的方法相同[17-24,29],采用的都是 2-ΔΔCt方法计算基因相对表达量。相对定量分析中内参基因的选择会影响 RT-qPCR的结果,用表达稳定的内参基因进行校正和标准化可以减少样品之间和样品内部的差异,从而减少样本之间的误差。一般来说管家基因常常作为内参基因。在苎麻研究中,actin基因[16-20,22-24,27],18S rRNA和 histone3基因[25,29]都可以用来做内参基因,尤其是 actin基因使用的频率较高。actin基因在各种类型的细胞中都能进行恒定表达,本研究也发现 actin基因在不同品种和同一品种的不同部位表达差异都较小,作为苎麻 RT-qPCR分析的内参是可以的,但是否有更好的内参基因,需要进一步研究确定。
[1]HiguchiR,Dollinger G,Walsh PS,etal.Simultaneous amplification and detection of specific DNA sequences[J].Biotechnology(NY),1992,10:413.
[2]王玉倩,薛秀花.实时荧光定量 PCR技术研究进展及其应用[J].生物学通报,2016,51(2):1-6.
[3]周良云,刘谈,王升,等.实时荧光定量 PCR研究进展及其在中药领域的应用[J].中国现代中药,2016,18(2):246-251,261.
[4]Bustin SA,Benes V,Nolan T,etal.Quantitative real-time RT-PCR -a perspective[J].Journal ofMolecular Endocrinology,2005,34(3):597-601.
[5]Kubista M,Andrade JM,Bengtsson M,et al.The real-time polymerase chain reaction[J].Mol Aspects Med,2006,27(2-3):95-125.
[6]VanGuilder H D,Vrana K E,Freeman W M.Twenty-five years of quantitative PCR for gene expression analysis[J].Biotechniques,2008,44(5):619-626.
[7]Wong M L,Medrano JF.Real-time PCR formRNA quantitation[J].Biotechniques,2005,39(1):75-85.
[8]Chen R,Mayumi G,Yoshihisa N,et al.Selection of Housekeeping Genes for Transgene Expression Analysis in Eucommiaulmoides Oliver Using Real-Time RT-PCR[J].Journal of Botany,2010:1-8.
[9]侯维海,孙鹏,陈全家,等.地黄实时定量 PCR内参基因的筛选[J].中国农学通报,2011,27(17):76-82.
[10]李宗道.苎麻生理生化与遗传育种[M].北京:农业出版社,1989.
[11]程超华,赵立宁,臧巩固,等.一种提取悬铃叶苎麻(B.tricuspis(Hance)Marino)花序 RNA的方法[J].中国麻作,2006,28(2):76-78.
[12]陈建荣.苎麻木质素合成关键酶 CCoAOMT基因分离及遗传转化的研究[D].长沙:湖南农业大学,2005.
[13]邢虎成,佘玮,秦占军,等.苎麻不同组织总 RNA的有效分离[J].2007,11(1):21-24.
[14]高志晖,魏建和,熊焕英.几种提取白木香茎干总 RNA方法的比较[J].生物技术通讯,2012(5):718-721.
[15]魏敏,熊建华,李阳生,等.实时 PCR定量分析干旱胁迫下水稻糖原合成酶激酶基因表达差异[J].中国水稻科学,2006,20(6):567-577.
[16]余伟林,钟英丽,揭雨成,等.苎麻 α-amylase基因的克隆与表达[J].农业生物技术学报,2014,22(1):27-36.
[17]薛丽君,周精华,邢虎成.苎麻 ACC氧化酶基因(BnACO1)的克隆及表达[J].中国农业科学,2013,46(11):2377-2385.
[18]周精华,揭雨成,邢虎成,等.苎麻 BnbZIP1转录因子基因的克隆与表达特征分析[J].中国农业科学,2013,46(7):1314-1322.
[19]朱守晶,余伟林,石朝燕,等.苎麻谷胱甘肽还原酶基因(BnGR1)的克隆和表达分析[J].农业生物技术学报,2015,23(10):1318-1326.
[20]朱守晶,周精华,揭雨成,等.苎麻抗坏血酸过氧化物酶基因的克隆和表达分析[J].植物遗传资源学报,2013,14(5):879-884.
[21]朱守晶,石朝艳,余伟林,等.苎麻植物螯合肽合成酶 BnPCS1基因的克隆和表达特性分析[J].植物遗传资源学报,2014,15(3):582-588.
[22]周精华,余伟林,邢虎成,等.苎麻 ACC合酶基因(BnACS1)的克隆和表达分析[J].作物学报,2012,38(12):2306-2311.
[23]刘昱翔,陈建荣,彭彦,等.两种苎麻纤维素合酶基因 cDNA序列的克隆及表达[J].作物学报,2014,40(11):1925-1935.
[24]唐映红,陈建荣,刘芳,等.苎麻肉桂酰辅酶 A还原酶基因 cDNA序列的克隆与分析[J].作物学报,2015,41(9):1324-1332.
[25]马雄风,喻春明,唐守伟,等.苎麻 Actin1基因克隆及其在韧皮部纤维不同发育阶段的表达[J].作物学报,2010,36(1):101-108.
[26]郑建树,喻春明,陈平,等.苎麻谷氨酰胺合成酶 BnGS2等位基因的克隆及其转基因烟草特性[J].中国农业科学,2014,47(17):3348-3358.
[27]刘建新,喻春明,唐守伟,等.苎麻果胶合成关键酶 GalAT基因的克隆及表达[J].中国农业科学,2009,42(2):425-433.
[28]黄妤,刘峰,郭清泉,等.苎麻生长素结合蛋 ABP1基因 cDNA的克隆及表达[J].作物学报,2008,34(8):1358-1365.
[29]Liu TM,Zhu SY,Tang QM,etal.De novo assembly and characterization of transcriptome using Illumina paired-end sequencing and identification of CesA gene in ramie(Boehmeria nivea L.Gaud)[J].BMCGenomics,2013,14(1):125.
Establishment of Real-time Quantitative PCR System for Ram ie
MA Xin1,TAN Songlin1,XING Hucheng1,2,3*,LIAO Shaobo1
(1.Ramie Institute of Hunan Agricultural University,Changsha 410128,China;2.Hunan Provincial Key Laboratory of Corp Germplasm Innovation and Utilization,Changsha 410128,China;3.Grass Research Institute of Hunan Agricultural University,Changsha 410128,China)
The application of real-time quantitative PCR technology iswidely used at present.The accuracy of real-time quantitative PCR is affected by RNA quality and reverse transcription efficiency,amplification efficiency and reference gene.In this study,real-time quantitative PCR system was established using 3 ramie varieties,2 ramie gene sequence,and actin gene sequence as the reference gene. The results showed that RNA extracted by RNAkits canmeet the requirements of RT-qPCR.The amplification curve and melting curve were consistentwith the experimental requirements.Actin gene can be used as a reference for research on relative quantitative analysis of ramie.Relative quantitative analysis shows that the RT-qPCR method established in this study can be used to study gene expression level. This study can provide reference for the application of real-time quantitative PCR in ramie.
ramie;real-time PCR;RNA;
S563.1
A
1671-3532(2017)03-0111-09
2016-12-19
湖南省自然科学基金项目(2015JJ2083)
马鑫(1989-),女,在读硕士,主要从事麻类作物种质资源及遗传育种工作。E-mail:348554662@qq.com
邢虎成(1978-),男,副教授,主要从事麻类作物种质资源及遗传育种工作。E-mail:xhcsoldier@163.com
