基于光子晶体带边效应的表面增强拉曼基底
2017-06-15赵文斌王梦凡曾川齐崴苏荣欣何志
赵文斌+王梦凡+曾川+齐崴+苏荣欣+何志敏

摘 要 将光子晶体的带边效应与金纳米粒子的拉曼散射增强作用相结合,制备了一种新型光子晶体表面增强拉曼散射基底(PCAuNPs),利用罗丹明B(RhB)作为报告分子,对所得基底性能进行检测。PCAuNPs基底的制备包括3个步骤:在SiO2微球表面修饰氨基,再通过垂直沉降自组装得到蛋白石结构光子晶体(PC), 最后, 在光子晶体表面负载金纳米粒子(AuNPs)。结果表明,光子晶体的带隙范围及AuNPs的负载量直接影响了PCAuNPs基底的检测效果;以所得的PCAuNPs基底测定RhB分子,其拉曼散射特征峰强度与浓度对数值呈现良好的线性关系,线性方程为I=1711lg[RhB(mol/L)]+15244,线性相关系数R2=0.9994,检出限为1×108 mol/L,表明此PCAuNPs基底可用于目标物的定性及定量检测。本方法提高了传统拉曼散射光谱检测灵敏度,操作简单,具有良好的重现性,可为其它新型检测基底的制备提供。
关键词 表面增强拉曼散射光谱; 光子晶体; 带边效应; 金纳米粒子
1 引 言
表面增强拉曼散射(Surface enhanced Raman scattering, SERS)是在拉曼散射原理的基础上,通过引入表面粗糙的纳米金属材料作为基底,大幅度提高待测物拉曼散射强度的一种技术[1,2]。近年来,随着纳米技术的发展,人们借助物理光刻[3]、磁控溅射[4]、有序组装[5]、固相基底原位合成[6]等方法开发出许多新型SERS基底,并广泛应用于生物医学、环境污染及食品安全等检测领域[7~10]。如Cottat等[11]利用电子束刻蚀法制得了周期性排列的硅模板,通过磁控溅射沉积金纳米颗粒层,获得了结构均一、重现性好的SERS基底,对1 mmol/L卵白素具有良好的检测效果。Guo等[12]在玻璃表面通过静电吸附作用结合空心金纳米球,利用此SERS基底检测牛奶中的三聚氰胺,检出限达到1 mg/L。Zhao等[13]利用水热法在氧化石墨烯表面原位还原氯金酸, 得到了负载金纳米粒子的石墨烯SERS基底,实现了对Pb2+的定量检测。
光子晶体(Photonic crystal,PC)是不同介电常数的介质呈周期性排列的纳米材料,由此产生的光子带隙(Photonic band gaps,PBGs)能够抑制特定频率的光在其中传播[14]。这一性质使光子晶体被应用于图像显示[15~17]、传感检测[18~20]、图形防伪[21,22]等领域。光子晶体带边效应是指在光子带隙带边位置,光传播的群速度趋于零,光子态密度(Density of states,DOS)显著增大,使得光与物质间的相互作用增强,有效地提高了光信号的输出强度[23,24],因此光子晶体常被应用于光学信号的放大[25,26]。Shen等[25]将光子晶体与蛋白荧光免疫检测体系相结合,在光子晶体短波带边与激发波长匹配的条件下,将信号强度提高了两个数量级。Jovic等[26]通过将反蛋白石光子晶体长波带边与TiO2 电子吸收边相匹配,使气相乙醇的光氧化效率提高了两倍。
2 实验部分
2.1 仪器与试剂
NTEGRA Spectra多功能拉曼光谱仪(俄罗斯NTMDT公司); S4800场发射扫描电子显微镜(日本日立公司); Nano ZS型纳米粒度及Zeta电位仪(英国马尔文公司)。
氯金酸(HAuCl4·3H2O,Sigma Aldrich);罗丹明B(RhB,Aladdin)。正硅酸四乙酯(TEOS)、氨水、乙醇、3氨丙基三乙氧基硅烷(APTES)、异丙醇、柠檬酸钠等均为市售分析纯。载玻片(75 mm×25 mm)浸泡在H2SO4H2O2(7∶3, V/V)混合液中12 h,去离子水超声洗涤3次并吹干后使用。除特殊说明外,实验用水均为二次蒸馏水。
2.2 单分散SiO2微球的制备及氨基修饰
利用Stber法[28]制备单分散SiO2微球。于250 mL圆底烧瓶中加入适量水,1100 r/min磁力搅拌下,加入16.25 mL乙醇和9 mL氨水。随后将4.5 mL TEOS和45.5 mL乙醇混合均匀,迅速加入圆底烧瓶中。1100 r/min磁力搅拌1 min后调低转速至380 r/min。混合液在25 ℃恒温水浴中反应2 h,得到乳白色悬浊液,于8000 r/min转速下离心分离,并用乙醇和水分别洗涤3次,冷冻干燥, 备用。
Stber法是经典的制备单分散SiO2微球的方法,通过改变反应温度、氨水浓度、加入纯水量等条件,可以制备不同粒径的单分散微球。本研究中首先利用Stber法,合成了一定粒径且单分散性良好的SiO2微球。由于柠檬酸钠还原法制备的AuNPs表面带负电[31],为了增强AuNPs与SiO2微球的结合,在步骤(1)中利用APTES对SiO2微球进行氨基修饰,使其表面带正电,通过静电相互作用结合AuNPs。在步骤(2)中,经Prianha溶液处理后的载玻片被垂直插入SiO2微球乙醇悬浮液,随着乙醇蒸发,微球在弯液面作用力和毛细管力的驱动下,于载玻片表面自组装形成有序的蛋白石结构光子晶体。第(3)步,将AuNPs水溶液均匀滴加至蛋白石结构表面,随着溶剂的自然蒸发,在静电作用和蛋白石结构毛细力共同作用下,AuNPs结合在SiO2微球的表面及间隙中,最终制得PCAuNPs基底。检测时,将待测物溶液滴于PCAuNPs基底表面,待自然干燥后,进行表面增强拉曼光谱的测定。
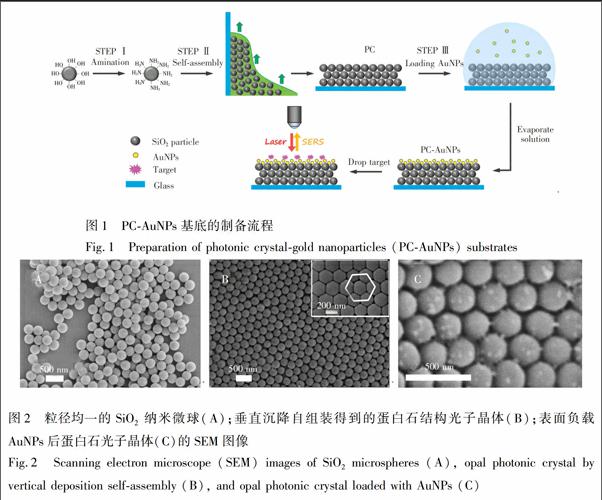
图2A为本研究中制备的SiO2微球的SEM图,其粒径均一(262 nm),单分散系数为0.005,球形度好。圖2B为垂直沉降自组装后的蛋白石结构光子晶体,由内嵌图片可见,SiO2微球密堆积呈规则的面心立方排列结构。图2C为结合AuNPs后的蛋白石光子晶体SEM图,AuNPs较均匀地分布于蛋白石结构表面和间隙中,相邻的金纳米颗粒间距小于15 nm,增强了AuNPs间隙处的电荷密度及局域电磁场密度。
3.2 光子带隙对PCAuNPs基底检测效果的影响
光子晶体对表面增强拉曼光谱的作用来自两个方面:(1)光子晶体的结构效应:SiO2微球密堆积形成的蛋白石结构在纳米尺度上存在球与球之间的间隙凹陷和单个微球顶部凸起的分层组合,大大增加了该结构的比表面积[32],当微球表面和球与球的间隙中结合大量的AuNPs时,会产生高密度的“热点”,从而增强SERS信号。(2)光子晶体的带边效应[23,24]: 光子晶体具有周期性的介电结构,其内部态密度(DOS)的分布不同于均匀介质,在光子带隙中DOS趋于零,而在带边位置DOS显著增加。当拉曼激光波长与光子带隙带边波段匹配时,光电场与金属纳米颗粒的相互作用被增强,局域光电场强度增大,令待测分子的拉曼信号得到增强。因此,光子带隙带边范围与所选拉曼激光波长的匹配度,将直接影响PCAuNPs基底的拉曼信号增强效果。
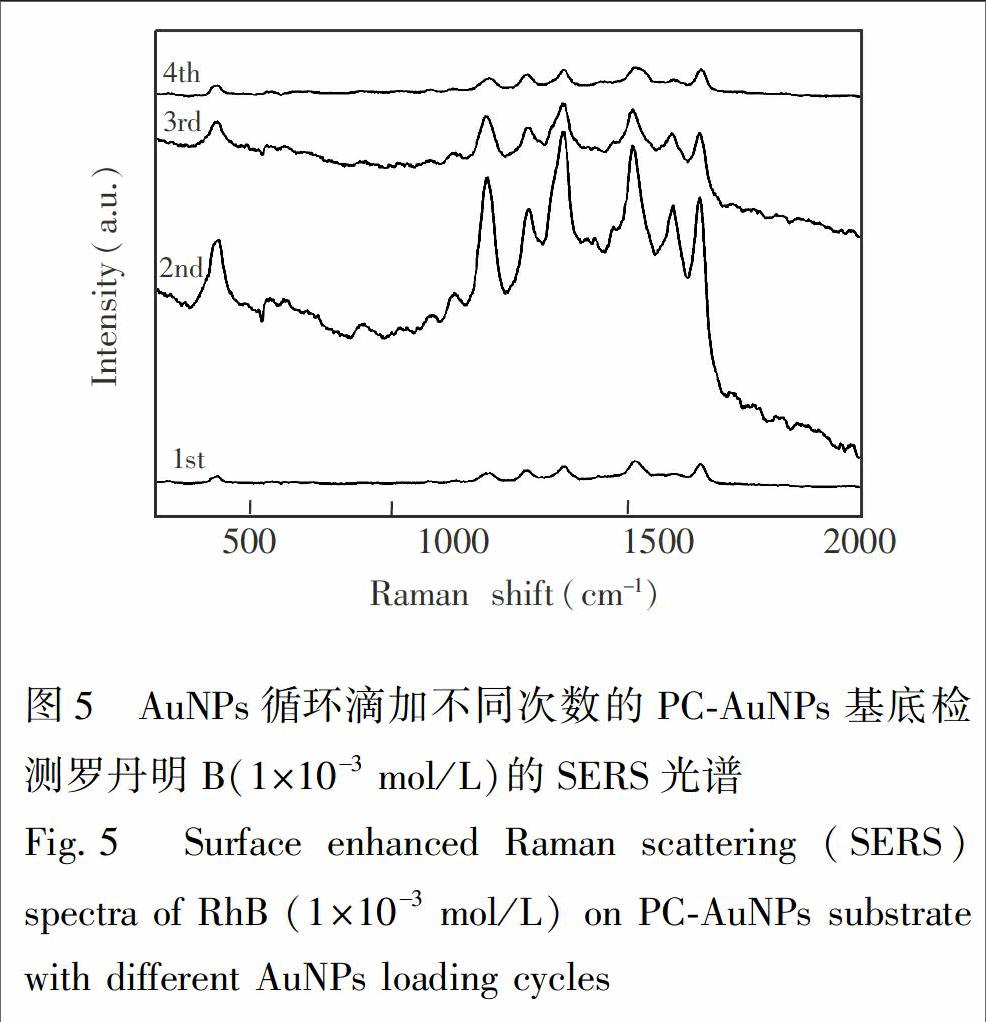
图4A~D分别为在PCⅡ表面循环滴加1~4次AuNPs溶液并蒸干溶剂后所得PCAuNPs基底的SEM图,AuNPs溶液浓度为0.5 mmol/L,每次滴加量为30 μL。从图4可见,随着循环滴加次数的增加,PC表面负载AuNPs的量逐渐增多,密集程度逐渐增大。图5为相应PCAuNPs基底检测RhB的拉曼光谱结果。在第1次滴加后,蛋白石结构表面仅结合了少量AuNPs,拉曼信号强度很弱,这是由于AuNPs过于分散,使得局域电场强度较低(图5, 1st)。当循环次数为2次时,在SiO2微球表面和间隙中结合的AuNPs量均增多,且分布均匀,使得AuNPs间隙处的电荷密度增高,形成较强的局域电场,RhB的拉曼光谱信号得到明显增强(图5, 2nd)。当循环次数为3次时,AuNPs的负载量进一步增大,在小范围内部分AuNPs聚集,减弱了粒子之间的共振效应,拉曼信号强度有所减弱(图5, 3rd)。当循环次数为4次时,AuNPs在大范围内发生聚集,过多占据了蛋白石结构的表面和间隙,导致RhB的拉曼信号大幅减弱(图5,4th)。综上,AuNPs的负载量直接影响了PCAuNPs基底的SERS增强效果。本研究中以循环滴加2次AuNPs溶液制备的PCAuNPs基底为最佳。
References
1 Schlucker S. Angew. Chem. Int. Ed., 2014, 53(19): 4756-4795
2 LUO ZhiXun, FANG Yan. Spectroscopy and Spectral Analysis, 2006, 26(2): 358-364
骆智训, 方 炎. 光谱学与光谱分析, 2006, 26(2): 358-364
3 Radha B, Lim S H, Saifullah M S, Kulkarni G U. Sci. Rep., 2013, 3: 1078
4 ubr M, Petr M, Kylin O, Kratochvíl J, Prochzka M. J. Mater. Chem. C, 2015, 3(43): 11478-11485
5 Ma Z, Tian L, Qiang H. J. Nanosci. Nanotechnol., 2009, 9(11): 6716-6720
6 Kitahama Y, Itoh T, Aoyama J, Nishikata K, Ozaki Y. Chem. Commun., 2009, (43): 6563-6565
7 Han X X, Chen L, Kuhlmann U, Schulz C, Weidinger I M, Hildebrandt P. Angew. Chem. Int. Ed., 2014, 53(9): 2481-2484
8 TANG XiaoPing, ZHANG XiaoFang, QI XiaoHua, ZOU MingQiang, SHAO Yong, WANG JiPing, ZHOU Jian, CUI ShaSha. Chinese J. Anal. Chem., 2015, 43(8): 1224-1230
唐晓萍, 张孝芳, 齐小花, 邹明强, 邵 勇, 王纪平, 周 建, 崔莎莎. 分析化学, 2015, 43(8): 1224-1230
9 Cao Q, Liu X,Yuan K, Yu J, Liu Q, Delaunay J J, Che R. Appl. Catal. B, 2017, 201: 607-616
10 ZHAO RuiChi, WANG PeiLong, SHI Lei, SU XiaoOu. Chinese J. Anal. Chem., 2017, 45(1): 75-82
趙蕊池, 王培龙, 石 雷, 苏晓鸥. 分析化学, 2017, 45(1): 75-82
11 Cottat M, LidgiGuigui N, Tijunelyte I, Barbillon G, Hamouda F, Gogol P, Aassime A, Lourtioz J M, Bartenlian B, de la Chapelle ML. Nanoscale Res. Lett., 2014, 9(1): 623
12 Guo Z, Cheng Z, Li R, Chen L, Lv H, Zhao B, Choo J. Talanta, 2014, 122: 80-84
13 Zhao L, Gu W, Zhang C, Shi X, Xian Y. J. Colloid Interface Sci., 2016, 465: 279-285
14 Zhao Y, Shang L, Cheng Y, Gu Z. Acc. Chem. Res., 2014, 47(12): 3632-3642
15 Kim S H, Jeon S J, Jeong W C, Park H S, Yang S M. Adv. Mater., 2008, 20(21): 4129-4134
16 Yu Z, Wang C F, Ling L, Chen L, Chen S. Angew. Chem. Int. Ed., 2012, 51(10): 2375-2378
17 Zhu C, Xu W, Chen L, Zhang W, Xu H, Gu Z Z. Adv. Funct. Mater., 2011, 21(11): 2043-2048
18 Zhao Y, Zhao X, Tang B, Xu W, Li J, Hu J, Gu Z. Adv. Funct. Mater., 2010, 20(6): 976-982
19 LAN XiaoBo, ZHAO WenBin, WANG MengFan, QI Wei, SU RongXin, HE Zhimin. Chinese J. Anal. Chem., 2015, 43(4): 471-478
蘭小波, 赵文斌, 王梦凡, 齐 崴, 苏荣欣, 何志敏. 分析化学, 2015, 43(4): 471-478
20 Phillips K R, England G T, Sunny S, Shirman E, Shirman T, Vogel N, Aizenberg J. Chem. Soc. Rev., 2016, 45(2): 281-322
21 Bai L, Xie Z, Wang W, Yuan C, Zhao Y, Mu Z, Zhong Q, Gu Z. ACS Nano, 2014, 8(11): 11094-11100
22 Zhang J, Yang S, Tian Y, Wang C F, Chen S. Chem. Commun., 2015, 51(52): 10528-10531
23 John S, Quang T. Phys. Rev. A, 1994, 50(2): 1764
24 Li Z Y, Lin L L, Zhang Z Q. Phys. Rev. Lett., 2000, 84(19): 4341
25 Shen W, Li M, Xu L, Wang S, Jiang L, Song Y, Zhu D. Biosens. Bioelectron., 2011, 26(5): 2165-2170
26 Jovic V, Idriss H, Waterhouse G I. Chem. Phys., 2016, 479: 109-121
27 Mu Z, Zhao X, Huang Y, Lu M, Gu Z. Small, 2015, 11(45): 6036-6043
28 Stber W, Fink A, Bohn E. J. Colloid Interface Sci., 1968, 26(1): 62-69
29 Ge J, Zhang Q, Zhang T, Yin Y. Angew. Chem. Int. Ed., 2008, 120(46): 9056-9060
30 Lee H, Lee M Y, Bhang S H, Kim B S, Kim Y S, Ju J H, Kim K S, Hahn S K. ACS Nano, 2014, 8(5): 4790-4798
31 Sonavane G, Tomoda K, Makino K. Colloids Surf. B, 2008, 66(2): 274-280
32 Zheng S, Zhang H, Ross E, Le T V, Wirth M J. Anal. Chem., 2007, 79(10): 3867-3872
33 Zhang J, Li X, Sun X, Li Y. J. Phys. Chem. B, 2005, 109(25): 12544-12548
34 Yan H, Gu C, Yang C, Liu J, Jin G, Zhang J, Hou L, Yao Y. Appl. Phys. Lett., 2006, 89(20): 204101
