表面辅助激光解吸电离—飞行时间质谱中多聚体离子产生规律的研究
2017-06-15聂龙辉王卫国
聂龙辉+王卫国

摘 要 表面辅助激光解吸电离质谱(SALDIMS)已经成为固态、液态样品分析的重要手段,并且分析对象逐渐由生物大分子扩展到小分子。然而,对小分子电離微观反应机理的研究仍处于起步阶段。本研究选择3种分子结构相似的稠环芳烃化合物芘、六苯并苯、红荧烯作为研究对象,考察了这3种化合物激光电离产物的差异,并研究了激光能量对六苯并苯产物离子分布的影响。结果表明,观察到芘、六苯并苯多聚体离子产物,还观测到了六苯并苯失去C2H2的碎片离子峰;而没有观测到明显的红荧烯聚合物离子产物,只观测到了大量失去C6H5的碎片离子峰。最后,对3种不同化合物的激光电离微观机理进行了分析。由于芘、六苯并苯具有平面大π键,分子间的ππ键相互作用是产生多聚体离子的主要原因;而红荧烯的空间位阻削弱了分子间相互作用,从而阻碍了多聚体离子的形成。
关键词 表面辅助激光解吸电离飞行时间质谱; 稠环芳烃; 多聚体离子; ππ键相互作用; 空间位阻
1 引 言
激光电离质谱技术是可直接用于分析固体、液体样品,样品制备简单,避免了繁琐的样品前处理过程,通过调节激光能量,可以实现各种样品的分析。激光电离质谱技术是将激光光源与质谱检测器相结合的新型分析手段。1963年,Honig等[1]发表了第一篇关于激光电离质谱的论文, 将激光离子源与双聚焦质谱仪联用研究了不同参数下的离子产率。随着激光技术的飞跃发展和质谱检测器性能的不断提升,近年来, 激光电离质谱技术在无机微量元素分析[2~5]、环境污染物分析[6]、生物大分子分析[7,8] 等领域受到越来越多的关注。
目前,用于固态和液态样品分析的激光质谱技术主要分为两大类:基质辅助激光解吸电离质谱(MAIDIMS)[9,10]和表面辅助激光解吸电离质谱(SALDIMS)[11~15]。MAIDIMS是可以实现大分子的解吸,是一种重要的生物分析技术[7]。其原理是利用一定强度激光照射样品和基质混合物时,基质从激光中吸收能量,基质和样品发生电荷转移产生样品离子,然后进入质谱检测。但是由于有机小分子基质也发生电离,产生背景信号,会对小分子量化合物产生强烈的干扰。而SALDIMS对材料表面辅助解吸样品分子并用激光进行电离,可以有效避免小分子化合物的干扰,从而将分析对象由大分子扩展到小分子。
SALDIMS的一个重要应用领域是沥青质化学[16~23]。沥青质多由芳香环和芳杂环构成[16,17],通过研究沥青质分子量分布可以对其形成年代和地域进行溯源。前期研究结果显示, 不同激光能量获得的质量分布差异很大,平均分子量从2000到50000不等[22,23]。目前仍存在争议:AlMuhareb等采用高激光能量观测到峰值在50000的质量数分布,他们认为低激光能量不足以解析大质量数的沥青质[22];Hortal等则认为激光能量过大会引起分子聚合,在解吸电离过程中形成大质量数团簇离子[22,23]。因此,深入研究表面辅助激光解吸电离的微观机理对于谱图的准确解析具有重要意义。本研究选取3种与沥青质结构相似的、含有苯环的高度对称结构化合物芘、六苯并苯、红荧烯(如图1所示)进行了检测。研究了它们在激光场中的电离产物差异,发现具有共面π键结构的芘、六苯并苯观测到了大量的团簇离子产物,而红荧烯产生了大量的碎片离子。考察了激光能量对产物离子及其分布规律的影响,并对产物离子的形成机理进行了分析。本研究可为激光电离质谱的谱图解析和归属提供参考。
2 实验部分
2.1 仪器与试剂
实验采用自制的表面辅助解析电离飞行时间质谱。甲苯(分析纯,天津市科密欧化学试剂有限公司);芘(分析纯,百灵威科技有限公司); 六苯并苯和红荧烯(分析纯,大连瑞凯姆石化有限公司)。
2.2 实验方法
以甲苯为溶剂,分别配制2 mg/mL的芘、六苯并苯和红荧烯的标准溶液。分别滴加2和6 μL标准溶液于样品靶台上,待溶剂甲苯挥发10 min后,在样品靶表面2.3 mm的圆盘上得到待测样品。将待测样品放入质谱的解析/电离腔体内,经激光解吸和电离后,在质谱探测器中进行检测。
本实验所用的电离激光为波长355 nm的Nd∶YAG激光器, 激光能量范围为1000~6000 nJ,电离区光斑直径约为0.5 mm。数据采集卡包括微通道板,高速瞬态数据采集卡和前置放大器等。测量时真空度保持在104 Pa量级。正离子模式下采集质量范围m/z 0~20000的质谱信号。
3 结果与讨论
3.1 芘、六苯并苯、红荧烯谱图分析
激光能量为3000 nJ时,芘、六苯并苯、红荧烯的SALDIMS质谱图见图2,观测到了芘、六苯并苯明显的聚合离子峰和碎片离子峰。其中,芘的团簇离子的聚合分子数最多达到4个;六苯并苯团聚的团簇离子的聚合分子数最多达到10个以上(为了能够在图中标注谱峰的归属,显示的范围在m/z 0~2000,更大质量数的未展示),且随着结合分子数量的增加,信号强度近似指数形式逐渐衰减。这种差异归结于不同分子结构的差异,六苯并苯分子的ππ键作用比芘分子更强,而红荧烯分子的空间位阻阻碍了分子聚合,导致未能观察到聚合离子峰(详细见讨论部分)[24,25]。同时,没有观察到芘分子碎片离子峰,六苯并苯观测到了失去1~3个C2H2的碎片离子峰,红荧烯断裂CC键失去1个或2个C6H5基团的谱峰。
3.2 激光能量的影响规律
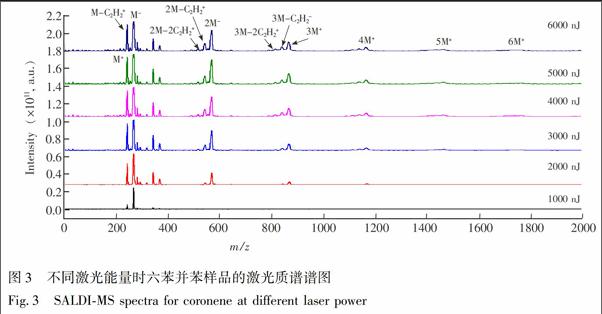
图3给出了不同激光能量时六苯并苯的SALDIMS质谱图。从图3可见,在激光能量为1000 nJ时,仅观测到母体离子峰和少量失去一个C2H2的谱峰。随着激光能量增加,聚合物分子离子的谱峰强度增大,聚合分子数增多。这是因为增加激光能量,热解吸和电离的分子数均逐渐增大,真空腔内样片表面附近形成高浓度的等离子体,导致中性分子和分子离子碰撞聚合的几率增大,从而检测到大量团簇离子谱峰。M+,2M+,3M+,4M+,5M+,6M+离子(M代表六苯并苯分子)近似呈指数形式递减,这是由于多分子碰撞结合形成大分子团簇离子的几率逐渐降低导致的结果。而且还可以观察到,随着激光能量增大,出现了明显的(2M C2H2)+,(2M 2C2H2)+,(3M C2H2)+,(3M 2C2H2)+ 离子质谱峰。
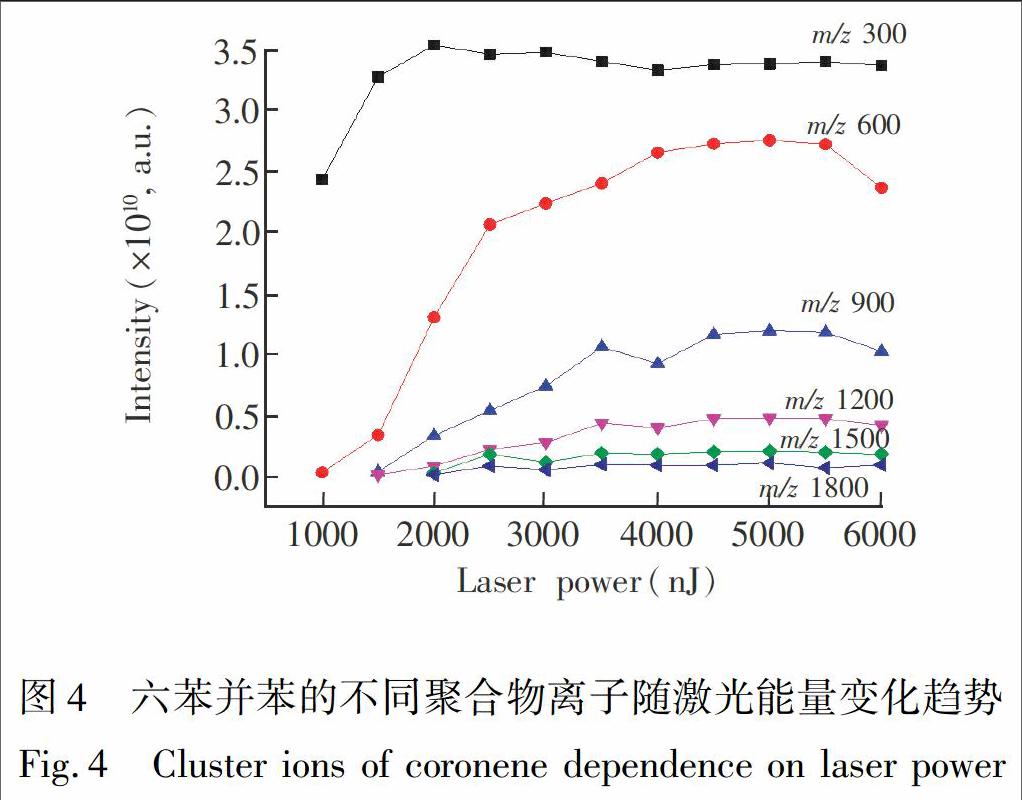
图4给出了六苯并苯的不同聚合物离子随激光能量变化趋势,其中激光能量步长为500 nJ。质量数m/z 300,600,900,1200,1500,1800分別代表了M+,2M+,3M+,4M+,5M+,6M+离子(M代表六苯并苯分子)。可以看出,各离子强度在低激光能量内随能量的增加而增大,继续增加激光能量,各离子峰强度基本保持不变。
3.3 稠环芳烃质谱分析与讨论
芘、六苯并苯、红荧烯聚合离子峰会出现差异,可以归结于ππ键的相互作用。在DNA的结构中以及药物分子同蛋白质的相互作用,ππ键相互作用扮演了重要的角色。ππ键相互作用是具有平面结构的芳香性分子或官能团之间非键合作用,主要来源于体系的色散相互作用。前人对苯分子的理论研究[24,25]表明,这种相互作用会使苯环体堆叠的最优结构,且平行堆叠相互作用随苯环数目增加而增大。芘和六苯并苯同为平面结构,六苯并苯的苯环数量比芘中的多,ππ键相互作用更强,更容易形成聚合体。这解释了芘比六苯并苯体系观测到离子中的聚合分子数目少的原因。
红荧烯虽然具有更多的苯环结构,但是整个分子却并非平面结构。它是由一个并四苯构成的骨架结构,并且由4个苯基取代并四苯的5,6,11,12号氢原子构成的支环组成。由于四个苯基之间存在位阻效应,使得苯基与并四苯不在同一个平面内,而是与并四苯所形成的平面呈一定夹角[23,24]。这种空间位阻使得红荧烯很难聚合,因此没有观测到明显的聚合物离子。综上所述,具有苯环结构的平面型分子在激光电离质谱中容易产生聚合物离子,这种离子可以通过质量数之间的倍数差异进行归属;另外,对于未知样品,可以通过对聚合物离子形成及分布研究对样品分子的立体结构和构成进行分析研究。
4 结 论
利用表面辅助激光解吸电离质谱技术研究了3种稠环芳烃化合物(芘、六苯并苯、红荧烯)激光解吸电离产物的差异。结果表明,可以观察到芘和六苯并苯多聚体离子产物,还观测到了六苯并苯失去C2H2的碎片离子峰;而没有观测到明显的红荧烯聚合物离子产物,共观测到了大量失去C6H5的碎片离子峰。通过对3种化合物的激光电离微观机理的分析,得出结论:由于芘和六苯并苯平面大π键,这种分子间的ππ键相互作用导致了多聚体离子的形成;而红荧烯的空间位阻削弱了分子间的相互作用,从而阻碍了多聚体离子的形成。本研究结果对于SALDIMS中产物离子谱图的解析和归属具有重要的参考意义。
References
1 Honig R E, Woolstron J R. Appl. Phys. Lett., 1963, 2(7): 138-139
2 Cheng Y H, Zhang Y, Chau S L, Lai S K M, Tang H W, Ng K M. ACS Appl. Mater. Interfaces, 2016, 8(43): 29668-29675
3 Popovié I A, Nei M, Vranjes M, aponjic' Z, Petkovié M. Anal. Bioanal.Chem., 2016, 408(26): 7481-7490
4 Juang Y M, Chien H J, Chen C J, Lai C C. Talanta, 2016, 153: 347-352
5 Fujii M, Nakashima N, Niidome Y. Opt. Mater. Express, 2016, 6(4): 1376-1383
6 Yonezawa T, Asano T, Matsubara M. Bull Chem. Soc. JPN, 2016, 89(3): 346-353
7 Karas M, Hillenkamp F. Anal. Chem., 1988, 60(20): 2299-2301
8 Vorderwülbecke S, Cleverley S, Weinberger S R, Wiesner A. Nat. Methods, 2005, 2(5): 393-395
9 BhaisareM L, Wu B S, Wu M C, Khan M S, Tseng M H, Wu H F. Biomater. Sci., 2016, 4(1): 183-194
10 SONG ShaoYun, ZHOU LiHua, ZHANG ChuYing, ZHANG YiShun. Journal of Instrumental Analysis, 2013, 32(8): 983-987
宋少云, 周丽华, 张楚英, 张以顺. 分析测试学报, 2013, 32(8): 983-987
11 Popovic' I, Milovanovic' D, Miletic' J, Neic' M, Vranje M, aponjic' Z, Petkovic M. Opt. Quantum Electron., 2016, 48(2): 113
12 YANG MengRui, WANG Ming, ZHOU Jian, TANG XiaoYan, MAO XueFei, WANG TongTong. Chinese J. Anal. Chem., 2016, 44(2): 513-518
杨梦瑞, 王 敏, 周 剑, 汤晓艳, 毛雪飞, 王彤彤. 分析化学, 2016, 44(2): 513-518
13 LI XiangYi, FANG Xi, REN HaoWei, CHENG Lin, ZHANG Tuo, FU GuoHong, LIU Ning. Chinese J. Anal. Chem., 2015, 43(5): 631-636
李相怡, 方 曦, 任皓威, 程 琳, 張 拓, 付国红, 刘 宁. 分析化学, 2015, 43(5): 631-636
14 YANG MengRui, WANG Min, TANG XiaoYan, ZHOU Jian, MAO XueFei. Chinese J. Anal. Chem., 2015, 43(7): 1058-1062
杨梦瑞, 王 敏, 汤晓艳, 周 剑, 毛雪飞. 分析化学, 2015, 43(7): 1058-1062
15 DONG MeiHua, SUN ShiMei, JIN Biao. Chinese J. Anal. Chem., 2014, 42(9): 1235-1239
董美花, 孙士美, 金 彪. 分析化学, 2014, 42(9): 1235-1239
16 Hortal A R, MartínezHaya B, Lobato M D, Pedrosa J M, Lago S. J. Mass Spectrom., 2006, 41 (7): 960-968
17 MartinezHaya B, Hortal A R, Hurtado P, Lobato M D, Pedrosa J M. J. Mass Spectrom., 2007, 42 (6): 701-713
18 Hortal A R, Hurtado P, MartinezHaya B, Mullins O C. Energy Fuels, 2007, 21 (5): 2863-2868
19 Tanaka R, Sato S, Takanohashi T, Hunt J E, Winans R E. Energy Fuels, 2004, 18 (5): 1405-1413
20 Sheremata J M, Gray M R, Dettman H D, McCaffrey W. Energy Fuels, 2004, 18 (5): 1377-1384
21 Murgich J, Abanero J A, Strausz O P. Energy Fuels, 1999, 13 (2): 278-286
22 AlMuhareb E, Morgan T J, Herod A A, Kandiyoti R. Pet. Sci. Technol., 2007, 25: 81-91
23 Hortal A R, MartínezHaya B, Lobato M D, Pedrosa J M, Lago S. J. Mass Spectrom., 2006; 41: 960-968
24 Kfer D, Ruppel L, Witte G, Wll Ch. Phys. Rev. Lett., 2005, 95: 166602
25 Petrenko T, Kr ylova O, Neese1 F, Sokolowski M, New J. Phys., 2009, 11: 015001
Abstract Surfaceassisted laser desorption/ionization mass spectrometry (SALDIMS) has become an indispensable tool in macromolecule and small molecule analysis for solid and liquid samples. However, there were few studies focusing on the ionization mechanisms especially for the small molecules. In this work, the compounds of pyrene, coronene and rubrene which have similar molecular structures were used to investigate the ionization mechanism via SALDIMS. Additionally the effect of the laser power on the product ions was also investigated. It was found that strong cluster ions peaks nM+(M= pyrene, coronene) were observed for pyrene and coronene, and daughter ions of coronene by loss of C2H2 were also observed. On the contrary, no cluster ion was obtained for rubrene, only daughter ions with the losses of nC6H5 (n=1, 2, 3) were acquired. Finally, the ionization mechanisms were discussed. The formation of clusters of pyrene and coronene was attributed to the interaction of ππ bands. For rubrene, the spatial barrier weakened the interaction of ππ bands because the four phenyl groups were not on the same plane of skeleton structure, thus impeding the formation of cluster ions.
Keywords Surfaceassisted laser desorption/ionization mass spectrometry; Polycyclic aromatic; Ionization; ππ bond interaction; Spatial barrier
(Received 26 February 2017; accepted 30 March 2017)
This work was supported by the National Natural Science Foundation of China (No. 51572074)
