黄瓜霜霉病抗性遗传分析
2017-06-15丁欢欢李晓辉户克云韦鹏飞
丁欢欢,李晓辉,户克云,韦鹏飞
(河南农业大学园艺学院郑州450002)
黄瓜霜霉病抗性遗传分析
丁欢欢,李晓辉,户克云,韦鹏飞
(河南农业大学园艺学院郑州450002)
以华北型黄瓜霜霉病抗病自交系‘HNAU0023’、霜霉病感病自交系‘IL112’通过自交、杂交、回交所构建的P1、P2、F1、F2、B1、B26个世代作为研究材料,使用6世代联合分离分析软件(SEA-G 6)对黄瓜霜霉病抗性进行遗传分析。结果表明,抗性遗传的最佳模型为E-0模型,即“2对加性-显性-上位性主基因+加性-显性-上位性多基因”混合遗传模型。2对主基因加性效应相同,均为13.05;显性效应为负值,分别为-30.34、-15.88。B1、B2、F2的主基因遗传率分别为68.63%、76.36%、87.15%,多基因遗传率分别为0、7.25%、0,各分离世代主基因遗传率明显大于多基因遗传率。因此,在黄瓜霜霉病抗性育种中应优先考虑主基因。
黄瓜;霜霉病;分离分析;遗传分析
黄瓜(Cucumis sativus L.),也称胡瓜、青瓜,在我国栽培历史悠久,属于葫芦科一年生蔓生草本。霜霉病是黄瓜生产过程中一种常见的真菌性病害,一般自下而上发病,靠气流传播,再侵染频繁,病害发生迅速,严重影响黄瓜的产量和品质。而抗病自交系、感病自交系与病原菌分别发生非亲和互作、亲和互作反应,抗病品种发病轻,可以把霜霉病造成的危害控制在一定范围内,所以培育并使用抗病品种无疑是减轻该病危害的最安全的有效措施[1]。
黄瓜霜霉病抗性遗传规律作为抗病育种的重要理论依据,具有重要的实践意义。自1868年首次报道以来,不少学者投身于霜霉病抗性遗传研究中,目前主要存在的有单基因抗性、多基因抗性2种结论:孟攀奇[2]的试验中,134株F2分离群体中抗病、中间型、感病3者比例基本符合1∶2∶1的比例,证明了抗性由隐性单基因控制,感病为不完全显性基因控制;丁国华等[3]通过对F3单株进行霜霉病抗病性鉴定,同样证实了霜霉病抗性由单个隐性基因控制;而张素勤[4]的研究结果表明:黄瓜霜霉病抗性由2对加性效应较强、显性效应较弱的主基因控制,遗传力高,同时还受微效多基因控制;张胜菊[5]的研究结果同样表明,黄瓜霜霉病抗性至少受2对基因控制,且加性效应比显性效应大。随着黄瓜全基因组测序的完成,大部分关于黄瓜霜霉病抗性遗传规律的研究转到了分子方面[6]:Pang、Zhang、Yosh⁃ioka、Szczechura等[7-10]在试验中发现了多个抗性相关QTL;2016年,Wang等[11]在研究中发现了2个霜霉病抗性主效QTL,同年,日本学者Khin ThandaWin等[12]采用田间自然鉴定法发掘了3个QTL。
试验材料、抗性鉴定方法、鉴定标准等的不同,导致黄瓜霜霉病抗性遗传规律至今尚无定论,定位出的抗性相关QTL位点的数目与位置也不同,不能较好地应用于黄瓜霜霉病抗性育种[13]。在遗传研究方面,分离分析法与QTL定位各有独特之处,虽然采用分子标记进行QTL定位是准确获得基因所在位置信息的最有效手段,但是分离分析法也是一种非常有效的数量性状遗传分析方法,目前已有多位学者采用分离分析法对数量性状的遗传规律进行分析[4,14-15]。
笔者采用6世代联合分离分析法[16-17]对P1、P2、F1、B1、B2、F26世代群体进行霜霉病抗性遗传分析,以期在前人研究的基础上进一步明确黄瓜霜霉病抗性遗传规律,对黄瓜抗性QTL定位与抗性育种带来实际的指导意义。
1 材料与方法
1.1 材料
以河南农业大学园艺学院黄瓜课题组提供的华北型黄瓜霜霉病感病自交系‘IL112’,霜霉病抗病自交系‘HNAU0023’分别为亲本,以及通过这2份材料杂交、自交、回交所得的P1、P2、F1、F2、B1、B2共6个世代为抗性遗传研究材料。
1.2 方法
1.2.1 试验设计2016年3—6月在河南农业大学毛庄科技园区的塑料大棚内进行抗性鉴定试验。整个试验采用随机区组设计,各世代设3次重复。田间采用宽窄双行定植,宽行行距80 cm,窄行行距40 cm,株距25 cm,试验材料与感病品种(病源)相间而种,并在棚前棚后各种植2行感病品种作为保护行,以保证在其他田间条件一致的情况下,病害在整个试验环境中均匀发生。定植后的管理参照春季大棚黄瓜田间常规管理方法,及时防治各种病虫害的发生。霜霉病病斑初显后,每隔3 d大水均匀漫灌1次,使田间发病均匀。连续漫灌3次后,每株材料随机选择3片叶进行调查统计,4 d调查1次,共调查4次。P1、P2、F1各调查45株,B1(54)、B2(54)、F2(360)全部调查。
1.2.2 分级标准参考1983年Jenkins和Wehner的分级标准将病害发病等级分为9级:0级,病斑面积为0;1级,病斑面积占总面积的0~3%;2级,病斑面积占总面积的3%~6%;3级,病斑面积占总面积的6%~12%;4级,病斑面积占总面积的12%~ 25%;5级,病斑面积占总面积的25%~50%;6级,病斑面积占总面积的50%~75%;7级,病斑面积占总面积的75%~87%;8级,病斑面积占总面积的87%~100%;9级,病斑面积占总面积的100%;病情指数的计算公式为:

抗性分级标准:高抗(HR)为0<DI≤15;抗病(R)为15<DI≤35;中抗(MR)为35<DI≤55;感病(S)为55<DI≤75;高感为(HS)为DI>75。
遗传分析采用章元明教授提供的数量性状分离分析软件(P1、P2、F1、B1、B2、F26世代联合分离分析软件SEA-G 6)和方法:即在24种遗传模型中根据AIC值进行候选遗传模型的选择,并通过对分布平均数U12、二阶原点矩U22、二阶中心矩U32等数字特征进行的均匀性检验,以及对分布的整体参数进行的Smirnov检验、Kolmogorov检验选出最佳遗传模型,最后估计该模型的一阶、二阶遗传参数。
2 结果与分析
2.1 各分离世代霜霉病抗性水平分布
由表1可以看出,P1平均病情指数为86.19,表现为高感;P2平均病情指数为4.39,表现为高抗:2亲本间存在明显的抗感差异。F1发病情况介于2亲本之间,偏向感病亲本,表明抗病性为隐性基因控制。P1、P2、F13个世代的病情指数变化范围小,变异系数较小,表型性状较稳定。分离世代B1、B2、F2变异幅度大:B1集中分布于感病、高感水平,偏向感病亲本‘IL112’;B2集中分布于高抗、抗病水平,偏向抗病亲本‘HNAU0023’;F2代变化幅度最大,包含了高抗、抗病、中抗、感病、高感5个抗感水平,位于中抗、感病水平的植株数最多(图1)。从表2可以看出,分离世代峰度、偏度的绝对值均小于1,表明黄瓜霜霉病抗性属于数量性状遗传,可以用数量性状分离分析方法进行遗传分析。
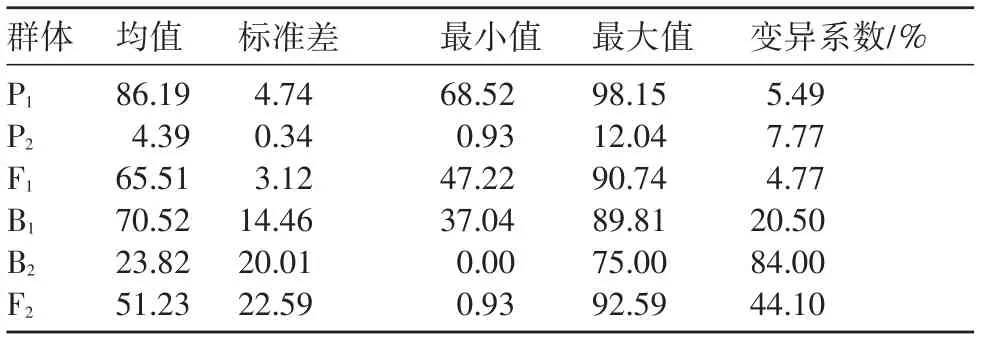
表1 各分离世代病情指数的比较

表2 分离世代正态性检验
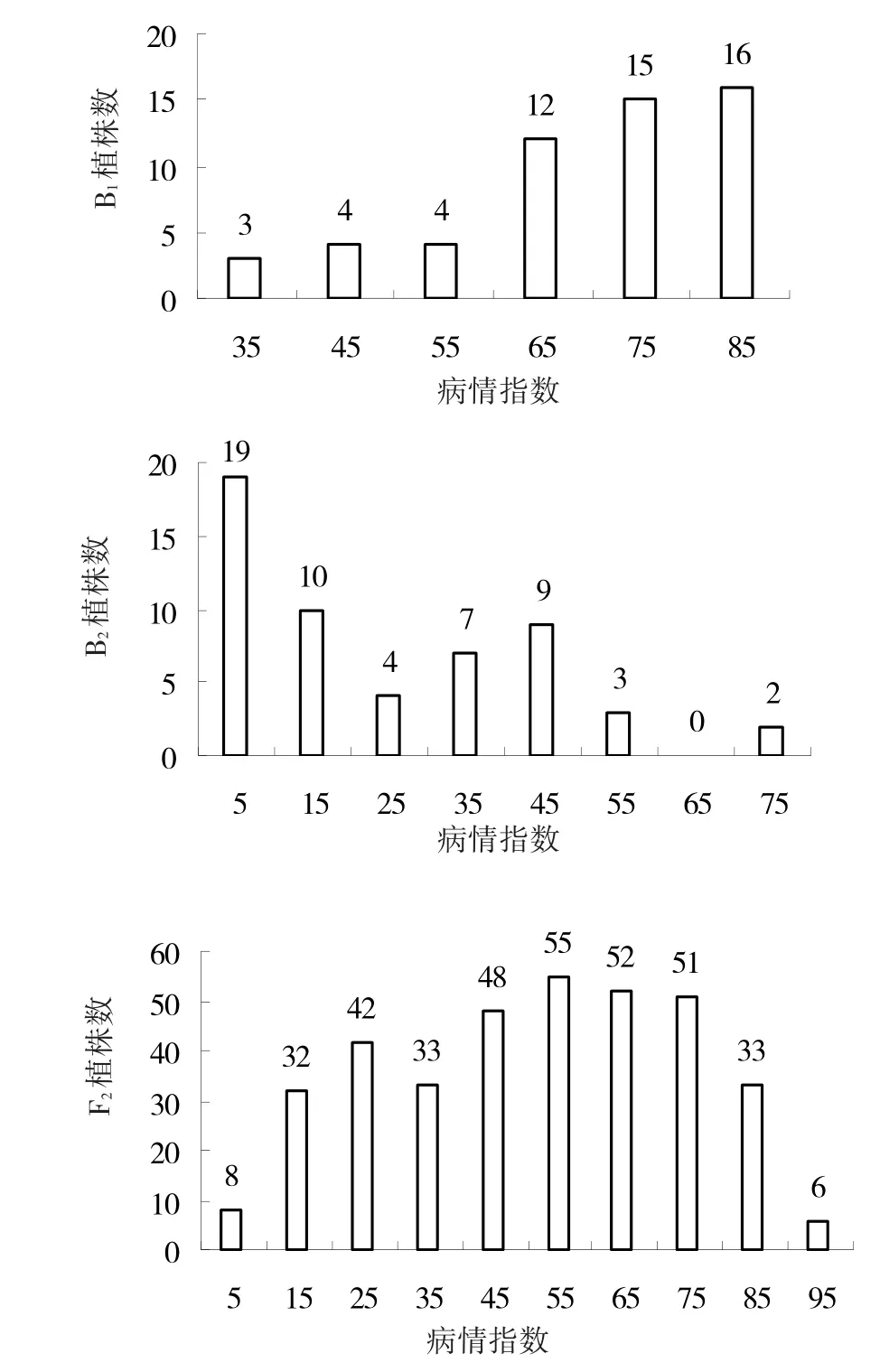
图1 B1、B2、F2各分离世代抗性水平分布
2.2 黄瓜霜霉病抗性“主基因+多基因”遗传模型的分析
表3显示,AIC值较低的遗传模型是B-1(2对加性-显性-上位性主基因模型)、E-1(2对加性-显性-上位性主基因+加性-显性多基因模型)、E-0(2对加性-显性-上位性主基因+加性-显性-上位性多基因模型)模型,AIC值依次为5 041.179 1、5 051.444 4、5 054.237 3,可作为黄瓜霜霉病抗性遗传分析的候选模型。

表3 各遗传模型极大似然值和AIC值
2.3 候选模型的适合性检验
表4检验结果表明,B-1模型、E-1模型中分别有4个、3个统计量达到显著水平,与分离群体的分布是不一致的;E-0模型中没有统计量达到显著水平,吻合度100%,为最佳遗传模型。

表4 候选遗传模型的适合性检验
2.4 最佳模型的一阶、二阶遗传参数估计
根据最小二乘法对最佳混合遗传模型进行一阶、二阶遗传参数进行估计。如表5、表6所示,“2对加性-显性-上位性主基因+加性-显性-上位性多基因”的遗传模型中,第1对主基因的加性效应为13.05、显性效应为-30.34、显性度为-2.33;第2对主基因的加性效应为13.05、显性效应为-15.88、显性度为-1.22,且ha/da与hb/db的绝对值都大于1,显性效应值大于相应的加性效应值,表明这2对主基因的遗传以显性效应为主;在上位性效应中,2对主基因间的显性×加性互作效应较小,其余的互作效应较大。从二阶遗传参数可以看出:B1、B2、F2的主基因遗传率分别为68.63%、76.36%、87.15%,多基因遗传率分别为0、7.25%、0,各分离世代主基因遗传率均明显大于多基因遗传率,表明黄瓜霜霉病抗性以主基因遗传为主,且在F2早期进行选择具有较高的效率。

表5 一阶遗传参数估计
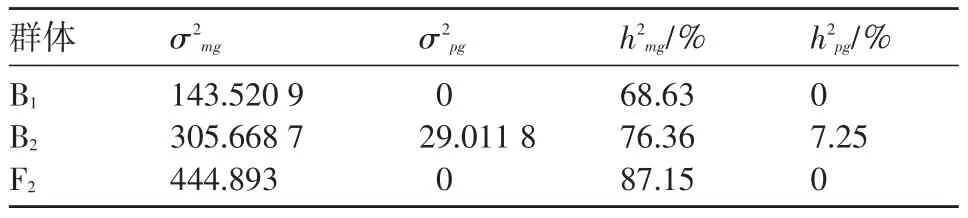
表6 二阶遗传参数估计
3 讨论与结论
本试验结果表明,黄瓜霜霉病抗性属于数量性状遗传,易受环境影响,采用主基因+多基因分离分析法可以降低试验误差,使结果更可靠。张素勤[4]对2个抗感杂交组合(K3×K6,K5×K6)进行遗传研究,所得最优模型分别为E-1-0(2对加性-显性-上位性主基因+加性-显性-上位性多基因)、E-1-4(2对等加性主基因+加性-显性多基因),分离世代主基因遗传率高。庞欣[18]以黄瓜高抗霜霉病渐渗系‘IL52’与‘长春密刺’2亲本所构建的4世代群体为材料,对荷兰与南京2地所种材料进行抗性遗传分析,结果表明,在不同时间与地点,抗性遗传均符合E-1-1(2对加性-显性-上位性主基因+加性-显性多基因)模型,分离世代F2主基因遗传率高,分别为91.78%、94.11%。本研究结果表明,‘HNAU0023’霜霉病抗性遗传受“2对加性-显性-上位性主基因+加性-显性-上位性多基因”控制,与张素勤、庞欣2人的研究结果略有差异,材料的不同是主要原因,抗性鉴定方法及鉴定环境条件的不同也可能导致差异的存在。黄瓜霜霉病抗性遗传机制复杂,但是从以上试验中,可以得出黄瓜霜霉病抗性遗传中存在共同点:在遗传模型方面,共同表明黄瓜霜霉病抗性遗传受2对主基因+多基因共同控制;在遗传效应上分离世代都以主基因遗传为主。因此,在进行抗性材料育种时,应在早期进行选择,优先考虑主基因。本次试验材料可在F2早期进行抗病材料筛选,效率高,结果可靠,同时也应注意多基因的积累,使抗性稳定持久[4,18]。此外,Wang等[11]发现了2个霜霉病抗性相关主效QTL和3个微效QTL位点,在分子水平验证了黄瓜霜霉病抗性由“主基因+多基因”共同控制的结论。
因黄瓜霜霉病抗性易受环境的影响,在单因素环境下进行抗性研究,虽具有一定的指导意义,但不全面,之后将在多因素环境条件下对‘HNAU0023’抗性遗传规律进行探究及验证,并以F2群体为材料进行黄瓜霜霉病抗性QTL初步定位,以期在对结论进行验证的同时,找出主效基因在染色体上的具体位置与所关联的分子标记,实现分子标记辅助选择育种。
[1]李建武.黄瓜霜霉病抗性相关基因筛选及过敏性抗病机制[D].武汉:华中农业大学,2010.
[2]孟攀奇,蔡丽静,张桂华,等.与黄瓜霜霉病抗性相关基因连锁的分子标记研究[J].长江蔬菜,2014(8):12-14.
[3]丁国华,秦智伟,周秀艳,等.黄瓜霜霉病抗病基因的RAPD及SCAR标记[J].西北植物学报,2007,27(9):1747-1751.
[4]张素勤,顾兴芳,张圣平,等.黄瓜霜霉病抗性遗传分析[J].西北植物学报,2007,27(12):2416-2420.
[5]张胜菊,司龙亭.黄瓜霜霉病抗性的遗传表现与基因效应分析[J].北方园艺,2009(4):71-72.
[6]HUANG S,LI R,ZHANG Z,et al.The genome of the cucumber,CucumissativusL.[J].NatureGenetics,2009,41(12):1275-1281.
[7]PANG X,ZHOU X H,WAN H J,et al.QTL mapping of downy mildew resistance in an introgression line derived from interspecific hybridization between cucumber and Cucumis hystrix[J].Journal of Phytopathology,2013,161(7/8):536-543.
[8]ZHANG S P,LIU M M,MIAO H,et al.Chromosomal mapping and QTL analysis of resistance to downy mildew in Cucumis sativus[J].Plant Disease,2013,97(2):245-251.
[9]YOSHIOKA Y,SAKATA Y,SUGIYAMA M,et al.Identification of quantitative trait loci for downy mildew resistance in cucumber (Cucumis sativus L.)[J].Euphytica,2014,198(2):265-276.[10]SZCZECHURA W,STANIASZEK M,KLOSINSKA U,et al.Mo⁃lecular analysis of new sources of resistance to Pseudoperonospora cubensis(Berk.et Curt.)Rostovzev in cucumber[J].Russian Jour⁃nal of Genetics,2015,51(10):974-979.
[11]WANG Y,VANDEMLANGENBEG K,WEHNER T C,et al.QTL mapping for downy mildew resistance in cucumber inbred line WI7120(PI 330628)[J].Theoretical and Applied Genetics,2016,129(8):1493-1505.
[12]WIN K T,VEGAS J,ZHANG C Y,et al.QTL mapping for downy mildew resistance in cucumber via bulked segregant analysis us⁃ing next-generation sequencing and conventional methods[J].The⁃ oretical&Applied Genetics,2016,130(1):199-211.
[13]熊艳,王鹤冰,向华丰,等.黄瓜霜霉病研究进展[J].中国农学通报,2016,32(1):130-135.
[14]盖鈞镒,章元明,王建康.植物数量性状遗传体系[M].北京:科学出版社,2003:340-341.
[15]路绪强,高磊,赵胜杰,等.西瓜果实番茄红素含量的遗传分析[J].中国瓜菜,2016,29(12):6-9.
[16]曹锡文,刘兵,章元明.植物数量性状分离分析Windows软件包SEA的研制[J].南京农业大学学报,2013,36(6):1-6.
[17]盖钧镒.植物数量性状遗传体系的分离分析方法研究[J].遗传,2005,27(1):130-136.
[18]庞欣.黄瓜/酸黄瓜渐渗系抗霜霉病QTLs定位及其与霜霉菌早期互作的表达谱分析[D].南京:南京农业大学,2013.
Genetic analysis for downy mildew resistance in cucumber
DING Huanhuan,LI Xiaohui,HU Keyun,WEI Pengfei
(College of Horticulture,Henan Agricultural University,Zhengzhou 450002,Henan,China)
Six generation of P1,P2,F1,B1,B2,F2derived from a crossing between parent‘IL112’,a susceptible to downy mildew(DM),and parent‘HNAU0023’,a high resistant to DM,were used for genetic analysis of downy mildew resistance(DMR)in cucumber by SEA-G 6.The results showed that the best model was“E-0 model”,“two pair of additive-dominant-epistasis major gene+additive-dominance-epistasis interaction polygene”.The additive effects of two major genes were 13.05;dominance effect of the major gene were-30.34,-15.88.Heritability of the major gene in B1,B2,F2population was 68.63%,76.36%,87.15%;Heritability of the polygene was 0,7.25%,0.Heritability of the major gene was higher than the polygene,obviously.Therefore,in the breeding of resistance to cucumber downy mildew,major gene should be high priority.
Cucumber;Downy mildew;Segregation analysis;Genetic analysis
2017-03-10;
:2017-04-11
河南省科技攻关计划(农业领域)项目(142102110052)
丁欢欢,女,在读硕士研究生,研究方向为蔬菜遗传育种与分子生物学。E-mail:13938471389@163.com
