2013—2016年国家医疗器械监督抽验产品质量状况分析
2017-06-15张欣涛罗庆祥张庆生成双红
张欣涛,郝 擎,石 现,朱 炯,罗庆祥,张庆生,成双红
1 中国食品药品检定研究院,北京市,100050
2 广东省医疗器械质量监督检验所,广州市,510663
2013—2016年国家医疗器械监督抽验产品质量状况分析
【作 者】张欣涛1,郝 擎1,石 现1,朱 炯1,罗庆祥2,张庆生1,成双红1
1 中国食品药品检定研究院,北京市,100050
2 广东省医疗器械质量监督检验所,广州市,510663
该文通过整理2013-2016年国家医疗器械监督抽验情况,分析了医疗器械抽验产品的整体质量状况以及不合格品种情况;对抽验结果进行深入分析发掘,发现医疗器械抽验产品在质量管理体系、产品技术要求、国家标准行业标准等方面存在着质量安全风险点,并以典型实例进行说明,同时针对生产企业和监管部门存在的问题提出了相应的建议。
医疗器械;监督抽验;质量状况
为保障公众用械安全,国家实行医疗器械监督抽验制度[1]。国家医疗器械监督抽验(以下简称“国抽”)是对医疗器械产品质量的抽查检验,是对医疗器械进行监管的重大举措,不仅作为评价医疗器械产品质量的重要方式,还在发现医疗器械注册、检验、生产、管理、经营、使用等方面问题发挥了重要作用,对医疗器械行业的健康发展也起了重要的促进作用。国抽工作自2001年首次开展以来,至今历时十六载,其中2013年随着抽验资金的加拨,抽验整体规模达到历年最大[2],国抽工作蓬勃发展。本文针对2013年以来国抽工作的巨大变化,回顾2013—2016年的国抽情况,深入分析医疗器械抽验产品质量状况,归纳出抽验产品存在的质量安全风险点,并向生产企业及药监部门提出加强医疗器械质量安全保障方面的建议。
1 2013—2016年国抽[3-6]基本情况
1.1 整体质量状况
2013—2016年,共抽验产品251个,其中有源产品88个,无源产品113个,体外诊断试剂产品50个,均是量大面广、使用频次较高、风险概率相对较大、不良事件发生较多的重点产品,涉及产品分类界定的多个领域,对一些需要重点关注质量安全的品种,连续2年甚至3年进行了抽验[6-7]。以下介绍这四年国抽的整体质量状况。
2013年国抽,抽取46个品种,3 250批次,合格2 677批次,合格率82%。其中,属于国家食品药品监督管理总局于2009年8月10日颁布的国食药监械[2009]395号文件《关于印发国家重点监管医疗器械目录(2009年版)的通知》[8]确定的重点监管目录中的品种(简称重点监管品种,下同)合格率93%,三类医疗器械合格率96%,二类医疗器械合格率72%。有源产品合格率70%,无源产品合格率84%,体外诊断试剂产品合格率93%。2014—2016年国抽情况参照2013年国抽情况进行了分类整理,结果详见表1。
1.2 不合格品种分析
下面我们来分析一下2013—2016年这4年不合格品种的情况。我们从不合格批次、涉及品种数、占总品种数量百分比、平均合格率、低于平均合格率品种(品种数、批次数、占全部不合格数量百分比)、不合格数量集中品种(品种数、批次数、占低于平均合格率品种批次数百分比、不合格集中品种)等11方面进行分析,分析结果详见表2。2013年不合格集中品种有7个,为呼吸道吸引导管(吸痰管)、呼吸机、医用防护口罩、医用离心机、体表式红外体温计、低中频治疗设备、手提式压力蒸汽灭菌器;2014年不合格集中品种有10个,为定制式固定义齿、微波治疗设备、中频治疗设备、裂隙灯显微镜、半导体激光治疗机、金属接骨板、立式蒸汽灭菌器、冷光源(硬性光学内窥镜用)、金属骨针、电动吸引器;2015年不合格集中品种有9个,为一次性使用无菌阴道扩张器、手术衣、医用外科口罩、医用防护口罩、无创自动测量血压计(电子血压计)、体外诊断试剂生产用水、神经和肌肉刺激器、中医诊疗电气设备、治疗呼吸机;2016年不合格集中品种有10个,为一次性使用无菌阴道扩张器、手术衣、医用外科口罩、手术单、无创自动测量血压计(电子血压计)、B型超声诊断设备、多参数患者监护设备、医用氧气浓缩器(医用制氧机)、红外辐射治疗设备、热敷贴。
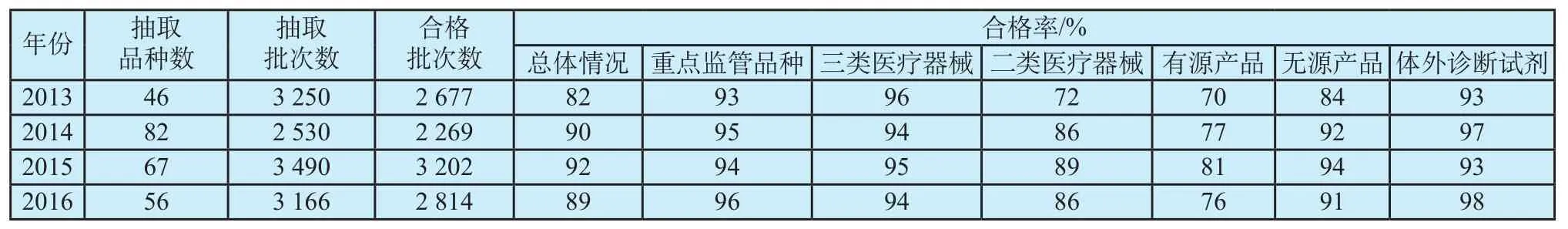
表1 2013-2016年国抽情况Tab.1 National sampling and testing situation in 2013—2016

表2 2013-2016年国抽不合格品种分析Tab.2 Analysis of the unqualif i ed varieties of national sampling and testing in 2013—2016
2 质量风险点分析
2.1 质量风险点情况
针对这些产品质量风险问题,我们对2013—2016年国抽结果进行深入分析发掘:逐批次分析产品法定检验不合格情况与成因,归纳整理探索性研究中可能影响产品质量的风险因素,最终在质量管理体系、产品技术要求、国家标准行业标准等方面汇总了医疗器械产品质量安全风险点共3 030个,其中2013年质量风险点455个,2014年质量风险点共489个,2015年质量风险点644个,2016年质量风险点1 452个,并分别形成年度国家医疗器械抽验产品质量安全风险点汇总分析报告。下面将以典型实例介绍质量风险点的情形。
2.2 质量管理体系方面
据统计,超过50%以上的质量风险点集中在质量管理体系方面,这方面存在2种质量风险点,分别是:①未严格按质量管理体系要求组织生产;②对说明书和标签重视不够。
2.2.1 未严格按质量管理体系要求组织生产
在抽验中发现,存在此类情况的产品最多,以下选取三个典型例子加以说明。例如使用量较大的植入性高风险产品——金属接骨板,同批次产品性能差异较大。主要不合格项目为:孔径、表面粗糙度;造成不合格可能原因:部分企业加工工艺不稳定、原材料管理不规范、不同批次材料混用。详见表3。

表3 金属接骨板抽验情况Tab.3 The metal bone plate sampling and testing situation
又比如在2014年国抽中,抽取的微波治疗设备,45%的企业生产的微波治疗设备的“输出闭锁”项目不合格。该项目在国标GB 9706.6—2007中规定:除非先将输出控制置于最小的位置,否则设备不能有输出;在电网电源中断或复位以后,这个要求被满足;观察和测试性能,检查是否符合要求。该项目不合格原因分析:企业未严格按照GB 9706.6—2007的有关规定组织生产。
存在这方面问题,同样未按GB 9706.1—2007有关规定组织生产的有:半导体激光治疗机,其熔断器座不用工具就可拧下盖子,能触及到带电部分。因不用工具就可触及到带电部分,且电压为AC 220 V,将发生电击危害,造成人员伤亡。类似的实例太多,这里不一一列举。
2.2.2 说明书和标签重视不够
除了不能严格按照要求组织生产,在质量管理体系方面还有一种风险因素表现较为突出,那就是:部分企业对于说明书和标签重视不够。这种情形在有源产品领域表现的更为突出。2013—2016年国抽中,有源产品合格率不是很高,依次为70%,77%,81%和76%。在不合格项目中,“随机文件”和“外部标记”两项占据了较高的比例。
这里以中低频治疗设备为例,其作为一种逐步进入个人家庭,用于自我治疗保健的产品,近几年国抽均对此产品质量予以了关注。2013年国抽,抽取60批次,不合格25批次,合格率58%;2014年国抽,抽取26批次,不合格12批次,合格率54%。而且连续抽验两年发现“随机文件”“外部标记”两项不符合标准要求数量较多,其中2013年和2014年分别占到了不合格项目的66%和79%。众所周知,诸如防电击程度等外部标识信息对于确保产品安全使用至关重要。生产企业存在不能在生产过程中规范执行质量管理体系关于说明书和标识有关规定的情形,这也为这类产品使用的质量安全埋下了隐患。诸如此方面的产品不少,这里不再举例。
2.2.3 质量管理体系方面相关建议
为保障医疗器械产品质量安全有效,必须严格执行质量管理体系。企业是产品质量的第一责任人,我们建议生产企业应当着重在原材料采购、严格按照标准/技术要求生产、工艺控制、出厂检验等几方面认真规范地落实质量管理体系的相关规定;针对有源产品在“随机文件”“外部标识”等方面存在的突出问题,建议生产企业要进一步强化重视程度,在生产中认真执行质量管理体系关于说明书和标识的有关规定,如注重一致性、按照规定程序变更等。同时我们也建议监管部门加强有针对性的监管,将企业落实质量管理体系的情况作为监管的首要着眼点。
2.3 产品技术要求方面
产品技术要求方面的风险点,在这一方面主要表现为产品技术要求自身不够完善以及与相应国行标存在差距。我们归纳出了5种具体情形,分别为:①未引用或引用过期作废的国行标;②引用国行标内容错误或不完整;③项目要求低于国行标;④试验方法缺失或不具操作性;⑤内容前后不一致或与说明书不一致。以下仍然以典型实例来具体介绍。
2.3.1 未引用或引用过期作废的国行标
在抽验中发现,存在此类情况产品较多,例如微波治疗设备:50%的产品注册标准(或产品技术要求)未引用行业标准YY 0838—2011《微波热凝设备》。只具有理疗功能的微波治疗设备,需引用GB 9706.1—2007《医用电气设备第1部分:安全通用要求》及GB 9706.6—2007《医用电气设备第二部分:微波治疗设备安全专用要求》,而具有热凝功能的微波治疗设备,除上述2个国家标准外,还需引用行业标准YY 0838—2011。
2.3.2 引用国行标内容错误或不完整
抽验发现存在此类情况的产品也挺多,以一次性使用肠营养导管为例,所抽55批有效产品中,共发现29批未完整引用强制性行业标准YY 0483—2004《一次性使用肠营养导管、肠给养器及其连接件设计与试验方法》,占比约53%,未完整引用的项目包括鼻饲营养导管拉伸性能、连接件拉伸性能、连接件液体渗漏、耐腐蚀性等4个关键性能指标项目。
2.3.3 项目要求低于国行标
存在此类情况的产品也非常多,例如在丙氨酸氨基转移酶检测试剂抽验中,我们发现有数量众多的生产企业,其产品技术要求中重复性和空白吸光度变化率两项低于行业标准。当然,这里所说的行业标准与前面例子中的有所不同,是推荐性行标,因此,在监督抽验中,我们仍然以各产品技术要求作为判定依据,但是这一现象却不得不引起我们的深思,而且这一现象在体外诊断产品领域也较为普遍。详见表4。

表4 丙氨酸氨基转移酶检测试剂项目要求低于国行标Tab.4 Alanine aminotransferase detection reagent testing items requirements below the national and industrial standard
虽然体外诊断产品在2013—2016年抽验中均表现出了较高的合格率,依次为:93%、97%、93%、98%。但这都是以各自产品技术要求为判定依据的结果,如果这些产品技术要求中相关的技术指标低于国行标,那么这种表面的高合格率是否能与产品自身的高质量相对等也许还是需要打上一个问号的。
2.3.4 检验方法缺失或不具操作性
除了与相应国行标存在差距外,我们在抽验中也发现了一些产品技术要求自身还存在不够完善的情形。比如:在抽验中发现有3家血管支架生产企业其产品技术要求存在试验方法缺失或不具可操作性的问题。血管支架作为医疗器械领域的高精尖技术产品,其生产企业技术实力也应处于上游水平,但是正是这些生产企业所起草的技术文件却存在诸如试验方法与性能要求不一致等问题,对此我们感到非常遗憾。
2.3.5 内容前后不一致或与说明书不一致
抽验还发现,部分注册产品标准(产品技术要求)存在内容前后不一致或与注册证、说明书等资料不一致的现象。例如2015年国抽中,某医用电子体温计的技术要求中显示温度测量范围为32.0oC~42.9oC,而说明书测量范围为32.5oC~42.8oC;某一次性使用硅橡胶胃管产品标准中引用了YY 0483—2004的连接件的条款,而标准编制说明中声称“由于胃管的连接器为较软材料,故YY 0483—2004标准中关于连接件的要求不适用”,前后矛盾。发现此类现象并不少见,究竟是哪一环节出现了问题,这值得我们深思。
2.3.6 产品技术要求方面相关建议
综上所述,我们认为产品技术要求是产品质量的重要技术依托,我们建议生产企业要牢固树立主动提升产品技术要求的意识。为此,要从4个方面做好工作:密切跟踪本领域国行标发展动向、全面了解本领域国行标情况、对产品技术要求进行充分验证、提升生产企业自身技术实力,为医疗器械质量安全打下坚实的基础。
2.4 国家标准、行业标准方面
在国家标准和行业标准方面,目前存在的问题:①部分国行标内容没有进一步完善;②部分产品国行标更新滞后;③部分产品需要建立国行标。
针对目前国家标准/行业标准方面的问题,我们向相关部门提出了多个产品关于国行标方面的建议,例如我们对一次性使用输血器、一次性使用人体静脉血样采集容器、二氧化碳激光治疗机等3个产品国行标相关内容提出了进一步完善或加速更新相关国行标的建议。对洁净工作台、一次性使用鼻氧管等两个产品提出了尽快制定国行标来统一规范产品质量的建议。
同时,针对前面所谈到的体外诊断领域产品技术要求低于国行标的情况,我们建议相关部门大力提升国家标准、行业标准对产品技术要求的导向力。目前在体外诊断领域,相关的推荐性国行标数量并不算少,但从实际效果来看,推荐性国行标对于产品技术要求的导向力还是不够的。
3 结语
目前医疗器械产业持续稳定的发展,国家对医疗器械质量愈发重视,对医疗器械监管力度也进一步加强,国抽作为重要的医疗器械监管方式,有效地衔接了从注册、生产、经营、使用的全链条医疗器械法规监管制度体系。希望各相关人员重视医疗器械质量状况,不断提升医疗器械产品技术水平,真正做好保障公众用械安全工作。
[1] 中华人民共和国国务院令第276号 原医疗器械监督管理条例[R]. 2000.
[2] 李海宁, 郝擎, 李静莉, 等. 国家医疗器械质量监督抽验分析及思考[J]. 中国医疗器械杂志, 2015, 39(2): 132-135
[3] CFDA. 2013年国家医疗器械抽验工作手册[Z]. 北京: 中国食品药品检定研究院, 2013.
[4] CFDA.关于2014年国家医疗器械抽验产品抽样方案和检验方案的通知[EB/OL].(2014-07-26)[2016-11-23]. http://www.sda.gov.cn/ WS01/CL0845/104014.html.
[5] CFDA. 食品药品监管总局办公厅关于印发2015年国家医疗器械抽验产品检验方案的通知[EB/OL]. (2015-07-16)[2016-11-23]. http://www.sda.gov.cn/WS01/CL0845/124960.html.
[6] CFDA. 总局办公厅关于印发2016年国家医疗器械抽验产品检验方案的通知[EB/OL]. (2016-06-03)[2016-11-23]. http://www. sda.gov.cn/WS01/CL0845/154781.html.
[7] 李延敏, 屈媛媛, 张蔓, 等. 2013—2015年国家医疗器械监督抽验情况分析及对医疗器械检验机构的相关建议[J]. 医疗装备, 2016, 29(11): 37-39.
[8] CFDA.关于印发国家重点监管医疗器械目录(2009年版)的通知[EB/OL]. (2009-08-14)[2016-11-23]. http://www.sda.gov.cn/ WS01/CL0845/40674.html.
Analysis of Quality Status of National Medical Device Supervision and Inspection from 2013 to 2016
【Key words 】ZHANG Xintao1, HAO Qing1, SHI Xian1, ZHU Jiong1, LUO Qingxiang2, ZHANG Qingsheng1, CHENG Shuanghong1
1 National Institute for Food and Drug Control, Beijing, 100050
2 Guangdong Province Medical Devices Quality Surveillance and Test Institute, Guangzhou, 510663
medical equipment, supervision and testing, quality status
F203
A
10.3969/j.issn.1671-7104.2017.03.016
1671-7104(2017)03-0216-04
2017-02-03
张欣涛,E-mail: 1297389708@qq.com
郝擎,E-mail: haulking@163.com
【 Abstract 】In this paper, we analyze the status of the medical device testing and the situation of the unqualifie varieties by sorting out the situation of the national medical device supervision and inspection from 2013 to 2016. We analyze the results of the inspection deeply, and fi nd that the safety risk points exists in the quality of the medical device testing products and management system, product technology requirements, the national standards, industry standards or other aspects, then explain one by one with typical examples. At the same time the corresponding suggestions are put forward to production companies and regulators respectively on the existing problems.
