药用植物宁夏枸杞 (Lycium barbarum L.) 土壤细菌群落演替特征
2017-06-13张俊华张翼李明
张俊华,张翼,李明
药用植物宁夏枸杞 (Lycium barbarum L.) 土壤细菌群落演替特征
张俊华1,张翼2,李明1
(1 宁夏大学环境工程研究院,宁夏银川 750021;2 宁夏大学教育学院,宁夏银川 750021)
【目的】研究土层、季节和树龄对宁夏枸杞土壤细菌群落结构的影响,对揭示枸杞种植区域土壤质量变化规律具有重要意义。【方法】以宁夏枸杞之乡—宁夏回族自治区中宁县为研究区,采用高通量测序分析了不同土层、季节和树龄条件下枸杞土壤细菌生物量及细菌群落结构和丰度的变化趋势。【结果】随着枸杞树龄增加,与幼龄 (种植当年,< 1 年) 枸杞土壤相比,春季和夏季 0—20 cm 中龄 (6 年) 和老龄 (12 年) 土壤总有机碳(total organic carbon,TOC) 及 0—40 cm 土壤总有机氮 (total organic nitrogen,TON) 含量先增加后减少;春季不同树龄 0—20 cm 土壤微生物生物量碳 (microbial biomass carbon,MBC)和微生物生物量氮(microbial biomass nitrogen,MBN)一直增加,但春季和秋季 20—40 cm 则呈相反趋势。夏季中龄植株表层土壤 MBC 最高,但MBN 却最低。随着树龄增加,枸杞表层土壤细菌多样性普遍呈先增加后减小的趋势。枸杞土壤变形菌门Proteobacteria、放线菌门 Actinobacteria、拟杆菌门 Bacteroidete 在细菌群落中占绝对优势。相同季节老龄土壤Proteobacteria 相对丰度普遍高于幼龄和中龄,幼龄土壤 Planctomycetes 和绿弯菌门 Chloroflexi 丰度高于中龄和老龄。变形杆菌中黄色单胞菌 Xanthomonadales、红杆菌 Rhodobacterales 和根瘤菌 Rhizobiales 占主导地位,尤其是在秋季中龄和 3 个季节的老龄枸杞土壤。土层、季节和树龄对土壤微生物数量影响不同。【结论】随着树龄增加,宁夏枸杞表层土壤微生物生物量和细菌多样性呈先增加后降低的趋势。老龄植株土壤 Xanthomonadales数量相对最多。土层对枸杞土壤碳分布有极显著影响,树龄主要显著影响土壤氮源和细菌群落多样性,季节对枸杞土壤碳源、微生物量碳氮均有极显著影响。
宁夏枸杞;细菌群落;多样性;季节;土层;树龄
土壤微生物能够影响许多生态过程、参与生物地球化学循环,如有机质和养分的转化与循环[1],故其多样性对生态功能的维持至关重要。植物种类在养分吸收、累积、分布和回归中充当了一个重要角色,而土壤微生物在控制植物养分有效性和土壤质量方面具有重要作用[2]。药用植物是对人类健康非常重要的资源。在微生物方面,许多学者对不同药用植物根际土壤组分和微生物群体、根际效应都做了较深入研究[3–4]。也有学者对不同耕作或施肥措施下药用植物土壤有机质、碳氮比、微生物多样性和功能性指数、灌木菌根真菌、微生物生物量等的差异进行了研究[5–6]。同时,虽然许多证据显示植物品种对根际区系、内生菌根真菌有较大影响[7–8],但也有研究表明土壤因素 (尤其是土壤 pH)、种植年限或植物生长阶段对微生物多样性影响较植物品种更显著[9]。微生物与植物根系防御和植物所需养分的获取密切相关,因而,有必要证明植物生长年限和发育阶段对微生物的影响[10]。
枸杞 (Lycium barbarum L.) 是茄科多年生灌木,其果实、叶片、根系都是传统中药。近年来,由于长期密集型管理,宁夏枸杞在 10~15 年就会出现果实产量减少、品质下降的现象。因此,我们假设宁夏枸杞在生长前期和中期土壤微生物多样性丰富,但随着树龄的增加,出现特有的土壤微生物种群并成为优势种群,或它们的数量达到了危害枸杞植株正常生长的程度。在此,本研究通过分析宁夏枸杞不同树龄、不同季节、不同土层土壤微生物组成和多样性,确定不同条件下枸杞土壤微生物细菌群落多样性及引起土壤退化的微生物种群。
1 材料与方法
1.1 研究区概况
宁夏回族自治区中卫市中宁县,位于东经 105°15′~106°05′,北纬 36°49′~37°47′,是中国枸杞之乡,也是宁夏枸杞的主产区。该地区年平均气温 9.5℃,降水202.1 mm,日平均气温 ≥ 10℃ 的天数约 170 d,积温 3200℃~3300℃。本研究在中宁县宁安镇南桥村选择树龄分别为幼龄 (种植当年,< 1 年)、中龄(6 年) 和老龄 (12 年) 枸杞地各 3 块 (每块面积约666 m2)。该地区土壤以灌淤土为主, 质地为砂壤土。
1.2 样品采集
分别于春季 (枸杞展叶期,4 月 26 日)、夏季 (盛果期,7 月 14 日) 和秋季末期 (落叶期,10 月 25 日)采集土壤样品。每块地按 S 形选择 9 株枸杞树,在树冠投影范围内,先去除地表枯枝落叶后,在表层(0—20 cm) 和亚表层 (20—40 cm) 取其土壤,挖取具有完整根系的土体,先轻轻抖落大块不含根系的土壤,然后用力将根表面附着的土壤全部抖落下来,获得目标土壤。每块地 9 株枸杞分别分层采样,然后将同一地块相同层次的土壤充分混匀,将新鲜土样分成 2 份,一份低温冷藏带回实验室,在–20℃ 下冷冻保存,用于土壤含水量和土壤微生物的测定,另一份带回室内风干用于测定土壤 TOC、TON。
1.3 样品分析
1.3.1 土壤样品理化性状测定 TOC 用重铬酸钾容量法;TON 用酸解法;微生物碳、氮 (MBC, MBN) 用氯仿熏蒸浸提法。
1.3.2 土壤 DNA 提取 每个样品取 0.5 g 土样提取DNA,本试验采用 FastDNA®SPIN Kit For Soil 试剂盒提取土壤微生物基因组 DNA,按说明书操作步骤进行。用 1% 的琼脂糖凝胶检验 DNA 纯度。DNA浓度用 NanoDrop (ND-2000) 检测。
1.3.3 illumina HiSeq 测序及数据分析 本研究目标基因为细菌的 16S rRNA V4 区基因片段,所用的引物为 515f (GTGCCAGCMGCCGCGGTAA)/806r (GGACTACHVGGGTWTCTAAT)。反应体系:15μL Phusion High-Fidelity PCR Master Mix (New England Biolabs, UK),Forward Primers (0.2 μmol/L),Reverse Primers (0.2 μmol/L),10 ngDNA 模板。PCR 反应条件:98℃ 1 min,30 × (98℃ 10 s, 50℃ 30 s, 72℃ 60 s),72℃ 5 min。PCR 产物用 2% 琼脂糖凝胶检测,选择位于 200~300 bp 的目标条带,切胶回收纯化进行下一步的分析。
用于 PCR 扩增的引物外侧都会加入一段 barcode序列进行区分,序列为一段 6 bp 碱基的寡核苷酸序列,每个样品用不同 barcode 序列进行区分。Barcode 序列由上海吉美生物医药科技有限公司设计并合成。所得 PCR 产物经切胶纯化后 (Qiagen 胶回收试剂盒),用 NanoDrop 2000 (Thermo Fisher Scientific Inc. USA) 测定浓度,等摩尔混合后采用完成文库构建,安排上机测序。高通量测序由诺禾致远 Illumina MiSeq 2500 平台运行 (Beijing, China, http://www.novogene.com/index.php),最后所测得数据在 250~300 bp 之间产生。
序列分析流程如下:MiSeq 测序序列首先需要得到的双端序列数据根据 PE reads 之间的 overlap 关系,使用软件 Seqprep 将成对的 reads 拼接 (merge)成一条序列,同时对 reads 的质量和 merge 的效果进行质控过滤,并根据序列末端的 box 序列校正序列方向,然后按照 barcode 标签序列识别并区分样品得到有效数据。
1.4 数据处理
利用 SAS 中 Duncan 法检验不同树龄、季节和土层枸杞土壤微生物指标间的差异显著性,用MANOVA 法研究土层、季节和树龄对土壤理化指标和微生物指标的交互影响,采用 Pearson 相关进行土壤理化性状与土壤微生物指标间的相关性分析。
2 结果与分析
2.1 土壤营养元素和微生物生物量
随着枸杞树龄的增加,春季和夏季 0—20 cm 土壤 TOC 先增加后减少,夏季变幅较大 (表 1);秋季表层和春季、夏季亚表层土壤 TOC 有逐渐降低的趋势;亚表层土壤 TOC 变幅普遍小于表层。不同树龄土壤 TON 差异显著;随着树龄的增加,0—40 cm 土壤 TON 均显著增加后显著降低,中龄土壤 TON 最高,其次为老龄。夏季土壤 TOC 和 TON 普遍高于春季和秋季,秋季最低;表层高于亚表层。春季表层土壤 MBC 和 MBN 随树龄的增加而增加,但春季和秋季亚表层则呈相反趋势;夏季 MBC 随树龄的增加先增大后减小,中龄表层土壤 MBC 最高,但MBN 却最低,亚表层该树龄两者均最低。秋季土壤MBC 相对最低。春季和夏季土壤不同树龄 MBN 差异较小,但秋季中龄土壤 MBN 显著高于其他 2 个树龄。微生物生物量 C/N 变化范围很大 (0.07~9.19),其中春季亚表层最高,秋季亚表层最低,幼龄树土壤微生物生物量 C/N 较高 (夏季表层除外)。
2.2 不同树龄枸杞土壤细菌群落多样性
可操作分类单元 (operational taxonomic units,OTU) 的丰度初步说明了样品的物种丰富程度,Chao1指数和 Shannon 指数则都指示了群落多样性、丰富度和均匀度的变化。由表 2 可以看出,春季和夏季 0—20 cm 土壤中龄土壤表层序列数、OUTs 值、Chao1和 Shannon 指数最大,老龄土壤序列数、OUTs 值、Chao1 和 Shannon 指数普遍最小;该土层秋季老龄土壤 OTUs 和 Chao1 指数最大。20—40 cm 土壤序列数和各指数没有一致的变化趋势。夏季土壤 OTUs、Chao1 和 Shannon 指数大于春季和秋季,表层土壤OTUs、Chao1 和 Shannon 指数大于亚表层。
2.3 不同树龄枸杞土壤细菌群落相对丰度分析
从门的角度来计算不同微生物相对丰度 (图 1),表层土壤中 Proteobacteria 相对丰度最大,为 35.3%~48.4% (平均为 41.4%);其次为 Actinobacteria,平均丰度为 13.6%;Bacteroidetes、Planctomycetes 和Chloroflexi 平均丰度也大于 7%,而 Nitrospirae 相对最低,只有 0.8%。亚表层土壤中 Proteobacteria 相对丰度依旧最大,平均为 39.6%;其次是 Actinobacteria,相对丰度为 12.3%;Nitrospirae 平均相对丰度有所增加 (1.4%)。夏季表层土壤 Proteobacteria 丰度在三个季节中最高,春季和秋季差异很小,Actinobacteria丰度在秋季相对丰度最高,春季和夏季基本持平,此外,秋季 Chloroflexi 和 Planctomycetes 丰度高于春季和夏季,春季 Firmicutes 丰度高于夏季和秋季,其它门类丰度在三个季节表层土壤中无明显差异。夏季亚表层土壤 Proteobacteria 丰度高于春季和秋季,秋季 Actinobacteria、Planctomycetes、Gemmatimonadetes、 Cloroflexi 均高于春季和夏季,春季 Crenarchaeota 高于夏季和秋季。相同季节老龄土壤 Proteobacteria 普遍丰度高于幼龄和中龄,幼龄土壤 Planctomycetes 和Chloroflexi 丰度高于中龄和老龄,春季幼龄 Bacteroidetes高于中龄和老龄。表层中龄土壤 Firmitutes 丰度最高,老龄最低;亚表层幼龄最高。表层幼龄土壤 Nitrospirae均高于其他两个树龄,其中夏季差异极显著,中龄土壤 Nitrospirae 丰度最低,亚表层无明显变化规律。2.4不同树龄枸杞土壤群落结构组成分析
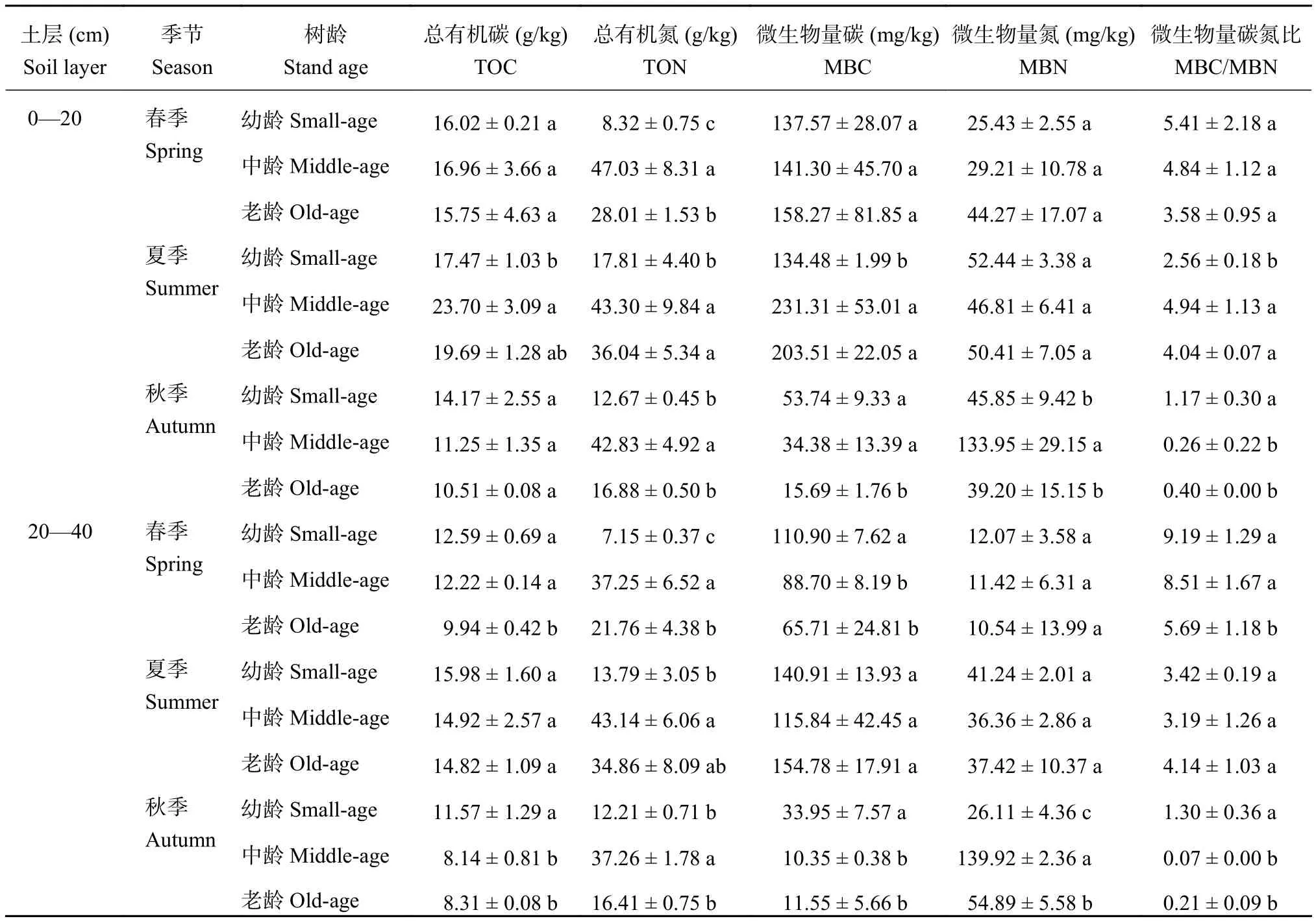
表1 土壤营养元素和微生物指标Table1 Values of nutrient elements and microbial biomass for soils in different conditions
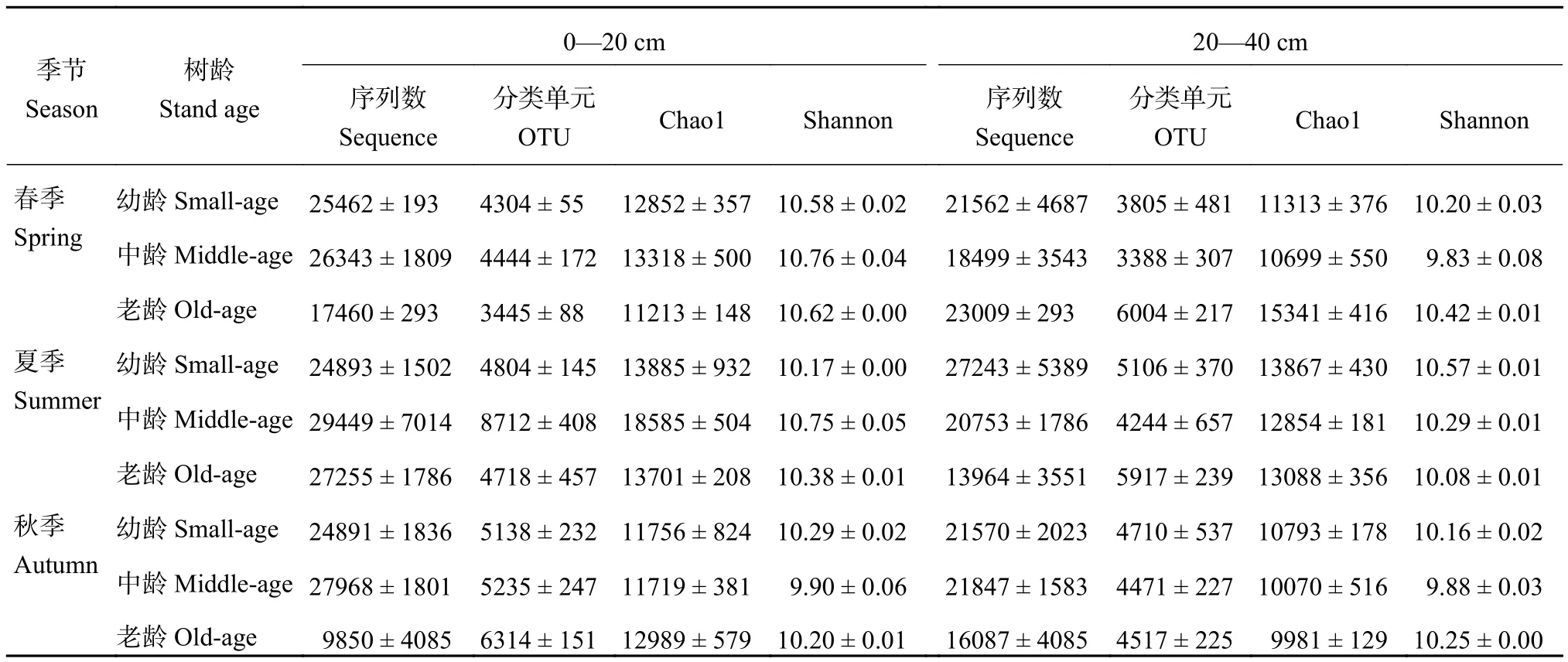
表2 不同季节和土层各树龄高通量序列数、OTUs 和 Shannon 指数Table2 Summary of high quality sequence numbers, numbers of operational taxonomic units (OTUs, ≥ 97% sequence similarity) and Shannon index in different conditions
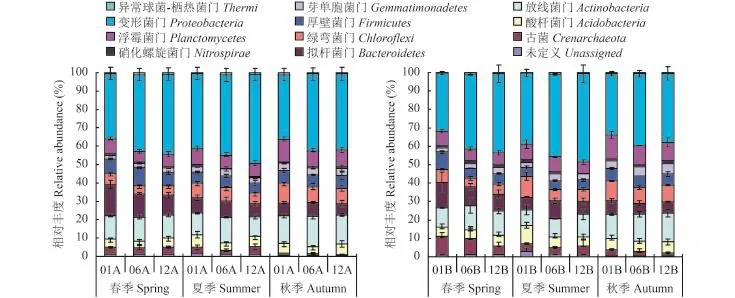
图1 不同季节和树龄土壤在 0—20 cm (左) 和 20—40 cm (右) 细菌各门类相对丰度图Fig. 1 The relative abundance of bacterial phylum in 0–20 cm (Left) and 20–40 cm (Right) in the soil of L. barbarum in different seasons
将微生物属数量大于 0.005 作为标准做热图 (图2),表层土壤筛选出 65 个属,亚表层筛选出 62 个属。表层土壤 Xanthomonadaceae 数量最多,尤其是在秋季中龄和 3 个季节的老龄枸杞土壤;Prielluflaceae含量次之,Candidatus、Flavobacteriaceae、o-iii1-15、Acidimicrobiales、Piscirickettsiaceae、Rhizobiales 和Bacullus 数量相对也较多。亚表层土壤微生物属类组成与表层相似,但 Xanthomonadaceae、Flavobacteriaceae、Piscirickettsiaceae 和 Bacullus 较表层有不同程度的减少,Priellulaceae、Candidatus、o-iii1-15 和Rhizobiales 较表层有不同程度的增加。从聚类分析结果看,表层土壤秋季中龄和老龄土壤微生物数量及结构相似,相同树龄土壤春季和夏季微生物数量及结构相似,亚表层土壤也有类似的变化趋势。
2.5 不同因素对土壤微生物量和细菌多样性的影响
从不同因素对土壤微生物指标的影响程度来看(表 3),土层对土壤 MBC 和细菌群落 Shannon 指数分别有极显著和显著影响,季节对 MBC、MBN、MBC/OM、MBC/TN、细菌群落 Chao1 和 Shannon指数均有极显著或显著影响;树龄对 MBN、MBN/ TN 和 Shannon 指数都有极显著影响,季节和树龄交互对 MBN、MBN/TN 有极显著影响。土层和季节、土层和树龄 2 因子交互及土层、季节和树龄 3 因子交互对土壤微生物指标均无显著影响。所以,土层主要影响土壤碳分布,树龄主要影响土壤氮分布,而季节对土壤碳和氮都有显著影响;树龄能够极显著影响细菌数量及其多样性。
2.6 细菌群落结构 PCA 分析
图3 为 0—20 cm (A) 和 20—40 cm (B) 土层不同季节和不同树龄土壤微生物群落结构的主成分分析结果,该结果可以提供土壤微生物群落结构信息。样品点距离的远近代表了样品中微生物群落的相似性,距离越远,差异越大。0—20 cm土层主成分 1 (PC1)和主成分 2 (PC2) 可以解释 56.58% 的信息,由图可知,不同季节幼龄土壤微生物结构与中龄和老龄差异最大,而春季 3 个树龄土壤微生物结构与夏季和秋季差异也较大。与表层不同,秋季 3 个树龄亚表层土壤微生物结构与春季和夏季差异最大,不同季节幼龄土壤微生物与其他 2 个树龄间差异也较大。从图可以看出,亚表层土壤季节差异大于表层。说明树龄和季节都可以改变枸杞土壤微生物群落结构。
3 讨论
3.1 枸杞土壤营养元素与微生物碳氮
土壤有机碳 (TOC) 不仅是土壤养分的重要组成部分,而且也是微生物活性的物质和能量源泉;土壤有机氮 (TON) 进行矿化,形成的矿质氮是作物吸
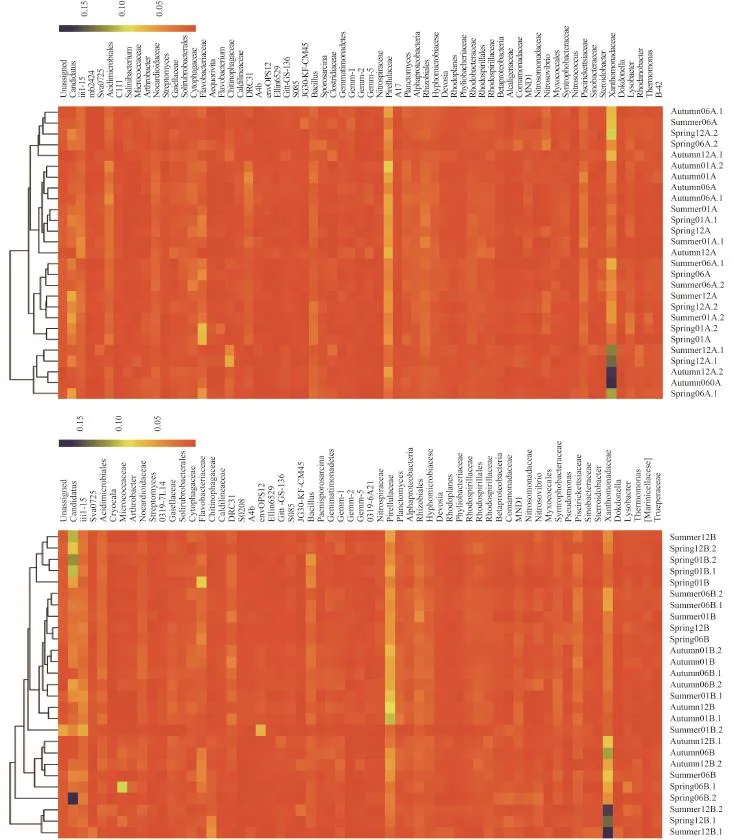
图2 土壤细菌在不同树龄枸杞 0—20 cm (上图) 和 20—40 cm (下图) 土壤分布情况Fig. 2 Distribution of the selected bacteria in 0–20 cm (Up) and 20–40 cm (Down) soils under different age of L. barbarum[注(Note): 图例中热图颜色表示不同树龄土壤细菌属类相对百分数The heat map colors represent the relative percentages of the bacterial genus within different age of soils with the legend indicated of each panel.]
收氮素的主要来源;土壤微生物量碳 (MBC) 是土壤有效养分的流动库和土壤变化的媒介物,它在土壤保持肥力和植物养分吸收方面具有重要作用;而土壤微生物量氮 (MBN) 则是土壤有机氮的来源[11–12]。随着宁夏枸杞树龄的增加,春季和夏季表层土壤TOC 及 0—40 cm 土壤 TON 都先增加后降低,与Ying 等[13]结论一致,这是因为中龄枸杞处于旺盛生长期,虽然对养分消耗很大,但由于产量高,农民对中龄枸杞施用的化肥和有机肥量大,以保证其高产,故 TOC 和 TON 都处于最高值,同时,由于植物根系在土壤中的分布影响有机碳含量的垂直分布,大量腐烂根系为土壤有机碳积累提供来源[14],故老龄枸杞土壤 TOC 和 TON 普遍高于幼龄枸杞土壤。春季表层土壤 MBC 和 MBN 随树龄的增加而增加[15],但春季和秋季亚表层则呈相反趋势,这可能是由于当地农民施肥普遍施在 10—20 cm,春季和秋季表层土壤养分丰富,能为微生物提供丰富的食物来源,而亚表层施肥量少,而该层枸杞根系对养分消耗量也较大,所以该层土壤养分缺乏,植株与微生物产生了养分竞争[16],导致主要以氮素为营养来源的微生物量下降,随着树龄的增加,MBC 和 MBN 逐渐减少,枸杞土壤环境逐步恶化[17]。由于夏季盛果期枸杞鲜果 7 天左右采摘一次,中龄植株产量高,对氮素的消耗非常大,故夏季亚表层中龄枸杞 MBC 和MBN 都最小,说明该季亚表层中龄植株氮素和碳源都需要补充。秋季枸杞果实采摘很少或不再采摘,所以土壤 MBN 大量累积,但中龄和老龄枸杞土壤MBC 均偏低,说明这些树龄需要大量增加碳源,农民需要多施用有机肥。此外,根系分布及根系分泌物在此过程中也起着积极作用[18–19]。

表3 季节、土层、树龄及其交互作用影响土壤微生物因子的多因素方差分析Table3 F-values form three-way ANOVA testing effects of season, layer, planting age, and their interactions on physicochemical and soil microbial parameters
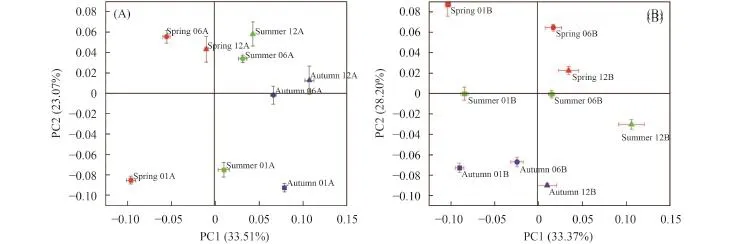
图3 不同树龄枸杞土壤 0—20 cm (A) 和 20—40 cm (B) 细菌群落结构的 PCA 分析Fig. 3 Principal components analysis of bacteria communities in 0–20 cm (A) and 20–40 cm (B) in the soil of L. barbarum intercropping under different standing ages
一般来说,土壤微生物群落的季节变化与土壤温度和湿度的季节变异密切相关[20],故夏季 TOC、TON 和 MBC 高于春季,秋季最低,这是由于 4 月底当地温度虽然有所升高,但是土温依旧很低,10月底土壤温度已经下降至 15℃ 左右,这两个时期植物生长缓慢,不利于土壤微生物的生存,而 7 月份,是植株生长茂盛时期,丰富的植物生物量为土壤提供大量的凋落物,另外发达的灌丛植物地下根系,其分泌物和死根是土壤微生物的重要能源物质,有利于土壤微生物的生长繁殖与土壤养分的积累。但何容等[21]对武夷山不同海拔植被土壤微生物量碳随季节的变化研究表明均为早春最大,夏季最小,研究结果的差异源于海拔高带来的温湿度差异而致。因此,影响土壤微生物的因素较多,其生物量的高低仍取决于起关键作用的影响因素[22]。
3.2 枸杞土壤微生物多样性
本研究中随着树龄增加,枸杞表层土壤 Chao1和 Shannon 指数普遍呈先增加后减小的趋势,说明中龄枸杞土壤微生物群落结构与幼龄和老龄相比最丰富,植株生长至 12 年左右时多样性减小,土壤微环境恶化。但亚表层随树龄的增加微生物群落多样性变化规律不同,中龄土壤 Chao1 和 Shannon 指数普遍最低,说明中龄植株土壤在亚表层微生物多样性较差,这可能是施肥多在表层,亚表层养分含量相对较少,根系对养分吸收与微生物形成竞争,抑制或阻碍了微生物群落的繁殖[15]。
在门的分类水平上,不同树龄间活性微生物组成比较一致,但各门相对丰度不同。从细菌的组成来看,35% 以上的细菌基因源于 Proteobacteria,在活性微生物中占绝对优势,其他门如 Actinobacteria、Bacteroidetes、Planctomycetes、Chloroflexi、Firmicutes、Acidobacteria、Gemmatimonadetes、Nitrospirae 均为农田土壤中的常见门类[23]。研究表明,Acidobacteria 广泛分布于理化性质迥异的各种土壤环境,是土壤中仅次于 Proteobacteria 的第二大微生物类群,其数量和组成受 pH 值影响较大[30],但本研究中 Actinobacteria 为该地区枸杞土壤微生物的第二大类群,这是因为其适合生长在中性或微碱性的土壤中[24]。李晨华等[25]指出 Actinobacteria 与Proteobacteria 是灰漠土表层土壤中的优势类群,此结论与本研究基本一致,但该研究指出随土壤深度的增加,Actinobacteria 相对丰度减少,Proteobacteria相对丰度增加,逐渐成为深层土壤的绝对优势类群,也有相关研究表明Proteobacteria 相对丰度会随土壤深度降低,Actinobacteria 相对丰度则在深土层中较高[26]。而本研究发现随着深度增加,Actinobacteria与 Proteobacteria 都略有降低。通常情况下放线菌适应好氧环境,而周期性灌溉与研究区较高的地下水位,使得土壤含水量随土壤深度的增加而升高,氧气含量随之下降,这可能是 Actinobacteria 随深度其相对丰度降低的一个原因。有研究指出,Acidobacteria是可以作为较贫瘠土壤环境的指标[25],中龄土壤Acidobacteria 最低,幼龄和老龄都较高,说明幼龄和老龄土壤质量都较差。幼龄枸杞表层土壤硝化螺杆菌相对丰度最高,这表明了幼龄枸杞土壤的硝化作用较强,从而可以促进氧化亚氮的排放[27]。研究区中 Firmicutes 的绝对优势类群为芽孢杆菌纲(Bacilli),其在抗盐碱方面具有优势[28],表层中龄树土壤 Firmitutes 丰度最高,说明该树龄表层抗盐碱能力最强,老龄抗盐碱能力最弱。
本研究变形杆菌中 Xanthomonadales、Rhodobacterales 和 Rhizobiales 占主导地位,尤其是在秋季中龄和 3 个季节的老龄枸杞土壤中。Xanthomonadales 是革兰氏阴性菌,其中的很多物种是植物的病原体,能够导致农作物病害[9],其含量与土壤遭受胁迫有关[29]。虽然表层土壤拮抗微生物Lysobacter 比例高于亚表层,对病原菌有一定的制约作用[30],但含量较少,其作用也有限。亚表层Xanthomonadaceae、Bacullus 等减少,Priellulaceae、Rhizobiales 较表层有不同程度的增加,其中Rhizobiales 具有固氮作用[31],说明亚表层土壤较表层土壤略健康。
3.3 枸杞土壤微生物影响因素
从不同因素对土壤微生物指标的影响程度来看,土层主要对土壤碳源和微生物生物量碳有极显著影响[32]。季节对枸杞土壤碳源、微生物生物量碳氮均有极显著影响,而树龄主要显著影响土壤氮源和细菌群落多样性,土层、季节和树龄 3 因子交互对土壤微生物均无显著影响。从 PCA 结果也可以看出,季节和树龄都可以显著影响枸杞土壤微生物结构,表层树龄影响更显著,但亚表层季节影响更大。
4 结论
随着宁夏枸杞树龄的增加,春季和夏季表层土壤 TOC 及 0—40 cm 土壤 TON 都先增加后降低,春季表层土壤 MBC 和 MBN 随树龄的增加而增加,但春季和秋季亚表层则呈相反趋势。随着树龄增加,枸杞表层土壤微生物多样性普遍呈先增加后减小的趋势,说明中龄枸杞土壤微生物群落结构最丰富,植株生长至 12 年左右时多样性减小,土壤微环境恶化。但 6 年树龄植株根系在亚表层微生物多样性较差,所以建议中龄枸杞施肥深度增加。枸杞土壤Proteobacteria、Actinobacteria、Bacteroidete 在活性微生物中占绝对优势。本研究变形杆菌中Xanthomonadales,Rhodobacterales 和 Rhizobiales 占主导地位,尤其是在秋季中龄和 3 个季节的老龄枸杞。不同因素对枸杞土壤细菌群落演替影响程度不同:季节对枸杞土壤碳源、微生物生物量碳氮均有极显著影响,而树龄主要显著影响土壤氮源和细菌群落多样性,土层、季节和树龄 3 因子交互对土壤细菌群落均无显著影响。
[1]He JZ, Li J, Zheng YM. Thoughts on the microbial diversitystability relationship in soil ecosystems[J]. Biodiversity Science, 2013, 21(4): 411–420.
[2]蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(8): 979–988. Jiang J, Song MH. Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling[J]. Chinese Journal of Plant Ecology, 2010, 34(8): 979–988.
[3]Karthikeyan B, Jaleel CA, Lakshmanan GM A, et al. Studies on rhizosphere microbial diversity of some commercially important medicinal plants[J]. Colloids and Surfaces B: Biointerfaces, 2008, 62: 143–145.
[4]Ahmed EA, Hassan EA, Tobgy KM KE, et al. Evaluation of rhizobacteria of some medicinal plants for plant growth promotion and biological control[J]. Annals of Agricultural Science, 2014, 59(2): 273–280.
[5]Palese AM, Vignozzi N, Celano G, et al. Influence of soil management on soil physical characteristics and water storage in a mature rainfed olive orchard[J]. Soil & Tillage Research, 2014, 144: 96–109.
[6]Taguas EV, Gómez JA. Vulnerability of olive orchards under the current CAP (common agricultural policy) regulations on soil erosion: a study case in Southern Spain[J]. Land Use Policy, 2015, 42: 683–694.
[7]Zubek S, Stefanowicz AM, Błaszkowski J, et al. Arbuscular mycorrhizal fungi and soil microbial communities under contrasting fertilization of three medicinal plants[J]. Applied Soil Ecology, 2012, 59: 106–115.
[8]Wei M, Zhuge YP, Lou YH, et al. Effects of fertilization on Xanthoceras sorbifolia bunge growth and soil enzyme activities[J]. Journal of Soil and Water Conservation, 2010, 24(2): 237–240.
[9]Campos SB, Lisboa BB, Flavio AO, et al. Soil suppressiveness and its relations with the microbial community in aBrazilian subtropical agroecosystem under different management systems[J]. Soil Biology and Biochemistry, 2016, 96: 191–197.
[10]Chaparro JM, Badri DV, Vivanco JM. Rhizosphere microbiome assemblage is affected by plant development[J]. The ISME Journal, 2014, 8(4): 790.
[11]刘金山, 戴健, 刘洋, 等. 过量施氮对旱地土壤碳、氮及供氮能力的影响[J]. 植物营养与肥料学报, 2015, 21(1): 112–120. Liu JS, Dai J, Liu Y, et al. Effects of excessive nitrogen fertilization on soil organic carbon and nitrogen and nitrogen supply capacity in dryland[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(1): 112–120.
[12]Li R, Liu YN, Cheng WY, et al. Study on remediation of phenanthrene contaminated soil by pulsed dielectric barrier discharge plasma: The role of active species[J]. Chemical Engineering Journal, 2016, 296: 132–140.
[13]Ying YX, Ding WL, Zhou YQ, et al. Influence of Panax ginseng continuous cropping on metabolic function of soil microbial communities[J]. Chinese Herbal Medicines, 2012, 4(4): 329–334.
[14]Jobbagy EG, Jackson RB. The vertical distribution of soil organic carbon and its relation to climate and vegetation[J]. Ecological Applications, 2002, 10(2): 423–436.
[15]王纪杰. 桉树人工林土壤质量变化特征[D]. 南京: 南京林业大学博士学位论文, 2011. Wang JJ. Variation characteristies of soil quality in EuealyPtus plantation [D]. Nanjing: PhD Dissertation, Nangjing Forestry University, 2011.
[16]Singh S, Ghoshal N, Singh KP. Variations in soil microbial biomass and crop roots due to differing resource quality inputs in atropical dryland agroecosystem[J]. Soil Biology and Biochemisty, 2007, 39: 76–86.
[17]Józefowska A, Wós B, Pietrzykowski M. Tree species and soil substrate effects on soil biota during early soil forming stages at afforested mine sites[J]. Applied Soil Ecology, 2016, 102: 70–79.
[18]Shahzad T, Chenu C, Genet P, et al. Contribution of exudates, arbuscular mycorrhizal fungi and litter depositions to the rhizosphere priming effect induced by grassland species[J]. Soil Biology and Biochemistry, 2015, 80: 146–155.
[19]Sun BJ, Jia SX, Zhang SX. Tillage, seasonal and depths effects on soil microbial properties in black soil of Northeast China[J]. Soil & Tillage Research, 2016, 155: 421–428.
[20]张琪. 高寒草原区不同植被恢复方式对土壤微生物的影响研究[D]. 兰州: 兰州大学博士学位论文, 2015. Zhang Q. Influence of vegetation restoration methods on alpine steppe soil microorganisms [D]. Lanzhou: PhD Dissertation, Lanzhou University, 2015.
[21]何容, 王国兵, 汪家社, 等. 武夷山不同海拔植被土壤微生物量的季节动态及主要影响因子[J]. 生态学杂志, 2009, 28(3): 394–399. He R, Wang GB, Wang JS, et al. Seasonal variation and its main affecting factors of soil microbial biomass under different vegetations along an elevation gradient in Wuyi Mountains of China[J]. Chinese Journal of Ecology, 2009, 28(3): 394–399.
[22]Yao HY, Bowman D, Shi W. Seasonal variations of soil microbial biomass and activity in warm- and cool-season turfgrass systems[J]. Soil Biology and Biochemistry, 2011, 43: 1536–1543.
[23]陈月星. 覆盖对渭北旱作苹果园土壤微生物群落特征的影响[D].杨凌: 西北农林科技大学博士学位论文, 2015. Chen YX. Effects of mulching managements on soil microbial communities in an unirrigated apple orchard of Weibei Loess Plateau [D]. Yangling: PhD Dissertation, Northwest Agriculture and Forestry University, 2015.
[24]刘方春, 邢尚军, 马海林, 等. 干旱生境中接种根际促生细菌对核桃根际土壤生物学特征的影响[J]. 应用生态学报, 2014, 25(5): 1475–1482. Liu FC, Xing SJ, Ma HL, et al. Effects of inoculating plant growthpromoting rhizobacteria on the biological characteristics of walnut(Juglans regia) rhizosphere soil under drought condition[J]. Chinese Journal of Applied Ecology, 2014, 25(5): 1475–1482.
[25]李晨华, 张彩霞, 唐立松, 等. 长期施肥土壤微生物群落的剖面变化及其与土壤性质的关系[J]. 微生物学报, 2014, 54(3): 319–329. Li CH, Zhang CX, Tang LS, et al. Effect of long-term fertilizing regime on soil microbial diversity and soil property[J]. Acta Microbiologica Sinica, 2014, 54(3): 319–329.
[26]肖烨. 三江平原典型湿地类型土壤微生物学特性对土壤有机碳的影响[D]. 北京: 中国科学院大学博士学位论文, 2015. Xiao Y. Effects of soil microbiological characteristics on soil organic carbon in the typical wetlands of Sanjiang Plain, Northeast China [D]. Beijing: PhD Dissertation, University of Chinese Academy of Sciences, 2015.
[27]路丹, 雷静, 韦燕燕, 等. 短期免耕和垄作对稻田土壤微生物群落及多样性指数的影响[J]. 西南农业学报, 2015, 28(4): 1670–1674. Lu D, Lei J, Wei YY, et al. Effect of microbial community and diversity index of paddy soil under short no-tillage and ridge tillage[J]. Southwest China Journal of Agricultural Sciences, 2015, 28(4): 1670–1674.
[28]Naushad HS, Gupta RS. Phylogenomics and molecular signatures for species from the plant pathogen-containing order xanthomonadalles[J]. PloS One, 2013, 8(2): e55216.
[29]汪华. 茶园土壤微生物群落结构对植茶年限、施肥和高温条件的响应研究[D]. 杭州: 浙江大学博士学位论文, 2014. Wang H. The response of soil microbial community structure to cultivating age, fertilization and high temperature in tea orchard [D]. Hangzhou: PhD Dissertation, Zhejiang University, 2014.
[30]Rehman K, Ying Z, Andleeb S, et al. Short term influence of organic and inorganic fertilizer on soil microbial biomass and DNA in summer and spring[J]. Journal of Northeast Agricultural University (English Edition), 2016, 23(1): 20–27.
[31]Dombrecht B, Marchal K, Vanderleyden J, et al. Prediction and overview of the RpoN-regulon in closely related species of the rhizobiales[J]. Genome Biology, 2002, 3(12): RESEARCH0076.
[32]Eilers KG, Debenport S, Anderson S, et al. Digging deeper to find unique microbial communities: The strong effect of depth on the structure of bacterial and archaeal communities in soil[J]. Soil Biology and Biochemistry, 2012, 50: 58–65.
Evolution characteristics of bacteria in soil of medical plant (Lycium barbarum L.)
ZHANG Jun-hua1, ZHANG Yi2, LI Ming1
( 1 Institute of Environmental Engineering, Ningxia University, Yinchuan 750021, China; 2 College of Education, Ningxia University, Yinchuan 750021, China )
【Objectives】Studying effects of soil layer, seasons and stand ages on soil bacteria of Lycium barbarum L. is very important to reveal trends of soil quality change in cultivated regions of L. barbarum.【Methods】The study was achieved by high throughput sequencing analysis of bacteria community structure and abundance of soil samples from L. barbarum fields in Zhongning County, Ningxia Province, which is the origin of L. barbarum. Three stand ages of L. barbarum were selected, small-age (< 1 year), middle-age (6 year) and old-age (12 year). The soil samples (three plots each) were collected in spring, summer and autumn in surface (0–20 cm) and subsurface (20–40 cm) layers.【Results】Compared to the small-age of soil, the total organic carbon (TOC) of 0–20 cm in spring and summer and total organic nitrogen (TON) of 0–40 cm of the middle-age and old-age were increased and then decreased and the microbial biomass carbon (MBC) andmicrobial biomass nitrogen (MBN) of 0–20 cm in spring were increased from the small-age to old-age, while those of 20–40 cm in spring and autumn were decreased. The MBC of 0–20 cm of the middle-age in summer was highest, while the MBN was lowest. With the increase of stand age, the soil bacteria community diversity of L. barbarum was increased and then decreased. Proteobacteria, Actinobacteria and Bacteroidete were prodominent plyumn. The relative abundance of Proteobacteria of the old-age was higher than that of the smallage and middle-age, Planctomycetes and Chloroflexi of small-age were higher than the middle-age and old-age. Xanthomonadales, Rhodobacterales and Rhizobiales were the prodominent classes, especial for the middle-age in autumn and old-age in three seasons. There were different effects of soil layer, seasons and stand ages on the microbial biomass.【Conclusions】With the increase of stand age, microbial biomass and diversities of soil of L. barbarum have an increased–decreased tendency. Compared to the small-age and middle-age, the soil of the old-age had maximum Xanthomonadales. Carbon of soil was influenced significantly by soil layers in our study, nitrogen and bacterial community diversities were influenced significantly by stand ages and carbon, MBC and MBN were all influenced significantly by seasons.
Lycium barbarum L.; bacteria community; diversity; season; soil layer; stand age
2016–09–02 接受日期:2016–11–28
国家自然科学基金(41261080);宁夏自治区环保专项资金项目资助。
张俊华(1977—),女,宁夏中卫人,博士,研究员,主要从事精准农业和土壤质量提升方面研究。E-mail:zhangjunhua728@163.com
