外源硫酸铝调节八仙花花青苷组成和含量变化的分子生物学机制
2017-06-13龚仲幸何勇杨静宋亚叶真逍朱祝军
龚仲幸,何勇,杨静,宋亚,叶真逍,朱祝军*
(1 杭州职业技术学院,浙江杭州 310018;2 浙江农林大学农业与食品科学学院/浙江省农产品品质改良重点实验室,浙江临安 311300)
外源硫酸铝调节八仙花花青苷组成和含量变化的分子生物学机制
龚仲幸1,何勇2,杨静2,宋亚2,叶真逍2,朱祝军2*
(1 杭州职业技术学院,浙江杭州 310018;2 浙江农林大学农业与食品科学学院/浙江省农产品品质改良重点实验室,浙江临安 311300)
【目的】八仙花是我国重要的观赏植物之一,本研究旨在探讨 Al2(SO4)3对八仙花花色的影响及其机制。【方法】以‘蓝色妈妈’品种为对象进行盆栽试验,设置了 0 (pH 为 6 的柠檬酸缓冲液)、2‰ 和 4‰ 3 个Al2(SO4)3水平,在植株出现花蕾约 1 cm 时进行处理。在开花盛期进行花色分析,采用高效液相色谱法和质谱分析花青苷成分和含量,采用电感耦合等离子体原子发射光谱法分析金属离子含量,采用荧光定量 PCR 分析 Al3+运输相关基因表达水平。 【结果】2‰ 和 4‰ 的 Al2(SO4)3处理 21 d 后,花瓣颜色从粉色变为紫色和蓝紫色。‘蓝色妈妈’花瓣中检测到了飞燕草素-3-葡萄糖苷等 12 种花青苷;2‰ 和 4‰ 的 Al2(SO4)3处理显著 (P < 0.05)增加了飞燕草素苷、矢车菊素苷和芍药花素苷含量,其中增加幅度最大的是飞燕草素苷含量,从对照 (CK) 组的 5159.9 μg/g FW 分别增加到 24681.2 μg/g FW 和 30485.7 μg/g FW;飞燕草素苷含量增加主要是由于飞燕草素-3-葡萄糖苷和飞燕草素-3-戊糖-5-葡萄糖苷含量增加,飞燕草素-3-葡萄糖苷含量从对照的 4679.2 μg/g FW 分别增加到 23610.0 μg/g FW 和 29129.7 μg/g FW,飞燕草素-3-戊糖-5-葡萄糖苷从对照的 142.3 μg/g FW 分别增加到805.6 μg/g FW 和 1114.9 μg/g FW。2‰ 和 4‰ 的 Al2(SO4)3处理后,花瓣中 Al3+含量从对照的 2.24 μg/g FW 分别增加到 5.12 μg/g FW 和 11.83 μg/g FW;2‰ 和 4‰ 的 Al2(SO4)3处理后,花瓣中质膜铝转运基因 (plasma membrane Al transporter, PALT) 和液泡膜铝转运基因 (vacuolar Al transporter, VALT) 表达水平显著提高 (P < 0.05),PALT 表达水平分别比对照提高了 88.5% 和 148.2%,VALT 表达水平分别比对照提高了 74.8% 和135.7%。 【结论】Al2(SO4)3处理诱导了 Al3+运输相关基因的表达,增加了花瓣中 Al3+积累,提高了飞燕草素苷含量,进而改变了花的颜色。
八仙花;花色;硫酸铝;花青苷;基因表达
八仙花 (Hydrangea macrophylla) 又名大花绣球、阴性绣球等,属虎耳草科八仙花属,原产于中国和日本,在我国广泛用作观赏灌木和盆栽花卉。八仙花品种繁多,主要的花色有红色、粉色、白色、蓝色等[1]。研究发现,八仙花颜色会由于栽培方式、周围环境变化而变化,如八仙花花色与土壤 pH 值有关,在中性或碱性土壤中呈现粉红色,在酸性土中呈蓝色[2–3]。Ito 等[4]发现蓝色品种八仙花花瓣内 Al3+含量比红色品种高 39 倍。Schreiber 等[5]分析了多个红色、紫色和蓝色八仙花品种色素及 Al3+含量,发现红色品种花瓣 Al3+含量范围为 0~10 μg/g FW,紫色品种含量范围为 10~40 μg/g FW,蓝色品种 Al3+含量大于 40 μg/g FW,并提出八仙花呈现不同颜色是因为不同浓度的 Al3+与飞燕草素-3-葡萄糖苷形成的复合物呈色反应不同造成的。在酸性条件下,苹果酸等会激活 Al3+运输通道,从而促进根系 Al3+的吸收[6]。在八仙花花瓣内,Al3+的积累主要是通过两个铝离子转运蛋白来实现,分别位于质膜和液泡膜上 [其编码基因分别为质膜铝转运基因 plasma membrane Al transporter (PALT) 和液泡膜铝转运基因vacuolar Al transporter (VALT)],均属于水通道蛋白家族。质膜铝离子转运蛋白将 Al3+从细胞外运输到细胞质中,继而由液泡膜铝转运蛋白运输到液泡并储存起来[7],与液泡中的飞燕草素-3-葡萄糖苷形成复合物。
我国八仙花品种繁多,当前研究主要关注八仙花组织培养、耐铝毒害机制等[8–9]。本研究以浙江省主要的八仙花品种之一‘蓝色妈妈’为材料,分析了不同浓度 Al2(SO4)3处理对其花色、花青苷含量、Al3+含量及 Al3+跨膜运输相关基因表达的影响,探讨通过控制根域 Al3+浓度调控八仙花花色,满足市场需求。
1 材料与方法
1.1 试验设计
采用八仙花品种为‘蓝色妈妈’,种苗购自浙江虹越花卉有限公司。2015 年 4 月,在扦插苗中选取整齐一致的幼苗移入标准 1 加仑营养盆中进行处理,栽培基质为混合基质 (珍珠岩∶蛭石∶草炭之比为 1∶1∶1,pH 6)。试验设置 3 个处理:1) CK,根系添加 pH 为 6 的柠檬酸缓冲液;2) 根系添加 2‰Al2(SO4)3,用柠檬酸缓冲液将 pH 调节至 6;3) 根系添加 4‰ Al2(SO4)3,用柠檬酸缓冲液将 pH 调节至6。在植株出现花蕾约 1 cm 时开始进行处理,以后每周处理 1 次,直至现蕾,每处理 4 次重复。开花盛期时拍照进行花色分析,取花瓣鲜样进行色素含量分析,取样品液氮冷冻放入 –80℃ 冰箱供基因表达水平分析。
1.2 花青苷含量测定与质谱分析
提取方法参照考 Park 等[10]的方法并略作修改。取 5 g 鲜样,加入 10 mL 5% 甲酸溶液,研磨至匀浆,超声 30 min,4000 rpm/min 离心,上清液过0.45 μm 滤膜,得到提取液。将提取液进高效液相色谱 (LC-20AT,日本岛津公司) 进行分析。色谱柱为InertSustain C18 (4.6 mm × 250 mm,5 μm),流动相A 相为 5% 甲酸水溶液,B 相为 5% 甲酸乙腈,进样量 20 μL,流速 1.0 mL/min。线性洗脱梯度:0 min,5% B;8~13 min,13%B;13~20 min,17% B;20~23 min,17% B;23~30 min,20%B;30~40 min,20% B;40~40.1 min,5% B;40.1~50 min,5%B。检测波长 520 nm。样品定量采用外标法,标准品为矢车菊-3,5-双葡萄糖苷[11],标准曲线为 y = 15188.01x – 16778.39 (R2= 0.999)。质谱分析采用高效液相色谱离子质谱联用仪 (6460 Triple Quad LC/MS,美国安捷伦科技有限公司)。质谱条件参照宋亚等[12]的方法,采用综合色谱相对保留时间、质谱分子离子峰和碎片离子峰等确定其分子结构。
1.3 金属离子含量分析
称取花瓣样品 10 g,将其放入到烘箱中烘干至恒重,样品经磨碎、过 0.425 mm 筛,用 V(H2SO4)∶V(H2O2) = 3∶1 消煮样品,利用 ICP-AES (inductively coupled plasma atomic emission spectroscopy) 测定离子含量。
1.4 基因表达分析
RNA 提取采用基于 Trizol 法的 RNA 试剂盒(Simgen) 进行,按说明书操作提取 RNA。反转录生成 cDNA,在荧光定量 PCR 反应体系混合液中加入2 μL 稀释后的 cDNA 模板,充分混匀。然后放置于ABI PRISM®7000 荧光 PCR 仪中进行荧光定量PCR。PCR 程序为 95℃ 变性 1 min;聚合反应阶段95℃ 5 s,60℃ 33 s,40 次循环;95℃ 15 s,60℃ 20 s,95℃ 15 s。各基因和内参基因 PCR 引物采用 Negishi等[7]设计的引物,18S rRNA 为内参基因,各基因引物如下:VALT,5′-GGCCCTAGCAGAGTTCTT CTCT-3′,5′-AATGTAATGTTCCCACCAAGGA-3′;PALT1,5′-ACCTGTAACTCCAGGGACTCCT-3′,5′-TATGAACTCAGCTCCCACCTTT-3′;18S rRNA,5′-GGAAGTTTGAGGCAATAACAGG-3′,5′-ATTGCAATGATCTATCCCCATC-3′。
2 结果与分析
2.1 花色变化
由图 1 可知,在对照 (CK) 植株中,‘蓝色妈妈’颜色为粉红色略带白色,是该品种的典型颜色,2‰Al2(SO4)3处理后,花瓣颜色呈现淡紫色,4‰Al2(SO4)3处理 21 d 后,花瓣颜色转为蓝紫色。试验表明,Al2(SO4)3处理后能明显改变‘蓝色妈妈’花瓣颜色。

图1 Al2(SO4)3处理对‘蓝色妈妈’花色的影响Fig. 1 Effects of the Al2(SO4)3application on flower colour in ‘mama blue’
2.2 花青素组成与含量
经质谱分析,‘蓝色妈妈’花瓣中检测到了 12种花青苷 (图 2),其中 11 种为芍药花素-3-葡萄糖苷、芍药花素-3,5-双葡萄糖苷、飞燕草素-3-戊糖-5葡萄糖苷、飞燕草素-3-葡萄糖苷、飞燕草素-3-戊糖苷、矢车菊素-3,5-双葡萄糖苷、矢车菊素-3-戊糖苷、矢车菊素-3-芥子酰-阿魏酰-槐糖苷-5-丙二酰-葡萄糖苷、矢车菊素-3-p-香豆酰-芥子酰-槐糖苷-5-丙二酰-葡萄糖苷、矢车菊素-3-咖啡酰-丙二酰-槐糖苷-5-葡萄糖苷和矢车菊素-3-p-香豆酰-p-香豆酰-槐糖苷-5-葡萄糖苷,另一种成分未知 (表 1)。

图2 ‘蓝色妈妈’花瓣花青苷组分色谱图Fig. 2 The anthocyanins components chromatogram of‘mama blue’ petal
从生色团 (chromophores) 类别上来说,飞燕草素苷中,随着 Al2(SO4)3处理浓度的增加,飞燕草素-3-戊糖-5葡萄糖苷、飞燕草素-3-葡萄糖苷含量显著 (P < 0.05) 提高;其中,飞燕草素-3-戊糖-5葡萄糖苷含量从 142.3 μg/g FW 增加到 805.6 μg/g FW 和 1114.9 μg/g FW,而飞燕草素-3-葡萄糖苷含量从对照的4679.2 μg/g FW 增加到 23610.0 μg/g FW 和 29129.7 μg/g FW。此外,保留时间为 11.14 min 的飞燕草素-3-戊糖苷含量相比对照显著 (P < 0.05) 降低,而保留时间为 12.558 min 的飞燕草素-3-戊糖苷则不受Al2(SO4)3处理的影响。对于矢车菊素苷,矢车菊素-3-戊糖苷和矢车菊素-3-咖啡酰-丙二酰-槐糖苷-5-葡萄糖苷的含量相比对照显著提高,尤其是矢车菊素-3-咖啡酰-丙二酰-槐糖苷-5-葡萄糖苷,含量从 62.9 μg/g FW 增加到 794.5 μg/g FW 和 1015.2 μg/g FW;矢车菊素-3-p-香豆酰-芥子酰-槐糖苷-5-丙二酰-葡萄糖苷含量在 2‰ Al2(SO4)3处理后显著增加,而在 4‰Al2(SO4)3处理中相比前者略微降低,但仍显著高于对照;同时,矢车菊素-3,5-双葡萄糖苷含量在Al2(SO4)3处理后降低,且下降幅度和 Al2(SO4)3浓度呈正相关。芍药花素苷中,芍药花素-3-葡萄糖苷、芍药花素-3,5-双葡萄糖苷含量均在 2‰ Al2(SO4)3处理后大幅增加,然而提高 Al2(SO4)3处理浓度对于增幅影响不明显。从花青苷总体含量而言,矢车菊素苷、飞燕草素苷和芍药花素苷含量均随着 Al2(SO4)3处理浓度增加而显著增加。2‰ Al2(SO4)3和 4‰Al2(SO4)3处理处理后,矢车菊素苷含量从 CK 的926.8 μg/g FW 增加到 1575.7 μg/g FW 和 1784.0 μg/g FW;飞燕草素苷含量从 CK 的 5159.9 μg/g FW 增加到 24681.2 μg/g FW 和 30485.7 μg/g FW;芍药花素苷含量从对照的 99.7 μg/g FW 增加到 375.9 μg/g FW 和399.2 μg/g FW。
2.3 金属离子含量
从表 2 可知,2‰ Al2(SO4)3处理显著 (P < 0.05)提高了花瓣 Al3+含量,4‰ Al2(SO4)3处理后 Al3+含量进一步提高,且显著 (P < 0.05) 高于 2‰ Al2(SO4)3处理,分别从对照的 2.24 μg/g FW 增加到 5.12 μg/g FW和 11.83 μg/g FW。与对照相比,2‰ 和 4‰ 的Al2(SO4)3处理均显著 (P < 0.05) 提高了 Mn2+和 Mg2+含量,但两浓度处理之间无显著差异。Al2(SO4)3处理对 Fe3+含量无显著影响。

表1 八仙花花青苷主要成分及含量Table1 The main composition and contents of anthocyanins of Hydrangea macrophylla
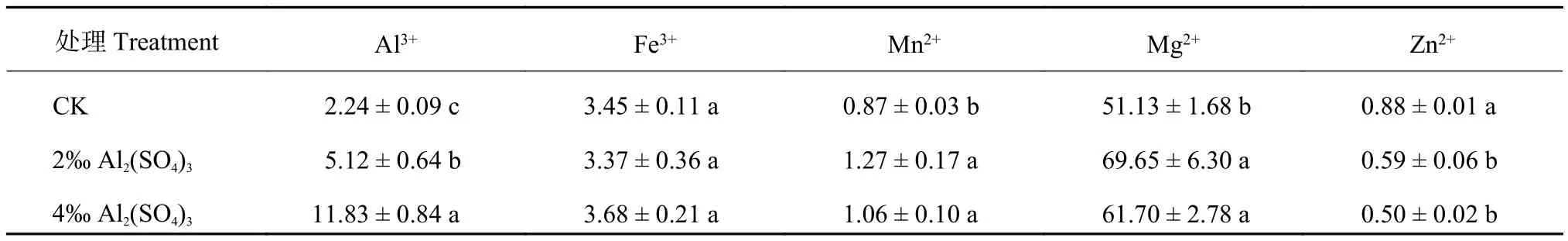
表2 硫酸铝处理对几种金属离子含量的影响 (μg/g,FW)Table2 Effects of the Al2(SO4)3application on several metal ions contents
2.4 Al3+运输基因表达分析
图3 表明,2‰ Al2(SO4)3处理显著 (P < 0.05) 提高了花瓣 PALT 基因和 VALT 基因的表达水平,4‰Al2(SO4)3处理进一步提高了两基因的表达水平,且均显著 (P < 0.05) 高于 2‰ Al2(SO4)3。

图3 Al2(SO4)3处理对 PALT 和 VALT 表达的影响Fig. 3 Effects of the Al2(SO4)3application on expression of PALT and VALT
3 讨论与结论
八仙花品种多样,颜色丰富,观赏性强,其颜色受外界环境条件等因素影响。本研究发现,通过在根系施用不同浓度的 Al2(SO4)3,‘蓝色妈妈’八仙花花色能从粉红色转变为淡紫色和蓝紫色。这与Neumann 等[13]的研究结果相一致,Neumann 还发现施用 Al2(SO4)3改变八仙花颜色存在品种特异性,部分品种花色不会受到 Al2(SO4)3影响。
花青苷是主要的呈色物质之一。八仙花主要的呈色物质均由飞燕草素-3-葡萄糖苷衍生物单体衍生而来,不同颜色花瓣中,所含有的花青素生色团不同,蓝色花瓣中以飞燕草素-3-葡萄糖苷衍生物为主,在粉色花瓣中包含了天竺葵素生色团或矢车菊素生色团[14]。本研究分析了八仙花所含花青苷种类和含量,‘蓝色妈妈’花瓣中含有 12 种花青苷 (表 1)。在粉色花瓣中含有一定量的矢车菊素苷,含量最高的是飞燕草素-3-葡萄糖苷,这与贾洪菊[15]的研究结果相类似。施用 Al2(SO4)3后,伴随着颜色从粉色转为紫色和蓝紫色,飞燕草素苷 (尤其是飞燕草素-3-戊糖-5葡萄糖苷和飞燕草素-3-葡萄糖苷花青苷) 的含量大幅度提高。Al2(SO4)3处理后,矢车菊素苷含量出现明显上升,说明其也受 Al3+诱导。这说明花青苷组成和含量变化是外源 Al2(SO4)3改变八仙花颜色的原因之一。
在八仙花中,Al3+能与飞燕草素-3-葡萄糖苷形成复合物,介导花色变蓝[16]。在不同颜色的花瓣中,Al3+含量与花瓣颜色密切相关。本研究发现,伴随着施用 Al2(SO4)3浓度的提高,花瓣中 Al3+含量显著提高,施用 4‰ Al2(SO4)3的后,花瓣中 Al3+含量达到11.83 μg/g FW。与 Schreiber 等[5]提出的蓝色花瓣 Al3+含量范围相比,本研究中含量数值略低,一方面可能是由于花的颜色并未呈现典型的蓝色,而是介于蓝色和紫色之间,另一方面也可能是由于根域 pH 值高于 Al3+吸收的最适 pH 范围 (4.2~4.7)[13],影响了Al3+的吸收。
在八仙花花瓣中,Al3+的积累主要依赖于水通道蛋白转运基因 PALT 和 VALT。其中 PALT 编码的水通道蛋白将 Al3+从质膜外运输到细胞质中,接着由VALT 编码的水通道蛋白将 Al3+输送至液泡中贮存起来[7, 17]。本研究发现,Al2(SO4)3处理后,PALT 和VALT 基因的表达均显著上调,说明转运 Al3+进入花瓣液泡的能力显著增强,有利于 Al3+的积累。这与本研究观测到的 Al2(SO4)3处理后花瓣中 Al3+含量显著增加的结果相符合。
综合上述分析,一定浓度的 Al2(SO4)3处理,诱导了八仙花 PALT 和 VALT 的表达,提高了花瓣 Al3+的积累,增加了花瓣中飞燕草素-3-葡萄糖苷类含量,从而有利于形成飞燕草素-3-葡萄糖苷和 Al3+复合体,促进了八仙花从粉红色转变为蓝色。本研究为进一步揭示观赏植物的花色分子调控机制提供了理论基础,为培育满足市场需求的新型花卉奠定了基础。
[1]刘焕新. 八仙花的花色调控[J]. 天津农林科技, 2004, (5): 21. Liu HX. The regulation of flower colour in Hydrangea macrophylla[J]. Science and Technology of Tianjin Agriculture and Forestry, 2004, (5): 21.
[2]Anderson N, Weiland J, Pharis J, et al. Comparative forcing of Hydrangea macrophylla ‘Bailer’as aflorist's hydrangea[J]. Scientia Horticulturae, 2009, 122(2): 221–226.
[3]徐慧, 刘超, 钟汉东. 不同光照强度对八仙花开花的影响[J]. 北方园艺, 2014, (1): 81–82. Xu H, Liu C, Zhong HD. Effects of different light intensity on the blossom of Hydrangea macrophylla[J]. Northern Horticulture, 2014, (1): 81–82.
[4]Ito D, Shinkai Y, Kato Y, et al. Chemical studies on different color development in blue-and red-colored sepal cells of Hydrangea macrophylla[J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(5): 1054–1059.
[5]Schreiber HD, Jones AH, Lariviere CM, et al. Role of aluminum in red-to-blue color changes in Hydrangea macrophylla sepals[J]. BioMetals, 2011, 24(6): 1005–1015.
[6]Ma JF, Ryan PR, Delhaize E. Aluminum tolerance in plants and the complex role of organic acids[J]. Trends in Plant Science, 2001, 6(6): 273–278.
[7]Negishi T, Oshima K, Hattori M, et al. Tonoplast and plasma membrane-localized aquaporin-family transporters in blue Hydrangea sepals of aluminum hyper accumulating plant[J]. Plos One, 2012, 7(8): e43189.
[8]雷亚灵, 李周岐. 八仙花茎段组织培养技术研究[J]. 西北林学院学报, 2008, (4): 101–103. Lei YL, Li ZQ. Tissue culture of stem segment of Hydrangea macrophylla[J]. Journal of Northwest Forestry University, 2008, (4): 101–103.
[9]彭尽晖, 陈海霞, 龚雯, 等. 铝胁迫对八仙花离体植株质膜透性与抗氧化系统的影响[J]. 湖南农业大学学报 (自然科学版), 2013, 39(1): 42–44. Peng JH, Chen HX, Gong W, et al. Effects of aluminium stress on membrane permeability and antioxidant system in vivo Hydrangea macrophylla plants[J]. Journal of Hunan Agricultural University (Natural Sciences), 2013, 39(1): 42–44.
[10]Park S, Arasu MV, Jiang N, et al. Metabolite profiling of phenolics, anthocyanins and flavonols in cabbage (Brassica oleracea var. capitate)[J]. Industrial Crops and Products, 2014, 60: 8–14.
[11]张淑江, 马越, 徐学玲, 等. 芸薹属5种紫红色蔬菜花青素苷含量及组分分析[J]. 园艺学报, 2014, 41(7): 1451–1460. Zhang SJ, Ma Y, Xu XL, et al. Components and amounts of anthocyanins in several Brassica vegetables[J]. Acta Horticulturae Sinica, 2014, 41(7): 1451–1460.
[12]宋亚, 杨静, 朱祝军. 紫结球甘蓝功能性成分的提取, 鉴定与分析[J]. 园艺学报, 2016, 43(1): 100–108. Song Y, Yang J, Zhu ZJ. Identification and analysis of the functional compounds in red cabbage[J]. Acta Horticulturae Sinica, 2016, 43(1): 100–108.
[13]Neumann A, Horst WJ. Effect of aluminium supply on aluminium uptake, translocation and blueing of Hydrangea macrophylla (Thunb.) Ser. cultivars in apeat clay substrate[J]. The Journal of Horticultural Science and Biotechnology, 2003, 78(4): 463–469.
[14]Yoshida K, Mori M, Kondo T. Blue flower color development by anthocyanins: from chemical structure to cell physiology[J]. Natural Product Reports, 2009, 26(7): 884–915.
[15]贾洪菊. 八仙花红色素分子结构分析及在压花上应用[D]. 哈尔滨:东北林业大学硕士学位论文, 2011. Jia HJ. A research on red Hydrangea macrophylla molecular structure and application in pressed flower protecting [D]. Harbin: MS Thesis of Northeast Forestry University, 2011.
[16]Oyama K, Yamada T, Ito D, et al. Metal complex pigment involved in the blue sepalcolor development of Hydrangea[J]. Journal of Agricultural and Food Chemistry, 2015, 63(35): 7630–7635.
[17]Kochian LV, Piñeros MA, Liu J, et al. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance[J]. Annual Review of Plant Biology, 2015, 66: 571–598.
Mechanism of exogenous Al2(SO4)3on regulating the anthocyanin concentration in Hydrangea macrophylla petal
GONG Zhong-xing1, HE Yong2, YANG Jing2, SONG Ya2, YE Zhen-xiao2, ZHU Zhu-jun2*
( 1 Hangzhou Vocational and Technical College, Hangzhou 310018, China; 2 College of Agricultural and Food Science/Key Laboratory of Quality Improvement of Agricultural Products of Zhejiang Province, Zhejiang A&F University, Lin’an 311300, China )
【Objectives】Hydrangea macrophylla is one of the most important ornamental plants. The present paper aimed to study effects of Al2(SO4)3on flower colour of Hydrangea macrophylla. 【Methods】Hydrangea macrophylla cultivar ‘mama blue’ was selected as material, and apot experiment was conducted by setting up two Al2(SO4)3concentration levels, 2‰ and 4‰. Al2(SO4)3was added into the growth media when the flower bud was about 1 cm length, and citrate buffer (pH 6.0) was added in control plants. The composition and concentrations of anthocyanins were determined by HPLC and mass spectrometry, ion concentrations weremeasured by ICP-AES, and expression of Al3+transport related genes was clarified by qRT-PCR. 【Results】The petal colour changed from pink to purple and blue-purple after 21 d by the 2‰ and 4‰ Al2(SO4)3application, respectively. Twelve kinds of anthocyanins, such as delphinidin 3-glucoside, were detected in the petal. The Al2(SO4)3treatments increased the anthocyanins contents, especially the delphinidinderivatives contents. The delphinidinderivatives contents in petals were increased from 5159.9 μg/g FW in control plants to 24681.2 μg/g FW and 30485.7 μg/g FW in 2‰ and 4‰Al2(SO4)3treated plants, respectively. The increase of delphinidin derivatives contents was due to the enhancement of delphinidin 3-glucoside and delphinidin 3-pentose-5-glucoside.The delphinidin 3-glucoside contents in petals were increased from 4679.2 μg/g FW in control plants to 23610.0 μg/g FW and 29129.7μg/g FW in 2‰ and 4‰ Al2(SO4)3treated plants, respectively, and the contents of delphinidin 3-pentose-5-glucoside in petals were increased from 142.3 μg/g FW in control plants to 805.6 μg/g FW and 1114.9 μg/g FW in 2‰ and 4‰ Al2(SO4)3treated plants, respectively. And the Al3+contents in petals were increased from 2.24 μg/g FW in control plants to 5.12 μg/g FW and 11.83 μg/g FW in 2‰ and 4‰ Al2(SO4)3treated plants, respectively. Accordingly, the gene expression of vacuolar Al transporter (VALT) and plasma membrane Al transporter (PALT) were increased significantly (P < 0.05) by the Al2(SO4)3application. Compared with control plants, the PALT expression levels were increased by 88.5% and 148.2% in 2‰ and 4‰ Al2(SO4)3treated plants, respectively, and the VALT expression levels were increased by 74.8% and 135.7%.【Conclusions】Our results suggested that Al2(SO4)3application induced the gene expression of VALT and PALT, enhanced the accumulation of Al3+, increased the delphinidinderivatives contents, and thus changed the flower colour from pink to purple and blue-purple.
Hydrangea macrophylla; flower colour; Al2(SO4)3; anthocyanin; gene expression
2016–11–01 接受日期:2017–01–06
浙江省自然科学基金重点项目(LZ14C150001)资助。
龚仲幸(1974—),女,浙江慈溪人,副教授,主要从事花卉栽培与应用的研究。E-mail: 526435688@qq.com * 通信作者 E-mail: zhuzj@zafu.edu.cn
