2017年2月我国东部四省份家禽H7N9流感横断面调查
2017-06-10李金平侯广宇王素春庄青叶于建敏王楷宬费荣梅陈继明蒋文明
王 灏,李金平,侯广宇,王素春,彭 程,庄青叶,刘 朔,于建敏,王楷宬,邱 源,费荣梅,陈继明,蒋文明
(1.南京农业大学动物医学院,江苏南京 210095;2.中国动物卫生与流行病学中心,山东青岛 266032)
2017年2月我国东部四省份家禽H7N9流感横断面调查
王 灏1,2,李金平2,侯广宇2,王素春2,彭 程2,庄青叶2,刘 朔2,于建敏2,王楷宬2,邱 源2,费荣梅1,陈继明2,蒋文明2
(1.南京农业大学动物医学院,江苏南京 210095;2.中国动物卫生与流行病学中心,山东青岛 266032)
为了解现阶段我国家禽中H7N9病毒感染状况,2017年2月在我国东部4个省份的123个场点进行了H7N9流感流行病学调查。结果显示:H7N9病毒的样品总阳性率为2.48%,其中活禽市场的阳性率与往年监测数据相比出现上升;阳性场点范围较大,涵盖了养殖场、屠宰场和市场等多个区域;鸭类样品中的H7N9病毒阳性率高于往年,为1.89%。HA序列分析结果显示,此次调查中检出的H7N9病毒均为低致病性病毒。这些数据为今后全面了解我国家禽中的H7N9病毒感染现状和制定有关防控措施提供了技术支持。
家禽;流感病毒;H7N9;流行病学;横断面调查
禽类流行性感冒是由禽流感病毒(Avian inf l uenza virus,AIV)感染禽类及其他易感动物引起的一种高致病性、高接触性人兽共患传染病。AIV属于正黏病毒科,分A、B、C、D 4个型。其中:A型流感病毒多感染禽类,也可感染猪、马、海豹和鲸等哺乳动物及人类;B型和C型流感病毒分别见于海豹和猪的感染;D型流感病毒主要感染牛[1]。根据表面血凝素(HA)和神经氨酸酶(NA)不同,AIV可分为16种HA亚型和9种NA亚型[2],其中H3、H5、H7、H9亚型可感染人。H7N9亚型流感病毒(以下简称 H7N9病毒)是一种新型流感病毒,于2013年3月底在上海和安徽两地被首次发现[3]。
H7N9病毒自首次被发现以来,在全国范围内的家禽中快速扩散。对华东地区的调查结果显示,其阳性率呈逐年上升趋势[4],对家禽养殖业影响较大。为评估目前家禽中H7N9病毒的分布及感染情况,2017年2月在我国东部4个省份的活禽批发市场、活禽零售市场、屠宰场、养禽场、散养户,随机选择了123个场点,进行病原学和血清学检测。
1 材料与方法
1.1 主要试剂与耗材
QIAamp Viral RNA Mini Kit,购自Qiagen公司;HiScript II One Step RT-PCR Kit,购自Vazyme公司;植绒拭子,购自深圳麦瑞科林科技有限公司;SPF鸡胚,购自济南斯帕法斯家禽有限公司;H7抗原,购自哈维科生物技术开发公司。
1.2 样品采集
2017年2月,对4个省份的123个场点(其中69个活禽市场),采集病原学样品进行检测。根据历年的流行病学调查结果,在每个省份选取2个重点县,采集活鸡咽/肛拭子作为代表性样品进行检测。由于此次调查为临时添加的调查,并且增加了除常规市场以外的其他场点样品采集计划,因此各地采样份额均采取随机分配方式,其中鸡样品3 461份、鸭样品212份、鹅样品5份、鸽样品13份、运输工具样品5份、环境样品90份,总计3 786份(表1)。
1.3 病毒分离
采集家禽的咽喉、泄殖腔双拭子置于加抗生素(庆大霉素、左旋氧氟沙星、阿奇霉素)的PBS-甘油采样液中(pH7.2~7.6),10 000 r/min离心10 min,取上清接种10~11日龄SPF鸡胚,0.2 mL/枚,37 ℃孵化96 h。每隔24 h照胚1次,用1%的鸡红细胞,测定鸡胚尿囊液的血凝效价。
1.4 RNA提取
用Qiaxtractor核酸自动提取工作站,提取死胚及血凝阳性胚尿囊液中的病毒RNA,置-70 ℃保存备用。
1.5 H7和N9基因扩增
根据GenBank和GISAID数据库中发表的序列,针对流感病毒H7基因序列保守区,设计1对引物,使其能够扩增HA1、HA2裂解位点区域(表2)。扩增N9的引物时,参考以前发表的文献[5]。

表2扩增H7和N9的引物
按照HiScript II One Step RT-PCR Kit说明书,配置44.0 μL RT-PCR 预混液,包括2×RT-PCR Buffer 25.0 μL、引物各2.0 µL(10 µmol/L)、Enzyme Mix 2.5 μL、ddH2O 12.5 μL,加入6.0 μL RNA模板。RTPCR反应条件为:50 ℃反转录30 min,94 ℃预变性5 min,然后进行30个循环(94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸5 min。利用QIAxcel毛细管电泳系统进行片段分析,将PCR产物送上海生工进行测序鉴定。
1.6 H7亚型抗体检测
在96孔血凝板内加入PBS,每孔25 μL,标记序号。在第1孔内加入25 μL被检血清,充分混匀后移出25 μL加至第2孔,依次类推,倍比稀释至第6孔,弃去25 μL,设第7和第8孔为对照。在1~6孔内各加入25 μL 4单位H7标准抗原,轻叩反应板,使反应物混合均匀,室温20~25 ℃下,静置30 min。之后依次向各孔内加入25 μL 1%的鸡红细胞悬液,室温(20~25 ℃)静置45 min后观察结果。在红细胞对照出现完全沉淀,病毒对照出现完全凝集的情况下,将反应板作45°倾斜,从反应板背侧观察。将完全抑制红细胞凝集的最大稀释倍数判为该血清的血凝抑制滴度,当被检血清的HI效价大于或等于4 log2时,判为抗体阳性。
2 结果
2.1 H7N9病毒检测结果
从4个省份123个场点采集的3 786份样品中,检出H7N9病毒94株,样品总阳性率为2.48%。其中,A省样品阳性率为1.83%,B省为5.95%,C省为0.10%,D省为1.65%(表3)。
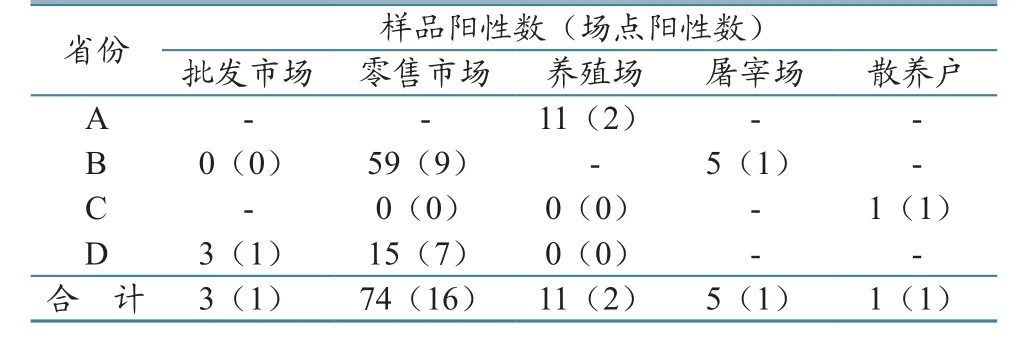
表3 H7N9病毒病原学阳性样品分布情况(单位:份)
各场点样品的检测结果显示,活禽零售市场的H7N9样品阳性率最高,为4.26%;其次是屠宰场,为3.09%;养殖场中的最低,为0.76%(图1)。
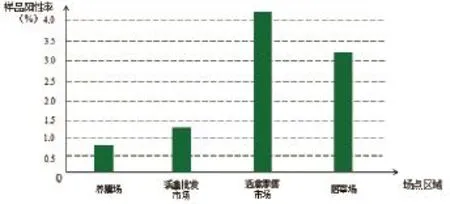
图1不同场点样品阳性率
各种类样品的检测结果显示:鸽样品的H7N9阳性率最高,为7.69%;鸡、鸭和环境样品的H7N9阳性率相差不大,分别为2.51%(86/3 461)、1.89%(4/212)和2.16%(3/95)。
分离出的94株H7N9病毒HA基因裂解位点处氨基酸序列均为“-PEIPKGR/GLF-”,符合低致病性禽流感病毒分子特征。
2.2 H7亚型抗体检测结果
在3 033份血清样品中,检出HI抗体阳性样品(HI效价≥4 log2)99份(鸡98份、鸭1份),样品阳性率为3.26%,阳性样品分布在A、C省的鸡养殖场和B、D省的鸡、鸭市场。
A、C、D省43个养殖场的1 445份样品中,有55份样品的HI效价≥4 log2,样品来自A、C省的14个养鸡场;B省1个屠宰场162份样品的HI效价≤4 log2;C省10个散养户220份样品的HI效价≤4 log2。B、D省18个市场44份样品的HI效价≥4 log2(表4)。
3 分析与讨论
此次调查均选取近年来的重点感染地区采样,调查结果具有一定的流行病学地域代表性,但由于取样方法为随机取样,因此不具有单一类型场点和种属代表性。在采样场点、种属类型等的选择上,由于此次调查的主要目的是了解4省份的H7N9病毒感染现状,仅为概括性调查,因此在场点选择上,并未针对某一特殊地域群体或个体,以及某一特殊种属禽类进行采样。本检测结果仅对了解2017年2月份4省份的H7N9病毒总体感染情况提供参考。同时,此次流行病学调查为临时性调查,并非常规春秋季流行病学调查,在时间上与以往历史数据时间略有不同,因此在同历史数据进行比较时得出的结论具有一定偏差性,但趋势上仍具有代表性。此次调查的采样地点没有覆盖各省的所有地点,采样时也可能存在人为失误导致的样品污染,因此本调查结果具有一定局限性和偏差性,仅可作为4省份感染情况的定性参考数据,不可作为定量分析数据。
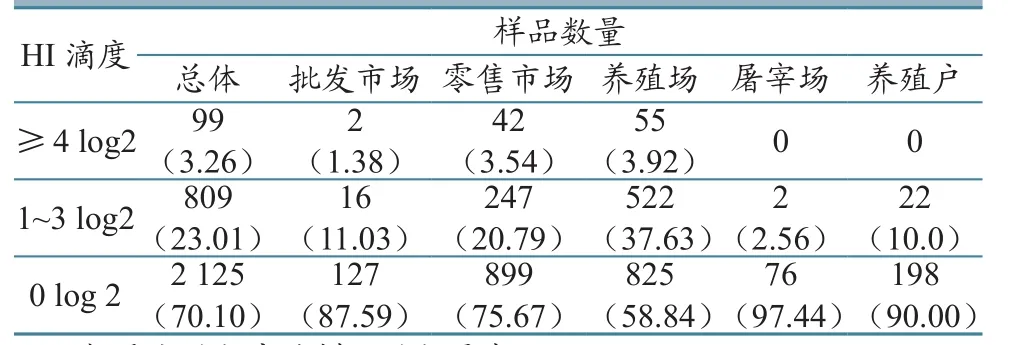
表4 H7亚型流感抗体统计结果(单位:份)
从此次调查的结果来看,4省份的H7N9病毒样品总阳性率为2.48%。由于采样地点的变动和采样时间的不固定,不能对数据进行准确地纵向比较。此次调查发现,4个省份的阳性率差异较大,如B省样品阳性率高达5.95%,而C省仅为0.10%。这可能是因样品采集的随机性及不均衡性导致的,这应在今后采样监测中引起足够的重视,要通过加大采样监测的范围和力度来避免。
从感染范围来看,H7N9病毒阳性场点的范围较大,几乎涵盖了家禽行业的全部供销途径,包括养殖场、屠宰场和市场等。其中,活禽零售市场样品H7N9阳性率达到4.26%,为阳性率最高的场点,再次证实了活禽市场是流感病毒的一个重要储存库。活禽市场为病毒的基因重组和跨种传播提供了有利条件[5],是人类感染H5N1、H7N9等流感病毒的高风险区域[6-7],应作为病原监测的重点对象[8]。
之前有研究显示[4],由于批发市场的家禽大都来自规模化养禽场,因此病毒携带量相对较小。此次调查结果显示,活禽批发市场阳性率仅为1.36%,但活禽零售市场的病毒携带量大大增加,活禽零售市场阳性率高达4.26%,提示市场的这种交叉性环境造成禽类流感感染率的上升。结合近年数次H7N9流感流行病学调查结果,可以看出活禽零售市场的病毒感染率呈现明显升高趋势(图2),提示活禽零售市场存在较大的交叉感染风险,应予以重视。
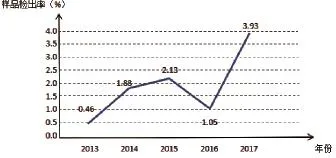
图2 2013—2017年活禽零售市场H7N9病毒检出率变化趋势
此次调查发现:鸡类样品的阳性率为2.51%,保持较高的检出水平;鸭类样品的阳性率为1.89%,较之前的检测结果明显提升,提示H7N9病毒的感染范围在鸭类等水禽中可能正逐步扩大。因此,在今后的采样检测中,仍需要以鸡作为重点监测对象,但要扩大监测范围,涵括多种禽类[9],这样才更有利于H7N9病毒感染水平的评估和防控措施的制定。
此次调查检出的94株H7N9病毒HA基因裂解位点处的氨基酸序列均为“-PEIPKGR/GLF-”,符合低致病性禽流感病毒分子特征,对家禽危害较小。
此次调查共检测血清样品3 033份,检出HI抗体阳性(HI效价≥4 log2)99份,样品总阳性率为3.26%,处于较低抗体水平;从统计结果看,HI抗体阳性率最高的场所为规模化养殖场,说明规模化养殖场有一定程度的病毒感染,这与养殖场H7N9病原学检测结果一致。由于HI试验可能存在干扰和非特异性,因此不能依此判定目前以上地区H7亚型流感的真实抗体水平,只可作为参考。
此次调查发现H7N9病毒阳性率较高,说明在禽流感的防控方面仍面临巨大挑战。建议加大对活禽交易市场H7N9病毒的监测力度,定期开展流行病学调查,鼓励发展冰鲜禽销售,以此替代活禽交易,从而最大程度地减少交叉感染,不为流感病毒提供动物间传播和变异的环境。在无法做到统一管理、减少活禽交易的地区,应大力加强家禽业各环节的卫生防疫管理,制定合理的管理方法和防疫制度,尽量减少活禽之间以及活禽与人之间的接触机会。此外,应当加大对规模化养殖场的监测力度,随时关注病毒的变异情况,防止疫情大规模暴发。
[1]ZOWALATY M E,BUSTIN S A,HUSSEINY M I,et al. Avian influenza:virology,diagnosis and surveillance[J]. Future Microbiology,2017,8(9):1209-1227.
[2] OLSEN B,MUNSTER V J,WALLENSTEN A,et al. Global patterns of inf l uenza A virus in wild birds [J]. Science,2006,312:384-388.
[3] 陈雅,朱进,冯振卿. 新型人感染H7N9型禽流感病毒研究进展[J]. 医学研究生学报,2016,29(7):759-763.
[4] 蒋文明,王艳,李金平,等. 2014—2016年华东地区某市活禽市场禽流感流行病学调查与分析[J]. 中国动物检疫,2017,34(1):14-18.
[5] 蒋文明,李金平,于美芳,等. 双重RT-PCR快速检测H7N9流感病毒方法的建立[J]. 中国动物检疫,2015,32(5):65-68.
[6] SHORTRIDGE K F. Pandemic influenza:A zoonosis[J]. Semin Respir Infect,1992(7):11-25.
[7] LIU M,HE S Q,WALKER D,et al. The influenza virus gene pool in a poultry market in south central China[J]. Virology,2003,305:267-275.
[8] SHORTRIDGE K F,GAO P,GUAN Y,et al. Interspecies transmission of inf l uenza viruses:H5N1 virus and a Hong Kong SAR perspective[J]. Vet Microbiol,2000,74:141-147.
[9] AI J,HUANG Y,XU K,et al. Case-control study of risk factors for human infection with inf l uenza A(H7N9)virus in Jiangsu Province,China,2013[J]. Euro Surveill,2013,18 (26):1-6.
[10] 王伟. 禽流感的流行趋势与防控[J]. 畜牧兽医科技信息,2016(11):96-96.
[11] 汪招雄,欧阳金旭,杨玉莹,等. 规模化蛋鸡场H9N2亚型禽流感疫苗免疫效果调查[J].中国动物传染病学报,2016,24(1):15-21.
(责任编辑:朱迪国)
Cross-sectional Investigation of H7N9 inf l uenza in Domestic Poultry in Four Provinces of Eastern China in February 2017
Wang Hao1,2,Li Jinping2,Hou Guangyu2,Wang Suchun2,Peng Cheng2,Zhuang Qingye2,Liu Shuo2,Yu Jianmin2,Wang Kaicheng2,Qiu Yuan2,Fei Rongmei1,Chen Jiming2,Jiang Wenming2
(1. College of Veterinary Medicine,Nanjing Agricultural University,Nanjing,Jiangsu 210095;2. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
In order to recognize the situation of H7N9 virus infection in domestic poultry in China at the present stage,epidemiological investigation of H7N9 from 123 points in 4 provinces in eastern China was carried out in February 2017. The results showed that the total positive rate of H7N9 virus was 2.48%,in which the positive rate of live poultry markets increased compared with the monitoring data in previous years. The positive fi eld range of H7N9 virus expanded,covering farms,slaughterhouses and markets. And the positive rate of H7N9 was 1.89% in duck samples,which was higher than in previous years. The results of HA sequence analysis showed that the H7N9 viruses detected in this survey were all low pathogenic viruses. These data could develop a comprehensive understanding of the pollute status of avian inf l uenza virus in China and provide technical support for the prevention and control of avian inf l uenza.
domestic poultry;inf l uenza virus;H7N9;epidemiology;cross-sectional investigation
S852.65
:A
:1005-944X(2017)06-0018-04
10.3969/j.issn.1005-944X.2017.06.005
科技部科技基础性工作专项(2012FY111000)
蒋文明
