广东省镇海湾红树林根域中氟喹诺酮类(FQs)抗生素残留特征*
2017-06-10任珂君孙勤寓刘玉方旭婷彭逸生
任珂君,孙勤寓,刘玉,方旭婷,彭逸生
(中山大学环境科学与工程学院∥广东省环境污染控制与修复技术重点实验室,广东 广州510275)
广东省镇海湾红树林根域中氟喹诺酮类(FQs)抗生素残留特征*
任珂君,孙勤寓,刘玉,方旭婷,彭逸生
(中山大学环境科学与工程学院∥广东省环境污染控制与修复技术重点实验室,广东 广州510275)
对广东省江门市镇海湾红树林自然保护区两种优势红树植物——桐花树Aegicerascorniculatum、秋茄Kandeliacandel的根域(根际土、非根际土)中氟喹诺酮类(Fluoroquinolones, FQs)抗生素展开分析。采用高效液相质谱联用法测定14个根域土样品、6个排污口沉积物和3个光滩沉积物样品中4种FQs—氧氟沙星(Ofloxacin, OFL)、诺氟沙星(Norfloxacin, NOR)、环丙沙星(Ciprofloxacin, CIP)、恩诺沙星(Enrofloxacin, ENR)的残留特征,并与根域土理化因子pH、有机质(Soil organicmatter, SOM)、阳离子交换量(Cationex changecapacity, CEC)、过氧化氢酶(Catalase, CAT)、蔗糖酶(Sucrase, SUC)、土壤有效态Cu、Zn、Fe进行典范对应分析(canonical correspondence analysis, CCA)。结果表明:桐花树、秋茄根际土中4种FQs质量分数均值分别为55.22、29.25 μg·kg-1,非根际土中4种FQs均值分别为22.45、18.66 μg·kg-1,两种红树根域中4种FQs含量桐花树>秋茄(P<0.05),4种FQs含量均为根际土>非根际土;对FQs残留影响程度的环境因子权重排序为:pH> Fe > SOM ≥ CEC >Zn> SUC ≥ CAT;研究结果对阐释红树林对有机污染物(包括抗生素)的吸收净化作用具有重要理论意义。
红树林;根域;抗生素;氟喹诺酮类;环境因子;残留特征
抗生素作为治疗疾病和促进生长的有效药物被广泛用于医药、农业、畜牧业及水产养殖业中[1]。章强在我国地表水中检出浓度较高的68种抗生素,其中,含量最高的是氟喹诺酮类(Fluoroquinolones, FQs)和磺胺类,养殖业废水和城市污水是抗生素的主要来源[2]。喹诺酮类分为四代[3]。第三、四代喹诺酮类是由第二代的主环6或8位上添加氟原子后衍变而来,统称为FQs,是一种全合成的广谱抗菌药[4]。本文定义:FQs特指第三代喹诺酮类(第四代喹诺酮类由于价格昂贵,市场使用率不高,本文暂不做研究)。FQs由于抗菌谱广,价格适宜,现时应用最为广泛,主要用于养殖业、兽用等,占世界抗生素市场的17%[5]。主要代表物有氧氟沙星(Ofloxacin, OFL)、诺氟沙星(Norfloxacin, NOR)、环丙沙星(Ciprofloxacin, CIP)、恩诺沙星(Enrofloxacin, ENR),这4种FQs约占中国喹诺酮类总生产量的98%[6]。
沿海高位养殖是在陆地或海边滩涂建造虾塘和鱼塘,抽取符合养殖标准的海水到塘内,用以养殖虾苗和鱼苗[7]。随着人类对蛋白质需求量的急剧增大,沿海红树林高位养殖业日益蓬勃和壮大,集约化和高密度养殖促使抗生素使用量大增,养殖污染废水直排红树林,导致红树林内抗生素残留增大。目前国内外关于红树林中抗生素的研究鲜少,已有研究表明FQs在高位养殖区的残留浓度相对较高。越南红树林附近虾塘水体及沉积物中检测的抗生素中含量最高的是FQs[8];越南某一红树林高位养殖区在虾塘水体及沉积物中检测到NOR和CIP,NOR多用于成年虾塘,CIP多用于虾苗,且使用频繁[9];广西北海市大冠沙养殖红树林潮沟的底栖动物体内检测出NOR、CIP[10];湛江市高桥红树林潮沟沉积物中检测到OFL、NOR、CIP、ENR,平均质量浓度分别为109.77、57.75、80.95、77.56 μg·kg-1[11]。
近年来,FQs被认为是环境中的新兴污染物,是全球科研界最热点的研究问题之一[12]。FQs在生物体内的代谢率<25%,沉积物中半衰期长达580 d,在环境中持续残留时间较久且不易降解[13]。同时,有研究认为FQs的吸附作用与土壤有机质(Soil organicmatter, SOM)、pH、阳离子交换量(Cation exchange capacity, CEC)、土壤溶液中的金属阳离子等有关[14-15],因此本文选择pH、SOM、CEC、有效态Cu、Zn、Fe进行测定;为了探讨红树根域中FQs是否有微生物降解作用,本文选择土壤中有代表性的酶—与其它物质氧化有关的过氧化氢酶(Catalase, CAT)及与碳循环有关的蔗糖酶(Sucrase,SUC)进行测定。
本研究在广东省江门市镇海湾红树林自然保护区展开,重点对两种优势红树植物——桐花树Aegicerascorniculatum、秋茄Kandeliacandel的根域中4种FQs残留进行分析,根域分为根际土和非根际土,前者定义为根部0~2.5 cm范围土壤,非根际定为根部2.5~10 cm土壤[16],以此得到两种红树植物中FQs的根域污染水平科学数据。通过研究,可以较准确地了解红树根域中FQs的残留特征、两种红树植物对FQs的降解能力以及判断出影响此过程的主要环境因子;研究成果在红树林诸研究领域中占有重要热点位置,对阐释红树林对有机污染物(包括抗生素)的吸收净化作用具有重要理论意义;另一方面,对指导沿海红树林对污染的修复、降低生态环境风险和保障人类食品安全等方面均具有重要实践意义。
1 材料和方法
1.1 研究区域
镇海湾红树林是我国重要的原生红树林湿地之一,位于广东省江门市西南部汶村镇与北陡镇之间。镇海湾的地理位置:21°44′-21°56′30″N,112°24′-112°33′E。北陡镇分布着大面积连片虾塘,海水产品和淡水产品总产量高达3 229.55 t。虾塘周边分布着大片规整的红树林,主要优势物种为桐花树和秋茄。排污口位于直连外海的潮沟起点,潮沟宽约4 m。
根据镇海湾潮汐规律,于2015年5月采样,采样点位图见图1。选取桐花树和秋茄各7株成熟植株,分别采集其根际土(以S为标记)、非根际土(以N为标记);桐花树和秋茄所在区域排污口沉积物(以D为标记)各3个,光滩沉积物(以F为标记)3个点作为空白对照实验组,采样过程及实验过程所用编号见表1。

图1 广东省镇海湾红树林采样布点图Fig.1 Themangal sampling sites in Zhenhai Bay of Guangdong Province

土壤类型桐花树A.corniculatum秋茄K.candel根际土(Rhizospheresoil)A1S,A2S,A3S,A4S,A5S,A6S,A7SK1S,K2S,K3S,K4S,K5S,K6S,K7S非根际土(Non-Rhizospheresoil)A1N,A2N,A3N,A4N,A5N,A6N,A7NK1NK2N,K3N,K4N,K5N,K6N,K7N排污口(Dischargesediments)A1D,A2D,A3DK1D,K2D,K3D光滩(Tidalflatsediments)F1,F2,F3F1,F2,F3
1.2 样品采集
选定植株,用小铲挖出红树沉积物表层下0~2.5 cm的根,去掉包裹根的表面土壤,仅留下根表面0~5 mm的土壤为根际土样品;在距离根约10 cm处采集土壤表层下2.5~10 cm土作为非根际土样品,各取250 g左右[11]。
测定FQs的根域土样品用棕色玻璃瓶盛装,遮光、低温条件运输回实验室,冷冻干燥72 h后过100目筛,并储存于4 ℃冰箱待测;测定理化因子的根域土样品常温运输回实验室,置于阴凉通风处风干约2周待测。
1.3 主要试剂及仪器
OFL、CIP、ENR、NOR标准物(色谱纯,德国Dr. Ehrenstorfer)。甲醇、甲酸、乙腈均为色谱纯。柠檬酸、乙二胺四乙酸二钠、磷酸氢二钠、重铬酸钾、乙酸铵均为分析纯。富集柱为Poly-Sery HLB 和SAX强阴离子交换小柱(CNW, 500 mg, 6 mL)。主要仪器有三重四极杆液—质联用仪(Thermo Fisher USA)、固相萃取仪(CNW12位)、氮吹仪(USA DC-12)、电感耦合等离子发射光谱仪(Thermo Fisher USA ICAP 7000)、冷冻干燥机(FD-1A-50)。
1.4 根域土环境因子测定
pH值测定参照国家农业标准NY/T 1377-2007[17]。SOM的测定参照文献[18],采用重铬酸钾容量法。CEC的测定参照GB7863-87,采用乙酸铵交换法[19]。CAT和SUC的测定参照文献[20],分别采用高锰酸钾容量法和3,5-二硝基水杨酸(DNS)比色法。土壤有效态Cu、Zn、Fe含量的测定参照NY/T890-2004,采用二乙三胺五乙酸(DTPA)浸提法[21]。
1.5 根域土FQs含量测定
对于FQs的含量测定一般分为前处理和检测两步骤。其中前处理的提取过程,国际上最常用的方法是固相萃取,即通过吸附剂吸附目标化合物,与样品基底脱离,经过淋洗、洗脱等过程解吸,达到萃取富集的目的[22];FQs的检测常用高效液相—质谱联用方法,可以对FQs进行准确地定性定量研究,检出限较低,数据可信度高[23]。
1.5.1 样品前处理 称取2.000 0 g冷冻干燥过筛后的样品,放入聚四氟乙烯离心管(30/50 mL)中,分别加入0.1 mol·L-1Na2EDTA-McIlvaine缓冲液5 mL和酸化乙腈(体积比为90∶10)5 mL[14],漩涡混匀仪涡旋30 s,超声波清洗器振荡10 min,高速冷冻离心机离心15 min(4 ℃, 4 500 r/min)。重复循环3次,充分提取至500 mL棕色玻璃瓶中。用0.45 μm有机滤膜过滤,超纯水稀释至250 mL (调整pH至3.0)。
用超纯水和甲醇活化SAX-HLB串联柱,将提取液接入固相萃取仪进行SPE,保持水样以1~2mL/min流经串联柱,进样结束后真空干燥20 min。
用甲醇2×3 mL洗脱,收集洗脱液,置于氮吹仪中氮吹约10 h至近干。用φ=0.1%甲酸水:甲醇定容至1mL,漩涡混匀仪涡旋30s,经0.22μm针式过滤器过滤,所得样品储存于2mL棕色安捷伦进样瓶,4 ℃待测。实验中所有操作均在遮光条件下进行。
1.5.2 色谱、质谱条件 色谱条件:梯度洗脱(流动相A为φ=0.1%甲酸水,B为甲醇);柱温为35 ℃。
质谱条件:喷雾电压为+3 000V;源加热温度为300 ℃;离子传输管温度为300 ℃;鞘气(N2)流速为40arb;辅气(N2)流速为7arb;定量离子扫描模式为选择反应监测模式;碰撞气(Ar)为1.5mttor;正离子扫描。
1.5.3 标准曲线与检出限 采用空白加标、批量样品加标进行回收率实验。每个样品重复测定3次,取平均值确定方法的可靠性。外标法确定沉积物样中目标物回收率FQs为70%~75%。HPLC-MS测得4种FQs的标准曲线相关系数R2>0.991,方法的线性关系良好,方法建立适当。OFL、NOR、CIP、ENR的检出限值分别为0.09、0.90、0.19、0.74 μg/kg。
1.6 数据处理
数据间显著性分析采用单因子方差分析法分析(One-way ANOVA)和多重比较Dunnet’s T3检验,用ExceL (2007)、SPSS(21.0)软件计算,显著性水平设置为P=0.05;FQs残留与根域理化因子之间的关系用CANOCA(4.5)计算,根据实验数据采用典范对应分析(Canonical correspondence analysis, CCA)方法进行分析。图形使用OriginPro(8)、ArcGIS(10.2)绘制。
2 结果与讨论
2.1 根域土理化性质
两种红树根域理化性质如图2和表2所示。桐花树(A)和秋茄(K)各7株中根际土(S)和非根际土(N)的各理化因子的数据图见图2。
表2为各理化因子的均值综合表。根据图2和表2,可以看出,SOM、CEC、有效态Zn均为根际土>非根际土,pH、有效态Fe在部分采样点为根际土>非根际土。根域土理化因子对其中FQs归趋的影响见后续详细分析。
2.2 FQs在根域土中的分布
4种FQs的LC-MS分析图谱如图3所示,桐花树(A)和秋茄(K)根域中OFL、NOR、CIP、ENR的检出率均为100%。从根域、光滩及排污口沉积物的谱图中各选取一张为示。
根据色谱图得到桐花树(A)和秋茄(K)根域根际土(S)和非根际土(N)中的4种FQs含量如图4。
分析图4中4种FQs质量分数(单位均为μg·kg-1),桐花树根际土中为:OFL为31.80~101.85,NOR为34.07~152.02,CIP为25.49~131.48,ENR为27.26~122.73;非根际土中为:OFL为20.94~22.74,NOR为22.66~149.18,CIP为14.58~23.09,ENR为15.65~30.28。桐花树附近排污口沉积物中为OFL18.02~20.45,NOR为21.76~29.91,CIP为15.37~17.47,ENR为14.97~20.34。
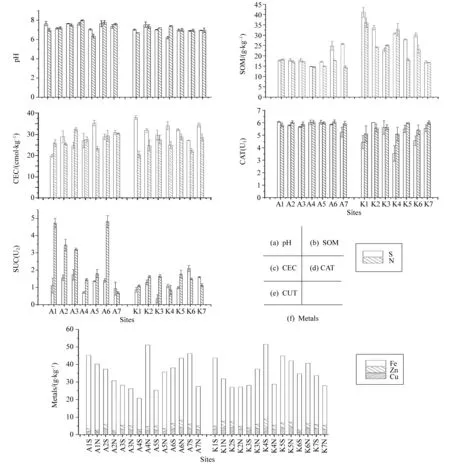
图2 桐花树(A)和秋茄(K)根域(根际土和非根际土)的理化性质Fig.2 Physico-chemical properties in root areas of A. corniculatum and K. candel

pHSOM/(g·kg-1)CEC/(cmol·kg-1)CATU1SUCU2w(Cu)/(g·kg-1)w(Zn)/(g·kg-1)w(Fe)/(g·kg-1)AS均值7.4519.4528.355.821.262.752.2629.44AN均值7.3516.3727.855.972.882.482.0431.93A均值7.4017.9128.105.902.072.622.1530.69KS均值6.9429.0632.505.031.183.172.6131.92KN均值7.0825.1825.775.551.373.542.5327.65K均值7.0127.1229.145.291.283.362.5729.79
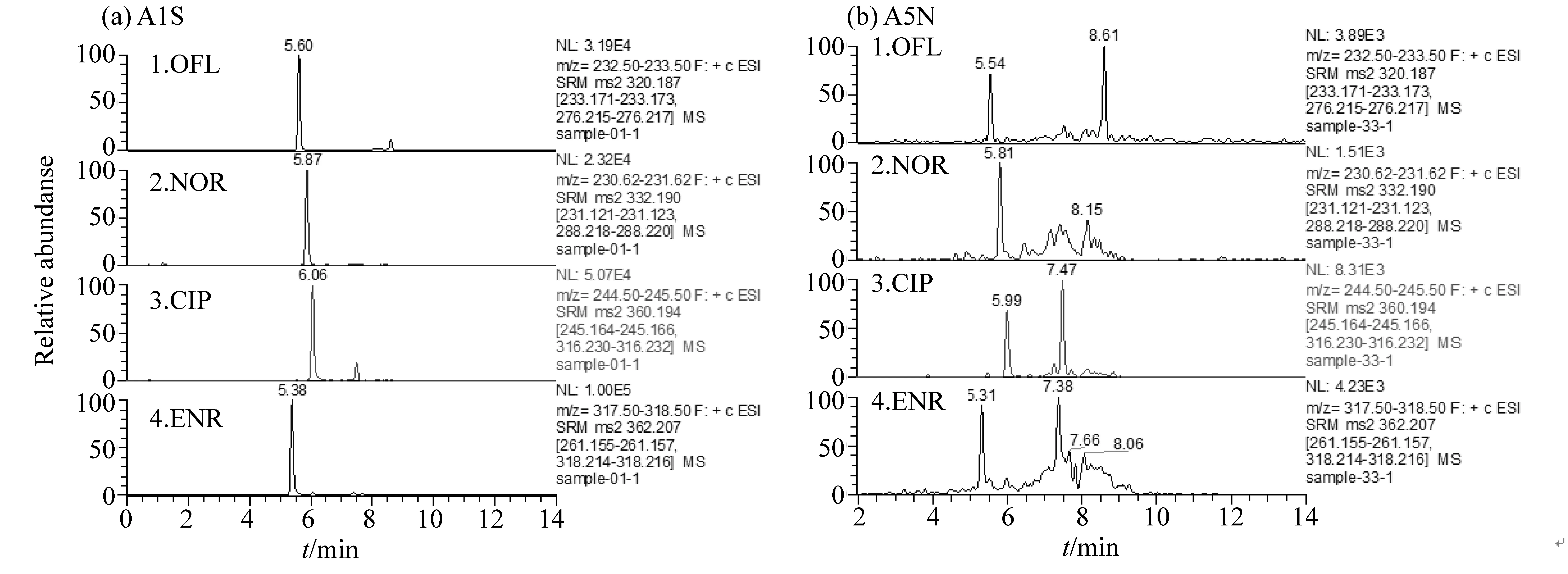
图3 桐花树(A)和秋茄(K)根域(根际土和非根际土)4种FQs的色谱图Fig.3 Chromatograms of four fluoroquinolones in root areas of A.corniculatum and K.candel, discharge sediments and tidal flat sediments

图4 桐花树(A)和秋茄(K)根域(根际土和非根际土)中4种FQs含量Fig.4 Four fluoroquinolones contents in root areas of A.corniculatum and K.candel
秋茄根际土中为OFL为23.94~28.22,NOR为14.90~83.44,CIP为15.76~25.90,ENR为20.57~33.68;非根际土中OFL为20.68~23.33,NOR为16.51~20.85,CIP为12.38~15.91,ENR为17.30~21.60。秋茄附近排污口沉积物中OFL为16.99~18.61,NOR为16.55~20.15,CIP为13.07~14.89,ENR为16.11~17.90。
另外测得,光滩沉积物中OFL均值16.50,NOR均值17.32,CIP均值12.23,ENR均值13.38。
桐花树(A)和秋茄(K)根域的4种FQs含量综合分析图如5。

图5 桐花树(A)和秋茄(K)根域(根际土和非根际土)的4种FQs含量Fig.5 The contents of four fluoroquinolones in root areas of A. corniculatum and K. candel
图5中,桐花树(A)和秋茄(K)根域中4种FQs含量均值NOR>CIP>ENR>OFL。Li等[11]对湛江高桥红树林虾塘的调查发现虾农更偏好使用NOR、CIP且频繁;ENR在不同环境中可能会转化为CIP[24],这些可以解释NOR、CIP含量高于ENR的原因。OFL是左旋体与右旋体的混合体,右旋体有药物毒副作用,左旋体即市场上的左氧氟沙星(第四代喹诺酮类),价格较昂贵,因此OFL使用较少,含量较低。
结合图5、6,桐花树(A)和秋茄(K)根际土中4种FQs含量均高于非根际土。植物根际是受到植物根及其分泌物影响最大的土壤空间,根系可直接吸附有机物,且通过释放的酶和分泌物影响有机物在根际的降解作用[25]。植物根系能分泌单体有机化合物如氨基酸、脂肪酸、单糖类等和高分子化合物如多糖、聚乳酸等多种物质,对根系生态有强烈的调控作用,根系分泌物刺激了细菌的转化作用,促进与腐殖酸的共聚作用,从而改变根际土壤对有机污染物的吸附能力[26]。红树根际土中FQs含量较高可能是根系作用增加了吸附在非根际土中有机物的迁移能力,使有机物向根际迁移。土壤吸附FQs的能力与土壤类型、不同土壤的理化性质都有一定关系[27],本研究中SOM、CEC、部分有效态重金属含量为根际土>非根际土,其通过螯合、络合等作用吸附大量FQs[14-15];根际土中大量微生物的新陈代谢也影响着土壤对FQs的吸附[28]。这些可以部分地解释红树根域中4种FQs含量根际土高于非根际土的原因。根际土中的微生物如何影响土壤中FQs的吸附等重要的科学问题有待后续进一步深入分析研究。
桐花树(A)和秋茄(K)根域FQs普遍高于排污口沉积物,光滩沉积物中FQs最低。原因可能是:排污口位于直连外海的潮沟起点,潮沟宽约4 m,镇海湾潮汐两涨两落,排污口被海水每日2次反复冲刷,这是造成排污口沉积物中FQs被稀释和含量较低的原因。FQs是光敏感型的抗生素,光强和光照频率会影响其光解过程,UV可见光波段光线直射会引起水体中FQs分解,分解方式主要是通过脱氟作用和氨侧链氧化作用[29],且光滩处海水冲刷严重,因而造成光滩沉积物中FQs含量最低。
结合图4、5,桐花树中根域4种FQs含量显著高于秋茄(P<0.05)。原因为:①由于FQs不能通过干湿沉降进入红树林,外源排入是红树林中FQs的唯一来源,可以解释桐花树区排污口沉积物FQs高于秋茄区,同时也表明桐花树区高位养殖塘FQs使用量显著高于秋茄区;②刘玉等[27-28]测得秋茄根泌物中草酸浓度显著高于桐花树。草酸能够提高土壤中难溶性养分的生物有效性,使有机酸能与重金属形成稳定复合体,减弱重金属对FQs的螯合、络合反应,从而降低土壤对FQs的吸附作用,这也可以部分解释桐花树根域中FQs高于秋茄的原因;③研究表明,不同类型土壤对FQs吸附能力差异较大[13]。Li等[11]测得湛江高桥红树林桐花树、白骨壤沉积物中OFL、NOR、CIP、ENR含量大有不同。
2.3 根域土理化因子对其中FQs归趋的影响
桐花树和秋茄红树根域FQs残留与其环境因子的CCA分析见图6(将FQs作为物种因子计算,理化性质作为环境因子计算)。由于有效态Cu在CCA分析过程中权重系数较小,系统自动筛掉此因子。

图6 红树根域(根际土和非根际土)FQs残留与其环境因子CCA分析Fig.6 CCA analysis between FQs contents with environmental factors in mangal root areas
图6中,对FQs残留影响程度的环境因子权重排序为:pH>Fe>SOM≥CEC>Zn>SUC≥CAT。CCA的第一、二轴共解释了FQs残留与环境因子间98.5%的关联,前两轴能够真实反映出FQs残留与环境因子之间的关系。

解释pH值对FQs残留影响最大的原因。
重金属在进入土壤之后,大部分会与土壤中的组分发生络合、吸附等反应,而其中少部分会以离子交换态、水溶态存在,并有效影响微生物的数量及代谢活性,这少部分重金属即为有效态重金属。根据CCA分析,有效态Fe对FQs的残留影响权重较大,有效态Zn的影响相对较小。不同有效态金属可能与FQs的吸附位点竞争性结合,且存在差异,导致土壤吸附更多FQs或者释放出部分已经吸附的FQs[6]。两种红树根域中有效态Fe含量高于Zn,且Fe的离子态为三价,Zn的离子态为二价,离子态价态更高,参与竞争土壤表面负电性吸附位点的能力越强。因此有效态Fe对FQs残留的影响更大。
SOM、CEC对FQs的残留有一定影响。刘叶探讨了不同液土比条件下SOM对四环素在土壤中的吸附动力学影响,提出土壤在去除SOM后,对四环素的饱和吸附量降低[32];SOM有羟基、羧酸等基团,FQs可通过氢键、范德华力吸附其上;CEC是负荷抗生素进行络合或螯合作用的必需物质,从而影响对FQs的吸附过程[33]。
SUC、CAT对FQs的残留影响相对较低。SUC和CAT对FQs残留影响程度相对较低,可能原因是:土壤酶主要来自土壤微生物。土壤微生物在需氧条件下,大多数抗生素不会发生微生物降解;厌氧条件下,一些抗生素能进行不完全的微生物降解[34],因此土壤酶对FQs的残留影响可能较弱。
综合来看,除了有效态Cu外,其它环境因子均对红树根域对FQs的残留产生影响。但由于4种FQs性质等的差异,不同因子对于4种FQs的影响并不完全相同,其机制有待进一步深入研究探讨。
2.4 本区域红树根域FQs含量与国内外养殖区域FQs的比较
对桐花树和秋茄红树根域FQs与国内外养殖区域FQs作比较,如表3。

表3 国内外养殖区域沉积物FQs含量比较1)Table 3 Comparisons of FQs contents with other farming areas sediments μg·kg-1
1)—表示此种抗生素未检出;n.d.表示未达到检出限
镇海湾红树根域中FQs含量与高位养殖虾塘比,远低于越南虾塘沉积物中NOR。原因在于高位养殖使用大量的抗生素,含有饵料和药物的养殖废水在虾塘底部沉积,时间越久,沉积物中吸附的FQs越多,而随虾塘排污进入红树林的FQs相对较少。与淡水养殖水体沉积物比,镇海湾红树根域FQs远高于广州珠江口、大亚湾大鹏澳、海陵岛沉积物,原因在于珠江口、大亚湾大鹏澳、海陵岛使用FQs较少,且开阔水体流动性大,污染易扩散,高位虾塘中确实使用了FQs且使用量较高,污染物受潮汐顶托作用,不易扩散。
3 结 论
1) 两种红树根域(根际土和非根际土)中OFL、NOR、CIP、ENR的检出率均为100%。最高值较多出现在桐花树根际土中,质量分数分别为:NOR 152.02 μg·kg-1,CIP 131.48 μg·kg-1,ENR为122.73 μg·kg-1,OFL 101.85 μg·kg-1;
2) 桐花树和秋茄根际土中4种FQs均值分别为55.22、29.25 μg·kg-1,非根际土中4种FQs均值分别为22.45、18.66 μg·kg-1。两种红树根域中4种FQs含量桐花树>秋茄(P<0.05),4种FQs含量均为根际土>非根际土。
3) 两种红树根域中FQs残留与其理化性质的CCA分析得出,对FQs残留影响程度的环境因子权重排序为:pH>Fe>SOM≥CEC>Zn>SUC≥CAT,尤以pH、Fe、SOM为主要影响因子。
4) 红树林内抗生素污染主要来源于高位养殖塘,应加大对养殖塘滥用抗生素的监管,完善养殖区抗生素使用及污水排放标准,以指导沿海红树林对污染的修复,降低抗生素的环境风险,从而切实保障人类食品安全。
[1] ADACHI F, YAMAMOTO A, TAKAKURA K, et al. Occurrence of fluoroquinolones and fluoroquinolone resistance genes in the aquatic environment [J].Science of the Total Environment, 2013,444:508-514.
[2] 章强,辛琦,朱静敏,等. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J].环境化学, 2014,33(7):1075-1083. ZHANG Q,XINQ,ZHU M J , et al.The antibiotic contaminations in the main water bodies in Chinaand the associated environmental and human health impacts[J]. Environmental Chemistry,2014,33(7):1075-1083.
[3] APPELBAUM P C, HUNTER P A. The fluoroquinoloneantibacterials: past, present and future perspectives[J].International Journal of Antimicrobial Agents, 2000,16(1):5-15.
[4] 管荷兰,于海凤,王嘉宇. 氟喹诺酮类抗生素在土壤中的归趋及其生态毒性研究进展[J].生态学杂志, 2012,31(12):3228-3234. GUAN H L,YU H F, WANG J Y. Fate and ecological toxicity of fluoroquinolone antibiotics in soil: A review[J].Chinese Journal of Ecology, 2012,31(12):3228-3234.
[5] GRAVE K, GREKO C, KVAALE M K, et al. Sales of veterinary antibacterial agents in nine European countries during 2005-09: trends and patterns [J].Journal of Antimicrobial Chemotherapy, 2012,67(12): 3001-3008.
[6] 张劲强,董元华. 阳离子强度和阳离子类型对诺氟沙星土壤吸附的影响[J].环境科学, 2007,28(10):2383-2388. ZHANG J Q, DONG Y H.Influence of strength and species of cation on adsorption of norfloxacin in typical soils of China[J]. Environmental Science,2007,28(10):2383-2388.
[7] 苏守明. 海水高位养殖造成的环境问题分析——以海水养殖为例[J]. 技术与市场, 2012, 6:432-433. SU S M. Analysis of the environmental problems of sea perch breeding——the case of sea perch breeding[J]. Technology and Market, 2012, 6:432-433.
[8] TAI M V. Usage of drugs and chemical products in aquacultures and propose appropriate management measures[R].Vietnamese,2003.
[9] TUAN L X, MUNEKAGE Y. Residues of selected antibiotics in water and mud from shrimp ponds in mangrove areas in Viet Nam[J].Marine Pollution Bulletin, 2004,49(11/12):922-929.
[10] 周如琼, 范航清, 何斌源. 养殖排放农药和抗生素在红树林区中残留的初步研究[J]. 广西植物, 2010, 30(6):776-780. ZHOU R Q, FAN H Q, HE B Y. Residues of pesticides and antibiotics in a mangrovearea suffering aquaculture drainages[J].Guihaia, 2010, 30(6):776-780.
[11] LI Y, QIN L, KAI Z, et al. Occurrence and distribution of the environmental pollutant antibiotics in Gaoqiao mangrove area, China[J]. Chemosphere, 2016,147: 25-35.
[12] VAN D X, DEWULF J, VAN L H, et al. Fluoroquinolone antibiotics: An emerging class of environmental micropollutants[J].Science of the Total Environment,2014,500/501: 250-269.
[13] 张劲强,董元华. 诺氟沙星的土壤吸附热力学与动力学研究[J].土壤学报, 2008,45(5):978-986. ZHANG J Q, DONG Y H. Thermodynamic sand kinetic sofnorfloxacin adsorption in typical soils of china[J].Acta Pedologica Sinica, 2008,45(5):978-986.
[14] 任珂君,刘玉,徐健荣,等. 广东一饮用水源地河流沉积物及鱼体中氟喹诺酮类(FQs)抗生素残留特征研究[J].环境科学学报,2016,36(3):760-766. REN K J, LIU Y, XU J R, et al. Residues characteristics of fluoroquinolones (FQs) in the river sediments and fish tissues in a drinking water protection area of Guangdong Province[J].Acta Scientiae Circumstantiae,2016,36(3):760-766.
[15] WANG R, LIU T Z, WANG T. The fate of antibiotics in environment and its ecotoxicology: A review[J].Acta Ecologica Sinica,2006,26(1): 265-270.
[16] 刘玉,温翠屏,李艳萍,等. 红树植物对根域真菌生态的影响[J].生态学报, 2015,35(8):2473-2480. LIU Y, WEN C P, LI Y P, et al. A comparative study on rhizosphere and non-rhizosphere fungi in six mangrove ecommunities [J].Acta Ecologica Sinica,2015,35(8):2473-2480.
[17] 中华人民共和国农业部. 土壤pH的测定 NY/T 1377-2007 [S].北京:中国标准出版社,2007.
[18] 鲍士旦. 土壤农化分析[M]. 3版,北京:中国农业出版社, 2000.
[19] 中华人民共和国林业部. 森林土壤阳离子交换量的测定GB/T 7863-1987 [S]. 北京:中国标准出版社,1987.
[20] 关松荫.《土壤酶及其研究法》[M]. 北京:农业出版社,1986.
[21] 中华人民共和国农业部. 土壤有效态锌、锰、铁、铜含量的测定:二乙三胺五乙酸(DTPA)浸提法 NY/T 890-2004 [S]. 北京:中国标准出版社,2004.
[22] ANDREA S, MICHELA S, FEDERICA M, et al. Analytical methods for the determination of fluoroquinolones in solid environmental matrices[J].TrAC Trends in Analytical Chemistry, 2011,30(8):1337-1350.
[23] KASPRZYK-HORDERN B, DINSDALE R M, GUWY A J. Multi-residue method for the determination of basic/neutral pharmaceuticals and illicit drugs in surface water by solid-phase extraction and ultra performance liquid chromatography-positive electrospray ionisation tandem mass spectrometry[J]. Journal of Chromatography A, 2007, 1161(1/2):132-145.
[24] KÜMMERER K. Antibiotics in the aquatic environment-A review-Part I[J].Chemosphere, 2009a,75(4):417-434.
[25] CHANG B V, CHANG I T, YUAN S Y. Anaerobic degradation of phenanthrene and pyrene in mangrove sediment[J].Bulletin of Invironmental Contamination and Toxicology, 2008,80(2):145-149.
[26] 刘玉,魏洁,黄雄飞,等. 红树植物桐花树、秋茄的有机酸类根分泌物组成及含量[J].应用与环境生物学报, 2014,20(5):850-855. LIU Y,WEIJ,HUANG X F,et al.Composition and contents of organic acids in root exudates of mangroveAegicerascorniculatumandKandeliacandel[J].Chin J Appl Environ Biol,2014,20(5):850-855.
[27] 吴银宝,汪植三,廖新俤,等. 土壤对恩诺沙星的吸附和解吸特性研究[J].生态环境, 2005,14(5):645-649. WU Y B, WANG Z S, LIAO X D,et al.Study on the absorption and desorption of soil to enrofloxacin[J].Ecology and Environment, 2005,14(5):645-649.
[28] 吴银宝,廖新俤,汪植三. 恩诺沙星对小型模型水生态系统中底泥微生物的影响[J].农业环境科学学报, 2009,28(10):2167-2172. WU Y B,LIAO X D,WANG Z S,et al.Effects of Enrofloxacin on microorganisms of silt in aquatic microcosms[J].Journal of Agro-Environment Science, 2009,28(10):2167-2172.
[29] HU D F, COATS J R. Aerobic degradation and photolysis of tylosin in water and soil[J].Environment Toxicology Chemistry, 2007,26:884-889.
[30] LIANG X M, CHEN B W, NIE X P, et al. The distribution and partitioning of common antibiotics in water and sediment of the Pearl River Estuary, South China[J].Chemosphere,2013,92: 1410-1416.
[31] HE X T, WANG Z H, NIE X P, et al. Residues of fluoroquinolones in marine aquaculture environment of the Pearl River Delta, South China[J].Environmental Geochemistry and Health, 2012,34(3):323-335.
[32] 鲍艳宇. 四环素类抗生素在土壤中的环境行为及生态毒性研究[D].天津:南开大学, 2008. BAO Y Y. Environmental behavior and eco-toxicity of tetracycline antibiotics in soils[D].Tianjin: Nankai University,2008.
[33] RICHTER M K, SANDER M, KRAUSS M, et al. Cation binding of antimicrobial sulfathiazole to leonarditehumic acid [J].Environmental Science & Technology, 2009,43(17):6632-6638.
[34] GARTISER S, URICH E, ALEXY R, et al. Anaerobic inhibition and biodegradation of antibiotics in ISO test schemes[J].Chemosphere, 2007,66(10):1839-1848.
The residual characteristics of antibiotics fluoroquinolones (FQs) in mangal root areas of Zhenhai Bay, Guangdong Province
RENKejun,SUNQinyu,LIUYu,FANGXuting,PENGYisheng
(School of Environmental Science and Engineering∥ Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology,Sun Yat-sen University, Guangzhou 510275, China)
This paper determines four Fluoroquinolones(FQs) in the mangal root areas (rhizosphere soil, non-rhizosphere soil) of two advantageous mangal communities [Aegicerascorniculatum(Ac),Kandeliacandel(Kc)] in Zhenhai Bay Mangrove Nature Reserve in Jiangmen, Guangdong Province. Analysis of the residual characteristics of FQs-Ofloxacin (OFL), Norfloxacin (NOR), Ciprofloxacin (CIP), Enrofloxacin (ENR) in sediments from fourteen mangal root areas, six discharge and three tidal flat were carried out by high performance liquid chromatogram-phymass spectrometry (HPLC-MS) qualitatively and quantitatively. The canonical correspondence analysis (CCA) analysis was used to analyze the relationship between the environmental factors (pH, Soil organic matter(SOM),Cationex change capacity(CEC), Catalase (CAT) ,Sucrase(SUC), available heavy metals such as Cu, Zn, Fe) and FQs in magal root areas. The results showed that the average contents of FQs in two mangalrhizosphere soils are 55.22,29.25 μg·kg-1, respectively. The average contents of FQs in two mangal non-rhizosphere soils are 22.45,18.66 μg·kg-1, respectively. FQs contents ofAcroot areas are higher than that ofKcroot areas (P<0.05). FQs contents in two mangalrhizosphere soils root areas are higher than that of non-rhizosphere soils. The CCA analysis indicates that the sorting of environmental factors as: pH > Fe > SOM ≥ CEC > Zn > SUC ≥ CAT.The study results have important theoretical significance on interpretation of mangroves to the absorption and purification of organic pollutants (including antibiotics).
mangal; root areas; antibiotics; fluoroquinolones; environmental factors; residual characteristics
2016-11-07 基金项目:国家自然科学基金(41171416);中央高校基本科研业务费专项资金
任珂君(1993年生),女;研究方向:水生态修复;E-mail:Junerke@163.com
刘玉(1963年生),女;研究方向:水环境与生态学、藻类生态学、红树林生态学;E-mail:eeslyu@mail.sysu.edu.cn
10.13471/j.cnki.acta.snus.2017.02.017
X173
A
0529-6579(2017)02-0102-10
