藏药唐古特乌头总生物碱的急性毒性及抗炎镇痛作用
2017-06-09吴国泰牛亭惠刘五州王瑞琼杜丽东李广远
吴国泰 牛亭惠 刘五州 王瑞琼 杜丽东,2 李广远*
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000
藏药唐古特乌头总生物碱的急性毒性及抗炎镇痛作用
吴国泰1,2牛亭惠1刘五州1王瑞琼1杜丽东1,2李广远1*
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000
目的:研究藏药唐古特乌头总生物碱(TAA)的急性毒性及抗炎镇痛作用。方法:采用灌胃和腹腔注射两种给药途径研究TAA的急性毒性;采用二甲苯致小鼠耳肿胀、琼脂肉芽肿两种炎症模型,考察TAA的抗炎作用;采用冰醋酸致小鼠扭体和热板致痛两种疼痛模型,观察TAA的镇痛作用。结果:TAA具有一定急性毒性,对二甲苯致小鼠耳肿胀和皮下琼脂肉芽肿两种炎症模型以及冰醋酸致小鼠扭体和热板致痛两种疼痛模型均有一定的抑制作用。结论:藏药唐古特乌头总生物碱具有抗炎镇痛作用,也具有一定的急性毒性。
唐古特乌头;生物碱;急性毒性;抗炎镇痛
藏药唐古特乌头Aconitumtanguticum(Maxim.) Stapf为高山珍稀药材,其性凉味苦,具有清热解毒,生肌燥湿的功效。主要用于肝胆热症、肺热肺炎、肝炎、胃肠炎、传染病引起的发烧等,传统藏医临床使用历史悠久,疗效确切[1,2]。唐古特乌头生长在高山草甸及碎石带,平均海拔为4000米,主产于西藏西东部、青海东南部、甘肃南部、四川西北部和云南北部等地。在四川(黑水县、红原县、马尔康、金川县)、甘肃省(天祝县、甘南州、和政县)、青海省(循化县、贵德县、互助县、贵南县、同德县、玉树州)、西藏(昌都地区)多呈零散分布,没有种群优势,易遭到破坏。目前在四川金川、马尔康地区有少量栽培,但是栽培状况和种植规模等并不乐观。唐古特乌头收载于《中华人民共和国卫生部药品标准·藏药》(第1册),由唐古特乌头组成复方形成的藏成药中共有9个品种,分别为安儿宁颗粒、二十五味肺病丸、十二味翼首散、八味獐芽菜丸、大月晶丸、十一味金色丸、红龙镇痛片、十三味榜嘎散、二十五味鬼臼丸。资料显示,藏药甘青乌头有小毒,具有广泛的药理活性,抗菌抗炎、抗病毒、抗高血压和抗肿瘤等作用已经得到实验验证[3,4]。唐古特乌头含有内酯型二萜生物碱,结构不稳定,追踪单个生物碱成分目前存在较大困难[5]。在前期制备总生物碱的基础上,研究其急性毒性和抗炎镇痛作用,为明确其抗炎镇痛的药效物质基础、开发藏药资源提供依据。
1 仪器与材料
1.1 供试药品 醋酸泼尼松片(批号:1306041,天津天药药业股份有限公司);氢溴酸高乌甲素注射液(批号:20131103,山东鲁抗辰欣药业有限公司);泊洛沙姆(pluronic-127,批号:201412,上海源叶生物科技有限公司);二甲基亚砜(DMSO,批号:WXBB5403V,Sigma-aldrich公司)。唐古特乌头(青海帝玛尔藏药有限公司)经甘肃中医药大学中药炮制教研室刘峰林博士鉴定为毛茛科乌头属植物唐古特乌头Aconitumtanguticum(Maxim.)Stapf的全草,标本存放于该教研室。总生物碱(TAA):将唐古特乌头粉碎过20目筛,称取500g,加15倍量(7500mL)90%乙醇在85℃条件下搅拌提取1.5h,回收乙醇,浓缩,冷冻干燥,得提取物88.25g,用氯仿精制,用酸碱滴定法测得总生物碱含量为0.3323%,即获得293.2mg唐古特乌头总生物碱。临用前用终浓度为0.1%的二甲基亚砜配制乳浊液备用。
1.2 动物 昆明种小鼠,SPF级,体重(20±2g),雌雄不拘,甘肃中医药大学实验动物中心提供,合格证号SCXK(甘)2011-0001,实验动物设施使用证号SYXK(甘)2011-0001。室温(25±0.5)℃,相对湿度(55±5)%,12h灯光,12h黑暗,适应3d开始实验。
1.3 仪器 BS110Sartorius电子天平(德国Sartorius公司);52770型冷热痛觉测试仪(美国Stoelting公司);KDM型可调电子控温电热套(成都泰盟科技有限公司);HH.S11-2型水浴锅(浙江科学实验仪器厂);DT510H型超声波清洗器(德国Bandelin公司)。
2 方法
2.1 TAA的急性毒性试验 分别以1:10:100剂量比例配制乳浊液,灌胃给药(20mL/kg体重)找出受试物的0%和100%估计致死量。另取小鼠,以受试物0%和100%估计致死量为依据,分别以1:4:16剂量比例配制乳浊液,灌胃给药(20mL/kg体重),测定受试物的Dmin和Dmax。根据Dmin和Dmax的值,以及计划分组数,计算组间剂量比值(K),以Dmin作为最低剂量组,Dmax作为最高剂量组,按K值计算出中间几组剂量。灌胃给药(20mL/kg体重)后观察并详细记录小鼠的反应情况以及死亡分布情况,采用LD50处理软件计算TAA的半数致死量(LD50)和LD50的95%可信区间,采用腹腔注射给药,同法测定腹腔注射的LD50和LD50的95%可信区间[6]。
2.2 TAA的抗炎作用
2.2.1 TAA对二甲苯所致小鼠耳壳肿胀的影响[7-8]取小鼠50只,雄性,按体重随机分为DMSO对照组,阳性对照组(醋酸泼尼松45mg/kg,相当于临床70kg成人日用量的10倍),总生物碱(TAA)高、中和低剂量组,共5组,每组10只。TAA高、中、低剂量分别用DMSO助溶(DMSO终浓度为0.1%),配成乳浊液供试,分别灌胃100、75、50mg/kg的TAA乳浊液,DMSO对照组小鼠灌胃0.1%DMSO蒸馏水乳浊液,给药容量均为20mL/kg,1次/d,连续3d,末次给药60min后,清洁小鼠双耳耳面,于左耳两面涂抹二甲苯25μL/只,右耳不涂抹作为对照,30min后,颈椎脱臼处死小鼠,用9mm打孔器取下左右耳相同部位的圆片,称重。用下面公式计算肿胀度和抑制率。
肿胀度=左耳片重-右耳片重
抑制率=[DMSO对照组肿胀度-药物组肿胀度]/DMSO对照组肿胀度×100%
2.2.2 TAA对小鼠皮下琼脂肉芽肿增生的影响[7,9]取小鼠50只,雄性,按体重随机分为DMSO对照组,阳性对照组(醋酸泼尼松45mg/kg,相当于临床70kg成人日用量的10倍),总生物碱(TAA)高剂量组、中剂量组和低剂量组,共5组,每组10只。分别在各小鼠背部皮下注射2%琼脂(65℃保温融化,生理盐水配制)0.4mL/只。TAA高、中、低剂量分别用DMSO助溶(DMSO终浓度为0.1%),配成乳浊液供试,分别灌胃100、75、50mg/kg的TAA乳浊液,DMSO对照组小鼠灌胃0.1%DMSO蒸馏水乳浊液,给药容量均为20mL/kg,1次/d,连续7d,末次给药60min后,颈椎脱臼处死小鼠,剥离皮下琼脂肉芽肿块,称湿重。用下面公式计算抑制率。
抑制率=(DMSO对照组肉芽肿重量-药物组肉芽肿重量)/DMSO对照组肉芽肿重量×100%
2.3 TAA的镇痛作用
2.3.1 TAA对冰醋酸致小鼠疼痛的影响[10]取小鼠50只,雌雄兼用,按性别体重随机分为DMSO对照组,阳性对照组(氢溴酸高乌甲素注射液1.0mg/kg,相当于临床70kg成人日用量的10倍),总生物碱(TAA)高、中和低剂量组,共5组,每组10只。TAA用DMSO助溶(DMSO终浓度为0.1%),配成乳浊液供试,分别灌胃100、75、50mg/kg的TAA乳浊液,DMSO对照组小鼠灌胃0.1%DMSO蒸馏水乳浊液,给药容量均为20mL/kg,1次/d,连续3d,末次给药60min后,各组小鼠分别腹腔注射新鲜配制的0.6%冰醋酸0.2mL/只,观察各小鼠的扭体反应,记录15min内小鼠扭体次数,用下面公式计算抑制率。
抑制率=(DMSO对照组扭体次数-药物组扭体次数)/DMSO对照组扭体次数×100%
2.3.2 TAA对小鼠热痛阈的影响[11]取小鼠50只(实验前筛选,热痛反应时间为5~30s),雌性,按体重随机分为DMSO对照组,阳性对照组(氢溴酸高乌甲素注射液1.0mg/kg,相当于临床70kg成人日用量的10倍),总生物碱(TAA)高、中和低剂量组,共5组,每组10只。TAA用DMSO助溶(DMSO终浓度为0.1%),配成乳浊液供试,分别灌胃100、75、50mg/kg的TAA乳浊液,DMSO对照组小鼠灌胃0.1%DMSO蒸馏水乳浊液,给药容量均为20mL/kg,1次/d,连续3d,末次给药60min后,用冷热痛觉测试仪(T=(55±0.5)℃)测定热刺激时小鼠舔后足时间,用下面公式计算抑制率。
抑制率=(药物组舔后足时间-DMSO对照组舔后足时间)/DMSO对照组舔后足时间×100%

3 结果
3.1 TAA的急性毒性 给药后小鼠在30min内出现兴奋,竖尾,不安,张口,弓背,抽搐,四肢僵直,眼球突出,大量唾液分泌等症状,最后抽搐死亡,大体解剖肉眼观察,未见肺、肝、肾、脑、心脏的形态和颜色异常;生存小鼠在给药120min后开始进水进食,在之后的整个观察期内,各小鼠活动正常,粪便性状正常,体重增加正常,对照组小鼠未见明显异常。测得TAA灌胃的LD50为0.745g/kg,置信系数a=0.05时的置信区间为0.646g≤LD50≤0.860g。同法测得TAA腹腔注射的LD50为0.336g/kg,置信系数a=0.05时的置信区间为0.285g≤LD50≤0.396g。
3.2 TAA对二甲苯所致小鼠耳壳肿胀的影响 由表1、图1结果显示TAA高、中剂量对二甲苯所致小鼠耳肿胀具有明显抑制作用,TAA低剂量抑制效应不显著。


表1 TAA对二甲苯所致小鼠耳肿胀的影响 ±s)
注:与DMSO对照组比较,*P<0.05,**P<0.01。
3.2 TAA对小鼠皮下琼脂肉芽肿增生的影响 由表2可知,TAA高剂量对二甲苯所致小鼠耳肿胀具有明显的抑制效应,TAA中、低剂量抑制效应不显著。

表2 TAA对小鼠皮下琼脂肉芽肿增生的影响 ±s,n=10)
注:与DMSO对照组比较,*P<0.05,**P<0.01。
3.3 TAA对冰醋酸致小鼠疼痛的影响 由表3可知,TAA高、中剂量组小鼠15min内的扭体次数明显减少,TAA低剂量组扭体次数减少得不明显。
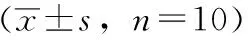
表3 TAA对冰醋酸致小鼠疼痛的影响
注:与DMSO对照组比较,*P<0.05,**P<0.01。
3.4 TAA对小鼠热痛阈的影响 由表4可知,TAA高剂量组小鼠热痛阈明显增高,TAA中剂量和低剂量组痛阈增高不明显。
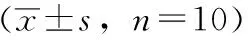
表4 TAA对小鼠热痛阈的影响
注:与DMSO对照组比较,*P<0.05,**P<0.01。
4 讨论
乌头属植物在我国分布约有200种,其中70多种可作为药用[12],该属药用植物大部分以块根或根入药,大多数具有温经止痛和祛风除湿的功效,其主要有效组分为生物碱类化合物[13]。唐古特乌头是乌头属药用植物的经典代表,是传统藏医临床常用药物之一,临床使用历史悠久,疗效确切,具有比较雄厚的临床基础。
文献记载唐古特乌头有小毒,临床使用时应严格控制用量[4,13]。前期研究表明,乌头中的双酯型生物碱的毒性是非常严重的,尤其是乌头碱,而单酯型乌头碱的毒性是乌头碱的1/200~1/500,并具有相同的抗炎,抗高血压活性[3,5]。本研究证实TAA经灌胃和腹腔注射对小鼠均具有一定的急性毒性,初步推测中毒靶器官为植物神经系统和运动神经系统,中毒较快,持续时间较短。另外,甘青乌头中含有苯甲酰异叶乌头碱、异叶乌头碱和阿替辛、大麦芽碱benzoylheteratisine、tangutimine,hetisinone,talatizamine,atisine,hordeine[14]。在唐古特乌头也分离得到异叶乌头碱、苯甲酰异叶乌头碱、唐乌碱等[15],其生物碱为有效的抗炎物质,能显著降低RA模型大鼠血清COX-2、IL-1、TNF-α和PGE2的含量[16]。
二甲苯致小鼠耳壳肿胀是经典的非特异性急性炎症模型,是筛选抗炎作用的经典方法之一,本研究结果显示TAA对耳壳肿胀具有一定的抑制作用,能迅速控制急性炎症反应;皮下棉球肉芽肿是经典的非特异性慢性炎症模型,本研究结果显示TAA对慢性增生性炎症反应也具有抑制作用,由此推断TAA的抗炎作用是明确的,非特异性的。冰醋酸致小鼠扭体反应是经典的化学损伤致痛模型,能有效反应受试物通过抗炎而减轻疼痛反应,本研究证实TAA能减少小鼠扭体次数,初步推断TAA在抗炎的同时产生镇痛作用。物理损伤也是导致机体疼痛的主要原因,热板法模拟烫伤导致的机体痛反应,是镇痛药有效性筛选的经典方法,本研究显示TAA能提高热刺激时的痛阈值,可以推断具有中枢性镇痛作用,具体作用机制还需进一步研究。
目前,对唐古特乌头的系统研究较少,在其药效物质基础成分、药理毒理作用及机制、质量评价方法和制剂质量控制的研究不足,鉴于唐古特乌头在藏药中的应用广泛而且极为重要,调查发现其资源蕴藏量大,因此,今后对甘青乌头进行细致深入的系统性研究,为有效合理地开发利用提供依据和参考。
[1]罗达尚.北京:中华藏本草[M].北京:民族出版社,1997:65.
[2]青海省食品药品监督管理局.青海省藏药炮制和规范(2010版)[M].西宁:青海人民出版社,2010:101.
[3]罗明,李春,林丽美,等.藏药榜嘎化学成分和药理作用的研究进展[J].中国实验方剂学杂志,2012,18(12):298.
[4]贾庆文,闫滨,王璐.乌头类药物的毒性研究及唐古特乌头的研究概述[J].食品与药品,2012,14(7):299.
[5]陈燕,易进海,刘云华.HPLC法测定藏药铁棒锤、榜嘎中双酯型生物碱的含量[J].世界科学技术中医药现代化,2009,11(4):570.
[6]陈奇.中药药理研究方法学[M].3版.北京:人民卫生出版社,2006: 355,360.
[7]高慧琴,吴国泰.秦艽不同配伍的抗炎镇痛作用[J].中国实验方剂学杂志,2010,16(9):181.
[8]李晓宇,栾永福,李晓骄阳.山豆根不同组分抗炎及伴随毒副作用研究[J].中国中药杂志,2012,37(15):2232.
[9]李永华,韩涛,吴国泰.芩仙胶囊治疗支气管哮喘的主要药效学研究[J].中国实验方剂学杂志,2013,19(4):209.
[10]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:901.
[11]夏勇兵,李林珍,马琳.响铃草抗炎镇痛活性部位的确定及其质量控制方法的建立[J].药物分析杂志,2010,30(7):1599.
[12]王锋鹏.从草乌化学研究开发的新药思考中药现代化的方法[J].化学进展,2009,21(1):63-65.
[13]Ellie J.Y.Kim, Yuling Chen, Johnson Q.,et al.Evidence-based toxicity evaluation and scheduling of Chinese herbal medicines [J].Journal of Ethnopharmacology, 2013, 146(1):40.
[14]Joshi B.S., Chen D.H., Zhang X., et al.Tanguticume, a new diterpenoid alkaloid from Aconitum tanguticum(Maxim)Stapf [J].Heterocycles,1991,32(9):1793-1804.
[15]Li Yanrong, Liu Ting, Yan Renyi, et al.Three new phenolic glycosides from the whole plant of Aconitum tanguticum(Maxim.) Stapf [J].Phytochemistry Letters, 2015(11):311-315.
[16]瞿燕.藏药榜嘎总生物碱的抗炎实验研究[J].时珍国医国药,2009,20(10) :2412.
Acute Toxicityand Anti-inflammatoryor Analgesic Effects of Total Alkaloids of Aconitum Tanguticum in Mice
WU Guotai1, 2NIU Tinghui1 LIU Wuzhou1WANG Ruiqiong1DU Lidong1, 2LI Guang yuan1*
1.Gansu University of Chinese Medicine, Lanzhou 730000, China; 2.Key Laboratory of Pharmacology and Toxicology of Traditional Chinese Medicine in Gansu province, Lanzhou 730000, China
Objective To study the acute toxicityand anti-inflammatoryor analgesic effectsoftotal alkaloids ofAconitumtanguticum(Maxim)stapf(TAA) through experiments.Methods Acute toxicity of TAA were measured by using oral and intraperitoneal injection of routes of administration.The anti-inflammatory effects of TAA were observed by using the test of mouse ear swelling induced by xylene and the weight of placing agar into subcutaneous of mouse to induce granuloma.The analgesic effects of TAA were observed by using the test of mouse twister induced by glacial acetic acid and the test of ache induced by hot were set up.Results TAA have inhibitory effect to both of the inflammatory models and ache models.TAA has some acute toxicity.Conclusion TAA had anti-inflammatory and analgesic effects,andacute toxicity was appreciated.
Aconitumtanguticum(Maxim)stapf; Alkaloids;Acute Toxicity; Anti-inflammatory and Analgesic Effect
西藏自治区重大专项(No.2013KJGX01-30),甘肃省中药药理与毒理学重点实验室开放基金(No.ZDSYS-KJ-2012-004)。
吴国泰(1978-) ,男,汉族,博士,副教授,研究方向为中藏药药理与毒理及新药开发。E-mali:wgt@gszy.edu.cn
李广远(1973-) ,男,汉族,副教授,研究方向为中医基础理论和民族药物。E-mali:lgy@gszy.edu.cn
R29
A
1007-8517(2017)10-0028-05
2017-03-14 编辑:陶希睿)
