Runx2通过促进MMP9的表达增强肝细胞肝癌迁移侵袭能力*
2017-06-09曹自孙保存赵秀兰张艳辉古强梁晓辉董学易赵楠
曹自 孙保存③ 赵秀兰③ 张艳辉 古强③ 梁晓辉③ 董学易③ 赵楠③
Runx2通过促进MMP9的表达增强肝细胞肝癌迁移侵袭能力*
曹自①孙保存①②③赵秀兰①③张艳辉②古强①③梁晓辉①③董学易①③赵楠①③
目的:研究Runx2对肝癌细胞中MMP9的表达以及其对肝癌细胞侵袭迁移能力的影响。方法:通过免疫组织化学染色法对2005年12月至2015年12月天津医科大学肿瘤医院和天津医科大学总医院189例肝细胞肝癌病例标本中Runx2和MMP9的表达进行分析;将Runx2过表达质粒和干扰质粒分别转染至肝癌细胞系HepG2和SMMC7721细胞中。使用Western blot法检测转染后HepG2和SMMC7721细胞中Runx2和MMP9的表达情况;划痕、侵袭实验检测Runx2对肝癌细胞迁移和侵袭能力的影响。结果:免疫组织化学结果显示Runx2的表达和MMP9的表达相关。在HepG2细胞中上调Runx2的表达,促进了MMP9的表达,增强了HepG2细胞迁移侵袭能力;在SMMC7721细胞中下调Runx2的表达,降低了MMP9的表达,抑制了SMMC7721细胞的迁移侵袭能力。结论:Runx2的表达可能参与促进肝细胞肝癌细胞MMP9的表达,进而促进肝细胞肝癌的迁移侵袭能力。
肝细胞肝癌 Runx2 MMP9 迁移 侵袭
在世界范围内,原发性肝细胞肝癌(hepatocellular carcinoma,HCC)在男性最常见肿瘤中位居第5位,女性最常见肿瘤中位居第7位,在癌症导致的死亡病例中位居第3位。我国是HCC的高发地区,仅2012年我国的肝癌病例数就占全球范围内肝癌病例数的一半以上。目前,HCC的治疗主要以手术切除为主。虽然治疗水平不断提高,肝癌患者术后的5年生存率仅约30%,这与肝癌的高侵袭性和转移密切相关[1-2]。HCC的转移是一个较为复杂的多步骤过程:肿瘤细胞失去正常细胞间连接,穿过基膜进入细胞间质,穿过血管内皮进入血流,进而播散到远处器官。
肿瘤细胞合成和分泌蛋白酶降解基膜和细胞外基质是转移的前提。MMP9属于基质金属蛋白酶(matrix metalloproteinases,MMPs)家族,是一类锌依赖的肽链内切酶,参与细胞外基质的降解,在胚胎发育、伤口愈合、肿瘤细胞侵袭和转移中发挥重要作用。研究表明MMP9的表达促进肿瘤细胞的侵袭和转移[3-4]。
Runx2属于RUNX家族,是一类转录因子。实验证明Runx2在肿瘤的侵袭转移过程中发挥重要的作用[5-10]。有研究证实Runx2可以通过结合MMP9的启动子来促进MMP9的表达[9]。目前,关于Runx2在肝癌中调控MMP9及肝癌迁移侵袭关系的研究尚少。
本研究首先通过免疫组织化学染色方法检测肝癌组织中Runx2和MMP9的表达情况,并分析了Runx2的表达与MMP9的表达相关性。之后分别转染Runx2过表达质粒至HepG2细胞,转染Runx2降表达质粒至SMMC7721细胞。使用Western blot法检测转染后HepG2细胞和SMMC7721细胞Runx2的表达水平和MMP9的表达水平,同时通过划痕和Transwell实验观察细胞侵袭迁移能力的变化。研究在肝细胞肝癌细胞中,Runx2的表达能否通过促进MMP9的表达从而促进肝癌的迁移侵袭能力。本研究旨在为HCC的临床治疗提供新的靶点和思路。
1 材料与方法
1.1 材料
1.1.1 组织标本 选取2005年12月至2015年12月天津医科大学肿瘤医院和天津医科大学总医院行手术切除,病理诊断为原发性HCC并且随访资料完整的患者标本89例。全部病例均为手术标本且患者术前未接受放、化疗,由两位资深病理医师诊断切片确诊为肝癌,组织标本及病例资料的使用均经天津医科大学伦理委员会审查批准,并被患者及其家属知情同意。
1.1.2 细胞株 人肝癌细胞株HepG2,SMMC7721细胞系(购自美国ATCC公司)。
1.1.3 实验试剂 MEM、RPMI-1640培养基(购自美国Neuronbc公司)。Opti-MEM培养基,胎牛血清(FBS)(购自美国ThermoFisher公司)。Runx2过表达质粒(Catalog No.:EX-H5214-Lv201),Runx2过表达对照质粒(Catalog No.:EX-NEG-Lv201),Runx2降表达质粒(Catalog No.:HSH021333-LVRU6GP),Runx2降表达对照质粒(Catalog No.CSHCTR001-LVRU6GP)。Transwell小室(购自美国FALCON公司)。小鼠抗人Runx2抗体,兔抗人MMP9抗体,兔抗人β-actin抗体均(购自英国Abcam公司)。山羊抗兔IgG抗体,山羊抗鼠IgG抗体(购自北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 免疫组织化学染色 肝癌组织石蜡标本连续切片脱蜡水化,使用3%过氧化氢灭活内源性过氧化物酶,微波修复;于室温正常血清封闭,一抗置于4℃冰箱过夜,次日常温下孵育二抗,DAB显色,苏木素复染细胞核,中性树脂封片。阴性对照用PBS代替一抗。染色结果判断标准参考文献[11]。
1.2.2 细胞培养 人肝癌细胞系HepG2,SMMC7721按照常规培养模式进行培养,HepG2培养基为MEM+10%胎牛血清(FBS)+1%双抗(100 U/mL青霉素,100 U/mL链霉素);SMMC7721培养基为RPMI-1640+10%FBS+1%双抗。培养环境为37℃,5%CO2恒温恒湿培养箱。
1.2.3 细胞转染 在6孔板中培养细胞至约70%时,更换不含血清和双抗的培养基,以1:4比例混匀PEI转染试剂盒质粒,室温静置20 min后加入培养基中,6 h后更换为完全培养基,48 h后评价转染效果。
1.2.4 Western blot法检测 使用RIPA-SDS裂解细胞,提取总蛋白。先在10%聚丙烯酰胺凝胶中电泳,PVDF膜转膜90 min。用5%脱脂奶粉于室温封闭1 h,根据实验需要分别加入Runx2(1:500),MMP9(1:500),β-actin(1:2 000),4℃孵育过夜,次日恢复室温后TBST洗膜3次,再与相应山羊抗兔或抗鼠IgG二抗室温孵育2 h,用TBST漂洗PVDF膜3次,加入发光液,在发光仪上显影,照相。蛋白条带的灰度定量分析使用Image J软件处理。
1.2.5 细胞划痕实验 将细胞均匀接种于6孔板中,待细胞长到70%密度时,使用100 μL枪头在细胞平面进行划痕,洗掉离壁细胞,加入完全培养基培养。将此时记为划痕0 h,分别在0、24、48 h倒置显微镜下拍摄同一位置视野,并测量和记录划痕距离,计算迁移率。
1.2.6 细胞侵袭实验 前一天在Transwell小室中加入30 μL Matrigel,放置于24孔板中,于培养箱中过夜。待Matrigel凝固后,用无血清培养基制细胞悬液,于上室200 μL加入细胞悬液,24孔板小孔加入500 μL完全培养基,培养48 h后取出Transwell小室,用冷甲醇固定,0.4%结晶紫染色,于倒置显微镜下观察并统计数据。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,计量资料分析采用t检验。病例计数资料采用Chi-square test,生存分析采用Kaplan-Meier法。以P<0.05为差异具有统计学意义。
2 结果
2.1 Runx2的表达和MMP9的表达关系
免疫组织化学染色后阳性表达呈棕黄色,Runx2阳性表达定位于肝细胞胞核(图1),MMP9的阳性表达定位于肝细胞胞质中(图2)。免疫组织化学染色结果显示,在89例肝癌标本中Runx2阳性表达率为61.8%,MMP9的阳性表达率为51.7%;在Runx2的阳性组中MMP9阳性率为61.8%,在Runx2的阴性组中MMP9阳性率为35.2%。MMP9在Runx2的阳性组中阳性率高于在Runx2的阴性组,差异具有统计学意义(表1)。
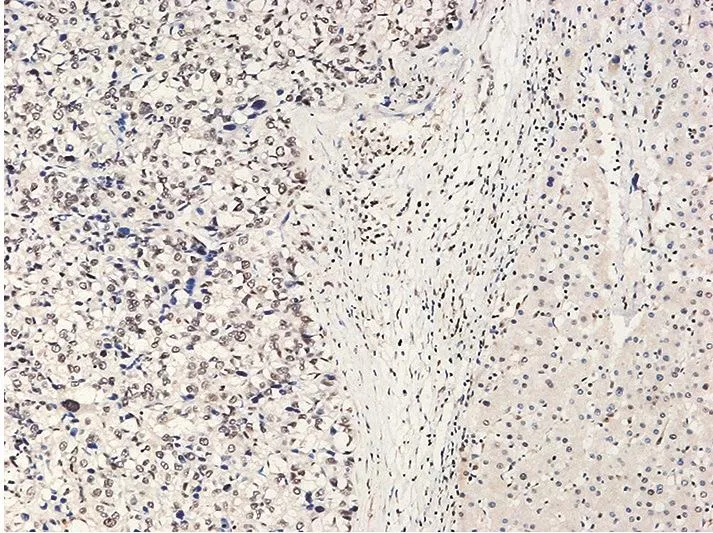
图1 Runx2在人肝癌组织中定位于细胞核的阳性表达(H&E×200)Figure 1 Positive expression of Runx2 located in nucleus in hepatocellular carcinoma specimens(H&E×200)

图2 MMP9在人肝癌组织中定位于细胞浆的阳性表达及阴性表达(H&E×200)Figure 2 Positive expression of MMP9 located in cytoplasm in hepatocellular carcinoma specimens(H&E×200)
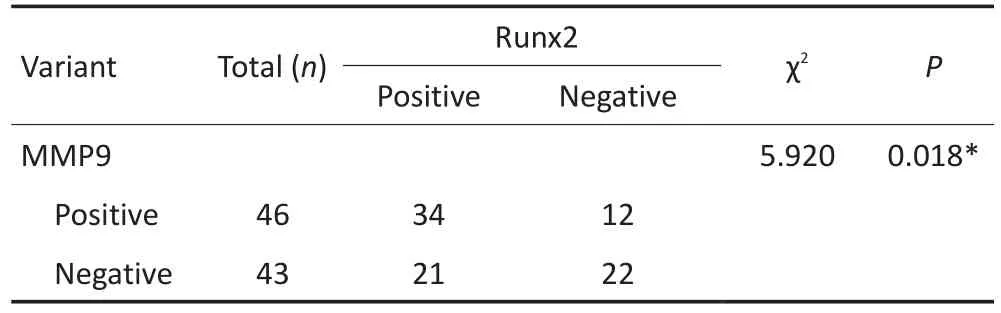
表1 HCC标本中Runx2与MMP9的关系Table 1 Correlation between Runx2 and MMP9 in HCC samples
2.2 Runx2和MMP9的表达与HCC患者临床病理资料的关系
分析Runx2和MMP9的表达与HCC患者临床病理资料的关系显示,Runx2和MMP9的表达在不同病理分级的患者中不同,Runx2和MMP9在低分化(Ⅲ/Ⅳ级)的患者中表达高于高分化(Ⅰ/Ⅱ级)的患者,差异具有统计学意义(χ2=5.633,P=0.025)。Runx2和MMP9在肝癌转移的患者中表达高于肝癌无转移的患者,差异具有统计学意义(χ2=4.492,P=0.049)。Runx2和MMP9在不同年龄、不同性别、是否有乙型肝炎、是否有肝硬化、肿瘤大小患者中的差异无统计学意义(P>0.05,表2)。生存分析,结果显示,Runx2和MMP9的表达均为阳性的患者较Runx2和MMP9均阴性的患者生存时间相对较短(图3)。

表2 HCC标本中Runx2和MMP9与肝癌临床病理资料的关系Table 2 Correlation between Runx2 MMP9 and clinicopathological data of HCC patients

图3 Runx2(+)MMP9(+)患者较Runx2(-)MMP9(-)患者生存时间相对较短Figure 3 Kaplan-Meier survival analysis showed that Runx2(+)MMP (+)patients had shorter survival period than Runx2(-)MMP(-)patients
2.3 转染后细胞中Runx2,MMP9的表达变化
使用Western blot法来检测转染后HepG2,SMMC7721细胞中Runx2和MMP9的表达情况。结果显示,转染Runx2过表达质粒的HepG2细胞,与对照组比较,Runx2表达水平上升,MMP9的表达水平上升(图4)。转染Runx2降表达质粒的SMMC7721细胞与对照组相比较,Runx2表达水平下降,MMP9的表达水平也下降(图4)。实验结果说明Runx2可以促进MMP9的表达。

图4 HepG2细胞转染Runx2过表达质粒和SMMC7721转染Runx2降表达质粒后Runx2和MMP9的表达情况Figure 4 Expression of Runx2 and MMP9 in HepG2 and SMMC7721 cells after transfection with overexpression or knockdown plasmid of Runx2
2.4 Runx2对HCC迁移运动能力的影响
划痕实验结果:HepG2细胞过表达Runx2后,与对照组相比,在24、48 h时间点,其细胞迁移能力增强,差异具有统计学意义(P<0.05,图5);SMMC7721细胞下调Runx2后,与对照组相比,在24、48 h时间点,其细胞迁移能力减弱,差异具有统计学意义(P< 0.05,图5)。

图5 过表达 Runx2对HepG2细胞迁移能力的影响Figure 5 Effects of Runx2 on the migration capacity of HepG2 cells
2.5 Runx2对HCC细胞侵袭能力的影响
Transwell实验结果显示:HepG2细胞上调Runx2后,与对照组相比,穿过小室的细胞数增多(图6);SMMC7721细胞下调Runx2表达后,与对照组相比,穿过小室的细胞数减少(图7)。结果提示,Runx2可以增强HCC细胞的侵袭能力,差异具有统计学意义(P<0.05)。

图6 下调Runx2表达对SMMC7721细胞迁移能力的影响Figure 6 Effects of Runx2-shRNA on the migration capacity of SMMC7721 cells

图7 过表达Runx2对HepG2细胞侵袭能力的影响和降表达Runx2对SMMC7721细胞侵袭能力的影响Figure 7 Effects of Runx2 overexpression or knockdown on invasion capacity of HepG2 and SMMC7721 cells
3 讨论
Runx2是RUNX(Runt相关的转录因子)转录因子家族的成员之一,通过核心结合子(core binding factor,CBF)结合DNA来调控基因的表达。RUNX家族是哺乳动物的发育过程中要素之一,尤其对成骨具有重要作用[12-13]。近年来,关于Runx2的研究表明其在肿瘤的侵袭迁移和转移过程发挥重要作用[14]。
HCC是我国最常见的恶性肿瘤之一,由于其侵袭性高、易转移、肝癌患者的术后复发率高,预后较差,5年生存率低,死亡率高。近年来,肝癌的治疗水平不断提高,但治疗效果不佳。肿瘤的转移是一个复杂的多步骤过程,肿瘤细胞合成和分泌MMPs降解细胞外基质,促进肿瘤细胞的侵袭和转移[15]。MMP9降解Ⅳ型胶原蛋白,为肿瘤细胞转移开通通道,此外还促进肿瘤细胞的迁移、侵袭和转移[3-4]。研究表明肝癌中MMP9的高表达与高侵袭能力相关[16]。免疫共沉淀实验发现,Runx2与MMP9启动子区域结合,激活MMP9内源性表达促进肿瘤细胞的侵袭转移能力,突变的Runx2与MMP9启动子区的结合导致MMP9转录水平的显著下降[10]。本研究推测Runx2可能在肝癌中通过调控MMP9的表达来调控肝癌细胞的迁移侵袭能力。
人肝癌组织免疫组织化学结果显示,Runx2的表达与MMP9的表达相关,生存分析结果显示,Runx2和MMP9共表达的肝癌患者,较Runx2和MMP9均为阴性表达的患者,生存时间较短。细胞转染后,上调Runx2的HepG2细胞与对照组相比,Runx2和MMP9的表达水平上升。而下调Runx2的SMMC7721细胞与对照组相比,Runx2和MMP9的表达水平下降。同时细胞功能学实验也证实,上调Runx2后HepG2细胞的迁移侵袭能力较对照组增强,而降低SMMC7721细胞Runx2的表达后,细胞的迁移侵袭能力较对照组降低。
结合上述研究结果,本研究提示Runx2的表达可能参与促进肝细胞肝癌细胞MMP9的表达,进而促进HCC的迁移侵袭能力,为肝癌的临床治疗提供一个新靶点。关于Runx2在肝癌中如何调控MMP9的表达机制及相关通路的相互作用关系亟需进一步的研究。
[1] Bosetti C,Turati F,La Vecchia C.Hepatocellular carcinoma epidemiology[J].Best Pract Res Clin Gastroenterol,2014,28(5):753-770.
[2] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[3] Daniele A,Abbate I,Oakley C,et al.Clinical and prognostic role of matrix metalloproteinase-2,-9 and their inhibitors in breast cancer and liver diseases:A review[J].Int J Biochem Cell Biol,2016,77(Pt A):91-101.
[4] Egeblad M,Werb Z.New functions for the matrix metalloproteinases in cancer progression[J].Nat Rev Cancer,2002,2(3):161-174.
[5] El-Gendi SM,Mostafa MF.Runx2 expression as a potential prognostic marker in invasive ductal breast carcinoma[J].Pathol Oncol Res,2016, 22(3):461-470.
[6] Li XQ,Du X,Li DM,et al.ITGBL1 Is a Runx2 transcriptional target and promotes breast cancer bone metastasis by activating the TGFβ signaling pathway[J].Cancer Res,2015,75(16):3302-3313.
[7] Sase T,Suzuki T,Miura K,et al.Runt-related transcription factor 2 in human colon carcinoma:a potent prognostic factor associated with estrogen receptor[J].Int J Cancer,2012,131(10):2284-2293.
[8] Vladimirova V,Waha A,Lückerath K,et al.Runx2 is expressed in human glioma cells and mediates the expression of galectin-3[J].J Neurosci Res,2008,86(11):2450-2461.
[9] Boregowda RK,Olabisi OO,Abushahba W,et al.RUNX2 is overexpressed in melanoma cells and mediates their migration and invasion[J].Cancer Lett,2014,348(1-2):61-70.
[10]PratapJ,JavedA,LanguinoLR,et al.TheRunx2osteogenic transcription factor regulates matrix metalloproteinase 9 in bone metastatic cancer cells and controls cell invasion[J].Mol Cell Biol,2005,25(19):8581-8591.
[11]Sun T,Zhao N,Zhao XL,et al.Expression and functional significance of Twist1 in hepatocellular carcinoma:its role in vasculogenic mimicry[J].Hepatology,2010,51(2):545-556.
[12]Furuichi T,Komori T.Multifunctional roles of Runx2/Cbfa1 in skeletal development[J].Nihon Rinsho,2004,62(Suppl 2):57-61.
[13]Komori T.Runx2,a multifunctional transcription factor in skeletal development[J].J Cell Biochem,2002,87(1):1-8.
[14]Blyth K,Vaillant F,Jenkins A,et al.Runx2 in normal tissues and cancer cells:A developing story[J].Blood Cells Mol Dis,2010,45(2):117-123.
[15]Talvensaari-Mattila A,Pääkkö P,Turpeenniemi-Hujanen T.Matrix metalloproteinase-2(MMP-2)is associated with survival in breast carcinoma[J].Br J Cancer,2003,89(7):1270-1275.
[16]Toi M,Taniguchi T,Yamamoto Y,et al.Clinical significance of the determination of angiogenic factors[J].Eur J Cancer,1996,32(14):2513-2519.
(2017-03-07收稿)
(2017-03-28修回)
(编辑:郑莉 校对:孙喜佳)
Runx2 promotes migration and invasion abilities of hepatocellular carcinoma by inducing MMP9 expression
Zi CAO1,Baocun SUN1,2,3,Xiulan ZHAO1,3,Yanhui ZHANG2,Qiang GU1,3,Xiaohui LIANG1,3,Xueyi DONG1,3,Nan ZHAO1,3
Baocun SUN;E-mail:sunbaocun@aliyun.com
1Department of Pathology,Tianjin Medical University,Tianjin 300070,China;2Department of Pathology,Tianjin Medical University Cancer Institute and Hospital,Tianjin 300060,China;3Department of Pathology,Tianjin Medical University General Hospital,Tianjin 300052,China This work was supported by the National Natural Science Foundation of China(No.81572872),and Key project of the National Natural Science Foundation of China(No.81230050)
Objective:To examine the expression of Runx2 in hepatocellular carcinoma(HCC)cells and its effect on the migration and invasion and to evaluate the expression of Runx2 in inducing MMP9 expression.Methods:Immunohistochemistry staining was performed to investigate the relation between the expression of Runx2 and MMP9.Transfection with Runx2 overexpression plasmid in HepG2 cells were conducted to induce exogenous expression of Runx2 and Runx2 knockdown plasmid in SMMC7721 cells and to interfere the quantity of Runx2 protein.The expression of Runx2 and MMP9 in HepG2 and SMMC7721 cells were analyzed by Western blotting and compared with the control.For wound healing assays,cell motility was assessed by measuring the movement of cells into a scarp,and the invasion assay was used to determine the function of invasive potential.Results:Immunohistochemistry staining results revealed the association of Runx2 expression with MMP9 expression in HCC specimen.After transfection,Runx2 expression in HepG2 cells increased with the expression of MMP9 and enhanced cell motility and invasion.In SMMC7721 cells,Runx2 and MMP9 expression decreased and cell motility and invasion were inhibited.Conclusion:Runx2 might promote hepatocellular carcinoma migration and invasion by promoting MMP9 expression.
hepatocellular carcinoma,Runx2,MMP9,migration,invasion

10.3969/j.issn.1000-8179.2017.09.046
①天津医科大学病理教研室(天津市300070);②天津医科大学肿瘤医院病理科;③天津医科大学总医院病理科
*本文课题受国家自然基金面上项目(编号:81572872)和国家自然科学基金重点项目(编号:81230050)资助
孙保存 sunbaocun@aliyun.com
曹自 专业方向为肝癌血管生成分子病理方面的研究。
E-mail:imcaozi@163.com
