哮喘患儿调节性B细胞改变及意义初探
2017-06-08马卓娅张建平刘萍王国兵罗颖郑跃
马卓娅 张建平 刘萍 王国兵 罗颖 郑跃杰
【摘要】 目的:探討调节性B细胞(Regulatory B cells,Breg)在儿童哮喘发病中可能的作用。方法:选取急性期哮喘患儿23例(试验组),同龄健康儿童21例(正常对照组),取血备检。采用流式细胞术分别检测外周血调节性T细胞(Regulatory T cells,Treg)、Breg比例及Breg细胞表面CD80、CD86的表达水平;PCR检测CD4+ T细胞中IL-17A、IL-17F IFN-γ、T-bet、GATA3、RORγt、IL-10、TGF-β mRNA表达;ELISA检测B细胞培养上清中IL-10浓度。结果:(1)试验组患儿急性发作期外周血中CD24hiCD27+Breg细胞比例及B细胞培养上清的IL-10浓度均比正常对照组低(P<0.05);CD80、CD86表达水平均低于正常对照组(P<0.05)。(2)试验组患儿CD4+CD25+Foxp3+Treg比例低于正常对照组(P<0.05);CD4+T细胞中T-bet、IFNG、RORγt、IL-17A、IL-17F表达上调,差异均有统计学意义(P<0.05);GATA3表达差异无统计学意义(P>0.05)。(3)CD19+B细胞中IL-10 mRNA在试验组和对照组差异无统计学意义(P>0.05),而TGF-βmRNA在试验组患儿中升高,差异有统计学意义(P<0.05)。结论:Breg细胞数量及功能异常可能是哮喘发病机制之一。
【关键词】 哮喘; 儿童; 调节性B细胞; 调节性T细胞; 白介素-10
Changes of Regulatory B Cells in Patients with Acute Asthma and Its Significance/MA Zhuo-ya,ZHANG Jian-ping,LIU Ping,et al.//Medical Innovation of China,2017,14(14):012-016
【Abstract】 Objective:To investigate the role of regulatory B cells in the pathogenesis in patients with asthma in children.Method:Twenty-three children with acute asthma(the experiment group) and twenty-one age-matched healthy subjects (the healthy control group)were enrolled in this study.Blood samples were collected and the proportions of Breg and CD4+CD25+Foxp3+regulatory T cells(Treg),and the expressions of co-stimulatory molecules(CD80,CD86) were analyzed by flow cytometry.The concentration of IL-10 protein was measured by enzyme-linkedimmunosorbent assay.Real-time PCR was performed to evalevaluate the expressions of T-bet,IFNG,RORγt,IL-17A,IL-17F in CD4+ T cells and IL-10 and TGF-β in CD19+B cells at mRNA level.Result:(1)The proportions of CD24hiCD27+Breg in the experiment group were significantly found to be lower than those of the healthy control group(P<0.05),and its expression levels of CD80 and CD86 were down-regulated(P<0.05),the concentrations of IL-10 protein in culture supernatant of B cells from patients were still lower than those of the healthy control group(P<0.05).(2)The proportions of CD4+CD25+Foxp3+Treg was significantly decreased in the experiment group compared with those of the healthy control group(P<0.05),and the expressions of T-bet,IFNG,RORγt,IL-17A,IL-17F at mRNA level were significantly increased inpatients compared with those of the healthy control group (P<0.05).(3)There no significant difference in the expressions of IL-10 at mRNA level in CD19+B cells between two groups and the expressions of TGF-β at mRNA level in CD19+B cells from patients were higher than those of the healthy control group(P<0.05).Conclusion:Breg cell deficiency and its impaired functiom might be one of the important factors causing immune dysfunction in patients with acute asthma.
【Key words】 Asthma; Child; Regulatory B cells; Regulatory T cells; Interleukin-10
First-authors address:Shenzhen Childrens Hospital,Shenzhen 518026,China
doi:10.3969/j.issn.1674-4985.2017.14.004
支气管哮喘是一种反复发作的咳嗽、喘息、胸闷及呼吸困难为表现的慢性气道炎症性疾病,全国城市14岁以下哮喘儿童的累及患病率由2000年的1.97%增至2010年的3.02%[1-3]。儿童哮喘在我国占儿科门诊量的3%~5%,是危害儿童健康的一种重要疾病[4]。支气管哮喘,简称哮喘,是由气道内的炎症细胞、结构细胞和细胞组分共同参与的慢性炎症性疾病,但其病因及发病机制迄今为止仍未完全阐明。以往的观点认为Th1/Th2细胞免疫失衡是哮喘发病的重要环节,但是随着研究的不断深入,Th1/Th2细胞平衡理论未能解释一些实验及临床现象[5]。体内存在具有免疫调节(或免疫抑制)功能的调节性B细胞(Breg),可通过细胞共刺激分子(CD80、CD86)或细胞因子(IL-10或TGF-β)抑制自身免疫T细胞活化,其数量或功能变化可引起自身免疫功能紊乱,导致免疫性疾病的发生[6-9]。本文探讨哮喘患儿急性发作期外周血Breg改变,为进一步揭示哮喘免疫发病机制提供理论基础及实验依据,现报道如下。
1 资料与方法
1.1 一般资料 哮喘试验组:选取2015年
10月-2016年5月深圳市儿童医院呼吸专科诊断支气管哮喘急性期患儿23例,其中男17例,女6例,男女比例为2.83∶1;年龄3~12岁,平均(6.58±2.38)岁。诊断均符合2008年由中华医学会儿科分会呼吸学组制定的哮喘诊断标准,均为首次确诊哮喘或规范吸入激素且停用>3个月后复发,没有其他传染病和自身免疫病。正常对照组:选取在深圳市儿童医院2015年10月-2016年5月体检的健康儿童21例,其中男7例,女14例,男女比例为2.00∶1;年龄2~10岁,平均(5.43±1.91)岁。经统计分析,两组年龄、性别组成比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案及步骤经深圳市儿童医院学术伦理委员会讨论通过,参与研究的受试者或其监护人均签署知情同意书。
1.2 分离CD4+、CD19+B 淋巴细胞:无菌采取静脉血3 mL,肝素抗凝,迅速送检。聚蔗糖(Ficoll)-泛影葡胺分离外周血单个核细胞(PBMC)。参照试剂盒(美国LifeTec公司,113.31 D和111.43 D)方法,磁珠分离法分离CD4+、CD19+B淋巴细胞,检测细胞活力>95%,纯度>97%,备用。
1.3 流式细胞术检测(flow cytometry,FC) 采用全血直接计数法,以CD19-eFluro450(流式抗体均购自美国eBioscience公司)设门,经CD24-PerCP-Cy5.5、CD27-PE-Cyanine7、CD80-APC、CD86-FITC、CD1d-PE染色30 min后检测,分析CD19+CD24+CD27+Bregs比例及CD80、CD86、CD1d平均荧光强度(mean fluorescence intensity,MFI)。另取部分细胞,以CD4-FITC设门,固定、破膜,经CD25-PE和Foxp3-APC抗体染色30 min,检测CD4+ CD25+Foxp3+细胞比例。全部数据经流式细胞仪(美国Bection Dickinson公司,CantoII)配套軟件DivaVer6.1.3获取分析。
1.4 实时荧光定量PCR(real-time PCR) (1) 提取、定量总RNA:参照试剂盒方法(美国Ambion公司,AM1912)分离CD4+ T、CD19+ B淋巴细胞总RNA,分光光度计测定RNA OD260及OD280,评估总RNA质量。(2)逆转录-PCR(RT-PCR):参照试剂盒(美国Thermo公司,K1632# )说明,RT合成cDNA。根据GenBank中IL-10、TGF-β等mRNA核酸序列合成引物(表1,引物均由广州Invitrogen公司合成),参照试剂盒(大连宝生物,DRR036A)进行PCR。(3)PCR产物鉴定:取PCR产物10 μL在2%琼脂糖可回收凝胶中,90 V电泳30 min,切胶回收纯化,并测序。PCR产物测序结果与GenBank中被检mRNA序列一致。(4)real-time PCR:采用SYBR Green试剂盒(大连宝生物,RR091Q),使用LightCycler 480II real-time PCR仪检测,并应用LCS 1.5软件分析,mRNA表达水平以目的基因/β-actin的比值表示。
1.5 酶联免疫吸附试验(ELISA) 取已分离的试验组及对照者外周血B细胞,经DETA CHaBEAD ?CD19(美国LifeTec公司,125.06 D)去除磁珠后,调整细胞浓度至1×105/mL,接种于含10%胎牛血清的RPMI1640培养基中,加入LPS(美国Sigma公司,L4397)至终浓度为10 ?g/mL的,于37 ℃孵育5 min,获取上清;ELISA(美国eBioscience公司,BMS215INST)检测IL-10蛋白水平,具体操作参照试剂说明书。
1.6 统计学处理 采用SPSS 19.0软件对所得数据进行统计分析,计量资料用(x±s)表示,F检验后采用独立样本t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Breg比例及CD80、CD86、CD1d表达检测结果 经FC检测,观察到试验组外周血中CD19+CD24hiCD27+Breg细胞比例明显低于正常对照组(P<0.05)。CD19+CD24hiCD27+Breg细胞共刺激分子CD80、CD86表达水平均明显低于正常对照组(P<0.05),而CD1d的表达水平有下降趋势,但差异无统计学意义(P>0.05)。见表2。
2.2 B细胞培养上清中IL-10检测结果 经ELISA法检测,观察到试验组患儿B细胞培养上清中的IL-10浓度低于正常对照组[(2.60±1.77)pg/mL vs (5.20±4.51)pg/mL,P<0.05]。
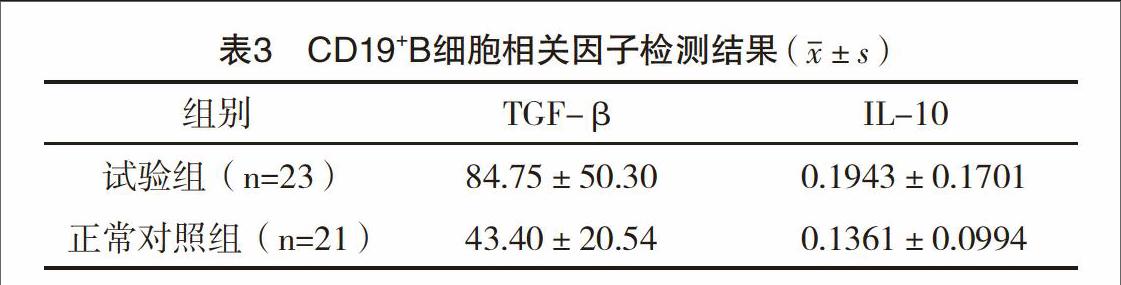
2.3 CD19+B细胞相关因子mRNA检测结果 real-time PCR检测观察到试验组患儿外周血CD19+B细胞中IL-10 mRNA与正常对照组比较,差异无统计学意义(P>0.05),而TGF-β mRNA较对照组升高,且差异有统计学意义(P<0.05),见表3。
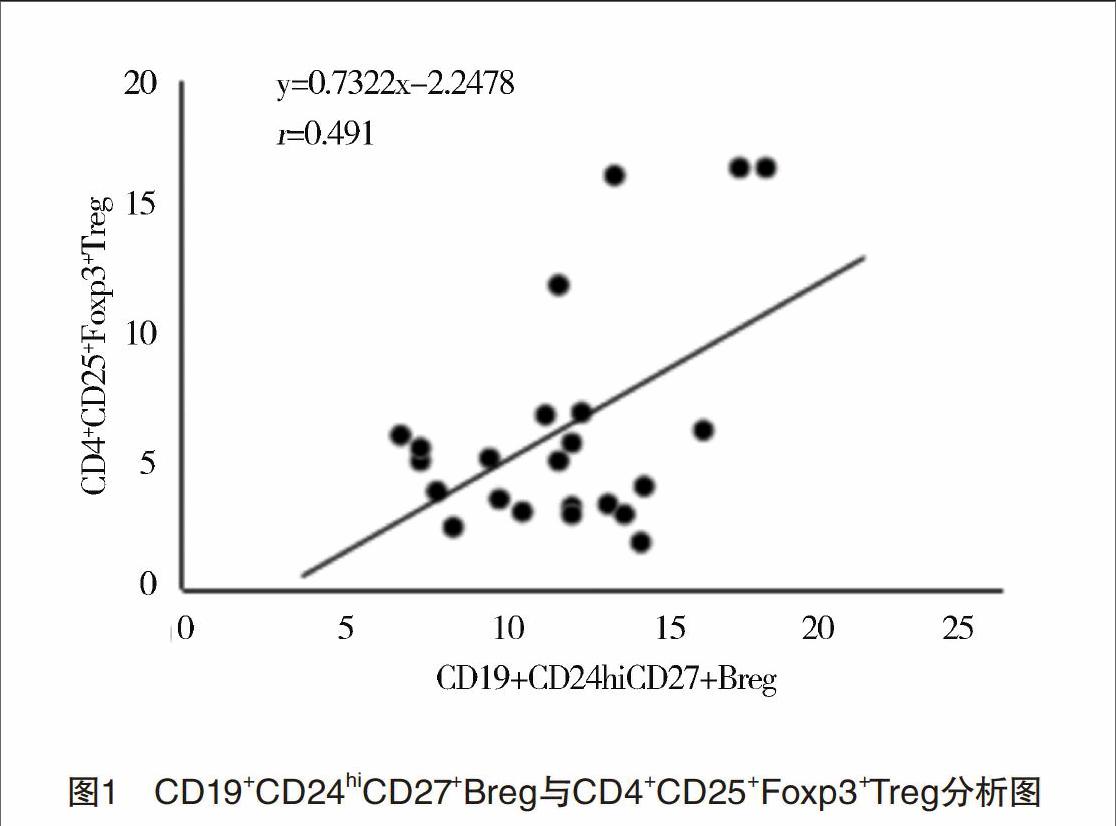
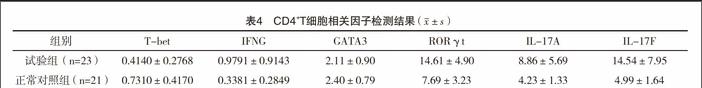
2.4 调节性T细胞及相关分子检测结果 试验组患儿外周血CD4+CD25+Foxp3+Treg比例明显低于正常对照组[(4.75±2.26)% vs(7.08±4.47)%,P<0.05]。经real-time PCR检测发现,试验组患儿CD4+T细胞中T-bet mRNA下调,IFNG、RORγt、IL-17A、IL-17F mRNA上调,差异均有统计学意义(P<0.05);两组GATA3 mRNA比较,差异无统计学意义(P>0.05)。见表4。分析CD19+CD24hiCD27+Breg与CD4+CD25+Foxp3+Treg相关性,发现两者成正向相关关系(r=0.491,P<0.05),见图1。
3 讨论
哮喘是由气道内的炎症细胞、结构细胞和细胞组分共同参与的慢性炎症性疾病,但其病因及发病机制仍未完全清楚。Breg细胞是一类产生IL-10的B细胞亚群,参与维持体内免疫功能动态平衡[6-9]。
随着Breg在哮喘中的研究不断深入,发现Breg在支气管哮喘中的发病中起重要的负向调节作用[10-13]。有研究报道,通过将局限性吸入耐受(local inhaltional tolerance,LIT)小鼠的肺门淋巴结B细胞过继转移到卵白蛋白(ovalbumin,OVA)致敏小鼠,发现OVA致敏小鼠的组织炎症明显减轻,支气管肺泡灌洗液中白细胞及嗜酸性粒细胞数量减少和气道高反应减轻[12-13]。van der Vlugt等[10]通过对13例过敏性哮喘患者的外周血检测,发现产生IL-10的CD24hiCD27+Breg不仅数量减少而且在受LPS刺激后分泌的IL-10也减少。
Kamekura等[11]在过敏性鼻炎和支气管哮喘的研究中发现过敏性鼻炎患者和过敏性鼻炎合并哮喘的患者外周血中发现Breg的数量比健康对照人群减少,且过敏性鼻炎合并哮喘比过敏性鼻炎Breg的数量减少程度更大。这些研究提示Breg细胞可能在哮喘发病的免疫机制中起着重要作用。近几年在人类Breg细胞的研究主要集中于CD19+CD24hiCD27+Breg细胞[14-15]。本组研究在未加任何丝裂原体外刺激培养,真实反映体内免疫活性细胞活化状态的情况下,观察到试验组急性发作时外周血CD19+CD24hiCD27+Breg细胞比例比正常对照组显著降低(P<0.05)。提示CD19+CD24hiCD27+Breg细胞可能与哮喘的免疫发病机制有关。
Breg细胞主要通过分泌IL-10和表达CD80、CD86发挥直接免疫调节功能。IL-10可抑制树突状细胞(dendritic cells,DC)、MC等细胞的抗原提呈功能、降低MHCⅡ类分子表达及炎性细胞因子分泌,从而抑制T细胞活化[16-17]。应用抗CD80、CD86单克隆抗体可逆转Breg的抑制作用,而预先删除Treg细胞并不影响Breg抑制效果,表明細胞间接触机制可能是Breg介导抑制功能的主要方式之一,但不完全依赖于Treg间接作用[6,8,18]。本组研究发现,哮喘患儿急性发作期外周血Breg细胞上清IL-10及细胞表面CD80、CD86表达显著下调(P<0.05),提示Breg细胞免疫调节功能失调可能是导致哮喘患儿急性发作机制之一。除直接发挥免疫抑制作用外,Breg细胞还可以通过IL-10,和CD80、CD86促进CD4+CD25+Foxp3+ Treg细胞增殖、活化,间接发挥抑制作用[7,18-19]。本研究观察到,试验组外周血CD4+CD25+Foxp3+Treg细胞比例明显降低,与CD19+CD24hiCD27+Breg细胞数量呈正相关关系,提示CD4+CD25+Foxp3+Treg细胞数量及功能异常可能是Breg细胞间接介导急性期哮喘患儿免疫功能紊乱的重要途径。
IL-10可以抑制信号转导和转录活化因子3(signal transducers and activatorsof transcription 3,STAT-3)的磷酸化,导致维甲酸相关孤儿核受体(retinnoid-relatedorphan nuclear receptor,ROR)-γt的表达水平降低,从而抑制了Th-17的分化;IL-10也可以抑制DC分泌IL-6和IL-12,抑制Th-17的分化,阻止抗原提呈,抑制单核细胞及巨噬胞产生促炎因子[20]。本研究发现CD4+T细胞中Th17特异性转录因子RORγt及IL-17A、IL-17F表达均上调的。提示急性期哮喘患儿的Breg比例下降,导致IL-10分泌减少,减少抑制信号转导和STAT-3的磷酸化,导致RORγt的表达水平增高,从而促进了Th-17的分化。间接发挥免疫调节机制。
新近的研究认为Breg也可通过表达TGF-β直接或间接介导部分免疫抑制功能[21],但对于B细胞中产生的TGF-β到底是来源于Breg还是其他亚群目前仍有争议。本研究发现CD19+B细胞中TGF-βmRNA表达上调,与Breg细胞比例下降的结果相反。推测可能是分泌TGF-β的其他亚群细胞在急性期哮喘增加。文献[22]报道人类CD5+Breg亚群可以大量分泌TGF-β,遗憾的是本研究未涉及到该群细胞的分析。因此TGF-β在哮喘患儿Breg功能异常中发挥的作用还有待于进一步研究。
綜上所述,Breg细胞可通过分泌IL-10和表达共刺激分子直接或间接的抑制效应性T细胞活化和炎性细胞因子产生,维持机体免疫平衡。Breg细胞比例降低和功能异常可能是导致急性期哮喘患儿免疫功能异常活化的原因之一。
参考文献
[1]全国儿科哮喘协作组.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51(10):729-735.
[2] Bai J,Zhao J,Shen K L,et al.Current trends of the prevalence of childhood asthma in three Chinese cities:a multicenter epidemiological survey[J].Biomed Environ Sci,2010,23(6):453-457.
[3]苏楠,杨萌,徐静,等.门诊支气管哮喘患者控制现状的调查分析[J].中国呼吸与危重监护杂志,2007,6(2):97-100.
[4] Braman S S.The global burden of asthma[J].Chest,2006,130(1 Suppl):4S-12S.
[5] Douwes J,Gibson P,Pekkanen J,et al.Non-eosinophilic asthma:importance and possible mechanisms[J].Thorax,2002,57(7):643-648.
[6] Evans J G,Chavez-Rueda K A,Eddaoudi A,et al.Novel suppressive function of transitional 2 B cells in experimental arthritis[J].J Immunol,2007,178(12):7868-7878.
[7] Mauri C.Regulation of immunity and autoimmunity by B cells[J].Curr Opin Immunol,2010,22(6):761-767.
[8] Matsushita T,Horikawa M,Iwata Y,et al.Regulatory B cells(B10 cells) and regulatory T cells have independent roles in controlling experimental autoimmune encephalomyelitis initiation and late-phase immunopathogenesis[J].J Immunol,2010,185(4):2240-2252.
[9] Bouaziz J D,Yanaba K,Tedder T F.Regulatory B cells as inhibitors of immune responses and inflammation[J].Immunol Rev,2008,224:201-214.
[10] van der Vlugt L E,Mlejnek E,Ozir-Fazalalikhan A,et al.
CD24hi CD27+ B cells from patients with allergic asthma have impaired regulatory activity in response to lipopolysaccharide[J].ClinExp Allergy,2014,44(4):517-528.
[11] Kamekura R,Shigehara K,Miyajima S,et al.Alteration of circulating type 2 follicular helper T cells and regulatory B cells underlies the comorbid association of allergic rhinitis with bronchial asthma[J].Clin Immunol,2015,158(2):204-211.
[12] Natarajan P,Singh A,McNamara J T,et al.Regulatory B cells from hilar lymph nodes of tolerant mice in a murine model of allergic airway disease are CD5+,express TGF-β,and co-localize with CD4+Foxp3+ T cells[J].Mucosal Immunol,2012,5(6):691-701.
[13] Singh A,Carson W F,Secor E R,et al.Regulatory role of B cells in a murine model of allergic airway disease[J].J Immunol,2008,180(11):7318-7326.
[14] Blair P A,Nore?a L Y,Flores-Borja F,et al.CD19+CD24hiCD38hi B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients[J].Immunity,2010,32(1):129-140.
[15] Iwata Y,Matsushita T,Horikawa M,et al.Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells[J].Blood,2011,117(2):530-541.
[16] Fiorentino D F,Zlotnik A,Mosmann T R,et al.IL-10 inhibits cytokine production by activated macrophages[J].J Immunol,1991,147(11):3815-3822.
[17] Sun C M,Deriaud E,Leclerc C,et al.Upon TLR9 signaling,CD5+B cells control the IL-12-dependent Th1-priming capacity of neonatal DCs[J].Immunity,2005,22(4):467-477.
[18] Blair P A,Nore?a L Y,Flores-Borja F,et al.CD19+CD24hi CD38hi B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients[J].Immunity,2010,32(1):129-140.
[19] Francisco L M,Salinas V H,Brown K E,et al.PD-L1 regulates the development, maintenance, and function of induced regulatory T cells[J].J Exp Med,2009,206(13):3015-3029.
[20] Bolland S.A newily discovered Fc receptor that explains IgG-isotype disparities in effector responses[J].Immunity,2005,23(1):2-4.
[21] Kessel A,Haj T,Peri R,et al.Human CD19+CD25hi B regulatory cells suppress proliferation of CD4+ T cells and enhance Foxp3 and CTLA-4 expression in T-regulatory cells[J].Autoimmun Rev,2012,11(9):670-677.
[22] Lee J H,Noh J,Noh G,et al.Allergen-specific transforming growth factor-β-producing CD19+CD5+ regulatory B-cell(Br3) responses in human late eczematous allergic reactions to cows milk[J].J Interferon Cytokine Res,2011,31(5):441-449.
(收稿日期:2017-03-07) (本文編辑:程旭然)
