基于中红外光谱法快速检测蜂蜜中还原糖的研究
2017-06-08高文佳张海华马雪巍那双俊马占峰
高文佳 张海华 马雪巍 张 莹 那双俊 刘 欣 马占峰
(哈尔滨市产品质量监督检验院,哈尔滨150090)
基于中红外光谱法快速检测蜂蜜中还原糖的研究
高文佳 张海华 马雪巍 张 莹 那双俊 刘 欣 马占峰
(哈尔滨市产品质量监督检验院,哈尔滨150090)
目前蜂蜜的还原糖测定方法主要有滴定法、液相色谱法、气相色谱法等。传统化学检测方法费时、费力,因此无法做到快速、无损检测。中红外光谱技术具有快速、简便、无样品预处理、无损伤等特点,现已成为国内外的研究重点。本研究采用中红外光谱技术,利用偏最小二乘法建立模型,结合高效液相色谱法测定的蜂蜜中果糖和葡萄糖的检测结果。采用主成分分析和PLS的方法,建立和优化蜂蜜果糖和葡萄糖的快速检测模型,实现蜂蜜还原糖的快速检测。
中红外光谱技术;蜂蜜;果糖;葡萄糖;高效液相色谱法
蜂蜜是指蜜蜂采集植物的花蜜或者分泌物经自身含有的特殊物质进行充分酿造而成的甜味物质,蜂蜜中主要成分是糖类物质,约占蜂蜜的3/4,其中果糖和葡萄糖含量最高,其次是蔗糖、麦芽糖、曲二糖等,还有蛋白质、氨基酸、有机酸、维生素等多种对人体有益的营养成分。现有国家标准对蜂蜜中果糖、葡萄糖、蔗糖给出了明确的限量规定。由于利益的驱使,蜂蜜掺杂、使假一直是我国蜂产品行业存在的重要问题[2]。现阶段蜂蜜的还原糖测定方法主要有滴定法、液相色谱法、气相色谱法等,传统化学检测方法费时、费力,因此无法做到快速、无损检测[1]。中红外光谱技术具有快速、简便、无样品预处理、无损伤等特点,并结合化学计量学方法提取光谱有效信息进行样品定性或定量分析被应用到很多领域[3],尤其在食品的无损检测方面显现出巨大优势,现已成为国内外的研究重点。本研究采用中红外光谱技术,采用化学计量学的方法[4],结合液相色谱测得蜂蜜中果糖和葡萄糖的检测结果,利用主成分分析和PLS的方法[5],建立和优化蜂蜜果糖和葡萄糖的快速检测模型[6],实现蜂蜜糖分的快速检测。
1 材料与方法
1.1 样品与试剂
本研究通过调研,找出不同蜜种的分布区域,从2013年开始连续到全国多个区域采集蜂蜜真实样本,共采集蜂蜜真实样本一千余批次,蜜种包括椴树蜜、槐花蜜、枣花蜜、油菜蜜、荆条蜜、百花蜜和其他一些蜜种,采样区域覆盖山东、辽宁、黑龙江、广东、广西等二十个省份。
D-果糖标准品:Purity≥99%,美国 SIGMAALDRICH公司;D-葡萄糖标准品:Purity 99.9%,美国SUPELCO公司;乙腈(色谱纯),一级水,符合GB/ T6682规定。
1.2 主要设备与仪器
中红外福斯光谱分析仪:MilkoScan FT120型,丹麦FOSS公司;液相色谱仪,配示差折光检测器:waters 2695型,美国waters公司;超纯水机:Milli-Q Advantage型,美国密理博公司;电子天平:梅特勒AL104型,美国梅特勒-托利多公司;磁力搅拌器:RO10型,德国IKA公司。
1.3 样品光谱采集法
1.3.1 样品的制备
对所有待测蜂蜜样品进行编号处理,并进行详细记录。对存在结晶现象的样品于50℃水浴锅中进行加热,直至样品中无结晶现象为止。精确称取待测样品10g(±0.05 g)于100 ml烧杯中,加入30 ml去离子水,放入磁子。将烧杯置于磁力搅拌器上搅拌,设定温度为30℃,搅拌8分钟。待样品均一后,转移至50 ml比色管中,并用去离子水清洗烧杯,全部转移至比色管中,定容至刻度。摇匀静置后待检。
1.3.2 样品扫描
测量前,预热中红外光谱分析仪,对仪器进行标准化,测试前进行清洗和调零。将选定的146个样品,按设定好的仪器条件进行红外检测,每个样品均检测两次,每次进样量为8 ml,取两次平均值作为样品的原始光谱。利用校正集合建立PLS模型后,对验证集合的样品进行扫描,验证模型的预测准确性。
1.4 蜂蜜中果糖、葡萄糖、蔗糖含量的测定
蜂蜜的果糖、葡萄糖含量按照国标 GB/T 18932.22-2003《蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法-液相色谱示差折光检测法》测定。
1.5 PLS定标模型的建立
将上述选定的146个样品的红外光谱数据建立正常样品集合,在集合分别增加果糖、葡萄糖和蔗糖的参数,输入液相色谱测得的结果作为真值(中红外扫描时样品经过5倍稀释),选择具有较强吸收的特征波段,打开蜂蜜成分快速检测模块,对相应的检测项目采用PLS定标方式定标,选择交互验证误差最小时对应的主成分数,建立最优的蜂蜜成分快速检测模型。
2 结果与讨论
2.1 定标波段的选择
采用主成分分析的方法,按照PLS定标程序选择确定的模块,选择最佳红外吸收的15个波段。
2.2 中红外光谱分析模型的建立
采用偏最小二乘法建立多元统计模型。校正模型的最佳因子个数由舍一交互验证法(leave-one-out)确定,计算出不同主因子数对应的Cross Validation Error交互验证误差 (交互验证误差)值和RESECV(root mean square errorof cross validation交叉验证均方差),然后以最小的交互验证误差值所对应的因子数作为模型的最佳因子数。图1显示了Norris平滑后葡萄糖PLS模型中Cross Validation Error值随PLS因子变化的趋势,随着PLS因子数的增加,PRESS逐渐降低,当PLS主成分因子达到6时,交互验证误差最小,当PLS主成分因子数大于6时,PLS模型拟合了部分噪声信息,导致交互验证误差值逐渐增大。因此,蜂蜜葡萄糖PLS模型的最佳主成分因子数为6。
图1中横坐标为模型和选择的主成分因子Factor数,纵坐标为Cross Validation Error(交互验证误差)值。
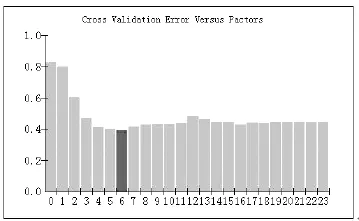
图1 Norris平滑后Cross Validation Error值和PLS主成分因子关系图
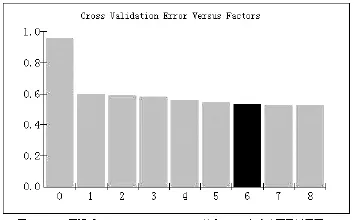
图2 Norris平滑后Cross Validation Error值和PLS主成分因子关系图
图2显示了Norris平滑后果糖PLS模型中Cross Validation Error值随PLS因子变化的趋势,随着PLS因子数的增加,PRESS逐渐降低,当PLS主成分因子达到6时,交互验证误差最小,当PLS主成分因子数大于6时,PLS模型拟合了部分噪声信息,导致交互验证误差值逐渐增大。因此,蜂蜜果糖PLS模型的最佳主成分因子数为6。
图2中横坐标为模型和选择的主成分因子Factor数,纵坐标为Cross Validation Error(交互验证误差)值。
2.3 PLS模型预测结果分析
2.3.1 葡萄糖PLS模型的预测值与液相色谱结果对照
146个检测蜂蜜样本中,葡萄糖PLS模型的预测值与手工输入的液相色谱结果(视为真值)对比情况见图3和图4。图3中横坐标代表葡萄糖的预测结果,纵坐标代表预测结果与真值之间的残差。图4为葡萄糖预测结果的部分截取图。
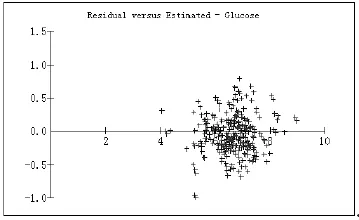
图3 葡萄糖预测值与真值之间的残差散点分布图
2.3.2 果糖PLS模型的预测值与液相色谱结果对照
146 个检测蜂蜜样本中,果糖PLS模型的预测值与手工输入的液相色谱结果(视为真值)对比情况见图5和图6。图3中横坐标代表果糖的预测结果,纵坐标代表预测结果与真值之间的残差。图6为果糖预测结果的部分截取图。
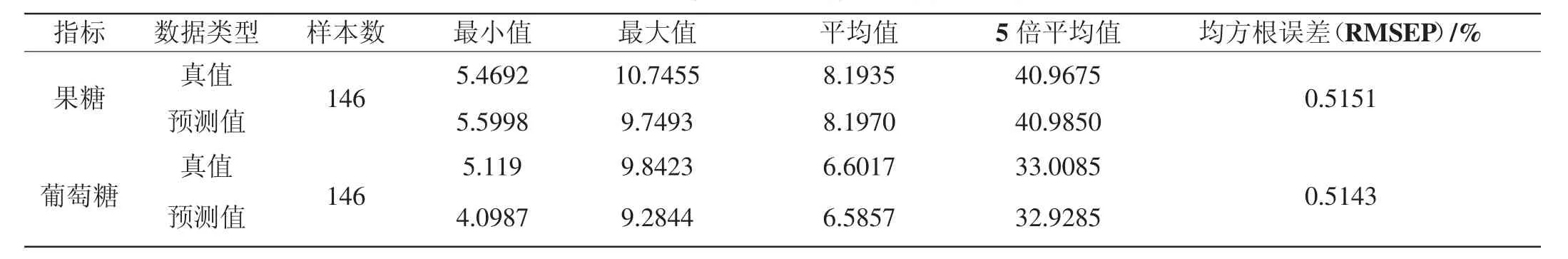
表1 PLS定标模型的预测情况同行估计结果表
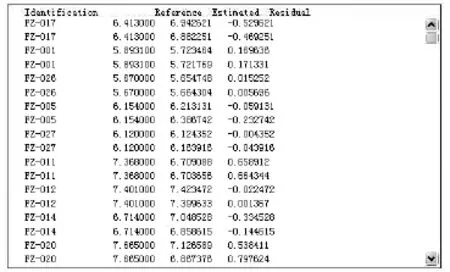
图4 葡萄糖预测值与真值的残差截取图
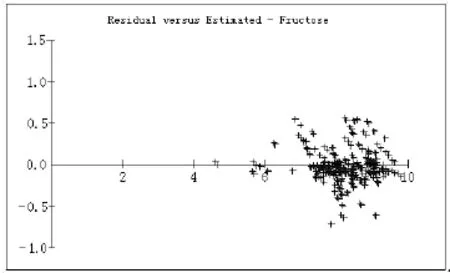
图5 果糖预测值与真值之间的残差散点分布图
参与品定量分析样品的含量应能涵盖待测样品的成分范围。将所有样本的预测值和真值作比较,分析对比数据见表1(本实验样品严格按照5倍质量比稀释,所得结果乘以5为蜂蜜中果糖和葡萄糖含量的真实值)。
对于建立的模型,交互验证均方差RMSECV越小,说明所提取的光谱信息与分析组分的相关性越好,所得到的模型的预测能力也就越好。通过表1可以看出,预测模型经过平滑、求导等处理方式后,交叉验证均方根误差分别为0.5151%和0.5143%,数值较小,说明模型可以很好地预测蜂蜜中果糖和葡萄糖的含量。
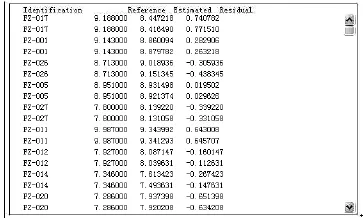
图6 果糖预测值与真值的残差截取图
2.4 结论
采用中红外光谱技术对蜂蜜中果糖和葡萄糖进行检测,检测速度快,检测成本低,污染小,而且能达到满意的检测精度。同时,采用Norris平滑、一阶导数、二阶导数等数据预处理方法,对利用中红外光谱法定量检测蜂蜜中的果糖和葡萄糖起到重要作用。试验模型中包含了来自多个省份的十几种蜂蜜样品,不同的地理位置和不同的植物来源都会对光谱产生影响,样品的合理选择使得模型具有更加广泛的适用性。
中红外光谱技术可以满足蜂蜜检测质量控制需求,是适合蜂蜜果糖和葡萄糖检测和质量控制的高效检测技术。
[1]史建国,马耀宏,杨艳,等.蜂蜜中还原糖的快速测定技术[J].山东科学,2004,17(2):30-32.
[2]赵延华,刘成雁,韩旭,等.傅里叶变换红外光谱法快速鉴别掺假蜂蜜[J].PTCA,2012,48(2):136-139.
[3]李水芳,朱向荣,单杨,等.中/近红外光谱技术结合化学计量学在蜂蜜快速检测中的应用研究进展 [J].食品与机械,2009,25(5): 121-124.
[4]张欣,单杨,李水芳.基于多元散射校正和偏最小二乘(MSC/ PLS)的傅里叶变换近红外光谱检测蜂蜜中还原糖[J].食品与机械,2009,25(6):109-112.
[5]许伟坚,周剑杨.基于PLS/Sugar预言的RISC模块验证[J].厦门大学学报,2005,44(3):337-340.
[6]褚小立,王艳斌,陆婉珍.近红外光谱定量校正模型的建立及应用[J].理化检验(化学分册),2008,44(08):796-800.
马占峰,E-mail:tct1998@163.com
