乙烯和水杨酸信号转导在拟南芥对聚乙二醇胁迫应答中的相互作用
2017-06-07李光哲李玲美姚展鹏柳福丹
李光哲, 李玲美, 姚展鹏, 柳福丹
(1. 沈阳师范大学 生命科学学院, 沈阳 110034; 2. 沈阳师范大学 化学化工学院, 沈阳 110034)
乙烯和水杨酸信号转导在拟南芥对聚乙二醇胁迫应答中的相互作用
李光哲1, 李玲美2, 姚展鹏1, 柳福丹1
(1. 沈阳师范大学 生命科学学院, 沈阳 110034; 2. 沈阳师范大学 化学化工学院, 沈阳 110034)
前期研究显示,乙烯缺失或信号转导阻断促进植物对干旱胁迫的耐受性。发现拟南芥乙烯信号转导阻断突变体对聚乙二醇模拟的干旱胁迫耐受性与水杨酸信号转导相关。在6%及以上浓度的聚乙二醇胁迫下,拟南芥乙烯不敏感突变体ein2-1植株表现出较野生型植株更强的耐受性,但乙烯和水杨酸信号转导阻断双突变体ein2-1/npr1-1植株表现出较野生型植株更加敏感的特性。在聚乙二醇胁迫下,与野生型植株相比,ein2-1植株的相对含水量、光合作用相关参数、脯氨酸含量以及抗氧化酶活性更高,而过氧化氢含量和脂质过氧化水平更低。然而,上述参数在ein2-1/npr1-1植株中的表现较野生型植株更差。这些数据表明,乙烯不敏感突变介导的聚乙二醇耐受性需要水杨酸信号转导递体NPR1的生物学作用。
水杨酸; 乙烯; 信号转导; 拟南芥;聚乙二醇
0 引 言
干旱胁迫影响植物生长与发育的几乎所有阶段,是农业生产的主要限制因子。在长期进化过程中,陆生植物在多方面发展了适应干旱的机制,如在形态与结构上的适应性变化[1-2],生理和生化代谢方面的适应性变化等[3-4]。在植物对干旱应答过程中,乙烯和水杨酸起重要的调节作用[5]。例如,乙烯生物合成的抑制或信号转导阻断促进植物对干旱胁迫的耐受性[6]。相反,外施乙烯降低植物对干旱的耐受性[7]。因此,乙烯在植物对干旱胁迫应答中起负调控作用,但对其作用机理仍有待阐明。研究表明,外源水杨酸促进植物对干旱胁迫的耐受性[8]。有研究表明乙烯信号转导与水杨酸信号转导在植物对生物或非生物逆境胁迫应答中具有相互作用机制,如对病原体的应答[9]和Al3+胁迫的应答[10]。然而,在植物对干旱胁迫的应答中有关二者相互作用还未见报道。本文以乙烯信号转导不敏感突变体ein2-1、水杨酸信号转导不敏感突变体npr1-1以及二者的杂交组合ein2-1/npr1-1双突变体为材料,探讨乙烯信号转导与水杨酸信号转导在拟南芥植株对聚乙二醇模拟的干旱胁迫应答中可能的相互作用机理。结果显示,乙烯不敏感突变介导的聚乙二醇耐受性需要水杨酸信号转导递体NPR1的生物学作用。
1 实验材料与方法
1.1 实验材料
拟南芥生态型哥伦比亚(Arabidopsisthalianaecotype Columbia)野生型及其突变体ein2-1、npr1-1和ein2-1/npr1-1种子分别由Dong教授(美国杜克大学)和Pieterse教授(荷兰乌特勒支大学)提供。种子经0.1%(w/v)次氯酸钠表面消毒5 min,自来水冲洗后置于4 ℃冰箱中处理2 d。播种于自制的培养装置中,培养基质为1/2的Hoagland溶液(pH6.2)。培养条件为:光辐射量100 μmol m-2s-1,光周期为14 h光照、10 h黑暗,温度为22 ℃(光下)/18 ℃(黑暗),相对含水量为70%。发芽20 d后移苗至分别含有终浓度为0、3、6和9%(w/v)聚乙二醇6 000的1/2强度Hoagland培养液中。除文中特别说明外,处理7 d后用于生理生化指标测定。与聚乙二醇胁迫处理同步进行土壤脱水处理,方法为土壤中生长20 d后停止浇水生长14 d,然后再复水生长5 d。
1.2 植物生长及相对含水量的测定
为了评价聚乙二醇对植株生长的影响,延长胁迫处理至14 d。将植株置于80 ℃的烘箱中干燥48 h,称重得植株干重。植株相对干重表示为聚乙二醇处理的植株干重占各自未处理植株干重的百分比。相对含水量的测定:收集各处理的植株,用滤纸吸干表面水分,称重得鲜重(FW),然后将植株浸入冰中预冷的水中静置10 h,取出后用滤纸吸干表面的水分并称重得水饱和重量(HW),再将植株置入80 ℃的烘箱中干燥48 h,称重得干重(DW)。相对含水量(RWC)=(FW-DW)/(HW-DW)×100%。
1.3 生理生化指标测定
净光合速率的测定采用便携式光合测量仪(LI-6200, LI-COR, Lincoln, NE, USA),配用拟南芥专用叶室(LI-6400-17),测量过程中的环境温度为25 ℃,光照度为150 μmolm-2s-1。叶绿素荧光参数的测定采用便携式荧光测量仪(Handy-PEA, Hansatech, Norfolk, UK),具体操作方法与结果计算见文献[11]。过氧化氢含量的测定方法见文献描述[11]。丙二醛含量的测定见文献描述[12]。
抗氧化酶的提取:收集新鲜叶片,在研钵中加液氮研磨成粉末,悬浮于5 ml冰浴中预冷的抽提液中。抽提液的组成为:50 mM磷酸缓冲液(pH 7.8),0.1 mM EDTA,1%(v/v) Triton X-100和4%(w/v)聚乙烯吡咯烷酮。悬浮液于冰浴中静置10 min,于4 ℃、12 000 g离心15 min,上清液即为粗酶提取液,用于测定超氧化物歧化酶[13]、过氧化物酶[14]和过氧化氢酶[15]活性。抗氧化酶同工酶凝胶电泳方法见文献[16]。还原型谷胱甘肽和氧化型谷胱甘肽以及脯氨酸含量的测定见文献[11]。
本文中的数据均为3次独立实验的平均值,表示为平均值±标准差。显著性差异(P<0.05)分析采用one-way ANOVA,SAS软件(SAS Institute, Cary, NC, USA)。
2 结果与分析
2.1 植物生长与相对含水量
聚乙二醇以剂量-效应关系抑制所有供试植株的生长,然而在6%及以上浓度下,ein2-1植株表现出比野生型植株更强的耐受性,而ein2-1/npr1-1植株比野生型更加敏感(图1a)。虽然npr1-1植株也表现出比野生型对聚乙二醇胁迫更高的敏感性,但其敏感程度远低于ein2-1/npr1-1植株(图1a)。聚乙二醇处理引起供试植株叶片卷曲、某些成熟叶片萎蔫、脱绿、甚至死亡(图1b)。在土培实验中,脱水14天导致所有植株严重萎蔫,但接下来复水5 d后,ein2-1植株完全恢复到正常,野生型和npr1-1植株有大部分恢复,而ein2-1/npr1-1植株中只有一小部分恢复(图1b)。聚乙二醇胁迫降低了所有供试植株的相对含水量(图1c),且在基因型之间的变化趋势与上述的植株生长变化趋势完全一致,表明聚乙二醇引发的相对含水量降低是抑制植株生长的主要因素。这些数据显示,乙烯信号转导阻断介导的植物对聚乙二醇耐受性机制依赖于水杨酸信号转导递体NPR1的生物学作用。

(a) 聚乙二醇胁迫14 d后的植株相对生物量;(b) 3%聚乙二醇处理14 d后植株表型(上)和土壤脱水处理14 d后复水处理5 d的植株表型(下);(c) 在供试浓度的聚乙二醇处理7 d后各种基因型植株的相对含水量。图中每一个数据均为3次独立实验的平均值±标准差,n=3,不同的小写字母表示具有显著性差异(P<0.05),下同。
2.2 过氧化氢与丙二醛含量、抗氧化酶活性
随着聚乙二醇浓度的加大,所有供试基因型植株的过氧化氢和丙二醛含量随之增加(图2)。然而,ein2-1突变体的增加幅度显著低于野生型植株,而ein2-1/npr1-1植株则高于野生型,尤其是在6%及以上浓度的聚乙二醇胁迫下(图2)。
在聚乙二醇胁迫下,野生型、npr1-1和ein2-1植株的超氧化物歧化酶和过氧化物酶增加,但ein2-1/npr1-1植株的上述2种酶活性则降低,这些酶活性的增加或降低均与聚乙二醇的供试浓度呈正相关(图2)。随着聚乙二醇浓度增加,野生型、ein2-1/npr1-1和npr1-1植株的过氧化氢酶活性逐渐降低,但ein2-1植株的过氧化氢酶活性在3%和6%聚乙二醇胁迫下增加,只有在9%的聚乙二醇胁迫下才低于对照(图2e)。聚乙二醇引发的抗氧化酶活性的变化也反映在它们的同工酶表达水平上(图2f)。在所有供试基因型中共检测到4条超氧化物歧化酶同工酶带,其中npr1-1植株含有带Ⅱ~Ⅳ,不含带Ⅰ,而其他3种基因型植株含有所有4条带。带强度的变化趋势与上述通过分光光度计检测的酶活性变化趋势基本一致。在每一种供试基因型中均检测到4条过氧化物酶同工酶带,其中带Ⅲ为主带,其在同一种基因型或在不同基因型之间的变化趋势与其分光光度计测得的变化趋势基本一致。在本研究中,只检测到1条过氧化氢酶同工酶带,其强度的变化趋势也与溶液测得的的酶活性大体上一致。聚乙二醇以依赖于供试浓度的方式降低所有基因型的还原型谷胱甘肽含量以及还原型谷胱甘肽与氧化型谷胱甘肽的比值(图3),同样,这2个指标的变化趋势与聚乙二醇胁迫下植物生长变化趋势一致(图1a)。
上述数据表明,ein2-1介导的聚乙二醇耐受性与其增加的抗氧化酶活性进而清除过量活性氧含量有关。已有研究显示,拟南芥乙烯不敏感突变体ein2-1表现出较野生型植株对重金属Cd胁迫更强的耐受性,且与降低的氧化胁迫伤害相关[17]。课题组前期的研究表明,该突变体明显增强了对Al3+胁迫的耐受性,且与提高的抗氧化能力相关[10]。这些结果预示着在逆境胁迫条件下,乙烯信号转导加强了植株的氧化胁迫伤害。在有关水杨酸的研究中,有报道表明,植株对干旱胁迫的耐受性与内源水杨酸水平和/或信号转导相关[11,18-19]。水杨酸介导植物对干旱胁迫耐受性的机理可能与气孔关闭、提高的抗氧化能力或降低的氧化胁迫伤害等相关[11,19-21]。很明显,本研究结果表明,作为水杨酸信号转导途径中唯一的正调节因子,NPR1-1在ein2-1介导的抗氧化防卫应答中起正调节作用。
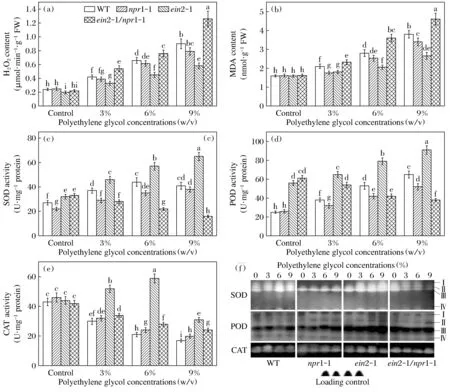
(a) 叶片过氧化氢含量; (b) 叶片丙二醛含量; (c) 叶片超氧化物歧化酶活性; (d) 叶片过氧化物酶活性;(e) 叶片过氧化氢酶活性; (f) 3种抗氧化酶同工酶表达图谱,其中蛋白质加样量为每泳道10 μg,加样量对照以考马斯亮蓝G-250染色显示。
聚乙二醇胁迫显著促进所用供试植株的脯氨酸积累,尤其是在6%及以上胁迫浓度下(图3c)。同样,ein2-1植株的脯氨酸积累量是所有供试基因型中最高的,而双突变体ein2-1/npr1-1则明显低于野生型植株。已有许多研究表明,在干旱胁迫下,细胞中脯氨酸含量与相对含水量呈正相关。例如,在干旱胁迫下,棉花耐受性品种的相对含水量显著高于其敏感性品种,同时,前者脯氨酸含量较后者高10倍以上[22]。相似的结果也在拟南芥野生型及其干旱耐受性转基因系中发现[23]。本研究的数据进一步证明脯氨酸积累在植株对聚乙二醇应答过程中起正调节作用。除了具有重要的渗透调节作用外,在细胞中脯氨酸也是一致重要的自由基清除剂和信号转导分子,参与活性氧脱毒、保护细胞膜以及稳定酶和蛋白质的功能[24]。在植物对逆境胁迫的应答中,脯氨酸的生物合成受水杨酸或乙烯的调控,或正调节或负调节[24-26]。本研究结果显示,在聚乙二醇胁迫下,乙烯不敏感突变体ein2-1植株的脯氨酸高积累需要有NPR蛋白的存在,因为在npr1-1遗传背景下,ein2-1介导的脯氨酸积累量被显著逆转。
随着聚乙二醇胁迫浓度的增大,所有供试基因型植株的净光合速率、最大光化学效率和实际光化学效率均逐渐降低(图3d~图3f)。相似地,与野生型植株相比,ein2-1植株受影响较小,而ein2-1/npr1-1植株降低幅度更大,npr1-1植株处于中间水平。在干旱胁迫下,光合速率是受影响最大的生物学过程之一,其中有气孔因素和非气孔因素[27]。非气孔因素的影响主要包括光和器官受损、光反应和暗反应相关的酶活性失活等[28]。在胁迫条件下,叶绿素荧光参数如最大光化学效率和实际光化学效率是衡量光系统II受损伤程度的重要指标[29]。很明显,本研究表明,ein2-1对聚乙二醇的耐受性与其维持较高水平的叶绿素荧光参数有关,这同样依赖于NPR1的生物学功能。
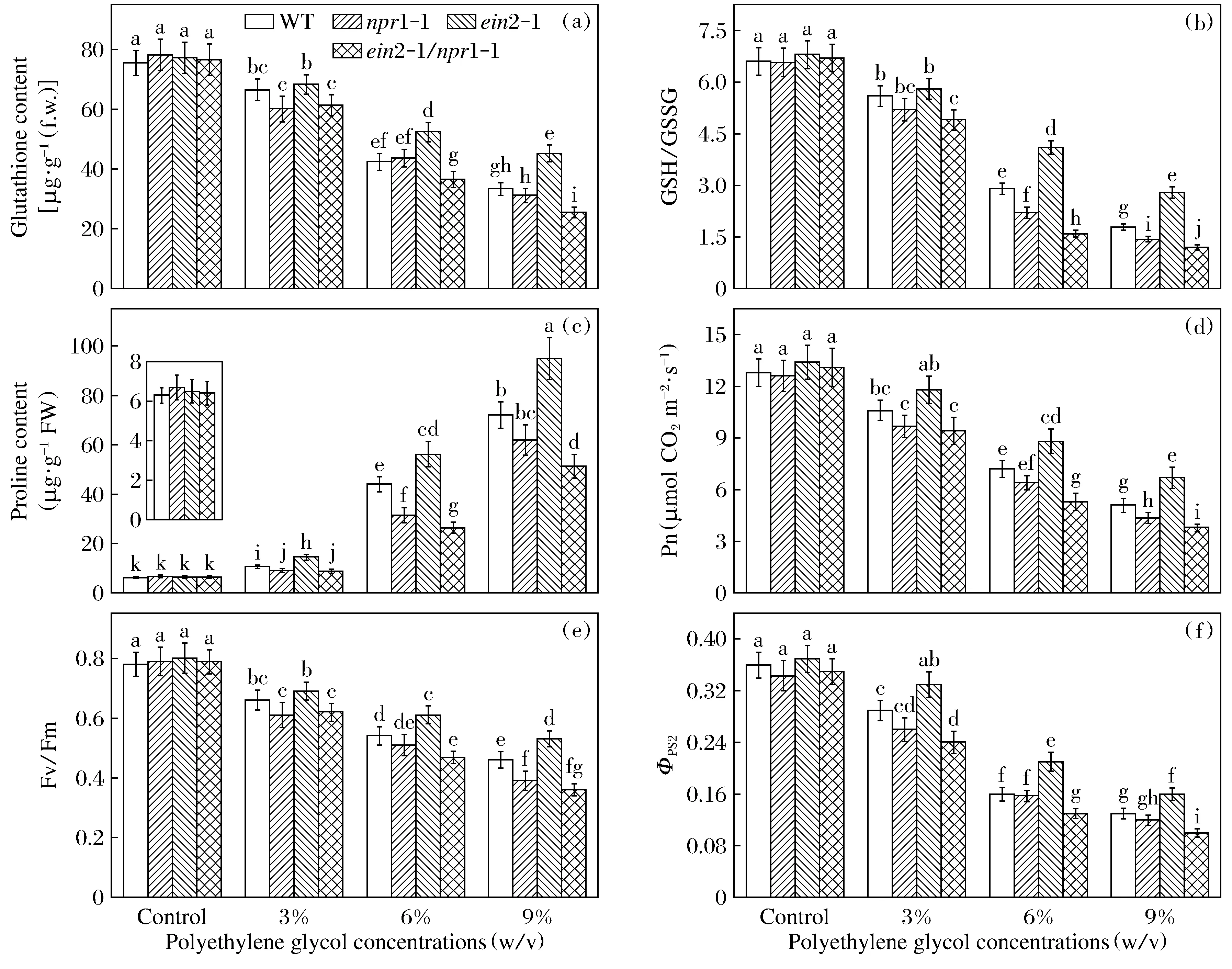
(a) 还原型谷胱甘肽含量; (b) 还原型与氧化型谷胱甘肽比值; (c) 脯氨酸含量;(d) 净光合速率; (e) 最大光化学效率; (f) 实际光化学效率。
3 结 论
本研究揭示了乙烯信号转导不敏感突变介导的拟南芥植株对聚乙二醇胁迫耐受性依赖于水杨酸信号转导中间递体NPR1的存在,具体反映在植株的生长、抗氧化防卫应答、脯氨酸积累以及光合作用相关过程等。进一步在分子水平上的研究将有助于阐明乙烯与水杨酸信号转导相互作用机制。
[ 1 ]MOORE J P, VICRÉ-GIBOUIN M, FARRANT J M, et al. Adaptations of higher plant cell walls to water loss: drought versus desiccation[J]. Physiol Plant, 2008,34(2):237-245.
[ 2 ]LAWLOR D W. Genetic engineering to improve plant performance under drought: physiological evaluation of achievements, limitations, and possibilities[J]. J Exp Bot, 2013,64(1):83-108.
[ 3 ]REDDY A R, CHAITANYA K V, VIVEKANANDAN M. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J]. J Plant Physiol, 2004,161(11):1189-1202.
[ 4 ]VALLIYODAN B, NGUYEN H T. Understanding regulatory networks and engineering for enhanced drought tolerance in plants[J]. Curr Opin Plant Biol, 2006,9(2):189-195.
[ 5 ]FAHAD S, HUSSAIN S, BANO A, et al. Potential role of phytohormones and plant growth-promoting rhizobacteria in abiotic stresses: consequences for changing environment[J]. Environ Sci Pollut Res Int, 2015,22(7):4907-4921.
[ 6 ]SHI J, HABBEN J E, ARCHIBALD R L, et al. Overexpression ofARGOSgenes modifies plant sensitivity to ethylene, leading to improved drought tolerance in both Arabidopsis and maize[J]. Plant Physiol, 2015,169(1):266-282.
[ 7 ]MUNNÉ-BOSCH S, PENUELAS J, ANSENIO D, et al. Airborne ethylene may alter antioxidant protection and reduce tolerance of Holm oak to heat and drought stress[J]. Plant Physiol, 2004,136(2):2937-2947.
[ 8 ]KHAN M I R, FATMA M, PER T S, et al. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants[J]. Front Plant Sci, 2015,6:462.
[ 9 ]CLARKE J D, VOLKO S M, LEDFORD H, et al. Roles of salicylic acid, jasmonic acid, and ethylene incpr-induced resistance in Arabidopsis[J]. Plant Cell, 2000,12(11):2175-2190.
[10]ZHANG Y Y, HE Q Q, ZHAO S Y, et al. Arabidopsisein2-1 andnpr1-1 response to Al stress[J]. Bull Environ Contam Toxicol, 2014,93(1):78-83.
[11]HE Q Q, ZHAO S Y, MA Q F, et al. Endogenous salicylic acid levels and signaling positively regulate Arabidopsis response to polyethylene glycol-simulated drought stress[J]. J Plant Grow Regul, 2014,33(4):871-880.
[12]SHALATA A, TAL M. The effect of salt stress on lipid peroxidation and antioxidants in the leaf of the cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii[J]. Physiol Plant, 1998,104(2):167-174.
[13]BEYER W F, FRIDOVICH I. Assaying for superoxide dismutase activity: some large consequences of minor changes in conditions[J]. Anal Biochem, 1987,161:559-566.
[14]HEMEDA H M, KLEIN B P. Effects of naturally occurring antioxidants on peroxidase activity of vegetable extracts[J]. J Food Sci, 1990,55(1):184-185.
[15]AEBI H E. Catalase. BERGMEYER H U (ed) Methods of enzymatic analyses[M]. Weinheim: Verlag Chemie, 1983:273-282.
[16]HAO L, ZHAO Y, JIN D, et al. Salicylic acid-altering Arabidopsis mutants response to salt stress[J]. Plant Soil, 2012,354:81-95.
[17]SCHELLINGEN K, VAN DER S D, REMANS T, et al. Ethylene signalling is mediating the early cadmium-induced oxidative challenge inArabidopsisthaliana[J]. Plant Sci, 2015,239:137-146.
[18]CHINI A, GRANT J J, SEKI M, et al. Drought tolerance established by enhanced expression of the CC-NBSLRR gene, ADR1, requires salicylic acid, EDS1 and ABI1[J]. Plant J, 2004,38(5):810-822.
[19]MIURA K, OKAMOTO H, OKUMA E, et al. SIZ1 deficiency causes reduced stomatal aperture and enhanced drought tolerance via controlling salicylic acid-induced accumulation of reactive oxygen species in Arabidopsis[J]. Plant J, 2013,73(1):91-104.
[20]KANG G, LI G, XU W, et al. Proteomics reveals the effects of salicylic acid on growth and tolerance to subsequent drought stress in wheat[J]. J Proteome Res, 2012,11(12):6066-6079.
[21]ALAM M M, HASANUZZAMAN M, NAHAR K, et al. Exogenous salicylic acid ameliorates short-term drought stress in mustard (BrassicajunceaL.) seedlings by up-regulating the antioxidant defense and glyoxalase system[J]. Aust J Crop Sci, 2013,7:1053-1063.
[22]SINGH R, PANDEY N, NASKAR J, et al. Physiological performance and differential expression profiling of genes associated with drought tolerance in contrasting varieties of twoGossypiumspecies[J]. Protoplasma, 2015,252:423-438.
[23]TAMIRISA S, VUDEM DR, KHAREEDU V R. Overexpression of pigeonpea stress-induced cold and drought regulatory gene (CcCDR) confers drought, salt, and cold tolerance inArabidopsis[J]. J Exp Bot, 2014,65(17):4769-4781.
[24]IQBAL N, UMAR S, KHAN N A, et al. A new perspective of phytohormones in salinity tolerance: regulation of proline metabolism[J]. Environ Exp Bot, 2014,100:34-42.
[25]YUSUF M, HASAN S A, ALI B, et al. Effect of salicylic acid on salinity induced changes in Brassica juncea[J]. J Integr Plant Biol, 2008,50(9):1-4.
[26]KHAN M I R, NAZIR F, ASGHER M, et al. Selenium and sulfur influence ethylene formation and alleviate cadmium-induced oxidative stress by improving proline and glutathione production in wheat[J]. J Plant Physiol, 2014,173:9-18.
[27]FLEXAS J, MEDRANO H. Drought-inhibition of photosynthesis in C3plants: stomatal and non-stomatal limitations revisited[J]. Ann Bot, 2002,89(2):183-189.
[28]GHOTBI-RAVANDI A A, SHAHBAZI M, SHARIATI M, et al. Effects of mild and severe drought stress on photosynthetic efficiency in tolerant and susceptible barley (HordeumvulgareL.) genotypes[J]. J Agron Crop Sci, 2014,200:403-415.
[29]MEGDICHE W, HESSINI K, GHARBI F, et al. Photosynthesis and photosystem 2 efficiency of two saltadapted halophytic seashoreCakilemaritimaecotypes[J]. Photosynthetica, 2008,46(3):410-419.
Interaction between ethylene-and salicylic acid-signaling in Arabidopsis response to polyethylene glycol stress
LI Guangzhe1, LI Lingmei2, YAO Zhanpeng1, LIU Fudan1
(1. College of Life Sciences, Shenyang Normal University, Shenyang 110034, China; 2. College of Chemistry and Chemical Engineering, Shenyang Normal University, Shenyang 110034, China)
Early researches have demonstrated that ethylene (ET) deficiency or signaling insensitivity improves plant tolerance to drought stress. Here, we report that ET-mediated plant response to polyethylene glycol (PEG)-simulated drought stress could be connected to salicylic acid (SA) signaling. Under exposure to 6% (w/v) and higher concentrations of PEG, Arabidopsisein2-1 plants (ET insensitivity) exhibited a significant tolerance, whereas theein2-1/npr1-1 plants (double mutant with both ET-and SA-signaling insensitivity ) suffered a severe damage, as compared with wild-type (WT) plants. Under the stress conditions,ein2-1 plants had a higher level in relative water content, photosynthesis-related performance, proline content, and antioxidative capacity, but a lower level in H2O2production and lipid peroxidation. However, these not only were reversed, but even worse inein2-1/npr1-1 plants than in WT plants. This suggested that the NPR1 functions were required forein2-1-mediated Arabidopsis tolerance to drought stress.
salicylic acid; ethylene; signaling; Arabidopsis; polyethylene glycol
1673-5862(2017)02-0214-06
2017-03-09。
国家自然科学基金资助项目(31570502)。
李光哲(1966-),男,吉林蛟河人,沈阳师范大学教授,博士。
Q89
A
10.3969/ j.issn.1673-5862.2017.02.018
