聚乙烯亚胺/戊二醛交联法固定化重组酯酶大肠杆菌细胞
2017-06-07郑建永李天一
郑建永,李天一,张 伟,汪 钊
(浙江工业大学生物工程学院浙江省生物有机合成技术研究重点实验室,浙江杭州310014)
聚乙烯亚胺/戊二醛交联法固定化重组酯酶大肠杆菌细胞
郑建永,李天一,张 伟,汪 钊
(浙江工业大学生物工程学院浙江省生物有机合成技术研究重点实验室,浙江杭州310014)
利用聚乙烯亚胺/戊二醛交联法对重组酯酶大肠杆菌E.coliBL21细胞进行固定化研究,并对交联工艺条件进行优化。结果表明:在大肠杆菌细胞质量浓度200 g/L、硅藻土质量浓度2 g/L、聚乙烯亚胺(PEI)体积分数3%、交联时间1.5 h、戊二醛(GA)体积分数0.5%以及交联时间0.5 h时,固定化细胞的酯酶活力最高。固定化细胞的最适反应温度和pH分别为45 ℃和8.0,且温度稳定性和pH稳定性均高于游离细胞。当底物浓度为300 mmol/L时,固定化细胞重复使用15批次后,其相对酶活仍能保留在80%以上。因此,该固定化细胞具有良好的操作稳定性。
聚乙烯亚胺;戊二醛;固定化;交联;酯酶
细胞的固定化,就是利用化学或物理的方法将游离细胞定位于限定的空间区域内,使其不溶于水且能保持生物活性,而且可反复利用的手段[1]。常见的细胞固定化方法有吸附法、包埋法、共价法和交联法四大类[2]。交联法又称为无载体固定法,是通过微生物与具有两个或两个以上官能团的试剂反应,使微生物菌体相互连接成网状结构而达到固定化的目的[3]。常见的交联剂是戊二醛。该技术具有以下特点:对酶纯度要求不高,不需要结晶等复杂步骤;获得的固定化酶稳定性好,活性高;成本低廉,设备简单;无需其他载体,且单位体积活性大,空间效率高。
酯酶(esterase,EC3.1.1.X)是一类催化酯键(羧酯键、酰胺键和硫酯键等)水解和合成的酶的总称,在动植物和微生物中普遍存在,动物胰脏酯酶和微生物酯酶是酯酶的主要来源[4]。利用酯酶在有机相中的酯交换或酯化功能对制备精细化学品、手性化合物和生物柴油有重要意义[5-7]。笔者所在实验室筛选获得蜡样芽胞杆菌BacilluscereusWZZ001(CCTCCM2012403)来源的酯酶[8],此酶具有高立体选择性水解手性药物左乙拉西坦中间体(R,S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯的催化特性(图1)。该酯酶编码基因(GenBank登录号KP975533)全长1 458 bp,编码485个氨基酸,已构建以大肠杆菌E.coliBL21(DE3)为宿主,高效表达该酯酶基因的重组工程菌株E.coliBL21/pEASY-E1-est[8]。左乙拉西坦(levetiracetam,LEV),商品名为开浦兰,是由比利时UCB公司研制的一种新型第二代抗癫痫药物[9],(R)-α-乙基-2-氧代-1-吡咯烷乙酸是合成左乙拉西坦药物的重要中间体。
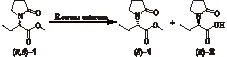
图1 蜡样芽胞杆菌酯酶催化拆分(R,S)-α-乙基-2- 氧代-1-吡咯烷乙酸甲酯Fig.1 Resolution of rac-α-ethyl-2-oxo-pyrrolidineacetic acid methyl ester catalyzed by B. cereus esterase
笔者前期研究利用重组工程菌E.coliBL21/pEASY-E1-est全细胞催化拆分(R,S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯反应,但是由于游离工程菌细胞的操作稳定性较差,此工艺达不到工业化的要求。本文中,笔者拟采用聚乙烯亚胺(PEI)和戊二醛(GA)交联法对重组E.coliBL21全细胞进行固定化研究,考察最佳细胞固定化的工艺条件以及固定化细胞催化拆分(R,S)-α-乙基-2-氧代-1-吡咯烷乙酸甲酯的操作稳定性,以期为规模化生产提供数据。
1 材料与方法
1.1 菌种
基因工程菌株E.coliBL21/pEASY-E1-est由笔者所在实验室成员自主构建,其中酯酶基因来源于筛选的菌株B.cereusWZ001(保藏于武汉大学菌种保藏中心,CCTCCM2012403)。
1.2 培养基
LB/Amp培养基:蛋白胨10 g/L,酵母膏5 g/L,NaCl 5 g/L。溶于蒸馏水中,并调节pH至7.0~7.5,在121 ℃灭菌20 min后向灭菌后的培养基中添加过滤除菌后初始质量浓度100 mg/mL的氨苄青霉素(Amp)至终质量浓度为100 μg/mL。
1.3 试剂与仪器
50%聚乙烯亚胺(PEI,分子量为70 000),上海晶纯生化科技股份有限公司;25%戊二醛(GA),天津阿法埃莎化学有限公司;硅藻土,温州化学材料厂;其他试剂均为市售分析纯。
RCT B S25型磁力搅拌器,德国IKA公司;HWY-2112型回转式恒温调速摇床,上海百典仪器设备有限公司;Agilent 6890型气相色谱仪,美国Agilent公司;BGB-175气相色谱柱,瑞士BGB公司。
1.4 聚乙烯亚胺/戊二醛交联固定化细胞方法
2 g重组大肠杆菌湿菌体加到20 mL磷酸盐缓冲液(PBS)中(pH 8.0,0.2 mol/L),制备得到菌悬液,并置于磁力搅拌器上,向其中加入0.2 g硅藻土。将50%PEI按质量比稀释10倍后,向菌悬液中加入稀释后的PEI,交联60 min,再加入体积分数1%GA,交联60 min。通过真空抽滤进行固液分离,分离过程中用磷酸盐缓冲液洗涤3次,最后所得固体即为固定化细胞。
1.5 酶活力的测定条件
取1 g固定化细胞于30 mL离心管中,加入10 mL磷酸盐缓冲液(pH 8.0,0.2 mol/L)和200 μL底物α-乙基-2-氧代-1-吡咯烷乙酸酯,在30 ℃、200 r/min条件下反应30 min后,取反应液0.5 mL加入1 mL乙酸乙酯萃取,无水Na2SO4除水后,以气相色谱检测剩余底物浓度,并计算对映体过量值e.e.s和转化率。酶活定义:上述反应条件下,每分钟将1 μmol的(R)-α-乙基-2-氧-1-吡咯烷乙酸甲酯转化成(R)-α-乙基-2-氧-1-吡咯烷乙酸所需的酶量。
气相色谱分析条件:采用美国Agilent公司的6890N气相色谱仪和瑞士BGB公司的BGB-175气相色谱柱进行分析。载体为N2(70 kPa),进样口温度220 ℃,空气流量300 mL/min,尾吹气流量30 mL/min,分流比30∶ 1,进样量1 μL;柱箱升温程序为初始温度115 ℃保持3 min,2 ℃/min升温至170 ℃,FID检测器温度250 ℃。
2 结果与讨论
2.1 聚乙烯亚胺浓度及交联时间对固定化细胞的影响
在细胞固定化体系中加入了PEI和GA,通过两者的交联作用能在细胞颗粒表面形成一层红色的聚合物膜,提高细胞的力学强度,其固定化效果比单独使用PEI或GA好[10]。PEI具有一定的蛋白质保护作用,可降低交联作用使酶失活。分别考察不同体积分数PEI对固定化细胞的活性的影响,固定化体系中的其他因素不变,结果如图2所示。由图2可知:固定化细胞的相对酶活随着PEI的浓度的增加而升高,当体积分数达到3%以上时趋向稳定,随后有一定的下降,这可能是GA虽然能和细胞交联,但是交联结构不够紧密,细胞容易从交联结构中脱落,使酶的回收率下降。综合考虑,选择体积分数为3%PEI进行交联化固定。
考察不同PEI交联时间对固定化细胞活性的影响,固定化体系中的其他因素不变,结果如图3所示。由图3可知:固定化细胞的相对酶活随着PEI交联时间的延长而升高,当交联时间为90 min时达到最大,随后开始急剧下降,这可能是因为PEI和GA的交联结构会随着交联时间的不断延长,导致结构越来越紧密,使得固定化细胞的传质阻力加大,降低了固定化细胞的活性,造成酶相对活力的下降。综合考虑,固定化体系选择PEI交联时间90 min为最佳。

图3 PEI交联时间对固定化细胞相对酶活的影响Fig.3 Effect of PEI crosslinking time on the relative activity of immobilized cell
2.2 戊二醛浓度及交联时间对固定化细胞的影响
考察不同体积分数GA对固定化细胞活性的影响,固定化体系中的其他因素不变,结果如图4所示。由图4可知:固定化细胞的相对酶活随着GA用量的增加而升高,当GA体积分数达到1%时相对酶活达到最高,随后又大幅度下降,这可能是因为过量的GA会导致蛋白变性,从而降低固定化细胞的活性,造成活力的下降。综合考虑,固定化体系选择体积分数1%的GA最佳。

图4 GA体积分数对固定化细胞相对酶活的影响Fig.4 Effect of GA concentration on the relative activity of immobilized cell
考察不同GA交联时间对固定化细胞活性的影响,固定化体系中的其他因素不变,结果如图5所示。由图5可知:固定化细胞的相对酶活随着GA交联时间的增加而升高,交联时间为30 min时趋向稳定。随后变化幅度不大,这可能是因为GA是小分子物质,与PEI的交联能在短时间内迅速完成,随着交联时间的不断延长,结构变化不大。综合考虑,固定化体系选择GA交联时间30 min为最佳。

图5 GA交联时间对固定化细胞相对酶活的影响Fig.5 Effect of GA crosslinking time on the relative activity of immobilized cell
2.3 细胞添加量对固定化细胞的影响
分别考察不同梯度(30、70、100、150、200和250 g/L)的细胞添加量对固定化细胞活性的影响,固定化体系中的其他因素不变,结果见图6。由图6可知:固定化细胞的相对酶活随着细胞添加量的增加而升高,这是因为低细胞添加量可以形成较小颗粒从而加速传质,但是不利于交联。而高细胞添加量更有利于交联,但是形成颗粒较大影响传质,使固定化细胞活性下降。综合考虑,固定化体系选择细胞添加量为200 g/L。
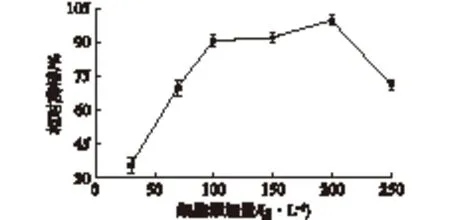
图6 细胞添加量对固定化细胞相对酶活的影响Fig.6 Effect of cell addition on the relative activity of immobilized cell
2.4 硅藻土浓度对固定化细胞的影响
硅藻土粉末不仅具有吸附和抗溶胀效果,还有塑形、助滤和改善固定化颗粒传质特性的作用,并且价格比SiO2及活性炭要低[11]。分别考察不同梯度(2、6、10、14、18和22 g/L)的硅藻土对固定化细胞活性的影响,结果见图7。由图7可知,加入硅藻土后相对未添加之前固定化细胞的酶活性有明显提高。但是当硅藻土浓度过高时,其相对酶活开始呈下降趋势。综合考虑,选择2 g/L硅藻土为最适质量浓度。在上述最佳固定化条件下获得的固定化细胞的比酶活为152.6 U/g,其回收率达到77.8%。与游离细胞相比,固定化细胞酶的底物选择性基本不变,当转化率为50%时,e.e.s达到99.5%。

图7 硅藻土浓度对固定化细胞相对酶活的影响Fig.7 Effect of diatomaceous earth on the relative activity of immobilized cell
2.5 固定化细胞和游离细胞的pH温度及pH稳定性
取制备好的固定化细胞和游离细胞各1 g置于30 mL离心管中,分别加入不同pH的缓冲液和底物,在45 ℃、200 r/min条件下反应30 min,气相检测反应结果,结果如图8所示。由图8可以看出:固定化细胞和游离细胞均在pH 8.0时活力最大,而且在最适pH附近,固定化细胞与游离细胞相比,其活性下降趋势明显更缓,这是因为固定化细胞周围的微环境为细胞提供了一定的缓冲作用,从而使细胞处在一个相对稳定的环境中,使它的酶活保持稳定。
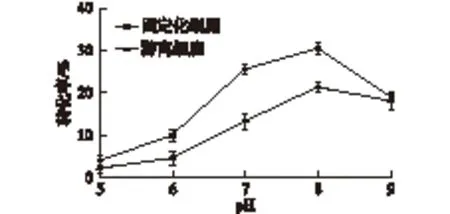
图8 pH对固定化细胞和游离细胞活力的影响Fig.8 Effects of pH on the activity of immobilized and free cell
在考察固定化细胞和游离细胞的pH稳定性时,以固定化细胞和游离细胞在不同pH时的初始活性为100%,考察固定化细胞和游离细胞在不同pH下保存6 h后的催化活力,结果如图9所示。由图9可知:在不同pH条件下,固定化细胞的催化活力均优于游离细胞,这充分说明了PEI/GA交联固定化后的细胞比游离细胞的pH稳定性有显著的提高,这是因为交联体系能在细胞表面形成一层紧密的网状结构[12],能较好地保护细胞,以减缓外界pH对其的伤害。

图9 固定化细胞和游离细胞的pH稳定性Fig.9 pH stability of immobilized and free cell
2.6 固定化细胞和游离细胞的最适温度及温度稳定性
取制备好的固定化细胞和游离细胞各1 g置于30 mL离心管中,加入pH 8.0的磷酸盐缓冲液10 mL和底物,200 r/min和不同温度下反应30 min,气相检测反应结果,结果如图10所示。由图10可知:游离细胞在35 ℃时活力最高,而固定化细胞在40~50 ℃均拥有很高的活力,且在45 ℃时达到最高,说明固定化细胞的温度使用范围比游离细胞更宽。
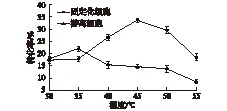
图10 温度对固定化细胞和游离细胞活力的影响Fig.10 Effects of temperature on the activity of immobilized and free cell
热稳定性是评价生物催化剂能否工业化应用的一个重要指标[13]。在考察固定化细胞和游离细胞的pH稳定性时,以固定化细胞和游离细胞在不同温度下的初始活力为100%,考察固定化细胞和游离细胞在不同温度下保存3 h后的催化活力,结果如图11所示。由图11可知:在40 ℃以下时,温度对固定化细胞和游离细胞的影响较小,而当温度在40 ℃以上时,游离细胞的活力开始大幅度下降,且在50 ℃时其活力只有初始活力的62.7%,而固定化细胞仍能保持其初始活力的87.5%,说明固定化细胞相比较于游离细胞的温度稳定性更好。
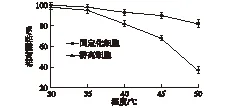
图11 固定化细胞和游离细胞的温度稳定性Fig.11 Temperature stability of immobilized and free cell
2.7 固定化细胞和游离细胞的操作稳定性
对商业化应用的生物固定化催化剂,最理想的性能就是其优良的操作稳定性和重复使用能力[14]。考察固定化细胞和游离细胞的操作稳定性,结果如图12所示。由图12可知:细胞经PEI/GA交联后结构非常稳定,在15个批次后依然能保持其初始酶活的85%以上,而游离细胞的酶活下降非常快,在第5批的时候,其相对酶活只有初始酶活的5%,这说明PEI/GA的交联固定化体系能够很好地保护细胞和酶结构,表现出了良好的操作稳定性。
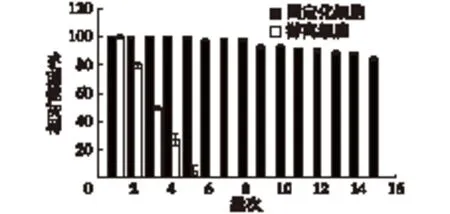
图12 固定化细胞的操作稳定性Fig.12 Batches stability of immobilized and free cell
3 结论
对聚乙烯亚胺和戊二醛无载体交联法固定化全细胞的工艺进行考察,得到交联固定体系最优条件:交联细胞质量浓度200 g/L,硅藻土质量浓度为2 g/L,聚乙烯亚胺(PEI)体积分数为3%、交联时间1.5 h,戊二醛(GA)体积分数为1%、交联时间0.5 h。与游离细胞相比,固定化后的细胞酶学性质发生了部分改变,最适温度从35 ℃提高至45 ℃。固定化酶的pH稳定性、热稳定性和操作稳定性均有一定的提高,因此该固定化工艺具有潜在的工业化应用价值。
[1] 王洪祚,刘世勇.酶和细胞的固定化[J].化学通报,1997(2):22-27.
[2] 张磊,张烨,侯红萍.固定化细胞技术的研究进展[J].食品与发酵科技,2006,42(1):5-7.
[3] 刘钧,周力.固定化微生物技术在废水处理中的应用分析[J].净水技术,1998(1):36-40.
[4] 张敏文,刘悦,李荷.微生物酯酶的研究进展[J].广东第二师范学院学报,2012,32(3):66-71.
[5] MELO L L M M,PASTORE G M,MACEDO G A.Optimized synthesis of citronellyl flavour esters using free and immobilized lipase fromRhizopussp.[J].Process Biochem,2005,40(10):3181-3185.
[6] SEKHON K K,KHANNA S,CAMEOTRA S S.Enhanced biosurfactant production through cloning of three genes and role of esterase in biosurfactant release[J].Microb Cell Fact,2011,10(1):49.
[7] GODINHO L F,REIS C R,TEPPER P G,et al.Discovery of anEscherichiacoliesterase with high activity and enantioselectivity toward 1,2-O-isopropylideneglycerol esters[J].Appl Environ Microbiol,2011,77(17):6094-6099.
[8] ZHENG J Y,LIU Y Y,LUO W F,et al.Biocatalytic resolution ofrac-α-ethyl-2-oxo-pyrrolidineacetic acid methyl ester by immobilized recombinantBacilluscereusesterase[J].Appl Biochem Biotechnol,2016,178:1471-1480.
[9] ISOHERRANEN N,ROEDER M,SOBACK S,et al.Enantioselective analysis of levetiracetam and its enantiomerR-alpha-ethyl-2-oxo-pyrrolidine acetamide using gas chromatography and ion trap mass spectrometric detection[J].J Chromatogr B,2000,745(2):325-332.
[10] CHEN J,ZHENG Y G,SHEN Y C.Biosynthesis ofp-methoxyphenylacetic acid fromp-methoxyphenylacetonitrile by immobilizedBacillussubtilisZJB-063[J].Process Biochem,2008,43(9):978-983.
[11] 邓辉,陈晟,陈坚,等.产葡萄糖异构酶细胞的固定化[J].食品科学,2013,34(9):164-169.
[12] VLAJINAC H,ADANJA B.Stereoselective nitrile hydrolysis by immobilized whole-cell biocatalyst[J].Biomacromolecules,2006,7(5):1536-1541.
[13] NESTL B M,NEBEL B A,HAUER B.Recent progress in industrial biocatalysis[J].Curr Opin Chem Biol,2011,15(2):187-193.
[14] FESSNER W D,TURNER N J,WANG M X.Biocatalysis:a gate way to industrial biotechnology[J].Adv Synth Catal,2011,353(13):2189-2190.
(责任编辑 荀志金)
Immobilization of recombinant esteraseEscherichiacolicellsby cross-linking with polyethyleneimine-glutaradehyde
ZHENG Jianyong,Li Tianyi,ZHANG Wei,WANG Zhao
(Key Laboratory of Bioorganic Synthesis of Zhejiang Province,College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
We studied the immobilization of whole cells ofE.coliBL21,and optimized the cross-linked system by using polyethyleneimine and glutaraldehyde as carriers. The optimal immobilization conditions were 200 g/L cells and 2 g/L diatomite,which was subsequently cross-linked in 3% of the polyethyleneimine (PEI) and 0.5% of glutaraldehyde (GA) for 1.5 h and 0.5 h,respectively. The optimal reaction temperature and pH of the immobilized cells were 45 ℃ and 8.0. Moreover,data showed that the temperature stability and pH stability of the immobilized cells were higher than those of free cells. The relative activity of the immobilized cells remained 80% after 15 batches when the substrate concentration was 300 mmol/L,indicating that the immobilized cells had a good operational stability.
polyethyleneimine; glutaraldehyde; immobilization; cross-link; esterase
10.3969/j.issn.1672-3678.2017.03.002
2017-02-15
国家自然科学基金(31600639)
郑建永(1982—),男,浙江永嘉人,高级工程师,研究方向:生物催化与转化;汪 钊(联系人),教授,E-mail:hzwangzhao@163.com
Q819
A
1672-3678(2017)03-0007-05
