基于UPLC-Q-Exactive Orbitrap Mass技术的山羊奶、大豆奶、牛奶的脂质组分析研究
2017-06-07周晓丽
周晓丽 译
(北京屯玉种业有限责任公司,北京海淀 100193)
检测分析
基于UPLC-Q-Exactive Orbitrap Mass技术的山羊奶、大豆奶、牛奶的脂质组分析研究
周晓丽 译
(北京屯玉种业有限责任公司,北京海淀 100193)
乳制品是不同种类脂质的丰富来源,对人类健康至关重要。本研究基于UPLC-Q-Exactive Orbitrap Mass技术建立了不同类型乳制品 (包括山羊奶、大豆奶和牛奶)全面脂质组分析的方法。研究表明:共5种神经酰胺(Cer),9种鞘磷脂(SM),4种溶血磷脂酰胆碱(LPC),21种磷脂酰胆碱(PC),14种磷脂酰乙醇胺(PE),17种甘油二酯(DG),300种甘油三酯(TG),7种磷脂酸(PA),9种磷脂酰甘油(PG),20种磷脂酰肌醇(PI),14种磷脂酰丝氨酸(PS),4种溶血磷脂酰乙醇胺(LPE)和38种脂肪酸(FA)被检出,并且其种类和含量在不同类型乳制品中的分布差异显著。其中,大豆奶中富含磷脂(包括PC、PE、PS、PG),而山羊奶中富含中链甘油三酯(MCT)、不饱和脂肪酸(USFA)、ω-6 FA和ω-3 FA(尤其是EPA和DHA)。此外,本研究基于脂质组分差异建立了PLS鉴别模型,并筛查出14类脂质标记物用来鉴别乳制品的类型,从而为乳制品真实性鉴别奠定基础。
山羊奶;大豆奶;牛奶;UPLC-Q-Exactive Orbitrap Mass;脂质组
乳制品是不同种类脂质的丰富来源(Trenerry等,2013;Haug等,2007;German等,2006)。脂质具有诸多生物活性,通常被分为8大类 (Fahy等,2005)。甘油三酯(TG)是乳脂肪的主要成分,含量占乳脂肪的98.3%,在乳制品质地和风味中起重要作用(MacGibbon和Taylor,2006)。然而,摄入过多的TG会导致肥胖,高血压等(Unger等,2001;Han等,2000)。乳制品中还含有丰富的脂肪酸。脂肪酸与人类健康直接相关,例如,高浓度的饱和脂肪酸(SFA)可诱导心血管疾病,而多不饱和脂肪酸(PUFA)可以减少心血管疾病的发生,并增强机体免疫力(Abedi等,2014;Mori,2006)。此外,乳制品中还含有一定量的功能活性脂,如磷脂。磷脂是生物膜的重要组成部分,并具有诸多功能活性,如抗炎活性,且磷脂与降低心血管疾病风险和机体对胆固醇的吸收有关(Küllenberg等,2012)。研究报道,不同种类的乳制品中脂质的种类与含量分布不同,从而导致不同种类的乳制品营养价值各异(Liu等,2015;Donato等,2011)。因此,乳制品的脂质成分分析对于评估乳制品的营养价值具有重要意义。此外,经脂质成分分析得到的乳制品的脂质种类与含量数据还可用于乳制品的真实性鉴别,从而为乳制品的质量安全提供保障。
为了实现乳制品的脂质成分分析,近年来,已开发了诸多方法,例如,气相色谱串联质谱法(GC-MS)(Fontecha等,2005;Fontecha等,2000),和液相色谱串联质谱法 (LC-MS)(Gastaldi等,2011;Donato等,2011;Haddad等,2011;Kalo等,2004;Mottram和 Evershed,2001;Laakso和 Manninen,1997)。Trenerry等 (2013)还开发了一种UHPLC-ion trap-MS法来鉴别牛奶中的极性脂。Byrdwell等(2007)则开发了一种LC-APCI/ESIMS技术同时检测牛奶中的鞘脂类成分。然而,仍缺少一种实现乳制品脂质组全面分析的方法。QExactive Orbitrap MS是近年来新开发出的一种具有高分辨率、灵敏度、准确度的技术,与普通质谱相比,它呈现出了一种碎片离子扫描分析鉴别各种脂质同分异构体的超强能力 (Senyuva等,2015)。目前,该技术已成功应用于牛奶和人奶的极性脂质组分差异识别鉴定上(Liu等,2015)。
本研究旨在建立一种基于UPLC-Q-Exactive Orbitrap Mass技术的山羊奶、大豆奶、牛奶的脂质成分分析方法。为获得山羊奶、大豆奶、牛奶中更全面的脂质分布信息,筛查山羊奶、大豆奶、牛奶的差别表征因子提供技术支持,并为进一步的乳制品掺假识别奠定基础。
1 材料和方法
1.1 试剂 标准品包括LPC,PC,PE,PS,PG从美国Avanti公司购买,Cer,DG,TG,FA和醋酸铵从美国Sigma公司购买。氯仿从北京普昔宜康公司购买,HPLC级乙腈(ACN)、异丙醇(IPA)、甲醇从美国Fisher公司购买,超纯水来自于Milli-Q超纯水系统。
1.2 样品前处理 超高温灭菌(UHT)山羊奶,大豆奶,牛奶各10个品牌,分不同批次,历时5个月,奶样采购于中国10个地区的超市,以确保样品具有代表性。
奶样提脂是依据Folch和Bligh的方法(Bligh和Dyer,1959;Folch等,1957):取0.2 mL奶样,加入1 mL超纯水和3 mL氯仿甲醇提取液 (CHCl3∶MeOH=2∶1,v/v),室温混匀10 min后于2000 r/min下离心15 min。取下层氯仿层后氮吹干燥,并重溶于400 μL CHCl3∶MeOH(2∶1,v/v),待测。样品重复试验3次。
1.3 仪器参数 采用Thermo Fisher公司的UPLC-Q-Exactive Orbitrap Mass仪器进行检测,该仪器配备HESI探头。分别选用Waters公司的CORTECS C18 100×2.1 mm 2.7 μm色谱柱和XSelect CSH C18 100×2.1 mm 2.5 μm色谱柱进行正、负离子模式检测。流动相A相为ACN∶H2O(60∶40,v/v,含10 mM醋酸铵),B相为IPA:CAN(90∶10,v/v,含10 mM醋酸铵)。流速设置为250 μL/min。洗脱梯度为:0~20 min流动相B由37%升至98%,之后为98%的流动相B洗脱6 min,再利用37%的流动相B平衡4 min。柱温箱和样品盘温度分别设置为45、10℃。
正负离子模式下的质谱数据采集范围分别为240~2000 m/z和200~2000 m/z。全扫描和碎片扫描分辨率分别为70000和17500。喷雾电压为3000 v,碰撞温度为320℃,加热器温度为300℃,鞘气流速为35 Arb,辅助气流速为10 Arb。数据分析采用软件Lipidsearch 4.0(Thermo Fisher,CA)。定性是基于碎片离子信息(MS2)来实现的。该方法中,MS1的误差<5 mg/L,MS2的误差<8 mg/L。并且分析过程中将m得分<10和峰面积<1e5的值剔除。正离子模式下将奶样的脂质提取物稀释20倍后进样1 μL;由于负离子模式灵敏度不如正离子模式高,因此是将奶样的脂质提取物稀释2倍后进样1 μL。
1.4 统计分析 峰面积计算采用软件Xcalibur 3.2.63(Thermo Fisher,USA)。最小二乘法判别分析(PLS-DA)采用软件SIMCA-P 11.5,方差分析(ANOVA)采用软件SPSS 21.0。置信区间为95%(Brown等,2005)。
2 结果与讨论
2.1 方法验证和脂质分析 如图1所示,为山羊奶、大豆奶、牛奶基于UPLC-Q-Exactive Orbitrap Mass技术分别在正离子模式和负离子模式下扫描得到的图谱,表1显示了山羊奶、大豆奶、牛奶的脂质定性信息。其中,共有5种神经酰胺(Cer),9种鞘磷脂 (SM),4种溶血磷脂酰胆碱(LPC),21种磷脂酰胆碱(PC),14种磷脂酰乙醇胺(PE),以及17种甘油二酯(DG)和300种甘油三酯(TG)由正离子模式扫描得到;共7种磷脂酸(PA),9种磷脂酰甘油(PG),20种磷脂酰肌醇(PI),14种磷脂酰丝氨酸 (PS),4种溶血磷脂酰乙醇胺 (LPE)和38种脂肪酸(FA)由负离子模式扫描得到。
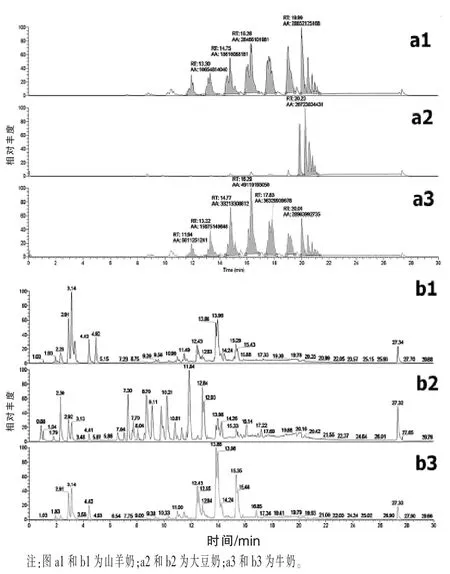
图1 利用UPLC-Q-Exactive orbitrap MS技术分别在正离子模式(a)和负离子模式(b)下的采集信息图
经外标法定量,可获得不同种类脂质的线性定量方程(如表2所示)。依据Donato(2011)等人的研究结果,将3倍信噪比定为检出限,10倍信噪比定为定量限,其中检出限均≤0.004 μg/mL,定量限均≤0.02 μg/mL。此外,将奶样加标提取后定量获得的脂质含量与标准溶液进行比较,可确定其回收率。将空白奶样提取后进行加标处理定量获得的脂质含量与标准溶液进行比较,可评价其基质效应。如表3所示,9类脂质的回收率为80.54%~110.07%,相对标准偏差小于10%,并且无显著的基质干扰,由此可见,该方法具有较高的重复性和准确性。
2.2 不同乳制品间脂质组差异分析 经定量分析发现,不同种类的乳制品中脂质的种类与含量分布具有显著性差异。其具有显著性差异的脂质如下所述:在正离子模式下,检测到大豆奶中含有PC(16∶0/22∶6,含量为0.03~0.12 μg/mL),PE(16∶1/20∶4,含量为0.05~0.17 μg/mL),DG(18∶3/18∶3,含量为0.08~0.2 μg/mL);牛奶中含有Cer(16∶0/22∶0,含量为0.2~1.0 ng/mL),Cer(16∶1/22∶0,含量为2.5~3.5 ng/mL)和Cer(18∶0/22∶0,含量为23.4~27.6 ng/mL)。在负离子模式下,检测到大豆奶中含有7种PA(16∶0/18∶2,16∶0/18∶3,18∶0/18∶2,18∶0/ 18∶2,18∶2/18∶2,18∶3/18∶2,18∶3/18∶3),9种PG(16∶0/ 16∶0,18∶0/16∶0,16∶0/18∶1,16∶0/18∶2,16∶0/18∶3,18∶0/ 18∶2,18∶1/18∶2,18∶2/18∶2,18∶3/18∶2,总含量为22.66~25.41 μg/mL),以及4种PI(15∶0/18∶2,18∶3/ 18∶2,22∶0/18∶2,16∶0/18∶3);在牛奶中检测到PA(18∶ 2/18∶2),2种PG(16∶0/18∶1,18∶0/18∶2,总含量为0.026~0.035 μg/mL)和2种PI(18∶0/23∶0,18∶1/20∶4);在山羊奶中检测到4种PG(16∶0/18∶1,16∶0/18∶2,18∶0/18∶2,18∶1/18∶2,总含量为0.54~0.66 μg/mL)和3种PI(16∶0/18∶3,18∶0/23∶0,18∶1/20∶4)。

表1 脂质定性信息表
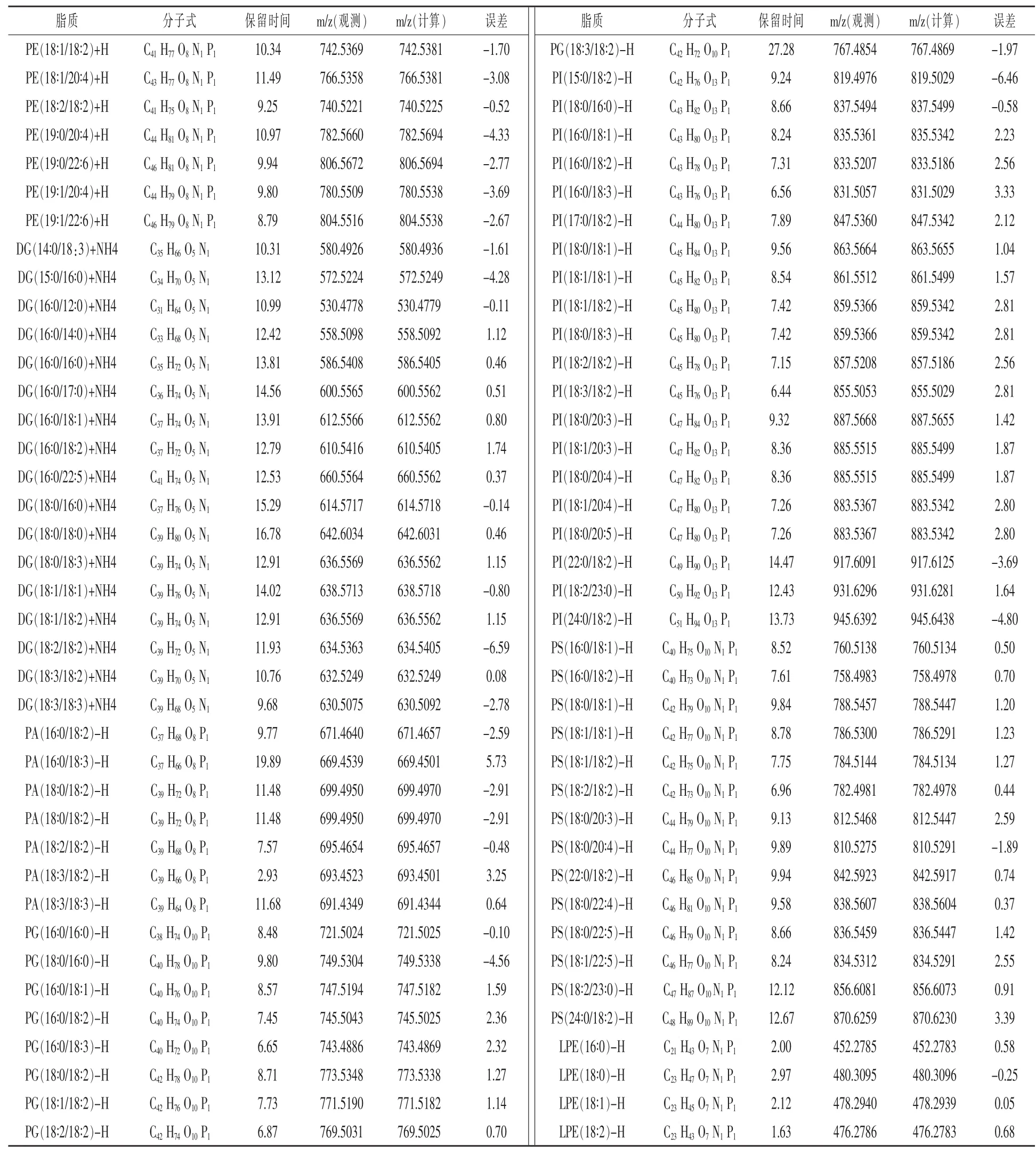
(续表1)
经方差分析(ANOVA)得出(如图2所示),大豆奶富含磷脂,其中PE,PG,PS,PC的含量高于山羊奶和牛奶(P<0.05)。与大豆奶和山羊奶相比,牛奶中含有较高的Cer和DG(P<0.01)。此外,TG和中链甘油三酯 (MCT)的含量在牛奶中最高 (P<0.001)。然而,MCT和TG的比值较山羊奶低,其中牛奶中MCT/TG为39%,山羊奶中MCT/TG为46%。据MosheRubin等(2000)和℃tavio等(2000)的研究表明,MCT更容易被人体吸收。因此,对于肥胖人群而言,摄入山羊奶要比牛奶更适合。
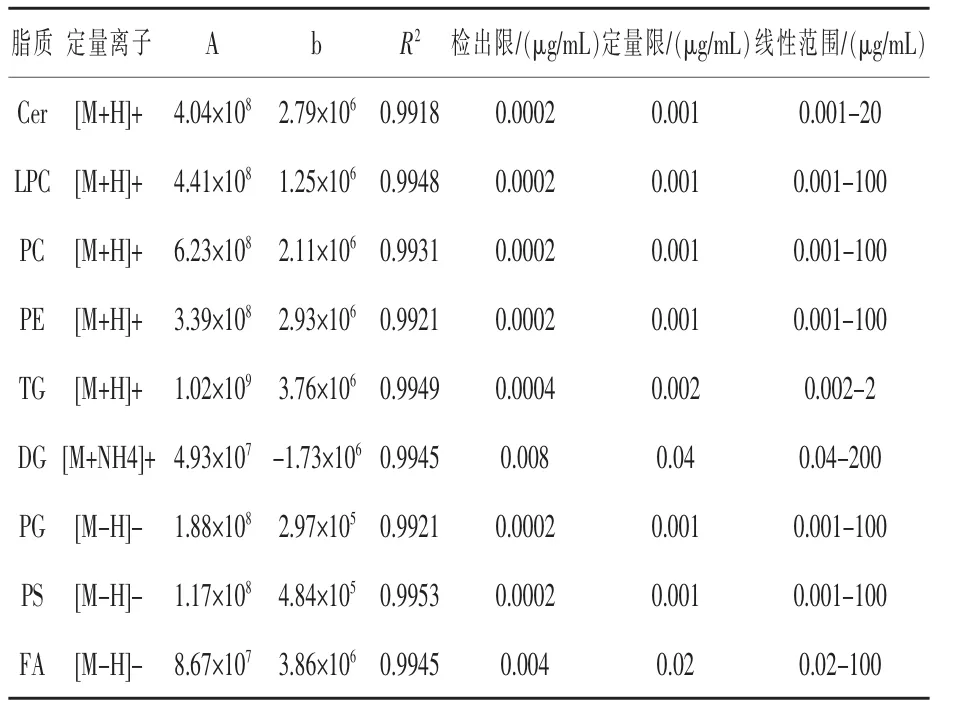
表2 9类脂质的定量方程及线性范围、检出限、定量限

表3 9类脂质的基质效应和添加回收率
2.3 山羊奶、大豆奶和牛奶的脂肪酸定量分析如图2所示,山羊奶、大豆奶、牛奶中单不饱和脂肪酸(MUFA),多不饱和脂肪酸(PUFA)和饱和脂肪酸(SFA)的含量差异显著(P<0.01)。其中,山羊奶中不饱和脂肪酸(USFA,i.e.MUFA+PUFA)的含量较大豆奶、牛奶较高(P<0.001)。山羊奶、大豆奶、牛奶中SFA,MUFA和PUFA的含量之比分别为1∶0.7∶0.2,1∶0.8∶0.4和1∶0.6∶0.1。ω-6和ω-3型脂肪酸在不同种类乳制品中的含量差异显著(P<0.001),例如,LA含量在大豆奶中最高,山羊奶次之,牛奶最低;ARA的含量在山羊奶中最高,牛奶次之,大豆奶最低;ALA的含量在大豆奶中最高,山羊奶次之,牛奶最低;EPA和DHA的含量均在山羊奶中最高,牛奶次之,大豆奶最低。其中,山羊奶中EPA和DHA的含量分别为1.87~1.99 μg/mL和1.17~1.27 μg/mL。研究报道,EPA和DHA可以降低总胆固醇、低密度脂蛋白和甘油三酯的水平,并增加免疫系统的活性 (Van Valenberg等,2013;Swanson等,2012;Abeywardena,2011;Moghadasian等,2008;Ruxton等,2007;Calder,2006)。

图2 脂质含量在山羊奶、大豆奶、牛奶中的差异比较
2.4 PLS鉴别模型的建立 基于不同种类的乳制品中具有显著性差异的脂质数据,进行偏最小二乘法判别分析(PLS-DA),可获得不同种类乳制品的偏最小二乘法判别模型(如图3a所示)。其中,前两个主成分的方差累积贡献率达86.9%,该模型可有效地进行不同种类乳制品的真实性鉴别。此外,方差贡献值(VIP)的大小可用于评估具有显著性差异的脂质对所建立的PLS-DA模型的贡献率大小,从而筛选出可用于不同种类乳制品真实性鉴别的表征因子。如图3b所示,总共14个变量(VIP>1)被认为具有显著贡献,且这些脂质可用作山羊奶,大豆奶和牛奶真实性鉴别的表征因子。

图3 偏最小二乘法判别分析(PLS-DA)得分图(a)与方差贡献因子柱形图(b)
3 小结
本研究建立了一种基于UPLC-Q-Exactive Orbitrap MS技术进行山羊奶、大豆奶、牛奶的脂质成分分析的方法。试验中比较了山羊奶、大豆奶、牛奶的脂质种类与含量分布的显著性差异,并利用具有显著性差异的脂质进行PLS-DA模型建立,以进行山羊奶、大豆奶、牛奶的真实性鉴别,并筛选出方差贡献值较高的14类脂质作为真实性鉴别的表征因子,为日后乳制品的质量安全提供技术支撑。
[1]Abedi E,Sahari M A.Long-chain polyunsaturated fatty acid sources and evaluation of their nutritional and functional properties[J].Food Science and Nutrition,2014,2:443~463.
[2]Abeywardena M Y,Patten G S.Role of ω-3 long chain polyunsaturated fatty acids in reducing cardio-metabolic risk factors[J].End℃rine Metabolic and Immune Disorders-Drug Targets,2011,11:232~246.
[3]Byrdwell W C,Perry R H.Liquid chromatography with dual parallel mass spectrometry and 31P nuclear magnetic resonance spectroscopy for analysis of sphingomyelin and dihydrosphingomyelin.II[J].Bovine milk sphingolipids.Journal of Chromatography A,2007,1146(2):164~185.
[4]Donato P,Cacciola F,Cichello F,et al.Determination of phospholipids in milk samples by means of hydrophilic interaction liquid chromatography coupled to evaporative light scattering and mass spectrometry detection[J].Journal of Chromatography A,2011,1218(37):6476~6482.
[5]Gastaldi D,Medana C,Giancotti V,et al.HPLC-APCI analysis of triacylglycerols in milk fat from different sources.European Journal of Lipid Science and Technology,2011,113:197~207.
[6]Haddad I,Mozzon M,Strabbioli R,et al.Electrospray ionization tandem mass spectrometry analysis of triacylglycerols molecular species in camel milk(Camelus dromedarius)[J].International Dairy Journal,2011,21:119~127.
[7]Haug A,Høstmark A T,Harstad O M.Bovine milk in human nutrition-a review[J].Lipids in Health and Disease,2007,6:25 doi:10.1186/1476-511X-6-25.
[8]Küllenberg D,Taylor L A,Schneider M,et al.Health effects of dietary phospholipids[J].Lipids in Health and Disease,2012,11(3).doi:10.1186/1476-511X-11-3.
[9]Liu Z,Moate P,C℃ksa B,et al.Comprehensive polar lipid identification and quantification in milk by liquid chromatography-mass spectrometry[J]. Journal of Chromatography B,2015,26:95~102.
[10]MacGibbon A K H,Taylor M W.Composition and structure of bovine milk lipids[A].P F Fox,P L H McSweeney.Advanced dairy chemistry volume 2 lipids(3rd ed.)[C].New York:Springer.2006.1~42.
[11]Moghadasian M H.Advances in dietary enrichment with n-3 fatty acids [J].Critical Reviews in Food Science and Nutrition,2008,48:402~410.
[12]Mori T A.Omega-3 fatty acids and hypertension in humans[J].Clinical and Experimental Pharmacology and Physiology,2006,33:842~846.
[13]Ruxton C,Reed S C,Simpson M J A,et al.The health benefits of omega-3 polyunsaturated fatty acids:a review of the evidence[J].Journal of Human Nutrition and Dietetics,2007,20:275~285.
[14]Senyuva H Z,Gökmen V,Sarikaya E A.Future perspectives in Orbitrap? -high-resolution mass spectrometry in food analysis:a review[J].Food Additives&Contaminants:Part A,2015,32:1568~1606.
[15]Swanson D,Bl℃k R,Mousa S A.Omega-3 fatty acids EPA and DHA:Health benefits throughout life[J].Advances in Nutrition,2012,3:1~7.
[16]Trenerry V C,Akbaridoust G,Plozza T,et al.Ultra-high-performance liquid chromatography-ion trap mass spectrometry characterisation of milk polar lipids from dairy cows fed different diets[J].Food Chemistry,2013,141:1451~1460.
[17]Van Valenberg H J F,Hettinga K A,Dijkstra J,et al.Concentration of n-3 and n-6 fatty acids in Dutch bovine milk fat and their contribution to human dietary intake[J].Journal of Dairy Science,2013,96:4173~4181.
(译自:Food Chemistry,2017,224:302~309.)
Lipids are very important for human health and milk is a rich dietary source of lipids.In this study,the lipid content in three types of milk(goat,soy and bovine)were determined by using UPLC-Q-Exactive Orbitrap Mass Spectrometry.A total of 13 classes of lipids(including Cer,SM,LPC,PC,PE,DG,TG,PA,PG,PI,PS,LPE,FA)were measured.Moreover,lipid profiles differed significantly between the different milk types.Soymilk is rich in phospholipids including PC,PE,PS,PG,while goat milk is rich in medium chain triglycerides(MCT),USFA,ω-6 FA and ω-3 FA,especially EPA and DHA.Furthermore,a PLS model was established for differentiation of milk types based on the lipid profiles. A total of 14 lipids were identified as biomarkers for differentiation of milk types,thus providing a basis for milk authentication and detection of adulteration.
goat milk;soymilk;bovine milk;UPLC-Q-Exactive Orbitrap Mass;lipidomics
S816.17
A
1004-3314(2017)10-0033-06
10.15906/j.cnki.cn11-2975/s.20171008
国家自然科学基金(31371779);国家国际科技合作专项(2015DFG31890)
