异氟烷干预下人羊膜间充质干细胞移植对大鼠脑梗死的影响
2017-06-06童宁周业波
童宁,周业波
·论著·
异氟烷干预下人羊膜间充质干细胞移植对大鼠脑梗死的影响
童宁1,周业波2
目的:观察人羊膜间充质干细胞(AM-MSCs)移植同时予以异氟烷治疗对脑梗死大鼠神经功能恢复的影响。方法:大鼠100只,采用线栓法建立大脑中动脉阻塞脑梗死模型,随机分成假手术组、脑梗死组、AMMSCs移植组、异氟烷组、(AM-MSCs+异氟烷)组,造模后 6 h 给予相应治疗。移植后 7 d 各组随机处死 6 只,采用 RT-PCR、Western Blot检测脑组织中 GAP-43、AQP4 mRNA 和蛋白表达的变化。移植后 24 h、3 d 及造模后 1、2、3、4 周行动物神经功能缺损(NSS)评分,在移植后 21~28 d 进行 Morris水迷宫试验。4 周后处死行免疫组化、HE 染色观察病理学变化。结果:移植后 7 d,(AM-MSCs+异氟烷)组大鼠脑组织中 GAP-43 mRNA 和蛋白表达高于脑梗死组、AM-MSCs组、异氟烷组(P<0.05);异氟烷组和 AM-MSCs组的大鼠脑组织中 GAP-43 mRNA 和蛋白表达水平高于脑梗死组(P<0.05)。(AM-MSCs+异氟烷)组的 AQP4 mRNA 和蛋白表达低于其他各组(P<0.05);AM-MSCs组和异氟烷组低于脑梗死组(P<0.05)。移植后 1 周,(AM-MSCs+异氟烷)组的 NSS 评分低于异氟烷组、AM-MSCs移植组,异氟烷组、AM-MSCs移植组低于脑梗死组(P<0.05)。移植后 3~5 d,(AM-MSCs+异氟烷)组平均逃逸潜伏期较异氟烷组、AM-MSCs组、脑梗死组缩短(P<0.05 或 P<0.01)。(AM-MSCs+异氟烷)组的目标距离百分比高于异氟烷组和 AM-MSCs组(P<0.05),并高于脑梗死组(P<0.01)。伤后4 周,脑梗死组未见神经轴索通过,异氟烷组、AM-MSCs移植组可见少量神经轴索样结构,(AM-MSCs+异氟烷)组可见较多神经轴索样结构(P<0.05)。CM-Dil的阳性细胞数(AM-MSCs+异氟烷)组高于 AM-MSCs组,异氟烷组高于脑梗死组,假手术组最少(P<0.05)。结论:异氟烷干预联合 AMMSCs移植治疗大鼠脑梗死可明显改善大鼠的神经学功能。
人羊膜间充质干细胞;移植;异氟烷;大鼠;脑梗死;功能
急性脑梗死的发病率和致残率均居于心脑血管疾病的前列,严重影响患者的神经系统功能[1-2]。研究表明 ,人 羊 膜 间 充 质 干 细 胞(amnion mesenchyme stem cells,AM-MSCs)可改善局灶性脑缺血造成的神经系统症状,提高神经疾病小鼠的运动、行为、记忆能力[3-5]。然而单纯的干细胞移植对缺血半影区神经元细胞 的 坏死和 凋 亡的缓 解 作用有 限[6-8]。在 脑 梗死治 疗中,异氟烷预处理可抵抗炎症反应。早期抗炎治疗可促进外源移植的AM-MSCs增殖,提高疗效。但目前AM-MSCs移植联合异氟烷干预对大鼠脑梗死的影响研究极少。本文拟就二者联合治疗脑梗死大鼠,观察其对大鼠脑组织中水通道蛋白-4(aquaporin,AQP-4)、神经生长相关蛋白(growth-associated protein-43,GAP-43)蛋白和基因表达,神经功能及脑组织病理变化的影响。
1 材料与方法
实验设计为随机对照动物实验,于2013年7月至2016年1月在山东医科大学实验动物中心完成。
1.1 材料
1.1.1 实验动物 2.5 月龄左右体质量 300~350 g 健康SD大鼠100只,雌雄各半,由山东医科大学实验动物中心提供,于室温25 ℃、湿度50%~80%、SPF环境下自由饮水和采食。
1.1.2 主要试剂及仪器 原代 AM-MSCs(购于中国医学科学院);LG-DMEM 完全培养基中包含 2 mmoL/L L-谷氨酞胺、10%FBS、1 mmoL/L 丙酮酸钠、100 mg/mL青链霉素二抗;Morris水迷宫(由友诚生科有限公司制作);BCA蛋白浓度测试试剂盒(增强型)、5×SDS蛋白上样缓冲液、20×TBS缓冲液(购于南京建成生物公司);胰蛋白酶(购于美国 Sigma公司);PBS(购于美国Hyclone公司);细胞培养箱(购于德国 Heraes Sepatech公司);Trizol试剂盒(购于美国 Invitrogen 公司)。
1.2 方法
1.2.1 体外复苏并培养 AM-MSCs 将冻存原代 AMMSCs置于 60 ℃恒温水浴箱,30 s内进行快速复苏。融化之后迅疾转入EP管并加入DMEM培养基,重复小心吹打细胞使其均匀分布,随后离心弃上清液。将复苏后的细胞用 LG-DMEM 完全培养基调整为 1×106/ mL的密度。将其接种到细胞培养板上于细胞培养箱中培养,第3天更换新的培养基。待AM-MSCs汇合度达 80%以上时,胰蛋白酶溶液消化 2~3 min 后终止消化;离心弃上清重悬细胞。调整细胞密度至 1×106/mL并传代培养 3 代。用 PBS 调整细胞密度至 8×105/mL,加入 5 μL CM-DiL 标记细胞;随后置于培养箱中标记孵化 25~30 min 后离心弃上清 PBS 重悬,重复标记 2次,显微镜下观察细胞标记的情况。继续培养 48 h 后分离出培养液备用,并用DMEM培养基将细胞浓度调整至 8×105个/mL。
1.2.2 脑损伤模型的建立及实验分组 将 100 只大鼠随机平均分为5组各20只:假手术组、脑梗死组、AMMSCs组、异氟烷组和(AM-MSCs+异氟烷)组。首先将异氟烷组和(AM-MSCs+异氟烷)组分别置于透明塑料箱;将箱体连接气体监测仪,调节氧气与异氟烷进气使箱中异氟烷浓度约 2.0%并持续约 2 h。假手术组、脑梗死组和AM-MSCs移植组所有大鼠在相同条件下进行处理,不通入异氟烷气体。处理后 24 h 对脑梗死组、AM-MSCs组、异氟烷组、(异氟烷+AM-MSCs)组建立脑梗死模型,对假手术组只进行开关颈部手术处理:麻醉固定大鼠,并分离结扎右颈总动脉与颈外动脉,于颈内动脉和颈外动脉之分叉处迅疾作一切口;插入一端为光滑球形的尼龙线(直径为 0.26 mm,球端直径 0.30~0.34 mm),直至 20 mm 处,再回撤至 18 mm 处,实现大鼠大脑中动脉阻断模型。将在切口外留约 1 cm 长度的尼龙线并缝合。2 h 后大鼠出现左前肢蜷曲或共济失调的体征,继续造模。将各组大鼠固定在超净手术台之上,轻拉留于体外的尼龙线线头直至产生阻力并实现大脑动脉的缺血再灌注,造模 6 h 后进行细胞移植。假手术组、脑梗死组和异氟烷组尾静脉注射 1mL 细胞培养液,AM-MSCs组、(异氟烷+AM-MSCs)组尾静脉注射 1 mLAM-MSCs悬液(含 8×105个)。连续注射 5 d,1 次/d。
1.2.3 RT-PCR 检测脑组织中 GAP-43、AQP4 mRNA 表达 移植后7 d,各组随机挑选6只大鼠,麻醉处死后剥离脑梗死区域周边的脑组织。并将之置于 1.5 mL EP管中,-80 ℃冻存备测。取出冻存脑组织,研磨匀浆后 Trizol试剂提取组织的总 RNA。通过 Primer Primer 5.0 软件设计引物,GAP-43 引物序列上游:5’-AGGAAAGGAGAGAAGGCAGG-3’;下游:5’-GCAGGAGAGACAGGGTTCAG-3’,目的片段长度 778 bp。AQP4 引 物 序 列 上 游 :5’-CCAGCTGTGATTCCAAAACGGAC-3’;下 游 :5’-TCTAGTCATACTGAAGACAATACCTC-3’,目的片段长度 305 bp;参照物 GAPDH 引物序列上游:5’-TGGTGAAGGTCGGTGTGAAC-3’;下游 5’-TTCCCATTCTCAGCCTTGAC-3’,片段长度为 190 bp。反应后琼脂糖凝胶电泳并成像仪摄片,用 Image proplus6.0 图像分析软件测算 OD值,计算其相对表达量。
1.2.4 Western Blotting 检 测 脑 组 织 中 GAP-43、AQP4蛋白表达 将采集来的大鼠脑组织0℃匀浆,离心取上清,取脑组织的组织匀浆液,4 ℃下解冻备用,Western blotting 检测脑组织 GAP-43 和 AQP4 蛋白的相对表达水平,BCA 法测定总蛋白浓度,SDS-聚丙烯酰胺凝胶电泳、转膜、摇床封闭 2 h;分别进行一抗与二抗的孵育洗涤,反应曝光,扫描图像并半定量分析,测定BNP蛋白相对表达水平,内参以GAPDH为准。
1.2.5 动物神经学缺损评分 于移植后 24 h、3 d、1、2、3、4周,对各组大鼠进行神经损伤严重缺损评分(neurological severity score,NSS):0 分,无神经系统损伤体征;1分,手术对侧前爪有明显的伸直障碍;2分,向手术对侧转圈;3分,向手术对侧倾倒;4分,不能自发行走,意识丧失。
1.2.6 Morris水迷宫试验 移植后 21~28 d 进行 Morris水迷宫试验。在水迷宫的池壁上标记4个入水点(根据东西南北的方位分别标记 1、2、3、4)。定位航行实验:从各组分别随机选取 6 只大鼠进行 7 d 实验(每天上、下午各进行1次,每次训练2遍)。训练之前首先将大鼠放到安全平台上停留 2~3 min。实验进行时随机择取一入水点,将大鼠从此入水点背对池水入水,并使同次实验中大鼠的入水点一致;开始记录大鼠从入水点入水后到达平台的时间间隔(逃逸潜伏期)。如果入水90 s之后大鼠仍未到目标地点,则将之引至平台,本次时间间隔记录为 90 s。将每天 4 次的逃逸潜伏期的平均值作为这1天的成绩。空间探索实验:定位航行实验完毕后将平台移走,将大鼠置于水中并记录大鼠在90 s之内穿越平台地点的次数及其在目标象限游泳距离与其游泳总距离的百分比。
1.2.7 各组大鼠的病理学变化 移植后 4 周,将所有大鼠麻醉,升主动脉插管灌注约 120 mL 生理盐水,随后继续灌注 4%多聚甲醛;90 min 后将大鼠脑组织取出固定、包埋,并分别制成石蜡和冰冻切片。石蜡切片进行苏木精-伊红(hematoxylin-eosin,HE)染色并在 25 ℃干燥后荧光显微镜下观察。对冰冻切片实施 4’,6-二脒基-2 苯基吲哚(DAPI)染色后,随机选取荧光显微镜下的10 个视野并计数视野中的CM-Dil阳性细胞数目,取其均值。
1.3 统计学处理
采用 SPSS17.0 统计软件,单因素方差分析,计量结果以(均数±标准差)表示,P<0.05为差异有统计学意义。
2 结果
2.1 GAP-43、AQP4 mRNA 表达
与其他各组相比,假手术组脑组织中 GAP-43mRNA 表达较高,(AM-MSCs+异氟烷)组大鼠脑组织中 GAP-43 mRNA 表达高于脑梗死组、AM-MSCs组、异氟烷组(P<0.05);与脑梗死组相比,异氟烷组和 AMMSCs组的大鼠脑组织中 GAP-43 mRNA 相对表达水平 升 高(P<0.05)。 在 AQP4 mRNA 表达 水 平 方 面 ,(AM-MSCs+异氟烷)组低于其他各组(P<0.05);AMMSCs组和异氟烷组低于脑梗死组,差异有统计学意义(P<0.05),假手术组 AQP4 基因表达水平最低。见图1A、表1。
2.2 GAP-43、AQP4 蛋白表达
在GAP-43蛋白相对表达水平方面,假手术组显著高于其他各组;(AM-MSCs+异氟烷)组与其他组相比较高(P<0.05);与脑梗死组相比,AM-MSCs组和异氟烷组大鼠脑组织中 GAP-43 蛋白相对表达水平提高(P<0.05)。 就 AQP4 蛋 白 相 对 表达 水 平 而 言 ,(AMMSCs+异氟烷)组低于脑梗死组、AM-MSCs组、异氟烷组(P<0.05);AM-MSCs组和异氟烷组均低于脑梗死组(P<0.05);假手术组最低。见图1B、表1。
2.3 NSS 评分比较
随着细胞移植干预后时间的延长,各组大鼠的神经功能均逐渐恢复正常。移植后 1 周,(AM-MSCs+异氟烷)组的NSS评分低于异氟烷组、AM-MSCs移植组,异氟烷组、AM-MSCs移植组低于脑梗死组,梗死组和其他治疗干预组均低于假手术组(P<0.05);见表2。
2.4 移植后 4 周 Morris水迷宫试验
移植后 1~7 d,随着时间的延长,大鼠的平均逃逸潜伏期逐渐缩短。移植后1~2 d,各组之间差异无统计学意义(P>0.05);移植后 3~5 d,假手术组低于其余各组,(AM-MSCs+异氟烷)组平均逃逸潜伏期较异氟烷组、AM-MSCs组缩短(P<0.05);(AM-MSCs+异氟烷)组平均逃逸潜伏期较脑梗死组缩短(P<0.01)。(AMMSCs+异氟烷)组的目标距离百分比高于异氟烷组和AM-MSCs组(P<0.05),并高于脑梗死组,有显著性差异(P<0.01);见表3。
2.5 各组大鼠的病理学变化
移植4周后,脑梗死组大鼠的脑组织为胶质纤维和胶质细胞所填充,并形成明显的胶质瘢痕,脑组织部分萎缩,也可见已经形成的软化灶;但未见到脑组织中有神经索结构。与之相比,异氟烷组和AM-MSCs组大鼠脑组织中软化灶和胶质瘢痕较小,并出现较多的神经索结构;(AM-MSCs+异氟烷)组脑组织中的病变更小,神经索结构更多;假手术组未观察到组织病变,神经索结构最多,见图 2A-2E。在 CM-DiL 阳性细胞方面,(AM-MSCs+异氟烷)组(38.22±5.23)显著高于其他各组,AM-MSCs组(21.36±3.41)和异氟烷组(23.07± 3.25)次之,脑梗死组阳性细胞再次之(8.10±2.92),假手术组最少(3.14±1.04),见图 2F-2J。
4 讨论
研究表明,AM-MSCs移植对神经性疾病有较好的疗效,并可通过分泌神经调节因子修复损坏的神经[9-12]。近年来众多研究发现 AM-MSCs移植可促进中枢神经系统损伤后的神经功能恢复,此外AM-MSCs可向神经样细胞分化,进而抑制脑梗死患者脑组织中神经细胞数量的下降[13-16]。

图1 RT-PCR(A)、Western blotting(B)检测各组大鼠脑组织 GAP-43 和 AQP4 mRNA 及蛋白表达
表1 各组大鼠脑组织 GAP-43 和 AQP4 mRNA 及蛋白表达水平比较(±s)
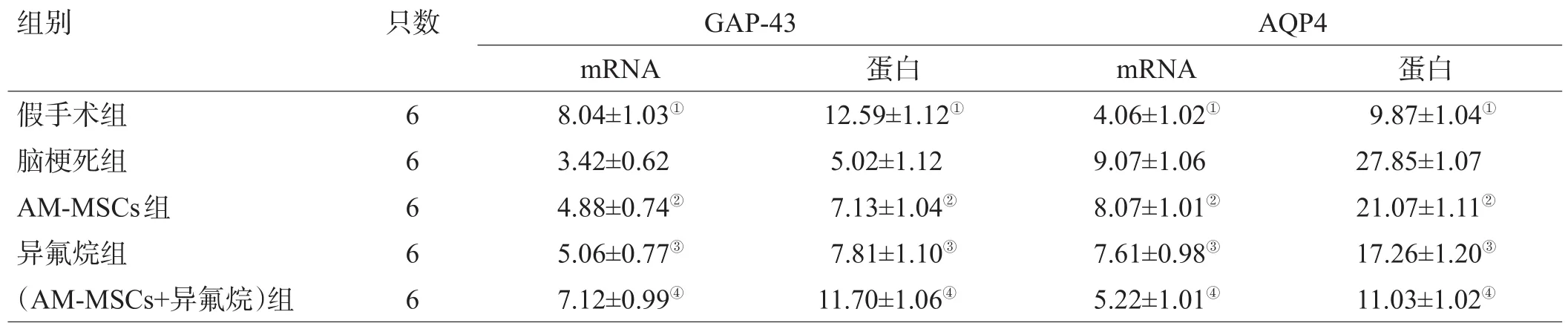
表1 各组大鼠脑组织 GAP-43 和 AQP4 mRNA 及蛋白表达水平比较(±s)
注:与假手术组比较,①P<0.05;与脑梗死组比较,②P<0.05;与 AM-MSCs组比较,③P<0.05;与易氟烷组比较,④P<0.05
组别 只数GAP-43AQP4假手术组脑梗死组AM-MSCs组异氟烷组(AM-MSCs+异氟烷)组6 6 6 6 6 mRNA 8.04±1.03①3.42±0.62 4.88±0.74②5.06±0.77③7.12±0.99④蛋白12.59±1.12①5.02±1.12 7.13±1.04②7.81±1.10③11.70±1.06④mRNA 4.06±1.02①9.07±1.06 8.07±1.01②7.61±0.98③5.22±1.01④蛋白9.87±1.04①27.85±1.07 21.07±1.11②17.26±1.20③11.03±1.02④
表2 各组大鼠 NSS 评分比较(分,±s)
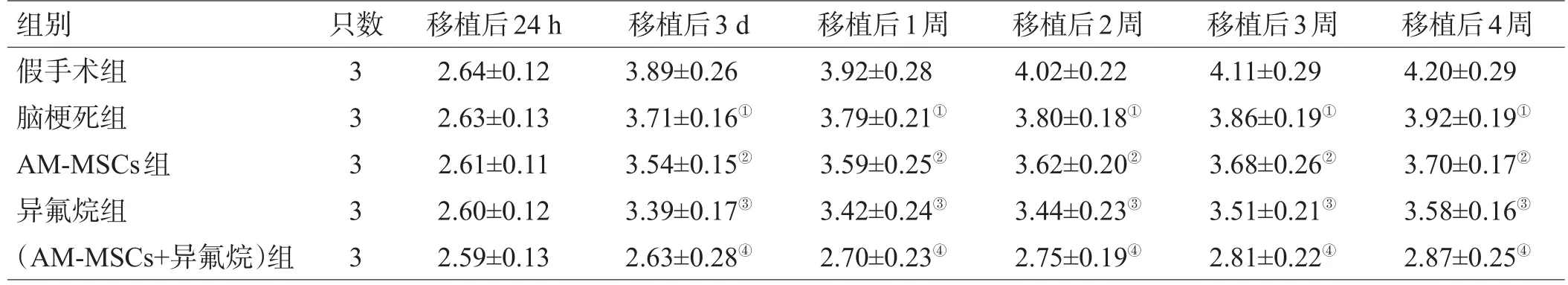
表2 各组大鼠 NSS 评分比较(分,±s)
注:与假手术组比较,①P<0.05;与脑梗死组比较,②P<0.05;与 AM-MSCs组比较,③P<0.05;与易氟烷组比较,④P<0.05
组别假手术组脑梗死组AM-MSCs组异氟烷组(AM-MSCs+异氟烷)组只数3 3 3 3 3移植后24 h 2.64±0.12 2.63±0.13 2.61±0.11 2.60±0.12 2.59±0.13移植后3 d 3.89±0.26 3.71±0.16①3.54±0.15②3.39±0.17③2.63±0.28④移植后1周3.92±0.28 3.79±0.21①3.59±0.25②3.42±0.24③2.70±0.23④移植后2周4.02±0.22 3.80±0.18①3.62±0.20②3.44±0.23③2.75±0.19④移植后3周4.11±0.29 3.86±0.19①3.68±0.26②3.51±0.21③2.81±0.22④移植后4周4.20±0.29 3.92±0.19①3.70±0.17②3.58±0.16③2.87±0.25④
本研究结果显示,(AM-MSCs+异氟烷)联合治疗显著降低AQP4的表达水平,但提高GAP-43的基因和蛋白相对表达。GAP-43是广泛存在于神经细胞中的神经调节因子,可促进脑损伤后的神经系统修复,并被认为是神经再生的标志。本研究中,(AM-MSCs+异氟烷)组大鼠平均逃逸潜伏期显著缩短,空间目标感明显增强。这提示AM-MSCs+异氟烷的联合干预显著提高大鼠的学习和记忆能力。病理学切片可见联合治疗后大鼠脑组织中软化灶和胶质瘢痕显著较小,并出现明显的神经细胞样形态学变化和明显的神经索结构。这从组织结构层面证实(AM-MSCs+异氟烷)干预的良好疗效,提示二者结合在脑梗死治疗中能显著改善脑损伤,促进细胞和组织结构恢复。生理状态下尾静脉移植细胞是无法通过血脑屏障的,然而脑梗死后血脑屏障的开放允许移植细胞通过。本研究结果表明,(AM-MSCs+异氟烷)组大鼠脑组织中的 CM-DiL 阳性细胞显著高于AM-MSCs组;这提示异氟烷的干预促使更多的 AM-MSCs通过血脑屏障,到达脑梗死部位。本研究从实验动物行为学表现、病理组织变化和脑组织标志分子表达三个层面,揭示了异氟烷可增强AM-MSCs移植对脑梗死大鼠的治疗作用。
表3 各组大鼠行为学和记忆能力比较(±s)
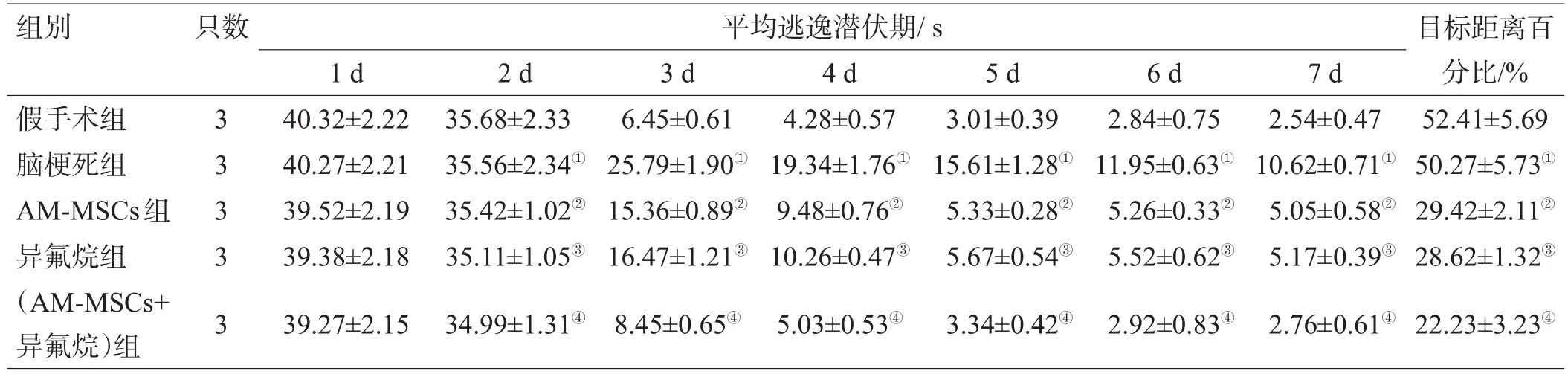
表3 各组大鼠行为学和记忆能力比较(±s)
注:与假手术组比较,①P<0.05;与脑梗死组比较,②P<0.05;与 AM-MSCs组比较,③P<0.05;与易氟烷组比较,④P<0.05
组别 只数 平均逃逸潜伏期/s假手术组脑梗死组AM-MSCs组异氟烷组(AM-MSCs+异氟烷)组3 3 3 3 3 1 d 40.32±2.22 40.27±2.21 39.52±2.19 39.38±2.18 39.27±2.15 2 d 35.68±2.33 35.56±2.34①35.42±1.02②35.11±1.05③34.99±1.31④3 d 6.45±0.61 25.79±1.90①15.36±0.89②16.47±1.21③8.45±0.65④4 d 4.28±0.57 19.34±1.76①9.48±0.76②10.26±0.47③5.03±0.53④5 d 3.01±0.39 15.61±1.28①5.33±0.28②5.67±0.54③3.34±0.42④6 d 2.84±0.75 11.95±0.63①5.26±0.33②5.52±0.62③2.92±0.83④7 d 2.54±0.47 10.62±0.71①5.05±0.58②5.17±0.39③2.76±0.61④目标距离百分比/% 52.41±5.69 50.27±5.73①29.42±2.11②28.62±1.32③22.23±3.23④
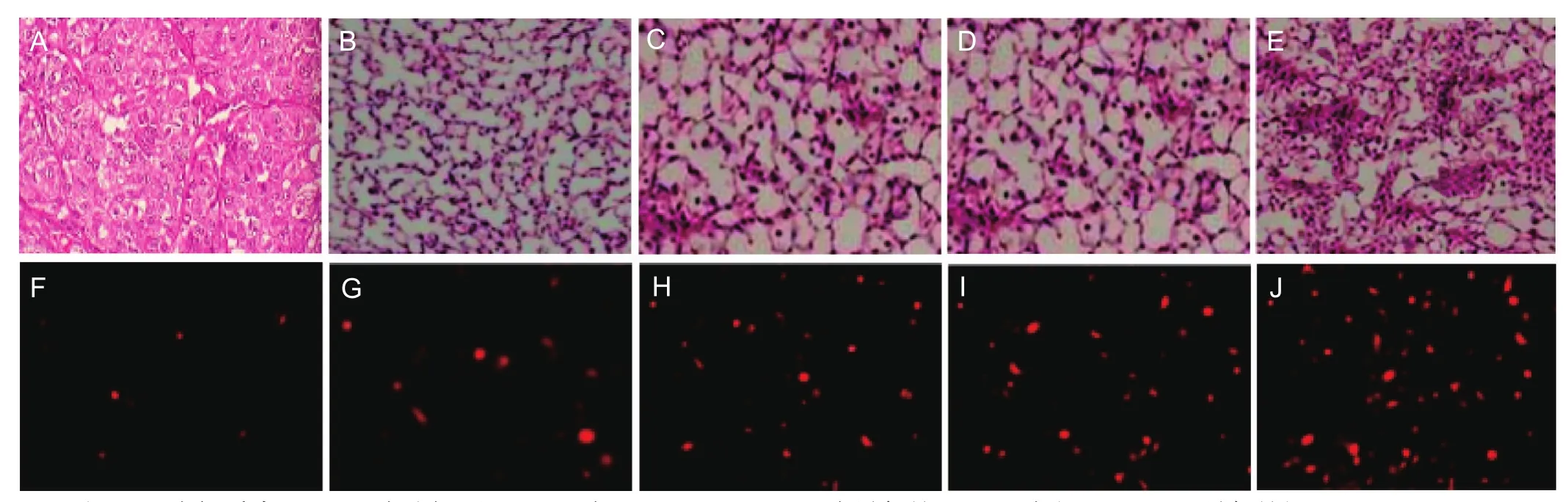
图2 各组大鼠 HE染色(A-E)和免疫组化染色(F-J)观察脑组织病理学变化(×200)
[1]Arboix A,Alió J.Acute cardioembolic cerebral infarction:answers to clinical questions[J].Curr Cardiol Rev,2012,8:54-67.
[2]Yu YL,Chou RH,Shyu WC,et al.Smurf2-mediated degradation of EZH2 enhances neuron differentiation and improves functional recovery after ischaemic stroke[J].MBO Mol Med,2013,5:531-547.
[3] 郭辉,陶蕾,孙美艳.异氟烷预处理对小鼠脑缺血再灌注后缺血半暗带炎性小体 NALP3 表达的影响[J].现代生物医学进展,2015,15: 4467-4470.
[4] 钟志坚,吕加希.促红细胞生成素基因修饰脐带间充质干细胞移植颅脑损伤大鼠脑细胞形态及神经功能的恢复[J].中国组织工程研究, 2012,16:1036-1040.
[5]Zheng W,Honmou O,Miyata K,et al.Therapeutic benefits of human mesenchymal stem cells derived from bone marrow after global cerebral ischemia[J].Brain Res,2010,1310:8-16.
[6] 梁锐超,方芳.内源性神经干细胞在中枢神经系统创伤修复中的研究进展[J].华西医学,2014,1:150-152.
[7]文亚男,郭明广,邓锦波.骨髓间充质干细胞研究进展[J].河南大学学报:自然科学版,2015,45:63-67.
[8]陈厚良.人胚胎干细胞培养体系的研究进展[J].安徽医科大学学报, 2014,49:1-6.
[9]王慎安,李云革.脑梗死颈动脉狭窄患者的相关危险因素研究[J].神经损伤与功能重建,2015,10:536-537,540.
[10]Banas RA,Trumpower C,Bentlejewski C,et al.Immunogenicity and immunomodulatory effects of amnion-derivedmultipotent progenitor cells [J].Human Immunol,2008,69:321-328.
[11]冯士军,韩建国.RhoA基因沉默联合脐带间充质干细胞移植脑损伤大鼠功能的恢复[J].中国组织工程研究,2013,1:23-30.
[12]姚观平,余丽梅,范振海,等.人羊膜间充质干细胞移植骨髓抑制小鼠的造血功能[J].中国组织工程研究,2013,17:4248-4255.
[13]曾宪卿,段言峰,何俊,等.超声射频信号技术检测脑梗死患者颈动脉的研究[J].神经损伤与功能重建,2016,11:15-17.
[14]Zhang Y,Wang D,Zeng H,et al.Differentiation of human amniotic mesenchymal stem cells into insulin-secreting cells induced by regenerating pancreatic extract[J].Sheng Wu Gong Cheng Xue Bao,2012,28:214-221.
[15]Kim SW,Zhang HZ,Kim CE,et al.Amniotic mesenchymal stem cells with robust chemotactic properties are effective in the treatment of a myocardial infarction model[J].Int J Cardiol,2013,168:1062-1069.
[16]Penn-Barwell JG,Murray CK,Wenke JC.Local antibiotic delivery by a bioabsorbable gel is superior to PMMA bead depot iin reducing infection in an open fracture model[J].J Orthop Trauma,2014,28:370-375.
(本文编辑:王晶)
Effect of Human Amnion Mesenchyme Stem Cell Transplantation Combined with Isoflurane on Rats with Cerebral Infarction
TONG Ning1,ZHOU Ye-bo2.
1.Department of Neurology,Heze Municiple Hospital,Shandong 274000,China;2.Department of Neurology,Nanjing Medical University,Nanjing 210029,China
Objective:To observe the effect of amnion mesenchyme stem cells(AM-MSCs)transplantation combined with isoflurane on the recovery of neurological function in rats with cerebral infarction.Methods: One hundred rats model of cerebral infarction of middle cerebral artery occlusion was established by suture method,which were randomly divided into groups sham-operation,cerebral infarction,AM-MSCs,isoflurane and (AM-MSCs+isoflurane),corresponding treatment given at 6 h after modeling.Six rats in each group were sacrificed randomly after transplantation,and the changes of GAP-43,AQP4 mRNA and protein expression in brain tissue were detected by RT-PCR and Western Blot.After 24 h,neurological severity score(NSS)was performed at 1,2,3 and 4 weeks after transplantation.The Morris water maze test was performed at 21~28 d after transplantation.After 4 weeks,the rats were killed and the pathological changes were observed by immunohistochemistry and HE staining.Results:At 7 d after transplantation,GAP-43 mRNA and protein of(AM-MSCs+isoflurane) group in brain tissue were higher than those of groups cerebral infarction,AM-MSCs and isoflurane(P<0.05). The expression of GAP-43 mRNA and protein levels in cerebral infarction group were higher than those of groups isoflurane and AM-MSCs(P<0.05).The expression of AQP4 mRNA and protein in(AM-MSCs+isoflurane)group was lower than those in other groups(P<0.05).AM-MSCs group and isoflurane group were lower than those in cerebral infarction group(P<0.05).At 1 week after transplantation,the NSS score of the(AMMSCs+isoflurane)group was lower than that of groups isoflurane and AM-MSCs,while that of isoflurane group and AM-MSCs transplantation group were lower than that of cerebral infarction group(P<0.05).At 3~5 d after transplantation,the mean escape latency of(AM-MSCs+isoflurane)group was shorter than that of groups isoflurane,AM-MSCs and cerebral infarction(P<0.05 orP<0.01).The percentage of target distance of(AM-MSCs+ isoflurane)group was higher than that of groups isoflurane and AM-MSCs(P<0.05),and higher than that of cerebral infarction group(P<0.01).At 4 weeks after injury,there was no axon in the cerebral infarction group,andthere was a small amount of nerve axon like structure in the groups isoflurane and AM-MSCs,and there was a lot of nerve axon like structure(AM-MSCs+isoflurane)group(P<0.05).The number of CM-Dil positive cells of(AM-MSCs+isoflurane)group was higher than that in AM-MSCs group,while that in isoflurane group was higher than that in cerebral infarction group(P<0.05).Conclusion:Isoflurane intervention combined withAM-MSCs transplantation can improve neurological function in rats with cerebral infarction.
human amniotic mesenchymal stem cells;transplantation;isoflurane;rat;cerebral infarction;function
R741;R651.1
ADOI10.16780/j.cnki.sjssgncj.2017.03.001
1.山东菏泽市立医院神经内科山东 菏泽 274000 2.南京医科大学神经内科南京 210029
2016-04-13
童宁tongninglw@163. com
