阳离子脂质体基因载体的稳定性研究
2017-06-06赵轶男张树彪
赵轶男,刘 安,付 莹,张树彪
(大连民族大学 教育部生物技术与资源利用重点实验室,辽宁 大连 116605)
阳离子脂质体基因载体的稳定性研究
赵轶男,刘 安,付 莹,张树彪
(大连民族大学 教育部生物技术与资源利用重点实验室,辽宁 大连 116605)
从阳离子脂质体的形态、平均粒径、粒径分布、Zeta电位及浊度等方面,考察了季铵盐型阳离子脂质体CPA14的稳定性。经透射电子显微镜检测,阳离子脂质体呈球形结构,粒径为100~200 nm。经粒度分析仪检测,阳离子脂质体平均粒径为210~260 nm,颗粒分布均匀,Zeta电位为55~90 mV。脂质体在4 ℃条件下存放3个月,外观无明显变化,脂质体的浊度变化不大。证实季铵盐型阳离子脂质体CPA14稳定性良好,适合用作基因载体进行基因转运。阳离子脂质体与质粒DNA在N:P质量比为3:1时可高效转染人宫颈癌细胞,与商品转染试剂DOTAP转染效率相当。为新型季铵盐型阳离子脂质体基因载体的构建提供了理论依据。
阳离子脂质体;粒径;Zeta电位;浊度;转染效率
在基因治疗发展的几十年里,全世界启动了超过1 500个基因转染的基因治疗临床试验。1990年美国国立卫生研究院采用基因治疗方法对腺苷脱氨酶缺陷症进行治疗,首次将基因治疗应用到临床并取得了成功[1]。2000年法国采用基因治疗方法成功治疗联合免疫缺陷综合症[2],从此证实了基因治疗策略的有效性。基因治疗要得到进一步的发展,必须获得具有靶向性的高效的基因导入系统。阳离子脂质体是目前研究最透彻、技术最成熟、应用最广泛的非病毒基因载体系统,具有制备容易、无免疫原性、缓释性能好、外源基因容纳量不受限制等优点[3]。但由于其体内基因表达持续时间短,转染效率低等问题,限制了阳离子脂质体基因载体的临床应用。而阳离子脂质体的稳定性是导致这些问题的重要因素之一。脂质体膜是动态膜,磷脂分子间不断交换位置,脂质体颗粒可自发聚集、沉降,造成脂质体的不稳定[4]。而阳离子脂质体的稳定性能延长阳离子脂质体载体的体内循环时间,延缓药物的释放,为持续靶向给药提供方便,能获得良好的治疗效果[5-6]。
本文选取课题组合成的季铵盐型阳离子类脂CPA14与助类脂二油酰基磷脂酰乙醇胺(DOPE)结合制备阳离子脂质体,其中CPA14的化学结构如图1。通过激光粒度仪测定脂质体的平均粒径、粒径分布及Zeta电位;通过透射电子显微镜测定脂质体的形态变化;采用浊度计测量脂质体的浊度变化。从阳离子脂质体的物理化学性质方面考察了脂质体的稳定性,并将阳离子脂质体作为基因载体运载质粒DNA转染Hela细胞,考察脂质体基因载体的体外转染效率,从而为季铵盐型阳离子脂质体介导基因转运研究提供理论依据及实验指导。

图1 季铵盐型阳离子类脂CPA14的化学结构
1 实验部分
1.1 试剂与仪器
阳离子类脂CPA14(课题组合成);二油酰基磷脂酰乙醇胺(DOPE,上海西格玛有限公司);人宫颈癌细胞Hela(中国科学院上海细胞库);1,2-二油烯氧基-3-三甲氨基丙烷(1,2-dioleoyl-3-trimethy-lammonium-propane(chloride salt),DOTAP,美国Roche公司);质粒pGFP-N2(含绿色荧光蛋白基因,实验室提取);磷酸盐缓冲液(DPBS,生工生物工程(上海)股份有限公司);Opti-DMEM培养基、胎牛血清(美国Gibco公司)。
携Zeta电位测定与纳米激光散射粒度分布仪(SZ-100,日本HORIBA公司);浊度计(WGZ-2000,上海仪电物理光学仪器有限公司);超纯水仪(美国Millipore公司);倒置荧光显微镜(IX71,日本Olympus公司);二氧化碳培养箱(美国Thermo公司);高压蒸汽灭菌锅(MLS-3750,日本三洋公司)。
1.2 阳离子脂质体的制备
按照1:1摩尔比准确称取类脂CPA14和DOPE,加入氯仿溶解,在N2下吹干形成均匀薄膜。将膜置于真空干燥箱过夜,准确加入0.5 mL预热的无水乙醇和4.5 mL超纯水,浸泡2 h。反复超声振荡处理,使膜充分溶解以至澄清,即得到阳离子脂质体,置于4 ℃冰箱保存待用。
1.3 脂质体的平均粒径及Zeta电位测定
阳离子脂质体每隔15天测定其平均粒径和Zeta电位,通过携Zeta电位测定与纳米激光散射粒度分布仪测量,测定前将脂质体经超声处理后,用超纯水稀释,1 mL超纯水加入20 μL脂质体样品。检测条件为波长630 nm的氦-氖激光,重复测量3次。
1.4 阳离子脂质体的形态测定
脂质体的形态主要是通过负染色透射电子显微镜(TEM)来表征。阳离子脂质体超声10 min,400目碳膜铜网吸附脂质体20~30 min,滴上2%磷钨酸染色30 s,干燥后在透射电镜下观测并照相,加速电压200 kV,检测最小物镜光阑孔为20~30 μm,放大倍数为15~30 K[4]。
1.5 阳离子脂质体的浊度检测
阳离子脂质体浊度测定通过WGZ-2000型浊度计测定,测定前将脂质体超声处理,准确移取脂质体20 μL,用1 mL超纯水稀释,样品测量重复5次,仪器稳定显示的读数即为被测样品浊度值。
1.6 阳离子脂质体转染绿色荧光蛋白基因
将Hela细胞种植于24孔细胞培养板中,每孔加DMEM细胞培养液(含双抗和血清)400 μL,浓度约为1.0×106个/孔。将细胞放置在37 ℃,5% CO2培养箱中孵育24 h,使在转染日细胞密度达80%~90%。移去生长培养基,用等量DME培养基(无血清)清洗,再用等量DMEM培养基(无血清)替换。将脂质体/DNA复合物100 μL,加到每孔中,摇动培养板,轻轻混匀。放在37 ℃,5% CO2培养箱中培养4~5 h,更换含10%血清和抗生素的培养基,培育48 h。采用倒置荧光显微镜进行基因表达分析,观察倍数20×10。
2 结果与讨论
2.1 阳离子脂质体的稳定性
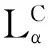

图2 阳离子脂质体三个月内的浊度变化
2.2 阳离子脂质体的平均粒径
脂质体的粒径对脂质体稳定性的影响很大,粒径较大的脂质体(>300 nm) 缺乏血管通透性,不能通过肝血管的细胞间隙,易被网状内皮系统吞噬,故在体内的半衰期较短。粒径小于300 nm的脂质体可以减少肝、脾的摄取,增加靶部位的聚集,延长其在血液中的半衰期[7-9]。另外,不同大小的脂质体融合和聚集的程度不同,也会影响脂质体的储存时间。阳离子脂质体的平均粒径的统计结果如图3。
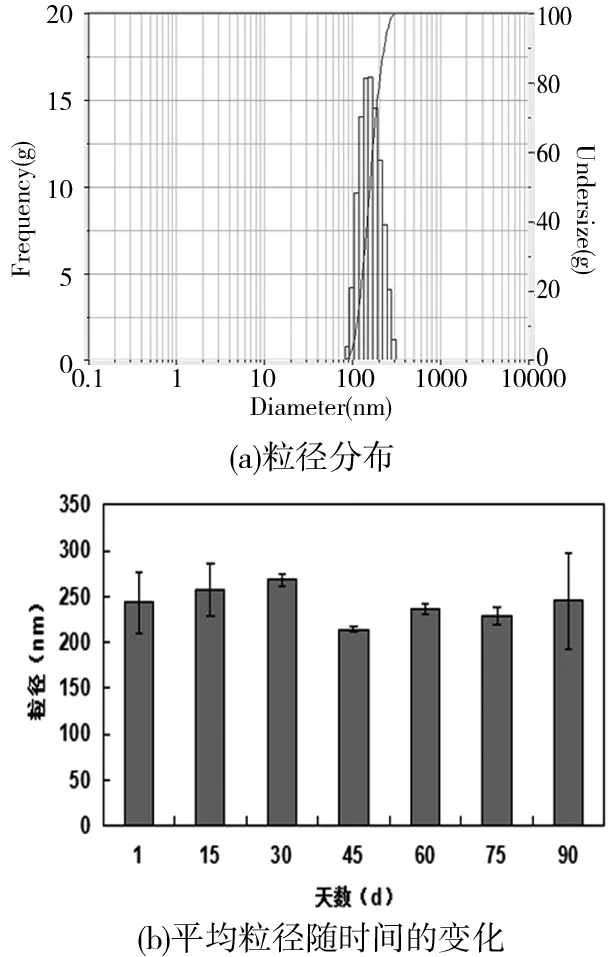
图3 阳离子脂质体的平均粒径
本文方法制得的阳离子脂质体的平均粒径在210~260 nm,随着脂质体放置时间的增加,粒径没有明显变化。脂质体的粒径分布通常用多分散性系数PDI值表示,PDI值越小,表明粒径分布的范围越窄,说明分散体系中颗粒的粒径具有较好的规整度和均一性,通常认为较小的粒度分布对应脂质体具有较好的稳定性,适于体内转染的应用;PDI值越大,越接近于1,表明脂质体颗粒分布越不均一[10-11]。本文所制备脂质体的PDI值都在0.3左右,脂质体的有效粒径分布均较窄,说明阳离子脂质体颗粒分布比较均匀。
2.3 阳离子脂质体的Zeta电位
脂质体表面带电性的一个重要指标就是Zeta电位,Zeta电位的大小可以预测脂质体系是否稳定[12]。Zeta电位越大表示脂质体表面所带电荷越多,可使由双电层引起的静电斥力增大,凝聚时要克服的能量越大,越不易产生凝聚,从而增加脂质体稳定性。此外,Zeta电位的高低还表明了其压缩DNA的能力,一般来说,Zeta电位越大,其压缩DNA的量越多,但同时细胞的毒性也越大,因此要将脂质体的Zeta电位控制在一个合适的范围。通常情况下,脂质体Zeta电位绝对值小于30 mV时,荷电粒子不稳定,容易聚集;脂质体Zeta电位绝对值大于30 mV时,具有较好的静电稳定性;而绝对值大于60 mV,已经相当稳定[13]。制备的阳离子脂质体的电位分布和Zeta电位如图4。

图4 阳离子脂质体的Zeta电位
3个月内脂质体的Zeta电位在55~90 mV变化,具有一定的电荷稳定性,可保证阳离子脂质体具有较好的稳定性。
2.4 阳离子脂质体的形态
透射电子显微镜是表征分子有序组合体微观形态的最直观检测手段,本文采用透射电子显微镜观察所制备脂质体的形态。采用负染色技术将脂质体滴加在附有碳膜的铜网上,以2%磷钨酸水溶液对脂质体的背景进行染色,脂质体被高密度的磷钨酸染色剂包围形成背景。背景对电子束产生散射作用,相对较暗,而大多数电子束可以穿过脂质体,于是屏幕上就形成了暗色背景下脂质体较亮的图像。这种方法能较好地观察脂质体的二维结构,但不能观察其三维表面特征,脂质体透射电镜结果如图5。
阳离子脂质体放置三个月后,电镜观察形态相差不大,脂质体基本为球形结构,平均粒径在100 nm以内,颗粒分布比较均匀。对比图3可看出,由电镜测得的粒径相对于粒度仪测得的平均粒径要小。这是因为电镜是极少的点面静态颗粒测量,粒度仪是立体的、大量的、动态测量;另外,脂质体失水后,粒径也要变小一些。由电镜图可以看出,脂质体平均粒径较小,形态相差不大,分布较为均匀,说明脂质体具有很好的稳定性。

图5 阳离子脂质体透射电镜(加速电压100kV)
2.5 阳离子脂质体转染绿色荧光蛋白基因
质粒pGFP-N2中含有绿色荧光蛋白基因,基因表达的产物含有绿色荧光蛋白(GFP),阳性细胞发出明亮的绿色荧光,GFP阳性细胞越多,信号越强,表明转染效率越高,可以定性分析脂质体/DNA复合物的转染效率[14-16]。选取制备三个月后的脂质体CPA14,与质粒DNA按质量比(N:P)为1:1,3:1,6:1和8:1分别制备脂质体/DNA复合物,转染对数增殖期的Hela细胞,定性分析阳离子脂质体的转染效率,结果如图6。

图6 阳离子脂质体介导pGFP-N2质粒转染Hela细胞绿色荧光蛋白表达
在N:P比为1时,阳离子脂质体压缩的质粒DNA量较少,转染效率不高;当N:P比为6和8时,由于阳离子脂质体用量相对较大,可能会对Hela细胞产生一定毒性,导致细胞转染效率降低。阳离子脂质体与质粒DNA以3:1质量比制备的脂质体/DNA复合物能高效转染Hela细胞,且与商品转染试剂DOTAP转染效率相当。
3 结 论
本文通过对季铵盐型阳离子脂质体CPA14的平均粒径、粒径分布、Zeta电位及浊度等方面的研究,考察了脂质体的稳定性。所制备的阳离子脂质体澄清透明,在4 ℃条件下存放3个月,外观无明显变化,无沉淀析出,稳定性较好。经透射电子显微镜检测,阳离子脂质体呈球形结构,粒径小于100 nm;经粒度分析仪检测,阳离子脂质体的粒径在210~260 nm,脂质体的PDI 值均在0.3左右,粒径分布较均一,粒径分散均匀,Zeta电位为55~90 mV,具有一定的电荷稳定性。脂质体的浊度在7.0 NTU左右,且随着时间的增加并无明显变化,具有良好的稳定性。阳离子脂质体与质粒DNA在N:P质量比为3:1时可高效转染人宫颈癌细胞,与商品转染试剂DOTAP相当。实验结果表明所构建的季铵盐型阳离子脂质体具有良好的稳定性,满足作为基因转染载体的条件,有适于体内外转染的应用潜力,具有一定的应用价值。
[1] CRYSTAL R G. Transfer of genes to humans: Early lessons and obstacles to success [J]. Science, 1995, 270(5235): 404-410.
[2] CAVAZZANA C M, HACEIN B S, SAINT B G, et al. Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease [J].Science, 2000,288: 669-672.
[3] ZHAO Y N, ZHANG S B, CUI S H, et al. Peptides-based cationic liposomes-mediated gene delivery [J]. Expert Opinion on Drug Delivery, 2012, 9(1): 127-139.
[4] ZHAO Y N, ZHANG S B, ZHANG Y, et al. Tri-peptide cationic lipids for gene delivery [J]. Journal of Material Chemistry B, 2015, 3: 119-126.
[5] WASUNGU L, HOEKSTRA D. Cationic lipids, lipoplexes and intracellular delivery of genes[J]. Controlled Release, 2006, 116(2): 255-264.
[6] 赵轶男, 张树彪, 崔韶晖, 等. 阳离子脂质体介导基因转染肿瘤细胞[J].中国细胞生物学学报, 2013, 35(10): 1459-1464.
[7] 赵轶男, 张树彪, 崔韶晖, 等. 胆固醇嵌入式阳离子脂质体运载基因研究[J].中国细胞生物学学报, 2014, 36(9): 1257-1261.
[8] KREUTER J. Nanoparticulate systems for brain delivery of drugs [J]. Advanced Drug Delivery Reviews, 2001, 47(1): 65-81.
[9] FRIEND D S, PAPAHADJOPOULOS D, DEBS R J. Endocytosis and in-tracellular processing accompanying transfection mediated by cationic liposomes [J]. Biochim Biophys Acta, 1996, 1278(1): 41-50.
[10] ZHAO Y N, QURESHI F, ZHANG S B, et al. Novel gemini cationic lipids with carbamate groups for gene delivery [J]. Journal of Material Chemistry B, 2014, 2: 2920-2928.
[11] ZHI D F, ZHANG S B, QURESHI F, et al. Structure-activity relationship of carbamate-linked cationic lipids bearing hydroxyethyl headgroup for gene delivery [J]. Colloids and Surfaces B: Biointerfaces, 2013, 112(1): 537-541.
[12] HEURTAULT B, SAULNIER P, PECH B, et al. Physico-chemical stability of colloidal lipid particles[J]. Biomaterials, 2003, 24(23): 4283-4300.
[13] ZUHORN I S, BAKOWSKY U, POLUSHKIN E, et al. Nonbilayerphase of lipoplexes membranemixture determines endosomal escape of genetic cargo and transfection efficiency [J]. Molecular Therapy, 2005, 11(5): 801-810.
[14] GAO X, HUANG L. A novel cationic liposome reagent for efficient transfection of mammaliam cells [J]. Biochemical and Biophysical Research Communications, 1991, 179(1): 280-285.
[15] METWALLY A A, BLAGBROUGH I S, MANTELLJ M. Quantitative silencing of EGFP reporter gene by self-assembled siRNA lipoplexes of LinOS and cholesterol [J]. American Chemical Society, 2012, 9(11): 3384-3395.
[16] ZHI D F, ZHANG S B, QURESHI F, et al. Synthesis and biological activity of carbamate-linked cationic lipids for gene deliveryinvitro[J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22: 3837-3841.
(责任编辑 赵环宇)
Study on Stability of Cationic Liposomes Gene Carriers
ZHAO Yi-nan, LIU An, FU Ying, ZHANG Shu-biao
(SEAC-ME Key Laboratory of Biotechnology and Bio-resources Utilization, Dalian Minzu University, Dalian Liaoning 116605, China)
The stability of liposome CPA14 was studied by examining the size, morphology, Zeta potentials and turbidity. The TEM showed the particle sizes of liposomes which is of spherical structure were 100~200 nm, and the dynamic light scattering showed the particle size of cationic liposomes were from 210 to 260 nm, which were distributed uniformly. Zeta potentials of the liposomes were between 55~90 mV. The appearance of liposomes did not change significantly at 4 ℃ for 3 months. The turbidity of liposomes remained unchanged in three months. It was confirmed that the quaternary ammonium cationic liposome CPA14 had good stability and was suitable for gene transfer.Invitrotransfection of the liposomes was evaluated by using pGFP-N2 plasmid DNA against Hela cells. The results indicated that they had nearly the same transfection to the reagent DOTAP at the N:P ratio of 3:1. The results provide a theoretical basis for the construction of a novel quaternary ammonium cationic liposome gene carriers.
cationic liposomes; particle sizes; Zeta potentials; turbidity; transfection efficiency
2017-03-27;最后
2017-04-10
国家自然科学基金项目(21176046,21606041), 国家高新技术研究发展计划(863计划)项目(2014AA020707),中央高校基本科研业务费专项资金资助项目(DC201501076)。
赵轶男(1979-), 女, 辽宁抚顺人, 高级工程师, 博士,主要从事基因载体及其输送技术研究。
张树彪(1971-), 男, 教授, 博士生导师, 主要从事基因载体及其递送技术研究,E-mail:zsb@dlnu.edu.cn。
2096-1383(2017)03-0202-05
R941
A
