IRF-2对胰腺癌细胞生物学特性及化疗敏感性的影响
2017-06-05沈根海高泉根
王 刚 沈根海 高泉根
IRF-2对胰腺癌细胞生物学特性及化疗敏感性的影响
王 刚 沈根海 高泉根
目的 探讨干扰素调控因子2(interferon regulatory factor 2,IRF-2)在胰腺癌细胞中的生物学特性及其对吉西他滨化疗敏感性的影响。方法 Western blot检测IRF-2基因在胰腺癌细胞株PANC-1及MIAPaCa-2中的表达水平,采用MTT检测吉西他滨对PANC-1及MIAPaCa-2的半数有效浓度(IC50),选择较为耐药的PANC-1细胞进行IRF-2基因干扰表达,并采用MTT检测吉西他滨对PANC-1及干扰IRF-2表达的PANC-1 si 1#的半数有效浓度(IC50)。结果 PANC-1及MIAPaCa-2中细胞中均存在IRF-2基因的表达,且PANC-1细胞中表达水平比MIAPaCa-2高。吉西他滨对PANC-1细胞的IC50显著高于MIAPaCa-2细胞,差异有统计学意义(P<0.05);干扰IRF-2表达的PANC-1 si 1#细胞其IC50值显著低于PANC-1对照细胞,差异有统计学意义(P<0.05)。结论 IRF-2基因可作为影响胰腺癌对吉西他滨化疗敏感性的基因之一,干扰IRF-2基因能够有效地提升胰腺癌细胞对吉西他滨化疗的敏感性。
干扰素调控因子2;胰腺癌;吉西他滨;化疗敏感性
(ThePracticalJournalofCancer,2017,32:542~544)
胰腺癌是恶性程度较高的一种肿瘤,由于早期诊断率低,多数胰腺癌确诊时已为中晚期,因此化疗是多数胰腺癌患者的综合治疗的主要方法之一[1-2]。吉西他滨仍代表着胰腺癌化疗的传统标准方案[3]。但是由于其内源性的耐药导致其临床上的疗效一般,因此近年来一系列的体外实验尝试检测对吉西他滨化疗敏感性产生影响的分子指标。干扰素调控因子-2(interferon regulatory factor-2,IRF-2)为干扰素调控因子家族中的一员,其生物学功能涉及到机体的免疫调节以及肿瘤的发生发展等生物学过程。有文献[4-6]报道IRF-2参与了原发性肝癌、Kaposi's肉瘤等恶性肿瘤的发生、发展,Sakai等[5]研究证实IRF-2的高表达水平与胰腺癌的进展呈密切关联,说明其在胰腺癌的发生发展过程中也起着重要的作用。但是关于IRF-2在胰腺癌中的细胞生物学的特性及其对吉西他滨化疗敏感性的影响,目前国内报道并不多见。本研究拟探讨IRF-2对胰腺癌细胞生物学特性及化疗敏感性的影响,现报告如下。
1 材料与方法
1.1 材料和试剂
人胰腺癌细胞株PANCl及MiaPaCa-2购于美国ATCC(American Type Culture Collection),上述胰腺癌细胞株在含10%胎牛血清的DMEM培养基中培养。所选用的药物吉西他滨(生产批号131022江苏豪森医药公司生产),0.2 g/支。
1.2 研究方法
1.2.1 Western blot检测IRF-2基因在PANC-1及MIAPaCa-2细胞系中的表达 取对数生长期的PANC-1及MIAPaCa-2细胞培养24 h后予以提取细胞总蛋白,并进行SDS-聚丙烯酰胺凝胶电泳,待显色后再于硝酸纤维素膜上置入含DAB的缓冲液中,同时采用数字凝胶成像系统进行摄像,分别检测2个细胞系的IRF-2蛋白表达情况。
1.2.2 PANC-1及MIAPaCa-2细胞吉西他滨的IC50检测 将PANC-1及MIAPaCa-2细胞均匀地铺在96孔板中,过夜贴壁后分别用浓度为0.1、1、10、100 μg/ml的吉西他滨处理细胞72 h,每个时间点均做3个平行孔,最后用MTT法检测细胞的增殖率(OD值),并与各自无药物处理的对照组进行对比,计算PANC-1及MIAPaCa-2细胞吉西他滨的半数有效浓度(IC50),IC50的计算公式为:lg IC50=Xm-I[P-(3-Pm-Pn)/4],其中Xm为lg最大浓度,I为lg(最大浓度/相邻浓度),P为阳性反应率之和,Pm为最大阳性反应率,Pn为最小阳性反应率。
1.2.3 不同IRF-2表达水平的PANC-1细胞吉西他滨的IC50检测 用氯化钙转染293T细胞获得慢病毒,将慢病毒进行高速离心纯化,然后将不同浓度慢病毒感染PANC-1细胞后采用siRNA技术下调IRF-2基因的表达,并命名为PANC-1 si 1#,具体方法见参考文献[7]。将等量的未处理的PANC-1细胞和PANC-1 si 1#细胞均匀的铺在96孔板中,过夜贴壁后用1.2.2中的方法处理细胞72 h,并检测IC50值。
1.3 统计学方法
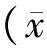
2 结果
2.1 PANC-1及MIAPaCa-2细胞系中IRF-2的表达及其IC50情况
Western blot检测结果示IRF-2基因在PANC-1细胞系中的表达水平高于MIAPaCa-2细胞系,见图1。MTT结果示PANC-1细胞的IC50值为(16.72±2.33)μg/ml,显著高于MIAPaCa-2细胞的(5.82±1.34)μg/ml,差异有统计学意义(P<0.05),见图2。

图1 PANC-1及MIAPaCa-2细胞系中IRF-2的表达情况

图2 吉西他滨作用PANC-1及MIAPaCa-2细胞的IC50比较
2.2 下调IRF-2的表达对PANC-1细胞吉西他滨化疗敏感性的影响
PANC-1细胞的IC50值为(15.87±2.14)μg/ml,显著高于PANC-1 si 1#细胞的(9.63±1.44)μg/ml,差异有统计学意义(P<0.05),见图3。

图3 下调IRF-2的表达对PANC-1细胞吉西他滨化疗 敏感性的影响
3 讨论
化疗尤其是吉西他滨在胰腺癌综合治疗中占有举足轻重的作用,单独或者以吉西他滨为基础的多种胰腺癌化疗方案能够显著延长胰腺癌患者的生存期[8]。吉西他滨是目前胰腺癌综合治疗中最常用的化疗药物之一,它是一种细胞周期特异性的抗代谢药物,主要作用于处于G1期及S期的肿瘤细胞,能够阻止肿瘤细胞由G1期转向S期分裂,转化后的活性物质竞争性的抑制DNA链延长,最终导致肿瘤细胞的凋亡。然而由于细胞的凋亡和周期改变常常由许多相互影响的网格化信号通路控制着,因此任何信号通路上的调控蛋白改变都可能使肿瘤细胞产生对化疗药物的耐药性。多项研究[9-10]已经证实相关基因参与了吉西他滨的耐药,说明胰腺癌患者对吉西他滨化疗的耐药性是一种多基因参与、多信号通路介导的分子生物学事件[11]。因此对胰腺癌患者产生耐药的相关基因的检测显得尤为必要。
本研究结果表明PANC-1细胞中IRF-2基因的表达水平高于MIAPaCa-2细胞,同时MTT结果显示吉西他滨对PANC-1细胞作用的IC50也显著高于MIAPaCa-2细胞,说明IRF-2基因在不同的胰腺癌细胞中表达水平存在差异,而且这种差异可能影响其对吉西他滨化疗的敏感性。为证实IRF-2对胰腺癌吉西他滨化疗的敏感性,本研究进一步通过沉默PANC-1细胞IRF-2基因的表达,并用吉西他滨处理细胞,发现干扰IRF-2基因表达的PANC-1细胞对吉西他滨的IC50值显著低于正常表达者。表明选择性的IRF-2基因的低表达能够增加胰腺癌细胞对吉西他滨化疗的敏感性。IRF-2是定位于4号染色体长臂的基因之一,其不仅在免疫调节以及干扰素信号通道中发挥作用,还可作为癌基因通过调控细胞凋亡及周期转变参与肿瘤的发生和发展。IRF-2能够激活促进细胞进行G1-S期细胞周期转换和DNA复制必须的调控原件-组蛋白H4转录。此外IRF-2还能够通过转变为突变的N-ras基因导致细胞生长受到抑制、抑制巨噬细胞的凋亡等途径促进肿瘤细胞的生长[4]。有研究[6]表明与IRF-2的DNA结合结构域一旦出现点突变就可使肿瘤细胞的增殖受到显著的抑制,因而可以促进细胞的凋亡。此外有研究[12]证实在胰腺癌的吉西他滨化疗过程中Ⅰ型干扰素能够增强其对化疗的敏感性,而IRF-2基因则在Ⅰ型干扰素的信号转导通路中起到一定的促进作用。这充分说明IRF-2在胰腺癌的发生发展中发挥着重要的作用。
总之,IRF-2基因可作为影响胰腺癌对吉西他滨化疗敏感性的基因之一。根据胰腺癌表达的遗传学和肿瘤标志物来选择合适的治疗策略是未来胰腺癌个体化靶向治疗的发展方向[13],因此IRF-2基因有可能作为未来个体化靶向治疗新的靶点。但是其确切的分子生物学机制仍需深入细致的研究,以证实其确实参与并介导了对化疗的耐药。
[1] 苏维宏,孙 备.胰腺癌化疗:替吉奥与吉西他滨的应用及展望〔J〕.中华胰腺病杂志,2014,14(1):69-72.
[2] 李慧超,王 宁,郑荣寿,等.中国2010年胰腺癌发病和死亡分析〔J〕.中国肿瘤,2015,24(3):163-169.
[3] 中华医学会外科学分会胰腺外科学组.胰腺癌诊治指南(2014版)〔J〕.中华消化外科杂志,2014,13(11):831-837.
[4] Kim Y,Cha S,Seo T.Activation of the phosphatidylinositol 3-kinase/Akt pathway by viral interferon regulatory factor 2 of Kaposi's sarcoma-associated herpesvirus〔J〕.Biochem Biophys Res Commun,2016,470(3):650-6.
[5] Sakai T,Mashima H,Yamada Y,et al.The roles of interferon regulatory factors 1 and 2 in the progression of human pancreatic cancer〔J〕.Pancreas,2014,43(6):909-16.
[6] Yi Y,Wu H,Gao Q,et al.Interferon regulatory factor (IR- F)-1 and IRF-2 are associated with prognosis and tumor invasion in HCC〔J〕.Ann Surg Oncol,2013,20(1):267-76.
[7] 崔 磊.IRF-2在胰腺癌中的功能及其对胰腺癌细胞化疗敏感性的影响〔D〕.复旦大学,2012.
[8] 张太平,曹 喆,赵玉沛,等.胰腺癌的化疗与放疗〔J〕.中华消化外科杂志,2015,14(8):619-622.
[9] 郑衍玲,李 艳,罗红敏,等.Smac/DIABLO诱导胰腺癌细胞凋亡并增加对TRAIL及吉西他滨化疗的敏感性〔J〕.中华普通外科杂志,2013,28(3):211-214.
[10] 张建新,蒋海华,毛正发,等.富含半胱氨酸的酸性蛋白增加胰腺癌对吉西他滨化疗敏感性的机制〔J〕.中华肿瘤杂志,2014,36(5):335-340.
[11] 刘笑然,田孝东,杨尹默,等.胰腺癌化疗耐药研究的现状与进展〔J〕.中华实验外科杂志,2013,30(1):10-12.
[12] Hayashi T,Ding Q,Kuwahat T,et al.Interferon-alpha (IF- N-alpha)modulates the chemosensitivity of CD33-expressing pancreatic cancer cells to gemcitabine〔J〕.Cancer Sci,2012,103(5):9-16.
[13] 王三妹,陈宝安.胰腺癌的细胞治疗新进展〔J〕.中国肿瘤生物治疗杂志,2015,22(3):369-374.
(编辑:甘 艳)
Effect of IRF-2 on the Cellular Biological Characteristics and Chemosensitivity ofPancreatic Cancer
WANGGang,SHENGenhai,GAOQuangen.
TheFirstPeople'sHospitalofWujiangDistrict,Suzhou,215200
Objective To study the effect of IRF-2 on cellular biological characteristics and chemosensitivity of pancreatic cancer cells.Methods The expression level of IRF-2 in PANC-1 and MIAPaCa-2 cell lines were detected with Western blot,and the IC50 of PANC-1 and MIAPaCa-2 cell lines were detected with MTT.The IRF-2 gene were interfed in PANC-1 cell lines(named with PANC-1 si 1#),and the IC50 of PANC-1 and PANC-1 si 1# cell lines were also detected by MTT.Results PANC-1 and MIAPaCa-2 cells exist in IRF-2 gene expression,PANC-1 cells than MIAPaCa-2 high,gemcitabine PANC-1 cells median effective dose was higher than MIAPaCa-2,and the difference was statistically significant(P<0.05),the IC50 values of interference IRF-2-expressing cells was lower than PANC-1 control cells.Conclusion lRF-2 gene is one of the gene which could influence the sensitivity of pancreatic cancer to gemcitabine chemotherapy,and IRF-2 specific interference technology could effectively enhance chemosensitivity pancreatic cancer cells to gemcitabine.
IRF-2;Pancreatic cancer;Gemcitabine;Chemosensitivity
215200 江苏省苏州市吴江区第一人民医院
10.3969/j.issn.1001-5930.2017.04.006
R735.9
A
1001-5930(2017)04-0542-03
2016-06-02
2016-11-04)
