苦丁茶粗多酚对DSS诱导C57BL/6J小鼠溃疡性结肠炎的预防作用
2017-06-05赵欣,骞宇
赵 欣,骞 宇
(重庆第二师范学院 重庆市功能性食品协同创新中心;重庆市功能性食品工程技术研究中心; 功能性食品研发重庆市工程实验室;生物与化学工程系,重庆 400067)
苦丁茶粗多酚对DSS诱导C57BL/6J小鼠溃疡性结肠炎的预防作用
赵 欣,骞 宇*
(重庆第二师范学院 重庆市功能性食品协同创新中心;重庆市功能性食品工程技术研究中心; 功能性食品研发重庆市工程实验室;生物与化学工程系,重庆 400067)
目的:通过DSS(葡聚糖硫酸钠)诱导溃疡性结肠炎(UC)动物模型对苦丁茶粗多酚(KTCP)的UC预防效果进行了研究。方法:使用试剂盒检测小鼠的血清指标,同时使用RT-PCR技术检测小鼠结肠组织的mRNA表达。结果:动物实验结果显示KTCP能控制UC造成的小鼠体重下降和疾病活动指数(Disease activity index,DAI)增高;同时,KTCP还可以使UC造成结肠长度缩短和结肠重量/结肠长度比值降低得到有效的控制。解剖小鼠后对小鼠的血清和组织进行实验,观察到KTCP可以提高血清中SOD(超氧化物歧化酶)含量、降低细胞因子IL-6(白介素-6)、IL-12(白介素-12)和TNF-α(肿瘤坏死因子-α)的水平;KTCP还可以降低结肠组织中MPO(髓过氧化物酶)、MDA(丙二醛)的含量、提高GSH(谷胱甘肽)的含量。RT-PCR实验结果显示,相对于对照组KTCP可以下调结肠组织中TNF-α、IL-1β、IL-6、IL-8和CXCR2的mRNA表达。同时,高浓度的KTCP使小鼠的实验指标更接近于正常组小鼠,显示出更好的效果。结论:KTCP具有较好的溃疡性结肠炎的预防作用。
苦丁茶,多酚,溃疡性结肠炎,趋化因子受体,表达
苦丁茶作为一种传统的纯天然保健饮料,是冬青科植物大叶冬青的叶制备而成的一种饮品,与绿茶、红茶等传统茶叶相比,在口感、成分、生理活性作用上都有一定的差异[1]。苦丁茶包含超过200种成分,其中包括苦丁皂甙、氨基酸、维生素C、多酚、黄酮、蛋白质等生理活性物质[2]。绿茶等传统茶叶含有20%~35%茶饮料中的茶多酚,有研究表明苦丁茶也含有超过20%的多酚类物质[3]。
结肠炎是发生在结肠的炎症性病变,包括溃疡性结肠炎、缺血性结肠炎、伪膜性结肠炎,其中溃疡性结肠炎作为非特异性炎症性疾病在结肠炎中发病率最高,在我国溃疡性结肠炎在人群中的发病率已经超过10/10万[4]。溃疡性结肠炎有导致结肠癌的可能,有调查显示,在欧美国家患溃疡性结肠炎10年以上者,引发结肠癌的危险性提高,患病25年者危险性达到9%[5]。因为溃疡性结肠炎的引发原因尚不清楚,调整摄入食物的种类可能是一种有效的手段。
茶多酚物质多存在于包括绿茶、红茶和乌龙茶等多种传统茶叶中,有多种生理活性作用,包括抗氧化、提高免疫力、抗炎和抗癌效果等[6-8]。有研究表明苦丁茶中多酚类物质包括羟基酪醇葡萄糖苷、绿原酸、4,5-O-二咖啡酰奎尼酸、3,5-O-二咖啡酰奎尼酸和3,4-O-二咖啡酰奎尼酸等绿原酸及其衍生物[9],与传统绿茶、红茶中含儿茶素类化合物等多酚物质有明显差异,因此苦丁茶的生理活性作用也可能与绿茶等传统茶叶有一定差异。部分研究对苦丁茶多酚物质的基础生活活性作用进行了研究,证实苦丁茶多酚具有一定的抗氧化功效[10-11]。同时基础实验证明,多种食品的多酚提取物对结肠炎有一定的生理活性作用[12-13]。因此,本研究利用实验动物模型观察苦丁茶多酚物质对化学诱导的溃疡性结肠炎的预防效果,并通过包括分子生物学实验手段对作用机制进行初步分析,实验结果将有助于推动苦丁茶多酚物质功能性作用的研究,积累一定理论依据。
1 材料与方法
1.1 材料与仪器
苦丁茶 安国市祁珍养生食品有限公司出产野生苦丁茶,由重庆食品工业研究所冯璨高级工程师鉴定为真品。
DSS(葡聚糖硫酸钠) 美国MPBIO公司;MPO、GSH、MDA、SOD测定试剂盒 南京建成生物工程研究所;IL-6、IL-12、TNF-α血清细胞因子测定试剂盒 美国BioLegend公司;CycleTESTTM PLUS DNA染色试剂盒 德国Becton Dickinson公司;Trizol试剂、oligodT18、RNase、dNTP 和MLV 美国Invitrogen公司;RT-PCR引物TNF-α、IL-1β、IL-6、IL-8、CXCR2 天根生化科技有限公司;Folin-Ciocalteu 试剂、绿原酸标准品 美国Sigma公司;其余试剂均为国产分析纯;雄性6周龄SPF级C57BL/6J小鼠64只(体重20~25 g) 重庆医科大学动物实验中心,动物许可证号:SCXK(渝)2012-0001。
Biomate3S紫外可见光分光光度仪、A200PCR仪、LUX多功能性酶标仪 美国Thermo Fisher Scientific公司;Tancon2500PCR凝胶成像仪 上海天能科技有限公司;ICEN-24R高速冷冻离心机 杭州奥盛仪器有限公司。
1.2 实验方法
1.2.1 苦丁茶多酚物质的提取 按文献[14]方法,称取50 g打碎成粉的苦丁茶样品,加入50 mL的45%(体积比)的乙醇溶液,90 ℃下浸提30 min,重复1次浸提后合并2次浸提液后调节提取液的pH至6.0,然后加入80 mL的AlCl3(3 g)和ZnCl2(6 g)混合沉淀剂进行沉淀,接着对混合液进行离心分离(3000 r/min、10 min),将100 mL盐酸(12%,体积比)加入收集到的沉淀中转溶,分离出上清液,分别2次加入100 mL乙酸乙酯进行萃取。最后对萃取液进行旋转蒸发得到苦丁茶粗多酚提取物(KTCP)。
1.2.2 苦丁茶多酚物质的测定 将绿原酸溶于蒸馏水中配制成绿原酸原液,然后稀释绿原酸原液得到不同浓度的绿原酸溶液,按Folin-Ciocalteu比色法在1 mL不同浓度的绿原酸溶液中加入3 mL的Folin-Ciocalteu显色剂和4.5 mL的饱和Na2CO3溶液后定容至25 mL。去显色后的溶液在747 nm处测定吸光度值,以吸光度值为X轴坐标,绿原酸溶液浓度为Y轴坐标绘制绿原酸标准浓度。将KTCP溶解于蒸馏水中采用以上的方法测定吸光度值后对照标准曲线求得苦丁茶粗多酚的含量[3]。
1.2.3 动物实验 C57BL/6J小鼠适应环境饲养一周后将体重为(25±2) g的C57BL/6J小鼠分为5组,分别是正常组、对照组、苦丁茶多酚低浓度组和苦丁茶多酚高浓度组,每组16只。正常组小鼠在整个实验过程中不进行样品处理,维持正常饲养;对照组小鼠在前14 d内不进行样品处理,维持正常饲养,从15 d开始小鼠饮水更换为含有DSS(3%,质量分数)的饮水;苦丁茶多酚低浓度组高浓度小鼠实验开始后每天按25和50 mg/kg苦丁茶多酚对小鼠实施灌胃一次,苦丁茶多酚灌胃实施14 d后小鼠饮水更换为含有DSS(3%)的饮水,整个实验在第22 d对全部小鼠进行断颈处死,采用动脉取血收集血浆,并收集小鼠结肠部分,对结肠的重量和长度进行测量[14]。同时对DAI进行测定,
1.2.4 小鼠结肠组织中MPO、GSH、MDA含量的测定 在洗净的小鼠结肠中加入9倍质量的生理盐水,采用超声粉碎将结肠组织匀浆,然后按试剂盒说明书对小鼠结肠组织中MPO、GSH、MDA的含量进行测定。
1.2.5 小鼠血清中SOD含量的测定 解剖小鼠后将收集到的小鼠血浆放置1 h后进行离心分离(4000 r/min、10 min),取上层血清按试剂盒说明书对小鼠血清中的SOD含量进行测定。
1.2.6 小鼠血清炎症相关细胞因子的测定 取小鼠血清采用ELISA法按试剂盒说明书测定小鼠血清中的IL-6、IL-12和TNF-α细胞因子含量。
1.2.7 RT-PCR法测定结肠组织相关表达 取小鼠的结肠组织粉碎后用RNAzol提取结肠组织的总RNA,然后将总RNA浓度稀释到1 μg/μL。取2 μL稀释后的总RNA提取液,在其中依次加入1 μL的oligodT18、RNase、dNTP、MLV酶和10 μL的5×buffer,在条件37 ℃ 120 min,99 ℃ 4 min,4 ℃ 3 min合成cDNA。然后以反转录-聚合酶链反应法扩增TNF-α、IL-1β、IL-6、IL-8和CXCR2的mRNA表达,同时以持家基因GAPDH作为内参照按同样条件进行扩增。最后用含溴化乙锭琼脂(1%浓度)电泳检查PCR扩增产物,并用Image1.44软件进行半定量分析[15]。
1.3 数据统计
实验重复三次后将三次平行实验结果取平均值,然后使用SAS9.1统计软件采用one-way ANOVA方法分析各组数据在p<0.05 水平上相互是否具有显著差异。
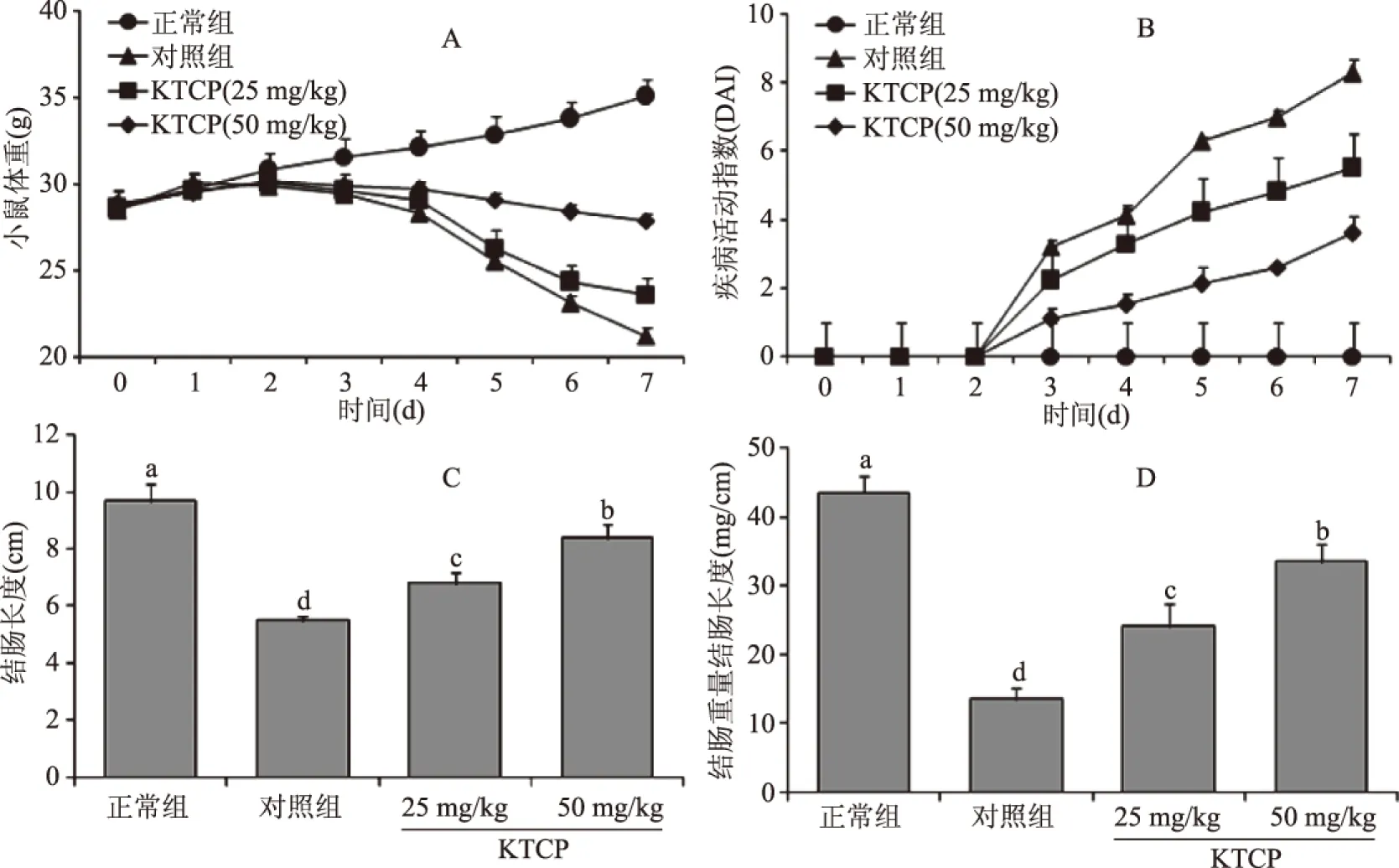
图2 苦丁茶粗多酚对小鼠体重(A)、DAI(B)、结肠长度(C)和结肠重量/结肠长度比值(D)的影响(DSS诱导小鼠溃疡性结肠炎开始)Fig.2 The Influence of KTCP(Kuding tea crude polyphenol)on mice body(A),DAI(B),colon length(C) and colon weight/colon length(D)of mice(from DSS induced ulcerative colitis)注:不同字母表示各组数据平均值显著性差异(p<0.05),图3~图5和表1、表2同。
2 结果与分析
2.1 苦丁茶粗多酚中的多酚物质含量
通过对绿原酸标准品吸光度的测定绘制出标准曲线为Y=217.4X-1.611(R2=0.998,Y为绿原酸含量,X为吸光度值)(图1),对照绿原酸标准曲线可计算出KTCP中多酚物质的含量达到63.1%(绿原酸计)。实验结果证明KTCP中的多酚物质含量较高,后续动物实验中起到关键作用的物质是苦丁茶多酚类物质。

图1 绿原酸标准曲线Fig.1 The standard curve of chlorogenic acid
2.2 苦丁茶粗多酚对结肠炎症状的影响
相对于正常组小鼠,DSS诱导结肠炎的对照组小鼠从DSS诱导开始体重下降,KTCP可以缓解DSS造成的小鼠体重下降,其中高浓度的KTCP(50 mg/kg)比低浓度的KTCP(50 mg/kg)具有更强的体重下降缓解效果(图2A)。溃疡性结肠炎患者常出现体重减轻、腹泻、出血等症状,DAI可以作为评价溃疡性结肠炎的标准[16],DSS小鼠溃疡性结肠炎模型小鼠也出现相似的症状,本实验中对照组小鼠的体重下降最多,同时对照组小鼠均出现出血症状,KTCP缓解了小鼠体重下降,同时出现出血症状的小鼠数量也大大下降。DAI指数显示KTCP可以大幅度降低DSS造成的溃疡性结肠炎症状(图2B),起到预防溃疡性结肠炎的作用。结肠长度和结肠重量/结肠长度的比值也是评价溃疡性结肠炎的重要指标,结肠长度缩短和结肠重量/结肠长度比值的增加都是溃疡性结肠炎加重的标志[14]。本实验中正常组小鼠的结肠长度最长,结肠重量/结肠长度比值最短(图2C);对照组小鼠表现出相反的趋势;KTCP能使结肠炎小鼠结肠长度和结肠重量/结肠长度的比值接近于正常组小鼠(图2D),50 mg/kg KTCP组小鼠的结肠长度和结肠重量/结肠长度的比值更接近于正常组小鼠。
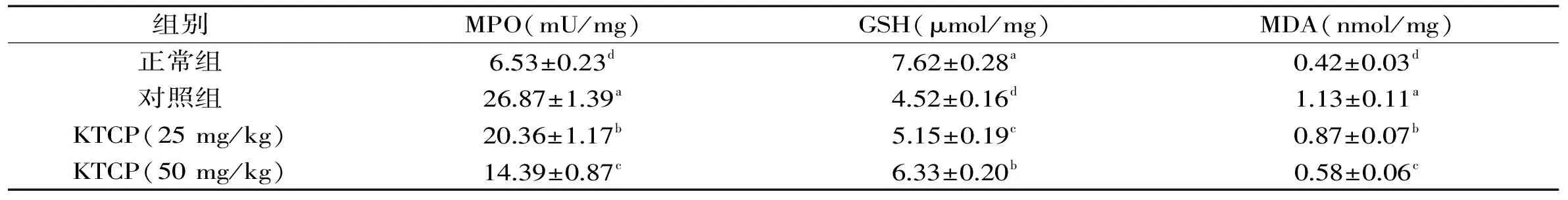
表1 苦丁茶粗多酚对小鼠结肠组织MPO、GSH、MDA含量的影响

表2 苦丁茶粗多酚对小鼠血清细胞因子IL-6、IL-12和TNF-α水平的影响
2.3 苦丁茶粗多酚对小鼠结肠组织MPO、GSH和MDA含量的影响
由表1可知,对照组小鼠结肠组织中的MPO和MDA含量比其他各组小鼠都高,GSH含量最低;正常组小鼠则表现出相反的趋势,MPO和MDA含量表现出最低的含量,GSH含量最高。KTCP可以显著(p<0.05)降低对照组小鼠的MPO、MDA含量和增加GSH含量,50 mg/kg浓度KTCP处理的小鼠的MPO、GSH和MDA含量比25 mg/kg浓度KTCP处理小鼠更接近于正常组小鼠。髓过氧化物酶(MPO)能在中性粒细胞中大量表达,在单核细胞和某些类型的巨噬细胞中的表达程度较轻,结肠中大量出现MPO表示中性粒细胞内流进入结肠组织,MPO活性降低是发炎组织中中性粒细胞聚集降低的表现[17]。DSS诱导结肠炎的一个表现就是结肠组织出现白细胞浸润,白细胞浸润是活性氧(ROS)和活性氮(RNS)的重要产生原因,ROS和RNS均是造成细胞损伤的细胞毒性剂[18]。结肠中过量的ROS将破坏组织中氧化/抗氧化平衡,从而增加脂质过氧化和降低结肠中GSH的含量,MDA则是脂质过氧化的终产物[19]。因此降低MPO、MDA含量和增加GSH含量均可以起到抑制结肠炎的作用,本研究中KTCP具有以上的效果,能够发挥实验溃疡性结肠炎的预防作用。
2.4 苦丁茶粗多酚对小鼠血清SOD含量的影响
通过对小鼠血清的分析可知(图3),正常组小鼠的SOD含量最高((66.3±3.2) U/mL),对照组小鼠的SOD含量最低((28.7±0.7) U/mL);相对对照组,KTCP可以显著提高DSS诱导结肠炎小鼠的SOD含量,25和50 mg/kg处理小鼠的SOD含量分别为(42.8±2.2)、(53.6±2.8) U/mL。在正常体细胞中,SOD保护自由基引发的组织损伤,抑制体内SOD的降低可以有效地缓解机体的损伤[20]。从实验结果可以看出KTCP可以显著地缓解由于DSS诱导结肠炎造成的SOD含量下降,起到保护机体的作用。
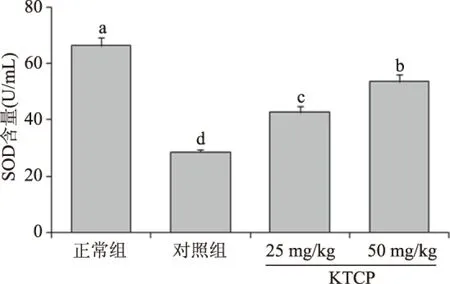
图3 苦丁茶粗多酚对小鼠血清SOD含量的影响Fig.3 The influence of serum KTCP (Kuding tea crude polyphenol)on SOD of mice
2.5 苦丁茶粗多酚对小鼠血清细胞因子IL-6、IL-12和TNF-α水平的影响
由表2可知,25和50 mg/kg浓度KTCP处理小鼠血清的IL-6、IL-12和TNF-α细胞因子水平显著低于对照组(p<0.05),50 mg/kg浓度KTCP处理小鼠血清的细胞因子水平仅高于正常组。促炎性细胞因子IL-6、IL-12和TNF-α可以增强炎症症状,导致溃疡性结肠炎患者结肠组织损伤,抑制促炎性细胞因子的水平可以起到抑制炎症的作用[21]。KTCP可以起到降低细胞因子IL-6、IL-12和TNF-α水平的作用从而达到预防溃疡性结肠炎的作用。
2.6 苦丁茶粗多酚对小鼠结肠组织TNF-α、IL-1β和IL-6 mRNA表达的影响
由图4可以看出,相对于对照组小鼠结肠组织,KTCP可以显著下调结肠炎小鼠结肠组织中TNF-α、IL-1β和IL-6的mRNA表达,并且50 mg/kg浓度KTCP可以使结肠炎小鼠的表达更接近正常组小鼠。TNF-α、IL-1β和IL-6均是溃疡性结肠炎发展中的关键因子,炎症患者体内的TNF-α水平较正常人更高[14];IL-1β能刺激腹泻和减少抑炎因子进入结肠,从而促进溃疡性结肠炎的发展[22];IL-6是受到炎症刺激后在体内产生的因子,可以加剧结肠炎的程度[23]。通过PT-PCR实验显示,KTCP可以有效地降低结肠组织中TNF-α、IL-1β和IL-6的mRNA表达,起到预防溃疡性结肠炎的作用,并且高浓度的KTCP效果更好。

图4 苦丁茶粗多酚对小鼠结肠组织TNF-α、IL-1β和IL-6 mRNA表达的作用(A)及半定量分析(B)Fig.4 Effects of TNF-α,IL-1β and IL-6 mRNA of KTCP(Kuding tea crude polyphenol) on colon tissue of mice(A)and semi-quantitative analysis(B)
2.7 苦丁茶粗多酚对小鼠结肠组织CXCR2和IL-8 mRNA表达的影响
结果显示,正常组小鼠结肠组织中的CXCR2和IL-8表达仅为对照组小鼠的0.7%和4.9%(图5),25 mg/kg浓度KTCP作用下表达为对照组小鼠的29.7%和78.5%,50 mg/kg浓度KTCP的作用可以使CXCR2和IL-8的表达更为接近正常组小鼠,仅为对照组小鼠的16.5%和68.6%。机体出现炎症后体内的趋化因子受体及配体会出现大量表达[24],其中趋化因子受体CXCR2是一种非常重要的肠道疾病关联因子,在急性炎症中,趋化因子通过氨基葡聚糖的作用能够大量集中在内皮细胞表面,通过与相应的趋化因子受体结合,使内皮细胞大量释放促炎细胞因子,加剧炎症[25]。CXCR2与其配体IL-8结合后可引起中性粒细胞的迁移和大量增加,从而加剧组织损伤,使溃疡性结肠炎加剧[26]。KTCP可以有效的降低CXCR2和IL-8在结肠中的mRNA表达,从而达到预防溃疡性结肠炎的目的。
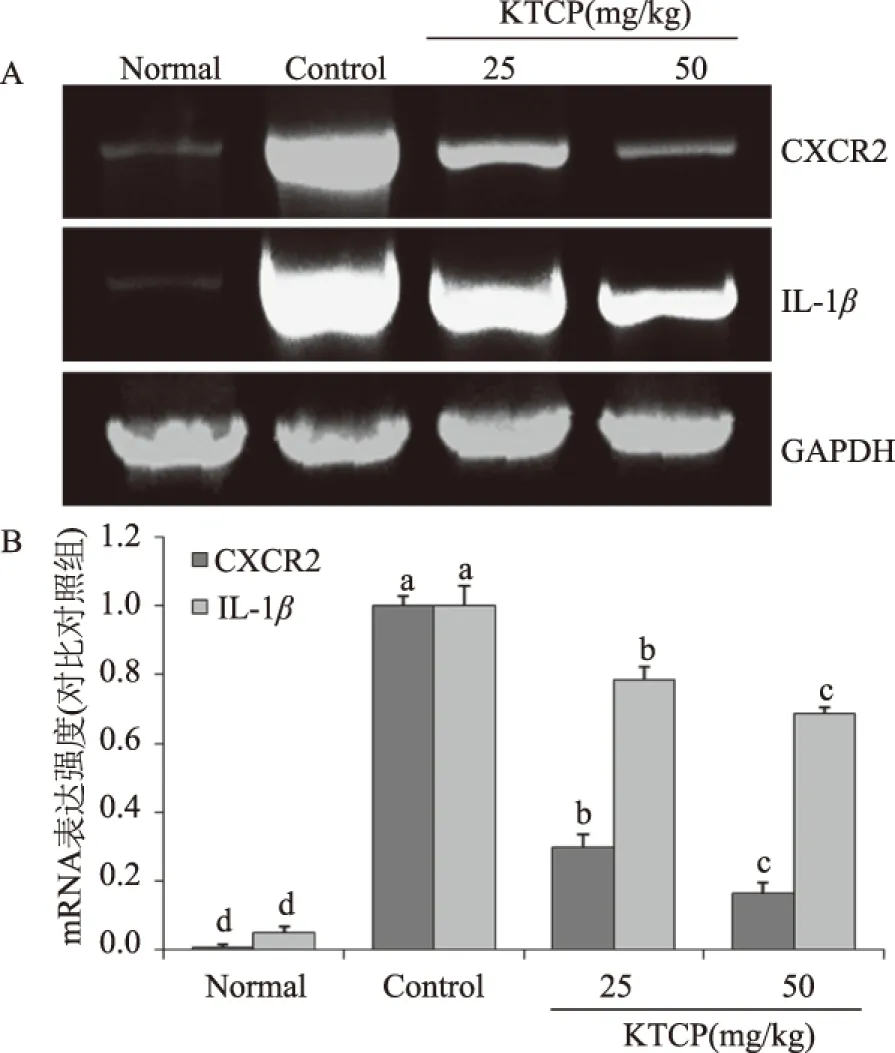
图5 苦丁茶粗多酚对小鼠结肠组织CXCR2和IL-8 mRNA表达的作用(A)及半定量分析(B)Fig.5 Effects of CXCR2 and IL-8 mRNA of KTCP (Kuding tea crude polyphenol)on colon tissue of mice(A)and semi-quantitative analysis(B)
3 结论
本研究通过建立DSS化学诱导溃疡性结肠炎动物模型来观察苦丁茶粗多酚(KTCP)对溃疡性结肠炎的预防效果。在实验过程中发现KTCP可以抑制结肠炎造成的小鼠体重下降、DAI增高和控制DSS造成的结肠长度缩短、结肠重量/结肠长度比值降低。通过对小鼠血清的实验也进一步表明KTCP可以增加结肠炎小鼠血清中SOD的含量,降低促炎细胞因子IL-6、IL-12和TNF-α的水平。对小鼠结肠组织的分析也表明,KTCP可以提高结肠炎小鼠结肠组织中GSH的含量、降低MPO、MDA的含量;同时下调结肠组织中TNF-α、IL-1β、IL-6、IL-8和CXCR2的mRNA表达。通过以上的作用KTCP可以起到对DSS诱导溃疡性结肠炎的预防效果,并且KTCP的作用呈浓度依赖,浓度越高,对溃疡性结肠炎的预防效果越好。
[1]叶国盛. 苦丁茶[J]. 特种经济动植物,2002,5(3):26.
[2]沈强,司辉清,于洋. 苦丁茶化学成分研究进展[J]. 茶业通报,2010,32(1):21-24.
[3]刘丽香,Tanguy Laura,梁兴飞,等. Folin-Ciocalteu比色法测定苦丁茶中多酚含量[J]. 茶叶科学,2008,28(2):101-106.
[4]汪芸,崔丁鹿. 溃疡性结肠炎脾胃气虚证的研究进展[J]. 现代中西医结合杂志,2015,24(25):2845-2847.
[5]郑红斌. 溃疡性结肠炎全球发病情况比较[J]. 中华消化杂志,2001,21(4):242-243.
[6]郑笑男. 茶多酚抗氧化功能及保护实验性肝损伤作用的研究进展[J]. 临床合理用药杂志,2011,15(4):126-128.
[7]龚裕强,李雷清,施小燕. 茶多酚抗炎作用研究进展[J]. 中国急救医学,2006,26(7):540-542.
[8]廖系晗,金翠兰. 茶多酚及其抗癌机理的研究进展[J]. 时珍国医国药,2006,17(9):1783-1785.
[9]孙怡,张鑫,张文芹,等. 苦丁茶冬青苦丁茶中多酚类物质的分离纯化与结构解析[J]. 食品科学,2011,32(11):60-63.
[10]刘佳,焦士蓉,唐远谋,等. 苦丁茶多酚的提取及抗氧化活性[J]. 食品科学,2011,32(14):134-138.
[11]刘丽香,梁兴飞,孙怡,等. 苦丁茶提取物多酚含量与抗氧化活性的测定[J]. 茶叶科学,2008,28(4):289-293.
[12]张燕,张红,迪丽胡玛尔,等. 新疆石榴皮多酚对实验性结肠炎的药效学研究[J]. 中国民族民间医药,2011,20(6):16-18.
[13]王雨楠,努尔迪达,迪丽达尔,等. 葡萄籽多酚对DSS诱导的小鼠溃疡性结肠炎的抑制作用[A]. 第十五届中国中西医结合学会微循环专业委员会暨第二届中国微循环学会痰瘀专业委员会学术会议资料汇编[C],北京:中国中西医结合学会,2015:15.
[14]Song J L,Qian Y,Li G J.Anti-inflammatory effects of kudingcha methanol extract(Ilex kudingcha C.J. Tseng)in dextran sulfate sodium-induced ulcerative colitis[J]. Molecular Medicine Reports,2013,8(4):1256-1262.
[15]冯霞,赵欣. 不同容器发酵水豆豉预防CCl4诱导肝损伤的研究[J]. 现代食品科技,2016,37(7):338-342.
[16]Strober W,Fuss Ij,Blumberg R S. The immunology of mucosal models of inflammation[J]. Annual Review of Immunology,2002,20:495-549.
[17]Mustafa A,El-Medany A,Hagar H H,et al. Ginkgo biloba attenuates mucosal damage in a rat model of ulcerative colitis[J]. Pharmacological Research,2006,53(4):324-330.
[18]Osman N,Adawi D,Ahrné S,et al. Probiotics and blueberry attenuate the severity of dextran sulfate sodium(DSS)-induced colitis[J]. Digesrive Disease and Sciences,2008,53(9):2464-2473.
[19]FIOCCHI C. Inflammatory bowel disease:new insights into mechanisms of inflammation and increasingly customized approaches to diagnosis and therapy[J]. Current Opinion in Gastroenterology,2004,20(4):309-310.
[20]Alscher R G,Erturk N,Heath L S. Role of superoxide dismutases(SODs)in controlling oxidative stress in plants[J]. Journal of Experimental Botany,2002,53(372):1331-1341.
[21]Hyams J,Damaraju L,Blank M. Induction and maintenance therapy with infliximab for children with moderate to severe ulcerative colitis[J]. Clinical Gastroenterology and Hepatology,2012,10(4):391-399.
[22]Dionne S,D’agata Id,Hiscott J,et al. Colonic explant production of IL-1and its receptor antagonist is imbalanced in inflammatory bowel disease(IBD)[J]. Clinical and Experimental Immunology,1998,112(3):435-442.
[23]Papadakis K A,Targan S R. Role of cytokines in the pathogenesis of inflammatory bowel disease[J]. Annual Review of Medicine,2000,51:289-298.
[24]崔曼莉,张明鑫,张超,等. 肿瘤相关性炎症与结肠癌[J]. 世界华人消化杂志,2016,24(32):4343-4353.
[25]Akcay A,Nguyen Q,Edelstein C L. Mediators of inflammation in acute kidney injury[J]. Mediators of Inflammation,2009,2009(2):137072.
[26]胡婉明,王俊普,李景和. 趋化因子受体CXCR1、CXCR2与肿瘤研究进展[J]. 现代生物医学进展,2012,12(32):6389-6392.
Preventive effects of Kuding tea crude polyphenols in DSS-induced C57BL/6J mice ulcerative colitis
ZHAO Xin,QIAN Yu*
(Chongqing Collaborative Innovation Center for Functional Food;Chongqing Engineering Research Center of Functional Food;Chongqing Engineering Laboratory for Research and Development of Functional Food; Department of Biological and Chemical Engineering,Chongqing University of Education,Chongqing 400067,China)
Objective:The preventive effects of Kuding tea crude polyphenol(KTCP)on ulcerative colitis were determined through the DSS(Dextran sulfate sodium salt)-induced ulcerative colitis(UC)animal model in this study. Method:Experiment kits were used for the mice serum determination,meanwhile,the mRNA of mice colon tissue were determined by RT-PCR assay. Results:The animal experiment results showed that KTCP could control the UC caused mice body weight reduction and DAI(disease activity index)raise. Meantime,KTCP also could control the UC caused colon length shortening and colon ratio of weight/colon length reduction. After dissection,the serum and tissue of mice were experimentalized,it was observed that KTCP could increase the content of SOD(superoxide dismutase)in serum,decrease the cytokine levels of IL-6(interleukin-6),IL-12(interleukin-12)and TNF-α(tumor necrosis factor alpha). And it was also observed that KTCP could reduce the MPO(myeloperoxidase),MDA(malondialdehyde)contents and raise the GSH(glutathione)content in colon tissues. RT-PCR experiment results showed that KTCP could decrease the TNF-α,IL-1β,IL-6,IL-8 and CXCR2 mRNA in colon tissues compared to the control group mice. Meanwhile high concentration of KTCP could make the experiment index close to the normal group mice,and showed the better activities. Conclusion:As can be seen,KTCP had a good preventive effects of UC.
Kuding tea;polyphenol;ulcerative colitis;chemokine receptor;expression
2016-12-06
赵欣(1981-),男,博士,教授,研究方向:食品营养和功能性食品,E-mail:zhaoxin@cque.edu.cn。
*通讯作者:骞宇(1976-),女,博士,副教授,研究方向:食品营养和功能性食品,E-mail:qianyubaby@126.com。
重庆高校创新团队建设计划自助项目(CXTD201601040);重庆第二师范学院引进高层次人才项目(2013BSRC01);重庆市工程技术研究中心建设项目(cstc2015yfpt_gcjsyjzx0027)。
TS201.4
A
1002-0306(2017)09-0357-06
10.13386/j.issn1002-0306.2017.09.061
