苦瓜多糖铁的制备及其对小鼠降血糖活性研究
2017-06-05杜国丰陈红漫阚国仕郭龙伟
杜国丰,陈红漫,阚国仕,高 爽,郭龙伟
(1.营口理工学院化学与材料工程系,辽宁营口 115014; 2.沈阳农业大学生物科学技术学院,辽宁沈阳 110866;3.朝阳市食品检验检测所,辽宁朝阳 122000)
苦瓜多糖铁的制备及其对小鼠降血糖活性研究
杜国丰1,陈红漫2,阚国仕2,高 爽1,郭龙伟3
(1.营口理工学院化学与材料工程系,辽宁营口 115014; 2.沈阳农业大学生物科学技术学院,辽宁沈阳 110866;3.朝阳市食品检验检测所,辽宁朝阳 122000)
为研究络合效应对多糖生物活性的影响,从苦瓜中提取水溶性苦瓜多糖,制备苦瓜多糖铁络合物,用红外光谱法对苦瓜多糖及其铁络合物分别进行表征,对比苦瓜多糖及其铁络合物对四氧嘧啶致高血糖小鼠模型的降血糖作用,利用光镜对小鼠胰尾组织石蜡切片进行胰岛细胞形态学观察。结果表明,经铁离子络合后,苦瓜多糖的红外谱图基本骨架未发生较大变化,只是在局部吸收峰向高波数移动,在3407.6 cm-1处吸收峰增强;苦瓜多糖及其铁络合物给药组都能显著降低高血糖模型小鼠的血糖水平,且苦瓜多糖铁降血糖效果更显著;苦瓜多糖铁对β-细胞具有较好的保护和修复作用,可促进β-细胞内β-颗粒和线粒体再生,提高β-细胞释放胰岛素的能力。
多糖,苦瓜多糖铁络合物,降血糖活性,胰岛细胞
随着现代经济发展和生活方式的改变,以高血糖及糖尿病为代表的代谢综合症已成为影响人类健康的非传染性疾病之一[1],且患病趋势逐年上升。目前糖尿病治疗药物主要为注射型胰岛素制剂和化学合成药物。寻找新型高效、低毒,具有类胰岛素效果的抗糖尿病化合物是研究者关注的热点[2]。
多糖是一种高分子量的生物活性物质,其降血糖作用已为众多学者所证实,动物实验研究表明,植物多糖可通过修复胰岛细胞的形态,促进肝脏、肌肉等外周组织和靶器官对糖的利用达到降糖效果[3-5]。多糖是一种含多羟基的聚糖,羟基中含有的孤对电子可以与金属离子发生配合作用,形成多糖金属络合物,多糖金属络合物可使多糖生物活性增效[6-7]。水溶性苦瓜多糖是一种从苦瓜果肉中提取出的酸性多糖,主要由阿拉伯糖、半乳糖醛酸、鼠李糖、木糖组成,我们的前期研究及相关实验表明,具有抗氧化活性的苦瓜多糖可降低糖尿病小鼠的血糖水平[8-9]。本研究在利用金属络合法制备小分子量苦瓜多糖铁络合物的基础上,对其降血糖活性进行了比较研究,对苦瓜多糖铁络合物的应用研究提供理论支撑。
1 材料与方法
1.1 材料与仪器
苦瓜 市售;昆明系小鼠 雄性,体重(23±2) g,由中国医科大学动物实验中心提供。
纤维素酶 诺维信(中国)生物技术有限公司;SephadexG-100凝胶 Sigma公司;柠檬酸钠 沈阳市远东试剂厂;3-氨丙基-3-乙氧基硅烷(APES)武汉博士德生物工程有限公司;氢氧化钠 天津市瑞金特化学品有限公司;三氯化铁 天津市瑞金特化学品有限公司;溴化钾 临沂正衡化波仪器有限公司;四氧嘧啶 上海如吉生物科技发展有限公司;多聚甲醛 临沂市利恒化工有限公司;格列本脲片 上海华源长富药业集团旌德制药有限公司。
SXT-1型血糖测试仪 三诺;葡萄糖凝胶柱层析装置(玻璃层析柱Φ20 mm×600 mm) 上海青浦沪西仪器厂;ALPHA 2-4LD冷冻干燥机 德国CHRIST公司;N-1001旋转蒸发仪 东京理化器械株式会社;Nicolet Nexus 5DXC FT-IR红外光谱扫描仪 美国 Nicolet公司;SpectrAA-220型原子吸收分光亮度计 美国Varian公司。
1.2 苦瓜多糖的制备
将市售鲜苦瓜切片后于50 ℃烘箱内烘干,粉碎,称取苦瓜干粉10 g,加入40倍的蒸馏水,30 mg纤维素酶,50 ℃条件下浸提5 h。收集提取液,5000 r/min离心15 min,上清液再减压浓缩至原体积的1/3,加入3倍体积的95%乙醇,静置过夜后5000 r/min离心10 min。将沉淀冷冻干燥后用蒸馏水复溶,采用Sevag法脱蛋白后冷冻干燥。根据以下公式计算多糖得率,多糖得率(%)=冷冻干燥后多糖质量(g)/苦瓜质量(g)×100。采用sephadexG-100凝胶分离粗多糖,选用其中活性较高组分用于苦瓜多糖铁的制备。
1.3 苦瓜多糖铁的制备
称取1.2中分离到的苦瓜多糖0.5 g,溶解于30 mL蒸馏水中,并加入0.5 g的柠檬酸钠作为催化剂,在60 ℃恒温水浴的条件下不断的搅拌,与此同时,滴加2 mol/L FeCl3溶液和20%的NaOH溶液,反应液控制在pH8。当反应中滴入的FeCl3溶液产生的红褐色沉淀,经搅拌在2 min之内不再出现先沉淀后溶解现象,继而有少量摇之不溶的红褐色沉淀时,停止滴加FeCl3和NaOH溶液,继续在60 ℃水浴条件下搅拌1 h。待反应液冷却后,5000 r/min离心10 min取上清液,然后经透析、浓缩、冷冻干燥,即制得苦瓜多糖铁络合物。
1.4 金属离子的取代度测定
准确称量苦瓜多糖络合物样品20 mg于干燥的坩埚中,放入高温马弗炉中,于500~550 ℃下灰化2 h,冷却。用无机酸洗去灰分,去离子水定容后,用原子吸收光谱法对其进行测定,并采用GB1191-89中方法确定铁的取代度,苦瓜多糖铁络合物得率(%)=苦瓜多糖铁络合物络合物(冻干粉)/苦瓜多糖冻干粉×100。
1.5 傅立叶红外光谱分析
采用溴化钾压片法,无水样品20 mg与溴化钾混匀,研磨后压片,在400~4000 cm-1区间扫描。
1.6 苦瓜多糖及苦瓜多糖铁络合物降血糖活性
1.6.1 糖尿病小鼠模型构建 选用健康的昆明系雄性小鼠(体重23±2 g),适应性喂养3 d后,禁食24 h,按剂量为200 mg/kg·d-1腹腔注射四氧嘧啶(快速注射,以免四氧嘧啶分解失效),继续进行喂养3 d后,禁食12 h,测定其血糖值,血糖值>15 mmol/L即造模成功,以此为糖尿病动物模型。
1.6.2 实验设计 取未经处理的健康小鼠作为正常对照组,造模成功的小鼠分成4组,分别为:四氧嘧啶组、格列本脲组(药物组)、苦瓜多糖组及苦瓜多糖铁络合物组,每组12只。分别灌胃生理盐水(正常对照组25 mg/kg·d-1、四氧嘧啶组25 mg/kg·d-1)、格列本脲(25 mg/kg·d-1)、苦瓜多糖(250 mg/kg·d-1)、苦瓜多糖铁络合物(250 mg/kg·d-1),连续灌胃28 d,分别测定14 d和28 d灌胃5 h后的血糖值。
1.6.3 血糖测定 小鼠尾静脉血取血,用SXT-1型血糖测试仪及专用试纸测定血糖。
1.7 免疫组织化学标本制备和SP法染色
取小鼠胰尾组织,放于4%多聚甲醛液24 h,常规石蜡包埋,连续切片,厚度为6 μm,每隔20张取1片蜡带,裱于涂有APES的载玻片上,进行免疫组织化学染色,用于电镜观察,放大倍数为200倍。
1.8 数据统计处理及分析
2 结果与分析
2.1 苦瓜多糖的分离提取
苦瓜粉经过Sevag洗脱蛋白,浓缩、醇沉、洗涤及冷冻干燥后,质地比较膨松,便于后续溶解操作。实验中白色粗多糖得率为9.6%。粗多糖经过Sephadex G-100凝胶分离后得到一种活性较高的组分苦瓜多糖MCPⅡa。
2.2 苦瓜多糖铁的制备
苦瓜多糖分子中存在大量羧基、羟基等活性基团,具有良好的金属络合能力。按方法1.3所述制备的苦瓜多糖铁络合物MCPⅡa-Fe(Ⅲ),其得率为12.58%,取代度为49.08%,在滴加FeCl3和NaOH溶液的过程中,要在恒温下持续搅拌溶液,使得Fe3+能够得到充分的络合,络合后及时进行透析及冷冻干燥尽快降低所得苦瓜多糖铁产品的水分活度。
2.3 苦瓜多糖及其铁络合物的红外光谱
苦瓜多糖及其铁络合物红外扫描图谱如图1所示,与苦瓜多糖MCPⅡa的红外扫描图谱相比较,铁络合物图谱的基本骨架没有发生很大的变化。MCPⅡa在3500~3200 cm-1区域内出现的3407.6 cm-1处的O—H的伸缩振动吸收峰,在铁络合物中移向高波数3419.4 cm-1,分析是因为铁离子与MCP的羟基配位后,使得-OH的氢键缔合作用减弱,因此在3407.6 cm-1处的吸收峰增强;MCPⅡa在1700~1550 cm-1区域内出现的1621.6 cm-1处的C=O的非对称伸缩振动吸收峰[10],在铁络合物中移向高波数1623.7 cm-1,说明C=O可能参与了配位;MCPⅡa在1500~1380 cm-1区域内1424.1 cm-1处的吸收峰,在铁络合物中移向1424.8 cm-1;MCPⅡa在1390~1200 cm-1区域内1337.1 cm-1处的—OH的变形吸收峰,在铁络合物中向高波数移动[11-12]。
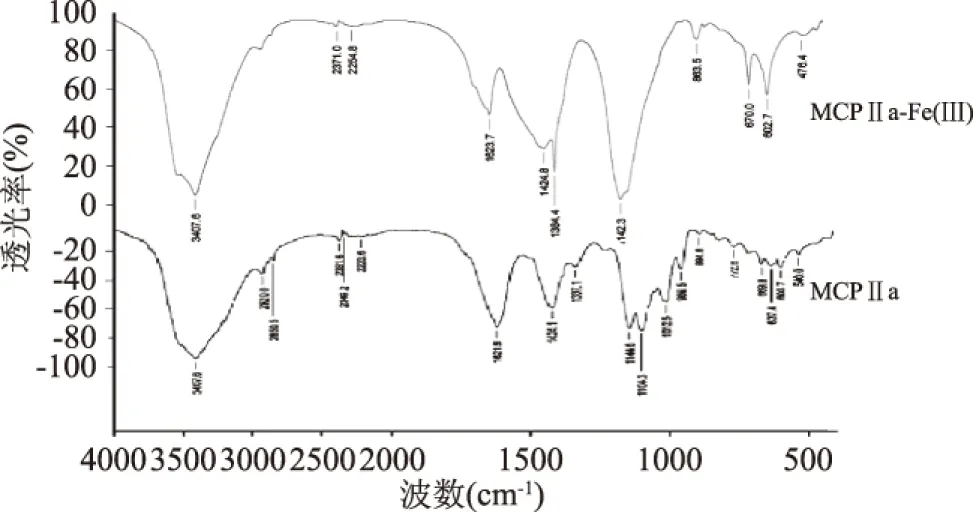
图1 苦瓜多糖、苦瓜多糖铁络合物的红外光谱Fig.1 Infrared spectra of MCPⅡa and MCPⅡa-Fe(Ⅲ)
2.4 苦瓜多糖与苦瓜多糖铁络合物对小鼠血糖值的影响
苦瓜多糖(MCPⅡa)及其铁络合物(MCPⅡa-Fe(Ⅲ))对糖尿病小鼠血糖的影响如图2所示。由图2可知,建模后与正常对照组比较,糖尿病小鼠的血糖明显升高,说明造模成功。在灌胃14 d后,各组小鼠的空腹血糖值都明显低于四氧嘧啶组,其中MCPⅡa-Fe(Ⅲ)组的血糖值较MCPⅡa组降低了2.03 mmol/L,而MCPⅡa-Fe(Ⅲ)与格列苯脲组差异不显著。苦瓜多糖铁络合物与苦瓜多糖组小鼠血糖浓度分别为14.04 mmol/L和12.26 mmol/L,与给药前相比,血糖浓度分别降低了39.13%和47.17%,阳性对照组则为52.13%;在灌胃28 d后,血糖浓度降低百分数与给药前相比则分别为36.95%、65.6%及69.5%,各组小鼠的空腹血糖值依然与四氧嘧啶组差异十分显著,其中MCPⅡa-Fe(Ⅲ)的血糖值明显低于MCPⅡa,但与格列苯脲组没有明显差异,且降糖效果呈量效关系。结果表明,相同剂量下MCPⅡa-Fe(Ⅲ)比MCPⅡa的降血糖效果好。
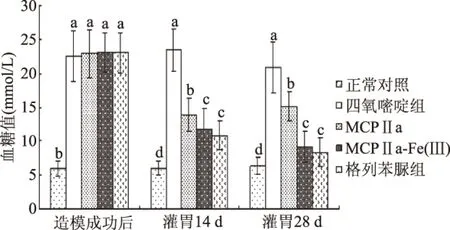
图2 苦瓜多糖及其铁络合物对糖尿病小鼠血糖的影响Fig.2 Effect of MCPⅡa and MCPⅡa-Fe(Ⅲ) on blood glucose in diabetic mice注:a:与糖尿病模型组对照(p<0.01); b:与糖尿病模型组对照(p<0.05); c:与正常组对照(p<0.01);d:与正常组对照(p<0.05)。
2.5 苦瓜多糖对糖尿病小鼠修复胰岛损伤的影响
在光镜下观察不同处理小鼠胰岛形态及变化,结果如图3(a)~(e)所示。正常对照组小鼠(a)胰岛为椭圆状,胰岛内细胞排列整齐,核呈圆形或椭圆形,染色质丰富分布均匀。模型对照组小鼠(b)胰岛损伤情况严重,胰岛形态不规则,胰岛内有较大空虚区域;胰岛内细胞有显著的坏死特征,数量明显减少;细胞核出现凝缩现象,染色质分布不均,且染色较浅。与模型对照组相比,阳性对照组(c)的胰岛虽外形仍为不规则形状,但内部细胞数量明显增多;核凝缩现象未得到较好的恢复,核染色较深,但染色质分布仍不均。经苦瓜多糖及苦瓜多糖铁络合物灌胃治疗后的糖尿病小鼠胰岛形态均向正常状态转变,但组间存在差异。苦瓜多糖铁络合物组(d)胰岛外形规整,内部几乎无坏死细胞,核多为椭圆形,染色质较丰富且分布均匀,且细胞排列较整齐,胰岛形态基本恢复正常状态。苦瓜多糖组(e)胰岛边缘较整齐,胰岛内坏死细胞得到恢复,细胞数量明显增多,但呈不规则排列;核凝缩现象得到缓解,染色质分布较均匀,着色却较浅。通过形态学观察可知,苦瓜多糖对于坏死的胰岛细胞有一定的修复作用,而多糖组分通过Fe3+的络合修饰后,修复作用有了很大的提高,胰岛细胞的内部形态与正常细胞非常接近。

图3 不同处理组小鼠的胰岛微细结构(×200)Fig.3 Microstructure of pancreas in different treatment groups of diabetic mice(×200)注:a正常对照组小鼠胰岛微细结构;b模型对照组小鼠胰岛微细结构;c阳性对照组小鼠胰岛微细结构;d 苦瓜多糖铁络合物组小鼠胰岛微细结构;e苦瓜多糖组小鼠胰岛微细结构。
3 结论与讨论
目前植物多糖的研究主要集中在提取分离纯化、构型构象分析和药理活性筛选等方面,但利用金属离子修饰多糖制备金属络合物的研究比较少[13-17]。多糖因糖链结构复杂且含有较多羟基,易与水分子键合形成胶体,很难获得相应的晶体,因此络合反应之后,不能直接确定络合的部位以及最终的结构式,因此我们利用IR推测其可能的络合部位。本实验将苦瓜多糖经Sevage法排除蛋白质干扰后与三价铁离子制备苦瓜多糖铁络合物,从IR数据的变化基本可以推测三价铁和苦瓜多糖羟基发生配位引起波数和波长的位移[18]。对糖尿病模型小鼠胰岛细胞观察显示,随着血糖的增高,β细胞结构受损加重,胞浆中分泌颗粒明显减少,甚至较多的细胞呈现凋亡早期改变:β细胞体积变小,核染色质边集,核固缩,出现许多畸形细胞核,线粒体数量减少破坏,内质网扩张脱颗粒,这都提示细胞凋亡的发生和合成胰岛素能力下降。而在苦瓜多糖铁络合物及苦瓜多糖的干预下,一定量的β细胞得到恢复,也保证了足够胰岛素量的维持,β细胞合成分泌胰岛素的功能趋向正常。综上所述,苦瓜多糖与苦瓜多糖铁络合物均能使糖尿病小鼠血糖水平下降,其中苦瓜多糖铁络合物调控血糖效果优于苦瓜多糖,这可能是由于多糖与金属离子络合后,空间结构发生了变化,使得配位部分与暴露的活性基团协同作用的结果出现[19]。因此,根据以上的实验结果我们初步认为,苦瓜多糖铁作为降糖活性物质具有潜在开发价值。
[1]R Jayawardena,P Ranasinghe,P Galappatthy,et al. Effects of zinc supplementation on diabetes mellitus:a systematic review and meta-analysis[J].Diabetology & Metabolic Syndrome,2012,4(1):1-12.
[2]Jian-Ya Qian,Ye-Yu Bai,Jing Tang,et al. Antioxidation andα-glucosidase inhibitory activities of barley polysaccharides modified with sulfation[J]. LWT-Food Science and Technology,2015,64:104-111.
[3]S A Moussa. Oxidative Stress in Diabetes Mellitus[J]. Romanian J Biophys,2008,18(3):225-236.
[4]SP Li,GH Zhang,Q Zeng,et al. Hypoglycemic activity of polysaccharide,with antioxidation,isolated from cultured Cordyceps mycelia[J].Phytomedicine,2006,13(6):428-433.
[5]Yupin Li,Takeki Hamasaki,Noboru Nakamichi,et al. Suppressive effects of electrolyzed reduced water on alloxan-induced apoptosis and type 1 diabetes mellitus[J].
Cytotechnology,2011,63(2):119-131.
[6]张晓茹,贾继龙,张书圣.糖-金属配合物的研究进展[J]. 合成化学,2006,14(1):1-6.
[7]李军平,于淑娟. 糖类物质与金属离子络合物的研究进展[J].中国生化药物杂志,2005,26(1):59-61.
[8]Wang huihui,Zhang shaozai,Chen hongman. Study on Correlation between Antioxidant and Hypoglycemic activity Polysaccharide isolation from Momordica charantia[J]. Bothalia Journal,2013,43(11):117-128.
[9]宋金平.苦瓜多糖对糖尿病小鼠的降血糖作用和胰岛素水平的影响[J].中国实用医药,2012,7(3):250-251.
[10]Mao wenjun,Li bafang,Gu qianqun,et al. Preliminary studies on the chemical characterization and antihyper lipidemic activity of polysaccharide from the brown alga Sargassum fusiforme[J]. Hydrobiologia,2004,512:263-266.
[11]Kacurakova M,Capek P,Sasinkova V,et al. FT-IR study of plant cell wall model compounds:pectic polysaccharides and hemicelluloses[J]. Carbohydrate Polymers,2000,43(2):195-203.
[12]杨丽敏,翁诗甫,杨鲁勤,等.几种单双糖及其部分固态金属糖络合物的远红外光谱研究[J].光谱学与光谱分析,2000,20(2):189-191.
[13]Hromádková Z,Paulsen B S,Polovka M,et al. Structural features of two heteroxylan polysaccharide fractions from wheat bran with anti-complementary and antioxidant activities[J]. Carbohydrate Polymers,2013,93(1):22-30
[14]Wijesekara I,Pangestuti R,Kim S K. Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae[J]. Carbohydrate Polymers,2011,84(1):14-21.
[15]Costa L S,Fidelis G P,Cordeiro S L,et al. Biological activities of sulfated polysaccharides from tropical seaweeds[J]. Biomedicine & Pharmacotherapy,2010,64(1):21-28.
[16]Jiao guangling,Yu guangli,Zhang junzeng,et al. Chemical structures and bioactivities of sulfated polysaccharides from marine algae[J]. Marine Drugs,2011,9(2):196-223.
[17]王兆梅,李琳,郭杞远,等.多糖结构修饰研究进展[J].中国医药工业杂志,2002,33(12):616-620.
[18]茹翌,徐光勋,赵欢,等.苦瓜多糖的分子修饰及抗氧化活性研究[J].食品安全质量检测学报,2015,6(8):2917-2923.
[19]Bao xingfeng,Liu guiping,Fang jinian,et al. Structural and immunological studies of a major polysaccharide from spores of Ganoderma lucidum(Fr.)Karst[J]. Carbohydrate Research,2001,332(1):67-74.
Study on preparation ofMomordicacharantiapolysaccharide-iron complex and its hypoglycemic activities in diabetic mice
DU Guo-feng1,CHEN Hong-man2,KAN Guo-shi2,GAO Shuang1,GUO Long-wei3
(1.Department of Chemical and Material Engineering,Yingkou Institute of Technology,Yingkou 115014,China; 2.College of Bioscience and Biotechnology,Shenyang Agricultural University,Shenyang 110866,China; 3.Chaoyang Institute for Food Control,Chaoyang 122000,China)
In order to study the effect of complexation on the biological activity of polysaccharide,the polysaccharide was extracted fromMomordicacharantiato prepare the polysaccharide-iron complex.The polysaccharide and its iron complex were characterized by infrared spectroscopy.The effects of the polysaccharide and its iron complex on blood levels of the diabetic mice induced by alloxan were contrasted.Morphology of pancreatic islet cells in paraffin sections of diabetic mice pancreatic tissue were observed by light microscopy.Results showed that the basic framework of the infrared spectrum of the polysaccharide fromMomordicacharantiadid not change much after the complexation of iron(Ⅲ),but the local absorption peak moved to the high wave number,and the absorption peak increased at 3407.6 cm-1. The prepared polysaccharides-iron complex can significantly reduce the blood glucose of the diabetic mice in comparison with those polysaccharides before administration(p<0.05). The complex of polysaccharide-iron has better effects on reducing blood glucose than those of polysaccharides alone,and they could protect and restoreβcell,promote the regeneration ofβparticles and mitochondrial,and improve the ability ofβcells to release insulin.
polysaccharide;Momordicacharantiapolysaccharide-iron complex;hypoglycemic activities;islet cell
2016-12-02
杜国丰(1984-),男,硕士,实验师,研究方向:食品生物化学,E-mail:duguofeng885624@163.com。
国家自然科学基金(31271842)。
TS201.4
A
1002-0306(2017)09-0353-04
10.13386/j.issn1002-0306.2017.09.060
